维持性血液透析病人外周血单核细胞凋亡与线粒体异常的关系
作者:金惠敏 徐琴君 吴直江 丁言德 高奇蓉 胡炜
单位:200080 上海市第一人民医院肾内科(金惠敏、徐琴君、丁言德);中国科学院上海细胞生物学研究所(吴直江、高奇蓉、胡炜)
关键词:血液透析;单核细胞;脱噬作用;流式细胞术
中华医学杂志990310 【摘要】 目的 探讨维持性血液透析(HD)病人外周血单核细胞凋亡与线粒体异常的关系。方法 20例HD病人体外培养的外周血单核细胞以流式细胞术通过荧光素标记的Annexin-V检测早期凋亡细胞的膜表面磷酯酰丝氨酸残基(PS),线粒体跨膜潜能 (ΔΨm) 通过线粒体探针DiOC6(3) 分析。线粒体渗透转移(PT)肿胀通过分光光度计记录。结果 HD病人体外培养的外周血单核细胞在24、72小时自发凋亡(41.4±12.2)%,(22.0±3.0)%,明显超过正常对照组(20.6±8.8)%,(9.8±2.1)%;新鲜分离的单核细胞在病人组和正常对照组细胞凋亡无差异,然而在病人组ΔΨm降低达(43±9)%。HD病人新鲜分离单核细胞PT肿胀高达(80±6)% 明显超过正常对照组(5±3)%。结论 线粒体肿胀和ΔΨm降低是导致HD病人外周血单核细胞凋亡的原因,这是HD病人单核细胞防御功能下降的另一主要因素。
, 百拇医药
Reduction of mitochondrial transmembrane potential constitutes an early event of peripheral blood monocytes apoptosis in hemodialysis patients JIN Hui min, XU Qin jun, WU Zhi jiang*, et al. Department of Nephrology, Shanghai Medical University, Shanghai First People′s Hospital, Shanghai 200080* Shanghai institute of cell biology, the Chinese Academy of Science
【Abstract] Objective To investigate the relationship between monocyte apoptosis and mitochondria function in hemodialysis (HD) patients. Methods Fluorescein labeled Annexin-V was used to detect the phospha-tidyserine (PS) of apoptosis cells, and mitochondrial transmembrane potential was studied by 3,3′-dihexyloxacarbocyanine iodide, DiOC6 (3), and analyzed by flow cytometry. Swelling of mitochondrial permeability transition (PT) was recorded by spectrophotometer.Results Spontaneous apoptosis of cultured monocytes increased at 24, 72 hours in HD patients (41.4±12.2)%、(22.0±3.0)% as compared with controls (20.6±8.8)%、(9.8±2.1)%. Freshly isolated monocytes in HD patients had little apoptosis, but mitochondrial transmembrane potential was reduced to half of disruption (43±9)%. As to swelling of PT, those freshly isolated monocytes mitochondria in HD patients experienced overwhelming opening of PT, (80±5.6)%.Conclusion Swelling of PT and breakdown of mitochondrial transmembrane potential constitute the early events of monocytes apoptosis in HD patients, which could contribute to the impaired monocytes function.
, 百拇医药
【Key words】 Hemodialysis Monocyte Apoptosis Flow cytometry
(Natl Med J China, 1999,79:190-193)
细胞凋亡的形态和生化特点主要表现在细胞核和染色质的改变,早期的文献报道表明[1],细胞凋亡时线粒体的形态和功能不发生改变。随后发现抗凋亡基因bcl-2分布于线粒体内膜和外膜,对传统的细胞核凋亡提出了挑战,这意味着线粒体参与细胞凋亡的调控。一些试验观察到淋巴细胞[2]、胸腺细胞[3],U937细胞和肝细胞[4]线粒体跨膜潜能 (ΔΨm) 的降低将随后发生不可逆转的细胞凋亡。这种ΔΨm降低主要由于线粒体渗透转换孔(PT)开放,随之允许分子量小于1 500和一些蛋白的自由通过,从而导致跨膜潜能的丧失[4]。
, http://www.100md.com
单核细胞是机体主要的防御细胞,Heidenreich等[5]报道HD病人体外培养的单核细胞凋亡增加。根据以上结果,我们对HD病人外周血单核细胞凋亡和线粒体功能进行了调查。
对象和方法
一、对象
HD病人20例,男12例,女8例,平均年龄(42±3.5)岁,平均血液透析时间(3±3.3)年。透析膜为铜仿膜或醋酸纤维素膜,每周透析2~3次。原发病均为慢性肾小球肾炎,所有病人检测时均无感染和原发性免疫系统疾病。对照组18例,均为健康志愿者,男10例,女8例,平均年龄(38±5.0)岁。
二、方法
1.FITC-Annexin-V/碘化丙啶(PI)双染色检测早期细胞凋亡:外周血单核细胞分离按参考文献[7]。主要步骤,全血首先用Ficoll-Hypaque离心(1 800 r/min,20 min),外周血单个核细胞(PBMC)收集后放入46% 等渗Percoll(Pharmacia)上层,然后离心1 900 r/min,30 min,界面白色细胞层即单核细胞,经形态检查和脂酶染色,纯度>95%。细胞凋亡时,磷酯酰丝氨酸残基(PS)从细胞内向细胞膜转移,Annexin-V对PS有高度亲和力,当细胞坏死和凋亡时,PS均存在于细胞膜,利用细胞膜对碘化丙啶通透性的差异鉴别凋亡与坏死。方法:0.5×106单核细胞用PBS洗一次后,细胞沉淀中加入100 μl标记缓冲液[20 μl Annexin V (德国Boehringer公司),20 μl碘化丙啶,1 ml Hepes]室温孵育15 min后,再加0.4 ml孵育缓冲液(10 mmol/L Hepes/NaOH pH 7.4,140 mmol/L NaCl、5 mmol/L CaCl2),流式细胞仪检测。
, 百拇医药
2.ΔΨm测定: 线粒体ΔΨm分析利用线粒体探针3,3′-DIHEXYLOXA-CARBOCYANINE IODIDE DiOC6 (3),它是一种阳离子亲脂染料,借助ΔΨm聚集在线粒体基质[3]。0.5×106单核细胞在含0.1 μmol/L DiOC6 (3)的100 μl PBS液中30 min,流式细胞仪分析(激发波长:488 nm,发射波长:525 nm)。
3.分离纯化单核细胞线粒体: 分离方法参考文献[8]。单核细胞悬于冷的低渗缓冲液(10 mmol/L Hepes pH 7.5、1.5 mmol/L MgCl2、5 mmol/L KCl),超声细胞破碎器破碎细胞,4 ℃离心3 100 r/min 5 min,上清放入Percoll梯度液上,4层分别是10%、18%、30% 和70%,经12 100 r/min 30 min后收集纯化的线粒体在30% 和70% 界面,用0.3 mmol/L甘露醇,5 mmol/L吗啡啉丙磺酸(pH 7.2) 洗一次,后置冰上悬于B缓冲液(400 mmol/L甘露醇,10 mmol/L KH2PO4、5 mg/ml 胎牛血清、50 mmol/L Tris-HCl pH7.2)。经测线粒体标志酶证实,氧化酶氧化细胞色素C通过分光光度计在545 nm记录每分钟吸光度下降[9]。
, 百拇医药
4.分离线粒体渗透转移肿胀测定:测定方法见参考文献[10]。分离纯化的线粒体悬于B缓冲液,后加入100 μl无细胞缓冲液(220 mmol/L甘露醇、68 mmol/L蔗糖、2 mmol/L NaCl、2.5 mmol/L KH2PO4、0.5 mmol/L EGTA、2 mmol/L MgCl2、5 mmol/L丙酮酸、0.1 mmol/L苯*****、1 mmol/L二硫苏糖醇、10 mmol/L Hepes-NaOH pH 7.4),在分光光度计540 nm下记录2 min吸光度下降。5 mmol/L Atractyloside (Sigma公司)在2 min内诱导的吸光度下降定为100% PT肿胀。
5.数据分析:所有数据表达采用均数±标准差,两组之间比较用t检验。
结 果
, 百拇医药 一、HD病人体外培养的单核细胞凋亡:新鲜分离的单核细胞凋亡在病人组和正常对照组无差异(图1)。培养24小时单核细胞凋亡明显增快,病人组细胞凋亡(20.6±8.8)%。对照组(9.8±2.1)%(P<0.05)。培养至72小时HD病人单核细胞凋亡增至(41.4±12.2)%明显超过正常对照组(22.0±3.0)%(P<0.01)。
下左1/4象限代表活细胞(Annexin-V-/PI-).上右1/4象限(R1)代表坏死细胞(Annexin-V+/PI+).下右1/4象限(R2)代表凋亡细胞(Annexin-V+/PI-)
图1 培养不同时间单核细胞凋亡在对照组(A)和HD病人组(B)比较结果
, 百拇医药
二、HD病人新鲜外周血单核细胞线粒体ΔΨm减低:DiOC6(3)进入线粒体基质主要依靠ΔΨm,而不与其它细胞成分结合。正常单核细胞线粒体有较少的染料降低吸收2.1%。然而在HD病人新鲜分离单核细胞线粒体(图2)已出现降低的染料吸收43.7%,这说明ΔΨm已降低,且发生在细胞PS暴露之前。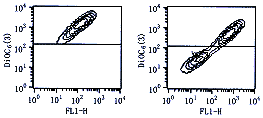
上格代表正常线粒体ΔΨm,下格代表下降的ΔΨm.
图2 正常对照组(左)和病人组(右)单核细胞线粒体ΔΨm改变
三、PT肿胀与ΔΨm降低密切相关:腺嘌呤核苷酸易位器(ANT)是PT孔的重要组成,Atractyloside通过与ANT结合而增加PT渗透性。HD病人新鲜分离单核细胞线粒体肿胀高达(80±6)%,明显超过正常对照组(5±3)%(P<0.001)。由图1、2看出,细胞凋亡时一系列改变相继出现,首先出现PT肿胀,跟着线粒体ΔΨm降低,随后细胞磷酯酰丝氨酸残基暴露。
, 百拇医药
讨 论
单核细胞是机体防御的主要细胞。终末期尿毒症免疫系统已有损害,血液透析本身可以加重这种损害,机理不完全清楚。Heidenreich等[5]报道HD病人体外培养的单核细胞凋亡增加,而且这种凋亡伴随着免疫功能下调。为了探讨HD病人外周血单核细胞凋亡的原因,我们对单核细胞线粒体进行了调查,试图解释这种异常的凋亡。尽管我们检测细胞凋亡的方法很特异,且检测早期细胞凋亡,但我们未发现新鲜分离的HD病人外周血单核细胞凋亡增加,与文献[5]稍有不同。然而随着培养时间的延长,HD病人单核细胞凋亡增加意味着HD病人单核细胞内部异常。线粒体控制细胞凋亡属新的学说,这在一些细胞株已观察到[2~4]。基于此设想,我们对亚细胞成分线粒体进行了探讨。结果支持这一学说,通过特异线粒体探针,我们观察到HD病人新鲜分离的外周血单核细胞线粒体ΔΨm已出现异常。ΔΨm降低或倒塌(breakdown) 会引起一系列改变,它引起能量代谢停止,超氧阴离子产生增加,线粒体钙外流[2,11]。对于PT进一步调查显示HD病人新鲜分离的单核细胞线粒体PT肿胀已达(80±6)%,说明PT异常是导致ΔΨm降低的原因。体外试验[4]已证实缺乏线粒体DNA(mtDNA)的线粒体经历PT渗透肿胀能够引起细胞核凋亡。
, 百拇医药
目前仍不清楚什么原因引起PT孔的开放。Zamzami等[4]报道线粒体PT肿胀时释放一种可溶性蛋白,这种蛋白体外能诱导细胞核凋亡。PT孔的开放将导致细胞浆氧化还原状态的改变,例如谷胱苷肽的产生减少。
线粒体异常和细胞膜改变分子之间的关系仍在探索中。通过对无核细胞和氧化剂处理过的胸腺细胞试验已排除反应性氧代谢产物的参与[2]。细胞凋亡时PS外露可能是由于ATP缺乏引起的外-内PS转换酶失活,而此酶对于保持脂质非均称必不可少[12]。亦可能与可溶性蛋白相关,它能激活内-外PS转换酶或PS抛锚细胞骨架成分的蛋白分解,有利于抛出PS残基[13]。
PT孔的开放可能与胞液钙增加,细胞硫醇氧化和/或胞内葡萄糖储存缺乏相关[14],然而关于PT异常的原因需进一步探讨。
参考文献
, http://www.100md.com
1 Darzynkiewicz Z, Bruno S, Delbino G, et al. Features of apoptotic cell measured by flow cytometry. Cytometry, 1992,13:795-808.
2 Maria C, Tamara H, Santos AS, et al. Sequential acquisition of mitochondrial and plasma membrane alteration during early lymphocyte apoptosis. J Immunol, 1996, 157: 512-521.
3 Patrice XP, Herve L, Zorn E, et al. Alterations in mitochondrial structure and function are early events of dexamethasone induced thymocyte apoptosis. J Cell Bio,1995, 130:157-167.
, 百拇医药
4 Zamzami N, Susin SA, Marchetti P, et al. Mitochondrial control of nuclear apoptosis. J Exp Med, 1996, 183:1533-1544.
5 Heidenreich S, Schmidt M, Bachmann J et al. Apoptosis of monocytes cultured from long-term hemodialysis patients. Kidney Int, 1996, 49:792-799.
6 Vermes I, Haanen C, Nakken HS, et al. A novel assay for apoptosis, flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labeled Annexin V. J Immunol Methods, 1995, 184: 39-51.
, 百拇医药
7 Colotta F, Peri G, Villa A, et al. Rapid killing of actinomycin D-treated tumor cells by human mononuclear cells. J Immunol, 1984, 132: 936-943.
8 Zhang CH, Ao ZH, Seth A, et al. A mitochondrial membrane protein defined by a novel monoclonal antibody is preferentially detected in apoptotic cells. J Immunol, 1996, 157: 3980-3987.
9 Storrie B, Madden EA. Isolation of subcellular organelles. Methods Enzymol, 1990, 182: 203-209.
, 百拇医药
10 Petronilli V, Cola C, Massari S, et al. Physiological effectors modify voltage-sensing by the cyclosporin A-sensitive mitochondrial permeability transition pore. J Biol Chem, 1993, 268:21939-21945.
11 Zamzami N, Marchetti P, Castedo M, et al. Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death. J Exp Med, 1995, 182:367-374.
12 Kroemer G, Petit PX, Zamzami N, et al. The biochemistry of apoptosis. FASEB J, 1995, 9:1277-1282.
, 百拇医药
13 Martin SJ, O′Brien CA, Nishioka WK, et al. Proteolysis of fodrin (non-erythroid spectrin) during apoptosis. J Biol Chem, 1995, 270: 6425-6431.
14 Kan O, Baldwin SA, Whetten AD. Apoptosis is regulated by the rate of glucose transplant in an interleukin 3 dependent cell line. J Exp Med, 1994, 180: 917-923.
(收稿:1998-06-24 修回:1998-10-22), 百拇医药
单位:200080 上海市第一人民医院肾内科(金惠敏、徐琴君、丁言德);中国科学院上海细胞生物学研究所(吴直江、高奇蓉、胡炜)
关键词:血液透析;单核细胞;脱噬作用;流式细胞术
中华医学杂志990310 【摘要】 目的 探讨维持性血液透析(HD)病人外周血单核细胞凋亡与线粒体异常的关系。方法 20例HD病人体外培养的外周血单核细胞以流式细胞术通过荧光素标记的Annexin-V检测早期凋亡细胞的膜表面磷酯酰丝氨酸残基(PS),线粒体跨膜潜能 (ΔΨm) 通过线粒体探针DiOC6(3) 分析。线粒体渗透转移(PT)肿胀通过分光光度计记录。结果 HD病人体外培养的外周血单核细胞在24、72小时自发凋亡(41.4±12.2)%,(22.0±3.0)%,明显超过正常对照组(20.6±8.8)%,(9.8±2.1)%;新鲜分离的单核细胞在病人组和正常对照组细胞凋亡无差异,然而在病人组ΔΨm降低达(43±9)%。HD病人新鲜分离单核细胞PT肿胀高达(80±6)% 明显超过正常对照组(5±3)%。结论 线粒体肿胀和ΔΨm降低是导致HD病人外周血单核细胞凋亡的原因,这是HD病人单核细胞防御功能下降的另一主要因素。
, 百拇医药
Reduction of mitochondrial transmembrane potential constitutes an early event of peripheral blood monocytes apoptosis in hemodialysis patients JIN Hui min, XU Qin jun, WU Zhi jiang*, et al. Department of Nephrology, Shanghai Medical University, Shanghai First People′s Hospital, Shanghai 200080* Shanghai institute of cell biology, the Chinese Academy of Science
【Abstract] Objective To investigate the relationship between monocyte apoptosis and mitochondria function in hemodialysis (HD) patients. Methods Fluorescein labeled Annexin-V was used to detect the phospha-tidyserine (PS) of apoptosis cells, and mitochondrial transmembrane potential was studied by 3,3′-dihexyloxacarbocyanine iodide, DiOC6 (3), and analyzed by flow cytometry. Swelling of mitochondrial permeability transition (PT) was recorded by spectrophotometer.Results Spontaneous apoptosis of cultured monocytes increased at 24, 72 hours in HD patients (41.4±12.2)%、(22.0±3.0)% as compared with controls (20.6±8.8)%、(9.8±2.1)%. Freshly isolated monocytes in HD patients had little apoptosis, but mitochondrial transmembrane potential was reduced to half of disruption (43±9)%. As to swelling of PT, those freshly isolated monocytes mitochondria in HD patients experienced overwhelming opening of PT, (80±5.6)%.Conclusion Swelling of PT and breakdown of mitochondrial transmembrane potential constitute the early events of monocytes apoptosis in HD patients, which could contribute to the impaired monocytes function.
, 百拇医药
【Key words】 Hemodialysis Monocyte Apoptosis Flow cytometry
(Natl Med J China, 1999,79:190-193)
细胞凋亡的形态和生化特点主要表现在细胞核和染色质的改变,早期的文献报道表明[1],细胞凋亡时线粒体的形态和功能不发生改变。随后发现抗凋亡基因bcl-2分布于线粒体内膜和外膜,对传统的细胞核凋亡提出了挑战,这意味着线粒体参与细胞凋亡的调控。一些试验观察到淋巴细胞[2]、胸腺细胞[3],U937细胞和肝细胞[4]线粒体跨膜潜能 (ΔΨm) 的降低将随后发生不可逆转的细胞凋亡。这种ΔΨm降低主要由于线粒体渗透转换孔(PT)开放,随之允许分子量小于1 500和一些蛋白的自由通过,从而导致跨膜潜能的丧失[4]。
, http://www.100md.com
单核细胞是机体主要的防御细胞,Heidenreich等[5]报道HD病人体外培养的单核细胞凋亡增加。根据以上结果,我们对HD病人外周血单核细胞凋亡和线粒体功能进行了调查。
对象和方法
一、对象
HD病人20例,男12例,女8例,平均年龄(42±3.5)岁,平均血液透析时间(3±3.3)年。透析膜为铜仿膜或醋酸纤维素膜,每周透析2~3次。原发病均为慢性肾小球肾炎,所有病人检测时均无感染和原发性免疫系统疾病。对照组18例,均为健康志愿者,男10例,女8例,平均年龄(38±5.0)岁。
二、方法
1.FITC-Annexin-V/碘化丙啶(PI)双染色检测早期细胞凋亡:外周血单核细胞分离按参考文献[7]。主要步骤,全血首先用Ficoll-Hypaque离心(1 800 r/min,20 min),外周血单个核细胞(PBMC)收集后放入46% 等渗Percoll(Pharmacia)上层,然后离心1 900 r/min,30 min,界面白色细胞层即单核细胞,经形态检查和脂酶染色,纯度>95%。细胞凋亡时,磷酯酰丝氨酸残基(PS)从细胞内向细胞膜转移,Annexin-V对PS有高度亲和力,当细胞坏死和凋亡时,PS均存在于细胞膜,利用细胞膜对碘化丙啶通透性的差异鉴别凋亡与坏死。方法:0.5×106单核细胞用PBS洗一次后,细胞沉淀中加入100 μl标记缓冲液[20 μl Annexin V (德国Boehringer公司),20 μl碘化丙啶,1 ml Hepes]室温孵育15 min后,再加0.4 ml孵育缓冲液(10 mmol/L Hepes/NaOH pH 7.4,140 mmol/L NaCl、5 mmol/L CaCl2),流式细胞仪检测。
, 百拇医药
2.ΔΨm测定: 线粒体ΔΨm分析利用线粒体探针3,3′-DIHEXYLOXA-CARBOCYANINE IODIDE DiOC6 (3),它是一种阳离子亲脂染料,借助ΔΨm聚集在线粒体基质[3]。0.5×106单核细胞在含0.1 μmol/L DiOC6 (3)的100 μl PBS液中30 min,流式细胞仪分析(激发波长:488 nm,发射波长:525 nm)。
3.分离纯化单核细胞线粒体: 分离方法参考文献[8]。单核细胞悬于冷的低渗缓冲液(10 mmol/L Hepes pH 7.5、1.5 mmol/L MgCl2、5 mmol/L KCl),超声细胞破碎器破碎细胞,4 ℃离心3 100 r/min 5 min,上清放入Percoll梯度液上,4层分别是10%、18%、30% 和70%,经12 100 r/min 30 min后收集纯化的线粒体在30% 和70% 界面,用0.3 mmol/L甘露醇,5 mmol/L吗啡啉丙磺酸(pH 7.2) 洗一次,后置冰上悬于B缓冲液(400 mmol/L甘露醇,10 mmol/L KH2PO4、5 mg/ml 胎牛血清、50 mmol/L Tris-HCl pH7.2)。经测线粒体标志酶证实,氧化酶氧化细胞色素C通过分光光度计在545 nm记录每分钟吸光度下降[9]。
, 百拇医药
4.分离线粒体渗透转移肿胀测定:测定方法见参考文献[10]。分离纯化的线粒体悬于B缓冲液,后加入100 μl无细胞缓冲液(220 mmol/L甘露醇、68 mmol/L蔗糖、2 mmol/L NaCl、2.5 mmol/L KH2PO4、0.5 mmol/L EGTA、2 mmol/L MgCl2、5 mmol/L丙酮酸、0.1 mmol/L苯*****、1 mmol/L二硫苏糖醇、10 mmol/L Hepes-NaOH pH 7.4),在分光光度计540 nm下记录2 min吸光度下降。5 mmol/L Atractyloside (Sigma公司)在2 min内诱导的吸光度下降定为100% PT肿胀。
5.数据分析:所有数据表达采用均数±标准差,两组之间比较用t检验。
结 果
, 百拇医药 一、HD病人体外培养的单核细胞凋亡:新鲜分离的单核细胞凋亡在病人组和正常对照组无差异(图1)。培养24小时单核细胞凋亡明显增快,病人组细胞凋亡(20.6±8.8)%。对照组(9.8±2.1)%(P<0.05)。培养至72小时HD病人单核细胞凋亡增至(41.4±12.2)%明显超过正常对照组(22.0±3.0)%(P<0.01)。

下左1/4象限代表活细胞(Annexin-V-/PI-).上右1/4象限(R1)代表坏死细胞(Annexin-V+/PI+).下右1/4象限(R2)代表凋亡细胞(Annexin-V+/PI-)
图1 培养不同时间单核细胞凋亡在对照组(A)和HD病人组(B)比较结果
, 百拇医药
二、HD病人新鲜外周血单核细胞线粒体ΔΨm减低:DiOC6(3)进入线粒体基质主要依靠ΔΨm,而不与其它细胞成分结合。正常单核细胞线粒体有较少的染料降低吸收2.1%。然而在HD病人新鲜分离单核细胞线粒体(图2)已出现降低的染料吸收43.7%,这说明ΔΨm已降低,且发生在细胞PS暴露之前。

上格代表正常线粒体ΔΨm,下格代表下降的ΔΨm.
图2 正常对照组(左)和病人组(右)单核细胞线粒体ΔΨm改变
三、PT肿胀与ΔΨm降低密切相关:腺嘌呤核苷酸易位器(ANT)是PT孔的重要组成,Atractyloside通过与ANT结合而增加PT渗透性。HD病人新鲜分离单核细胞线粒体肿胀高达(80±6)%,明显超过正常对照组(5±3)%(P<0.001)。由图1、2看出,细胞凋亡时一系列改变相继出现,首先出现PT肿胀,跟着线粒体ΔΨm降低,随后细胞磷酯酰丝氨酸残基暴露。
, 百拇医药
讨 论
单核细胞是机体防御的主要细胞。终末期尿毒症免疫系统已有损害,血液透析本身可以加重这种损害,机理不完全清楚。Heidenreich等[5]报道HD病人体外培养的单核细胞凋亡增加,而且这种凋亡伴随着免疫功能下调。为了探讨HD病人外周血单核细胞凋亡的原因,我们对单核细胞线粒体进行了调查,试图解释这种异常的凋亡。尽管我们检测细胞凋亡的方法很特异,且检测早期细胞凋亡,但我们未发现新鲜分离的HD病人外周血单核细胞凋亡增加,与文献[5]稍有不同。然而随着培养时间的延长,HD病人单核细胞凋亡增加意味着HD病人单核细胞内部异常。线粒体控制细胞凋亡属新的学说,这在一些细胞株已观察到[2~4]。基于此设想,我们对亚细胞成分线粒体进行了探讨。结果支持这一学说,通过特异线粒体探针,我们观察到HD病人新鲜分离的外周血单核细胞线粒体ΔΨm已出现异常。ΔΨm降低或倒塌(breakdown) 会引起一系列改变,它引起能量代谢停止,超氧阴离子产生增加,线粒体钙外流[2,11]。对于PT进一步调查显示HD病人新鲜分离的单核细胞线粒体PT肿胀已达(80±6)%,说明PT异常是导致ΔΨm降低的原因。体外试验[4]已证实缺乏线粒体DNA(mtDNA)的线粒体经历PT渗透肿胀能够引起细胞核凋亡。
, 百拇医药
目前仍不清楚什么原因引起PT孔的开放。Zamzami等[4]报道线粒体PT肿胀时释放一种可溶性蛋白,这种蛋白体外能诱导细胞核凋亡。PT孔的开放将导致细胞浆氧化还原状态的改变,例如谷胱苷肽的产生减少。
线粒体异常和细胞膜改变分子之间的关系仍在探索中。通过对无核细胞和氧化剂处理过的胸腺细胞试验已排除反应性氧代谢产物的参与[2]。细胞凋亡时PS外露可能是由于ATP缺乏引起的外-内PS转换酶失活,而此酶对于保持脂质非均称必不可少[12]。亦可能与可溶性蛋白相关,它能激活内-外PS转换酶或PS抛锚细胞骨架成分的蛋白分解,有利于抛出PS残基[13]。
PT孔的开放可能与胞液钙增加,细胞硫醇氧化和/或胞内葡萄糖储存缺乏相关[14],然而关于PT异常的原因需进一步探讨。
参考文献
, http://www.100md.com
1 Darzynkiewicz Z, Bruno S, Delbino G, et al. Features of apoptotic cell measured by flow cytometry. Cytometry, 1992,13:795-808.
2 Maria C, Tamara H, Santos AS, et al. Sequential acquisition of mitochondrial and plasma membrane alteration during early lymphocyte apoptosis. J Immunol, 1996, 157: 512-521.
3 Patrice XP, Herve L, Zorn E, et al. Alterations in mitochondrial structure and function are early events of dexamethasone induced thymocyte apoptosis. J Cell Bio,1995, 130:157-167.
, 百拇医药
4 Zamzami N, Susin SA, Marchetti P, et al. Mitochondrial control of nuclear apoptosis. J Exp Med, 1996, 183:1533-1544.
5 Heidenreich S, Schmidt M, Bachmann J et al. Apoptosis of monocytes cultured from long-term hemodialysis patients. Kidney Int, 1996, 49:792-799.
6 Vermes I, Haanen C, Nakken HS, et al. A novel assay for apoptosis, flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labeled Annexin V. J Immunol Methods, 1995, 184: 39-51.
, 百拇医药
7 Colotta F, Peri G, Villa A, et al. Rapid killing of actinomycin D-treated tumor cells by human mononuclear cells. J Immunol, 1984, 132: 936-943.
8 Zhang CH, Ao ZH, Seth A, et al. A mitochondrial membrane protein defined by a novel monoclonal antibody is preferentially detected in apoptotic cells. J Immunol, 1996, 157: 3980-3987.
9 Storrie B, Madden EA. Isolation of subcellular organelles. Methods Enzymol, 1990, 182: 203-209.
, 百拇医药
10 Petronilli V, Cola C, Massari S, et al. Physiological effectors modify voltage-sensing by the cyclosporin A-sensitive mitochondrial permeability transition pore. J Biol Chem, 1993, 268:21939-21945.
11 Zamzami N, Marchetti P, Castedo M, et al. Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death. J Exp Med, 1995, 182:367-374.
12 Kroemer G, Petit PX, Zamzami N, et al. The biochemistry of apoptosis. FASEB J, 1995, 9:1277-1282.
, 百拇医药
13 Martin SJ, O′Brien CA, Nishioka WK, et al. Proteolysis of fodrin (non-erythroid spectrin) during apoptosis. J Biol Chem, 1995, 270: 6425-6431.
14 Kan O, Baldwin SA, Whetten AD. Apoptosis is regulated by the rate of glucose transplant in an interleukin 3 dependent cell line. J Exp Med, 1994, 180: 917-923.
(收稿:1998-06-24 修回:1998-10-22), 百拇医药