雷公藤单体T4对小鼠肺泡吞噬细胞释放细胞因子的影响
作者:邱海波 陈德昌 潘家绮 于德泉 刘大为 马遂
单位:100730 北京,中国医学科学院中国协和医科大学北京协和医院[邱海波(现在南京铁道医学院附属医院),陈德昌、潘家绮、刘大为、马遂];中国医学科学院药物研究所(于德泉)
关键词:
中华医学杂志990331 肺泡吞噬细胞释放炎症介质而引起的异常炎症反应是急性肺损伤的主要原因[1]。中药雷公藤单体T4(T4)具有免疫抑制作用[2],但T4对肺泡吞噬细胞炎症反应的影响尚未见报道。本研究的目的是探讨T4对肺泡吞噬细胞促炎和抗炎介质表达的影响及其机制。
一、材料与方法
1.材料:昆明小鼠(18~22 g)由本院动物所提供。脂多糖(Ecoli 0127: B8)(LPS)、放线菌素D购自Sigma公司,T4由中国医学科学院药物所提供。肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6和IL-10酶联吸附检测盒购自美国Biosource公司。Advantage RT-FOR PCR试剂盒购自美国Clontech公司。
, 百拇医药
2.肺泡吞噬细胞的收集、纯化和鉴定:小鼠拉颈处死后,气管插管,以3 ml生理盐水灌洗全肺,重复3次。灌洗液离心后,将沉淀细胞悬浮于RPMI 1640完全培养基,细胞浓度1×106/ml,加入24孔板。37 ℃、5%CO2培养2小时,去除未贴壁细胞,剩余为肺泡吞噬细胞。过氧化物酶染色鉴定吞噬细胞比例高于95%。
3.TNF-α、IL-1β、IL-6和IL-10及NO产物浓度的检测:严格按试剂盒操作说明书进行。分别观察LPS(10 μg/ml),地塞米松(10-4、10-7 mol/L),T4(5、500 ng/ml),生理盐水对细胞因子释放的影响,每组5只小鼠。
4.RNA制备与RT-PCR:收集细胞,用TRIZOL液提取细胞总RNA。根据试剂盒要求,逆转录合成cDNA。PCR引物序列:TNF-α:正链5′-GCG ACG TGG AAC TGG CAG AAG-3′,负链5′-GGT ACA ACC CAT CGG CTG GCA-3′。PCR扩增片段长度为372 bp;IL-6:正链5′-CCA GTT GCC TTC TTG GA CTG-3′,负链5′-GGT AGC TAT GGT ACT CCA-3′。PCR扩增片段长度为328 bp;IL-10:正链5′-GCT ATG CTG CCT GCT CTT AC-3′,负链5′-CTG GGG CAT CAC TTC TAC C-3′。PCR扩增片段长度为274bp;诱导型一氧化氮合酶(iNOS):正链 5′-CTG CAG GTC TTT GAC GCT CGG-3′,负链 5′-GTG GAA CAC AGG GGT GAT GCT-3′。PCR扩增片段长度为741 bp。G3PDH引物由试剂盒提供,PCR扩增片段983 bp,作为内参照。PCR体系:1μl cDNA,5μl 10×Taq酶缓冲液,1 μl 10 mmol/L dNTP,上下游引物各1 μl,2U Taq酶,补水至50 μl。PCR扩增条件:94 ℃变性30~45秒,58~60 ℃复性30~45秒,72℃延伸1.5~2分钟。循环数均为20,最后72 ℃总延伸7分钟。扩增产物以2%琼脂糖凝胶电泳,结果紫外照像。
, 百拇医药
5.mRNA稳定性检测:按文献方法[3]测定mRNA相对表达量。
6.统计学分析:组间比较采用t检验,数据以均数±标准差表示。
二、结果
1.细胞因子及NO释放的变化:肺泡吞噬细胞受LPS(10 μg/ml)刺激24小时,上清液中TNF-α、IL-1β、IL-6、IL-10及NO浓度显著增加。在LPS刺激的同时加5、500 ng/ml T4或10-4mol/L地塞米松,上述介质浓度均显著降低。但10-7mol/L地塞米松无明显抑制效应(表1)。
表1 药物对LPS诱导的炎症性细胞因子释放的影响(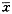 ±s) 组别
±s) 组别
, http://www.100md.com
鼠数
TNF-α
(pg/ml)
IL-1β
(pg/ml)
IL-6
(ng/ml)
IL-10
(pg/ml)
NO-2浓度
(μmol/L)
生理盐水
, 百拇医药
5
104±24*
0*
3.7±1.7*
70± 10*
16± 4*
LPS
5
762±401
489±122
12.8±2.1
, 百拇医药
1500±139
58±13
地塞米松
10-7mol/L
5
498±147
402±116
, http://www.100md.com
6.0±5.8
441±198*
34±11*
10-4mol/L
5
222±170*
151±174*
3.6±1.9*
558± 76*
26± 4*
, 百拇医药
T4
5ng/ml
5
450±214
380± 18
9.7±0.9*
, 百拇医药
652± 92*
37± 6*
500ng/ml
5
198± 32*
13± 16*
6.2±0.1*
518±221*
32± 8*
注:与LPS比较 * P<0.05
, http://www.100md.com
2.细胞因子和iNOS的mRNA表达:与LPS对照相比,地塞米松和T4组上述细胞因子和iNOS的mRNA表达量均明显减少(图1)。

1.生理盐水对照;2.LPS对照;3、4.分别为T4 5和500 ng/ml;5、6分别为地塞米松10-7和10-4mol/L
图1 药物对TNF-α、IL-6、IL-10和iNOS mRNA表达的影响
3.T4对mRNA稳定性的影响:与LPS组比较,T4组肺泡吞噬细胞中TNF-α、IL-6和IL-10的mRNA稳定性均无明显变化。
三、讨论
, 百拇医药
T4是从雷公藤多甙分离提纯得到的活性单体成分,结构为雷藤氯内酯醇(tripchrolide)[2]。有人发现T4抑制肾小球系膜细胞和脐带内皮细胞释放IL-1和IL-6[4,5]。T4对肺泡吞噬细胞炎症反应的影响尚未见报道。本研究发现,T4具有抑制肺泡吞噬细胞促炎反应的作用,T4使LPS诱导的TNF-α、IL-1β和IL-6的释放均明显下降。
肺泡吞噬细胞受LPS刺激后释放IL-10和NO。研究已证实,IL-10和NO均具有抗炎效应,介导代偿性抗炎反应,拮抗TNF-α等介导的促炎反应[1]。T4对抗炎反应的影响尚未见报道。本研究显示,T4对IL-10和NO的释放和mRNA的表达均具有强烈抑制作用,而且具有剂量相关效应,因此,T4对肺泡吞噬细胞的抗炎效应亦具有抑制作用。
本研究还显示,T4既抑制肺泡吞噬细胞TNF-α、IL-6、IL-10和iNOS的mRNA表达,同时不影响mRNA稳定性,提示T4主要通过抑制基因的转录速度而对上述介质发挥抑制作用。当然,是否影响翻译过程尚需进一步研究。同时观察地塞米松的作用,显示T4与地塞米松具有类似效应。对此深入研究,有可能开发出新的免疫调节药物,对急性肺损伤的治疗提供新手段。
, http://www.100md.com
参考文献
1 Meduri GU. The role of the host defence response in the progression and outcome of ARDS: pathophysiological correlations and response to glucocorticoid treatment. Euri Respir J, 1996, 9: 2650-2670.
2 郑家润, 冯方林, 顾克显, 等. 雷公藤抗炎免疫及抗生育活性成分的筛选V. 7个环氧二萜内酯化合物体外对T、B淋巴细胞增殖的影响. 中国医学科学院学报,1994,16:24-27.
3 Sobell HM. Actinomycin D and DNA transcription. Proc Natl Acad Sci USA, 1985, 82: 5328-5331.
4 张利华, 毕曾祺, 李学旺. 雷公藤T4单体对体外培养的肾小球系膜细胞增殖及白介素1产生的影响. 中国医学科学院学报,1994,16:270-274.
5 要庆平, 张乃峥. 雷公藤T4单体对体外培养的脐带静脉内皮细胞增殖和产生IL-6的影响. 中华微生物和免疫杂志,1994,14:329-331.
(收稿:1998-03-04 修回:1998-12-10), 百拇医药
单位:100730 北京,中国医学科学院中国协和医科大学北京协和医院[邱海波(现在南京铁道医学院附属医院),陈德昌、潘家绮、刘大为、马遂];中国医学科学院药物研究所(于德泉)
关键词:
中华医学杂志990331 肺泡吞噬细胞释放炎症介质而引起的异常炎症反应是急性肺损伤的主要原因[1]。中药雷公藤单体T4(T4)具有免疫抑制作用[2],但T4对肺泡吞噬细胞炎症反应的影响尚未见报道。本研究的目的是探讨T4对肺泡吞噬细胞促炎和抗炎介质表达的影响及其机制。
一、材料与方法
1.材料:昆明小鼠(18~22 g)由本院动物所提供。脂多糖(Ecoli 0127: B8)(LPS)、放线菌素D购自Sigma公司,T4由中国医学科学院药物所提供。肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6和IL-10酶联吸附检测盒购自美国Biosource公司。Advantage RT-FOR PCR试剂盒购自美国Clontech公司。
, 百拇医药
2.肺泡吞噬细胞的收集、纯化和鉴定:小鼠拉颈处死后,气管插管,以3 ml生理盐水灌洗全肺,重复3次。灌洗液离心后,将沉淀细胞悬浮于RPMI 1640完全培养基,细胞浓度1×106/ml,加入24孔板。37 ℃、5%CO2培养2小时,去除未贴壁细胞,剩余为肺泡吞噬细胞。过氧化物酶染色鉴定吞噬细胞比例高于95%。
3.TNF-α、IL-1β、IL-6和IL-10及NO产物浓度的检测:严格按试剂盒操作说明书进行。分别观察LPS(10 μg/ml),地塞米松(10-4、10-7 mol/L),T4(5、500 ng/ml),生理盐水对细胞因子释放的影响,每组5只小鼠。
4.RNA制备与RT-PCR:收集细胞,用TRIZOL液提取细胞总RNA。根据试剂盒要求,逆转录合成cDNA。PCR引物序列:TNF-α:正链5′-GCG ACG TGG AAC TGG CAG AAG-3′,负链5′-GGT ACA ACC CAT CGG CTG GCA-3′。PCR扩增片段长度为372 bp;IL-6:正链5′-CCA GTT GCC TTC TTG GA CTG-3′,负链5′-GGT AGC TAT GGT ACT CCA-3′。PCR扩增片段长度为328 bp;IL-10:正链5′-GCT ATG CTG CCT GCT CTT AC-3′,负链5′-CTG GGG CAT CAC TTC TAC C-3′。PCR扩增片段长度为274bp;诱导型一氧化氮合酶(iNOS):正链 5′-CTG CAG GTC TTT GAC GCT CGG-3′,负链 5′-GTG GAA CAC AGG GGT GAT GCT-3′。PCR扩增片段长度为741 bp。G3PDH引物由试剂盒提供,PCR扩增片段983 bp,作为内参照。PCR体系:1μl cDNA,5μl 10×Taq酶缓冲液,1 μl 10 mmol/L dNTP,上下游引物各1 μl,2U Taq酶,补水至50 μl。PCR扩增条件:94 ℃变性30~45秒,58~60 ℃复性30~45秒,72℃延伸1.5~2分钟。循环数均为20,最后72 ℃总延伸7分钟。扩增产物以2%琼脂糖凝胶电泳,结果紫外照像。
, 百拇医药
5.mRNA稳定性检测:按文献方法[3]测定mRNA相对表达量。
6.统计学分析:组间比较采用t检验,数据以均数±标准差表示。
二、结果
1.细胞因子及NO释放的变化:肺泡吞噬细胞受LPS(10 μg/ml)刺激24小时,上清液中TNF-α、IL-1β、IL-6、IL-10及NO浓度显著增加。在LPS刺激的同时加5、500 ng/ml T4或10-4mol/L地塞米松,上述介质浓度均显著降低。但10-7mol/L地塞米松无明显抑制效应(表1)。
表1 药物对LPS诱导的炎症性细胞因子释放的影响(
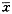 ±s) 组别
±s) 组别, http://www.100md.com
鼠数
TNF-α
(pg/ml)
IL-1β
(pg/ml)
IL-6
(ng/ml)
IL-10
(pg/ml)
NO-2浓度
(μmol/L)
生理盐水
, 百拇医药
5
104±24*
0*
3.7±1.7*
70± 10*
16± 4*
LPS
5
762±401
489±122
12.8±2.1
, 百拇医药
1500±139
58±13
地塞米松
10-7mol/L
5
498±147
402±116
, http://www.100md.com
6.0±5.8
441±198*
34±11*
10-4mol/L
5
222±170*
151±174*
3.6±1.9*
558± 76*
26± 4*
, 百拇医药
T4
5ng/ml
5
450±214
380± 18
9.7±0.9*
, 百拇医药
652± 92*
37± 6*
500ng/ml
5
198± 32*
13± 16*
6.2±0.1*
518±221*
32± 8*
注:与LPS比较 * P<0.05
, http://www.100md.com
2.细胞因子和iNOS的mRNA表达:与LPS对照相比,地塞米松和T4组上述细胞因子和iNOS的mRNA表达量均明显减少(图1)。


1.生理盐水对照;2.LPS对照;3、4.分别为T4 5和500 ng/ml;5、6分别为地塞米松10-7和10-4mol/L
图1 药物对TNF-α、IL-6、IL-10和iNOS mRNA表达的影响
3.T4对mRNA稳定性的影响:与LPS组比较,T4组肺泡吞噬细胞中TNF-α、IL-6和IL-10的mRNA稳定性均无明显变化。
三、讨论
, 百拇医药
T4是从雷公藤多甙分离提纯得到的活性单体成分,结构为雷藤氯内酯醇(tripchrolide)[2]。有人发现T4抑制肾小球系膜细胞和脐带内皮细胞释放IL-1和IL-6[4,5]。T4对肺泡吞噬细胞炎症反应的影响尚未见报道。本研究发现,T4具有抑制肺泡吞噬细胞促炎反应的作用,T4使LPS诱导的TNF-α、IL-1β和IL-6的释放均明显下降。
肺泡吞噬细胞受LPS刺激后释放IL-10和NO。研究已证实,IL-10和NO均具有抗炎效应,介导代偿性抗炎反应,拮抗TNF-α等介导的促炎反应[1]。T4对抗炎反应的影响尚未见报道。本研究显示,T4对IL-10和NO的释放和mRNA的表达均具有强烈抑制作用,而且具有剂量相关效应,因此,T4对肺泡吞噬细胞的抗炎效应亦具有抑制作用。
本研究还显示,T4既抑制肺泡吞噬细胞TNF-α、IL-6、IL-10和iNOS的mRNA表达,同时不影响mRNA稳定性,提示T4主要通过抑制基因的转录速度而对上述介质发挥抑制作用。当然,是否影响翻译过程尚需进一步研究。同时观察地塞米松的作用,显示T4与地塞米松具有类似效应。对此深入研究,有可能开发出新的免疫调节药物,对急性肺损伤的治疗提供新手段。
, http://www.100md.com
参考文献
1 Meduri GU. The role of the host defence response in the progression and outcome of ARDS: pathophysiological correlations and response to glucocorticoid treatment. Euri Respir J, 1996, 9: 2650-2670.
2 郑家润, 冯方林, 顾克显, 等. 雷公藤抗炎免疫及抗生育活性成分的筛选V. 7个环氧二萜内酯化合物体外对T、B淋巴细胞增殖的影响. 中国医学科学院学报,1994,16:24-27.
3 Sobell HM. Actinomycin D and DNA transcription. Proc Natl Acad Sci USA, 1985, 82: 5328-5331.
4 张利华, 毕曾祺, 李学旺. 雷公藤T4单体对体外培养的肾小球系膜细胞增殖及白介素1产生的影响. 中国医学科学院学报,1994,16:270-274.
5 要庆平, 张乃峥. 雷公藤T4单体对体外培养的脐带静脉内皮细胞增殖和产生IL-6的影响. 中华微生物和免疫杂志,1994,14:329-331.
(收稿:1998-03-04 修回:1998-12-10), 百拇医药