急性肺损伤大鼠肺组织细胞凋亡和Fas/FasL表达的改变及其意义
作者:宋勇 毛宝龄 钱桂生 王建春 夏锡荣
单位:210002 南京军区南京总医院呼吸内科(宋勇、夏锡荣);第三军医大学附属新桥医院解放军呼吸病研究所(毛宝龄、钱桂生、王建春)
关键词:
中华医学杂志990330 急性肺损伤(Acute Lung Injury,ALI)病程中,肺血管内皮细胞和肺泡上皮细胞的广泛受损,是本病发病的中心环节[1]。但这类靶细胞受损的确切机制和损伤方式仍不十分清楚。本研究通过复制内毒素性大鼠ALI模型、观察大鼠ALI发生过程中,肺组织细胞凋亡变化以及Fas/FasL系统蛋白质和mRNA表达的改变,探讨细胞凋亡与ALI发生、发展的关系以及在ALI发病中的作用地位。
一、材料与方法
1.材料:健康雄性Wistar大鼠,42只,体重150~250 g。分为内毒素致伤后1、2、4、6、12、24小时组及生理盐水对照组,每组6只。大肠杆菌(O111:B4)内毒素(LPS),购自Sigma公司。细胞凋亡原位检测试剂盒(In Situ Cell Deat h Detection Kit, POD) 、总RNA提取试剂盒(TriPure Isolation Regent)、寡核苷酸探针3′-末端标记试剂盒(Dig Oligonucleotide 3′-end labeling Kit)、地高辛检测试剂盒(Dig Nucleic Acid Detection Kit)均为Boe hringer Mann h eim公司产品。兔抗鼠Fas多克隆抗体(M-20,sc-716), 兔抗鼠FasL多克隆抗体(N-20,sc-834)为Santa Cruz公司产品。SqRT-PCR 试剂购自Promega公司。
, http://www.100md.com
2.ALI模型复制:大鼠经1%戊巴比妥钠40 mg/kg,腹腔麻醉后,分别行颈动、静脉插管,稳定15分钟后、静脉注射LPS 5 mg/kg。标本采集按常规方法。
3.肺组织细胞凋亡原位检测采用TUNEL法,按B.M公司试剂盒提供方法稍加改进进行。计算5个高倍视野(×400)下的凋亡细胞数,凋亡指数以凋亡细胞/100个细胞表示。
4.细胞凋亡DNA片段检测参照文献[2]加以改进。
5.肺组织细胞Fas mRNA、FasL mRNA表达的原位杂交检测。探针序列如下:Fas:5′-TGT GAA AGT CCA GAA CCC TAA GG-3′,FasL: 5′-CCA TAT CTG TCC AGT AGT GC-3′。
6.半定量逆转录PCR(SqRT-PCR):PCR产物的半定量方法采用Tiger 920G图象分析系统,对RT-PCR产物电泳图的Fas(326 bp)、FasL(240 bp)和各自相应的β-actin(587 bp)进行扫描、测得积分吸光度值,结果以Fas、FasL积分吸光度/相应β-actin积分吸光度的比值表示。
, http://www.100md.com
7.肺组织免疫组织化学染色步骤参照试剂盒推荐方法进行。 免疫组织化学对照试验:用正常兔血清或0.01 mol/L PBS代替一抗进行ICC染色。结果判断:采用Tiger920细胞图象分析仪分析图象。在显微镜(×200)下以相同外部条件(亮度)摄取图象,每张切片摄10幅,设定灰度值50~250。得出统计场总面积得积分吸光度值,每张切片取均值。
8.统计学分析:数据以均数±标准差(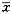 ±s)表示,采用t检验。
±s)表示,采用t检验。
二、结果
1.ALI大鼠肺组织细胞凋亡分布及变化:TUNEL染色阳性以肺泡上皮细胞为主,肺血管内皮细胞、其它间质细胞以及肺部炎性细胞也呈凋亡改变; 内毒素致伤后1小时、2小时未见肺组织出现细胞凋亡,至4小时后凋亡细胞数逐渐增加;生理盐水对照组未见肺组织细胞凋亡现象(表1)。
, http://www.100md.com
表1 ALI大鼠肺组织细胞凋亡的分级 组别
鼠数
细胞凋亡分级
1小时组
6
0(0~0)
2小时组
6
0(0~1)
4小时组
6
1(0~1)
6小时组
, 百拇医药
6
2(1~2)
12小时组
6
2(2~3)
24小时组
6
2(2~3)
对照组
6
0(0~0)
注:按凋亡细胞占细胞总数的百分率将其分为5级:0:<2%;1:3%~9%;2:10%~19%;3:20%~39%;4:>40%
, http://www.100md.com
2.肺组织DNA片段电泳分析:内毒素致伤后4小时肺组织DNA电泳即可出现典型“梯状”(Ladder)带,并随作用时间延长,带形逐渐清晰、明显。6小时、12小时、24小时组所有动物DNA电泳结果均示阳性(图1)。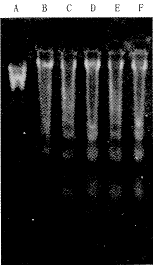
A:λDNA/EcoRI+Hind Ⅲ Marker,B:LPS 2小时组,C:LPS 4小时组,D:LPS 6小时组;E:LPS 12小时组;F:LPS 24小时组
图1 ALI大鼠肺组织DNA电泳
3.肺组织Fas mRNA、FasL mRNA的表达分布及变化:Fas mRNA在LPS致伤4小时后肺组织表达明显增强,阳性信号主要集中在支气管上皮、肺泡上皮细胞和肺部炎性细胞上(图2),而生理盐水对照组及LPS 1小时组未见明确阳性信号。FasL mRNA在实验各组及生理盐水对照组未检出明确阳性信号。SqRT-PCR结果见表2。
, http://www.100md.com
图2 内毒素6小时肺组织Fas mRNA原位杂交(×400)
表2 ALI肺组织FasmRNA、FasLmRNA表达结果的相对比值(A值,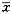 ±s) 组别
±s) 组别
鼠数
Fas
FasL
1小时组
6
0.357±0.072*
0.504±0.055*
, http://www.100md.com
6小时组
6
0.902±0.116*
0.727±0.049*
12小时组
6
0.914±0.047*
0.934±0.043*
24小时组
6
1.282±0.215*
, 百拇医药
1.217±0.228*
对照组
6
0.141±0.014
0.043±0.015
注:与生理盐水对照组比较,* P<0.01
4.肺组织细胞Fas、FasL免疫组织化学分析:结果见表3。
表3 ALI大鼠肺组织Fas、FasL蛋白质表达的变化(A值,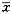 ±s) 组别
±s) 组别
鼠数
, http://www.100md.com
Fas
FasL
1小时组
6
1120±187
1027±143
2小时组
6
2109±201*
2231±199*
4小时组
6
, 百拇医药
2645±244*
2563±226*
6小时组
6
4069±542*
3981±488*
12小时组
6
4328±568*
4205±468*
24小时组
, 百拇医药
6
4782±583*
4677±487*
对照组
6
862±112
754±105
注:与对照组比较,* P<0.01
三、讨论
近年来的一些体外实验表明,一些致病因素如内毒素(LPS),炎性细胞因子(如肿瘤坏死因子等)可诱导肺血管内皮细胞和肺泡Ⅱ型上皮细胞凋亡[3]。临床和实验结果显示,细胞凋亡可发生于急性肺损伤(ALI)的不同阶段和时期[4]。本研究结果发现,大鼠注射LPS后4小时即可见支气管上皮、肺泡上皮细胞和肺血管内皮细胞呈凋亡改变;标记的阳性细胞呈散在的点状或小灶状分布,并随时间延长凋亡率呈上升趋势,而对照组未见上述细胞凋亡改变。提示细胞凋亡存在于ALI病程中;细胞凋亡可能参与ALI早期血管内皮细胞和肺泡上皮细胞受损,可能是急性呼吸窘迫综合征(ARDS)时,肺泡水肿、出血、萎陷,导致进行性呼吸困难等临床表现的原因之一。
, 百拇医药
对ALI大鼠肺组织提取DNA后进行电泳分析发现:LPS注射4小时后即可见肺组织DNA电泳带呈“梯状”,至6小时更趋明显。正常情况下,Fas/FasL系统在维持组织器官内细胞内稳态上占有举足轻重的地位[5]。本研究发现,Fas mRNA、FasL mRNA和蛋白质在肺泡上皮细胞及间质细胞中的表达在LPS注射后明显上调,与对照组比较差异有显著意义。ALI时Fas、FasL表达的增加与肺组织细胞凋亡的增加相一致。提示Fas/FasL系统在ALI发病机制中起着一定的作用。
我们从细胞水平和分子生物学水平三个方面研究观察,证实内毒素ALI早期,肺部靶细胞凋亡增加,Fas/FasL系统表达上调,提示细胞凋亡及相关基因表达异常可能参与ALI的发病机制。掌握ALI发病过程中细胞凋亡异常的规律,将有助于进一步阐明ALI的发病机制。从不同环节和时期对细胞凋亡进行干预和调控将可能成为ALI治疗的一个新途径。
参考文献
, 百拇医药
1 Sessler CN, Bloomfield GL, Fowler AA 3rd. Current concepts of sepsis and acute lung injury. Clin Chest Med,1996,17:213-235.
2 Sellins KS, Cohen JJ. Gene induction by gamma-irradiation leads to DNA fragmentation in lymphocytes . J Immunol, 1987,139:3199-3206.
3 Hiramatsu M, Hotchkiss RS, Karl IE, et al. Cecal ligation and puncture (CLP) induces apoptosis in thymus, spleen, lung, and gut by an endotoxin and TNF-independent pathway. Shock,1997,7:247-253.
, 百拇医药
4 Polunovsky VA,Chen B, Henke C, et al. Role of mesenchymal cell death in lung remodeling after injury. J Clin Invest,1993,92:388-397.
5 Hagimoto N,Kuwano K,Nomoto Y, et al. Apoptosis and expression of Fas/Fas ligand mRNA in bleomycin-induced pulmonary fibrosis in mice. Am J Respir Cell Mol Biol, 1997,16:91-101.
(收稿:1998-08-24 修回:1998-12-15), 百拇医药
单位:210002 南京军区南京总医院呼吸内科(宋勇、夏锡荣);第三军医大学附属新桥医院解放军呼吸病研究所(毛宝龄、钱桂生、王建春)
关键词:
中华医学杂志990330 急性肺损伤(Acute Lung Injury,ALI)病程中,肺血管内皮细胞和肺泡上皮细胞的广泛受损,是本病发病的中心环节[1]。但这类靶细胞受损的确切机制和损伤方式仍不十分清楚。本研究通过复制内毒素性大鼠ALI模型、观察大鼠ALI发生过程中,肺组织细胞凋亡变化以及Fas/FasL系统蛋白质和mRNA表达的改变,探讨细胞凋亡与ALI发生、发展的关系以及在ALI发病中的作用地位。
一、材料与方法
1.材料:健康雄性Wistar大鼠,42只,体重150~250 g。分为内毒素致伤后1、2、4、6、12、24小时组及生理盐水对照组,每组6只。大肠杆菌(O111:B4)内毒素(LPS),购自Sigma公司。细胞凋亡原位检测试剂盒(In Situ Cell Deat h Detection Kit, POD) 、总RNA提取试剂盒(TriPure Isolation Regent)、寡核苷酸探针3′-末端标记试剂盒(Dig Oligonucleotide 3′-end labeling Kit)、地高辛检测试剂盒(Dig Nucleic Acid Detection Kit)均为Boe hringer Mann h eim公司产品。兔抗鼠Fas多克隆抗体(M-20,sc-716), 兔抗鼠FasL多克隆抗体(N-20,sc-834)为Santa Cruz公司产品。SqRT-PCR 试剂购自Promega公司。
, http://www.100md.com
2.ALI模型复制:大鼠经1%戊巴比妥钠40 mg/kg,腹腔麻醉后,分别行颈动、静脉插管,稳定15分钟后、静脉注射LPS 5 mg/kg。标本采集按常规方法。
3.肺组织细胞凋亡原位检测采用TUNEL法,按B.M公司试剂盒提供方法稍加改进进行。计算5个高倍视野(×400)下的凋亡细胞数,凋亡指数以凋亡细胞/100个细胞表示。
4.细胞凋亡DNA片段检测参照文献[2]加以改进。
5.肺组织细胞Fas mRNA、FasL mRNA表达的原位杂交检测。探针序列如下:Fas:5′-TGT GAA AGT CCA GAA CCC TAA GG-3′,FasL: 5′-CCA TAT CTG TCC AGT AGT GC-3′。
6.半定量逆转录PCR(SqRT-PCR):PCR产物的半定量方法采用Tiger 920G图象分析系统,对RT-PCR产物电泳图的Fas(326 bp)、FasL(240 bp)和各自相应的β-actin(587 bp)进行扫描、测得积分吸光度值,结果以Fas、FasL积分吸光度/相应β-actin积分吸光度的比值表示。
, http://www.100md.com
7.肺组织免疫组织化学染色步骤参照试剂盒推荐方法进行。 免疫组织化学对照试验:用正常兔血清或0.01 mol/L PBS代替一抗进行ICC染色。结果判断:采用Tiger920细胞图象分析仪分析图象。在显微镜(×200)下以相同外部条件(亮度)摄取图象,每张切片摄10幅,设定灰度值50~250。得出统计场总面积得积分吸光度值,每张切片取均值。
8.统计学分析:数据以均数±标准差(
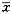 ±s)表示,采用t检验。
±s)表示,采用t检验。二、结果
1.ALI大鼠肺组织细胞凋亡分布及变化:TUNEL染色阳性以肺泡上皮细胞为主,肺血管内皮细胞、其它间质细胞以及肺部炎性细胞也呈凋亡改变; 内毒素致伤后1小时、2小时未见肺组织出现细胞凋亡,至4小时后凋亡细胞数逐渐增加;生理盐水对照组未见肺组织细胞凋亡现象(表1)。
, http://www.100md.com
表1 ALI大鼠肺组织细胞凋亡的分级 组别
鼠数
细胞凋亡分级
1小时组
6
0(0~0)
2小时组
6
0(0~1)
4小时组
6
1(0~1)
6小时组
, 百拇医药
6
2(1~2)
12小时组
6
2(2~3)
24小时组
6
2(2~3)
对照组
6
0(0~0)
注:按凋亡细胞占细胞总数的百分率将其分为5级:0:<2%;1:3%~9%;2:10%~19%;3:20%~39%;4:>40%
, http://www.100md.com
2.肺组织DNA片段电泳分析:内毒素致伤后4小时肺组织DNA电泳即可出现典型“梯状”(Ladder)带,并随作用时间延长,带形逐渐清晰、明显。6小时、12小时、24小时组所有动物DNA电泳结果均示阳性(图1)。

A:λDNA/EcoRI+Hind Ⅲ Marker,B:LPS 2小时组,C:LPS 4小时组,D:LPS 6小时组;E:LPS 12小时组;F:LPS 24小时组
图1 ALI大鼠肺组织DNA电泳
3.肺组织Fas mRNA、FasL mRNA的表达分布及变化:Fas mRNA在LPS致伤4小时后肺组织表达明显增强,阳性信号主要集中在支气管上皮、肺泡上皮细胞和肺部炎性细胞上(图2),而生理盐水对照组及LPS 1小时组未见明确阳性信号。FasL mRNA在实验各组及生理盐水对照组未检出明确阳性信号。SqRT-PCR结果见表2。

, http://www.100md.com
图2 内毒素6小时肺组织Fas mRNA原位杂交(×400)
表2 ALI肺组织FasmRNA、FasLmRNA表达结果的相对比值(A值,
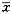 ±s) 组别
±s) 组别鼠数
Fas
FasL
1小时组
6
0.357±0.072*
0.504±0.055*
, http://www.100md.com
6小时组
6
0.902±0.116*
0.727±0.049*
12小时组
6
0.914±0.047*
0.934±0.043*
24小时组
6
1.282±0.215*
, 百拇医药
1.217±0.228*
对照组
6
0.141±0.014
0.043±0.015
注:与生理盐水对照组比较,* P<0.01
4.肺组织细胞Fas、FasL免疫组织化学分析:结果见表3。
表3 ALI大鼠肺组织Fas、FasL蛋白质表达的变化(A值,
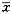 ±s) 组别
±s) 组别鼠数
, http://www.100md.com
Fas
FasL
1小时组
6
1120±187
1027±143
2小时组
6
2109±201*
2231±199*
4小时组
6
, 百拇医药
2645±244*
2563±226*
6小时组
6
4069±542*
3981±488*
12小时组
6
4328±568*
4205±468*
24小时组
, 百拇医药
6
4782±583*
4677±487*
对照组
6
862±112
754±105
注:与对照组比较,* P<0.01
三、讨论
近年来的一些体外实验表明,一些致病因素如内毒素(LPS),炎性细胞因子(如肿瘤坏死因子等)可诱导肺血管内皮细胞和肺泡Ⅱ型上皮细胞凋亡[3]。临床和实验结果显示,细胞凋亡可发生于急性肺损伤(ALI)的不同阶段和时期[4]。本研究结果发现,大鼠注射LPS后4小时即可见支气管上皮、肺泡上皮细胞和肺血管内皮细胞呈凋亡改变;标记的阳性细胞呈散在的点状或小灶状分布,并随时间延长凋亡率呈上升趋势,而对照组未见上述细胞凋亡改变。提示细胞凋亡存在于ALI病程中;细胞凋亡可能参与ALI早期血管内皮细胞和肺泡上皮细胞受损,可能是急性呼吸窘迫综合征(ARDS)时,肺泡水肿、出血、萎陷,导致进行性呼吸困难等临床表现的原因之一。
, 百拇医药
对ALI大鼠肺组织提取DNA后进行电泳分析发现:LPS注射4小时后即可见肺组织DNA电泳带呈“梯状”,至6小时更趋明显。正常情况下,Fas/FasL系统在维持组织器官内细胞内稳态上占有举足轻重的地位[5]。本研究发现,Fas mRNA、FasL mRNA和蛋白质在肺泡上皮细胞及间质细胞中的表达在LPS注射后明显上调,与对照组比较差异有显著意义。ALI时Fas、FasL表达的增加与肺组织细胞凋亡的增加相一致。提示Fas/FasL系统在ALI发病机制中起着一定的作用。
我们从细胞水平和分子生物学水平三个方面研究观察,证实内毒素ALI早期,肺部靶细胞凋亡增加,Fas/FasL系统表达上调,提示细胞凋亡及相关基因表达异常可能参与ALI的发病机制。掌握ALI发病过程中细胞凋亡异常的规律,将有助于进一步阐明ALI的发病机制。从不同环节和时期对细胞凋亡进行干预和调控将可能成为ALI治疗的一个新途径。
参考文献
, 百拇医药
1 Sessler CN, Bloomfield GL, Fowler AA 3rd. Current concepts of sepsis and acute lung injury. Clin Chest Med,1996,17:213-235.
2 Sellins KS, Cohen JJ. Gene induction by gamma-irradiation leads to DNA fragmentation in lymphocytes . J Immunol, 1987,139:3199-3206.
3 Hiramatsu M, Hotchkiss RS, Karl IE, et al. Cecal ligation and puncture (CLP) induces apoptosis in thymus, spleen, lung, and gut by an endotoxin and TNF-independent pathway. Shock,1997,7:247-253.
, 百拇医药
4 Polunovsky VA,Chen B, Henke C, et al. Role of mesenchymal cell death in lung remodeling after injury. J Clin Invest,1993,92:388-397.
5 Hagimoto N,Kuwano K,Nomoto Y, et al. Apoptosis and expression of Fas/Fas ligand mRNA in bleomycin-induced pulmonary fibrosis in mice. Am J Respir Cell Mol Biol, 1997,16:91-101.
(收稿:1998-08-24 修回:1998-12-15), 百拇医药