Gemcitabine治疗晚期非小细胞肺癌的临床研究
作者:管忠震* 陈茹琴 徐光川 李宇红 许立功 李龙云 刘叙仪 廖美琳 李金瀚
单位:管忠震 陈茹琴 徐光川 李宇红(中山医科大学肿瘤防治中心Δ(广州510060));许立功(上海医科大学肿瘤医院(上海,200030));李龙云(北京协和医院(北京,100021));刘叙仪(北京市肿瘤医院(北京,100036));廖美琳(上海胸科医院(上海,200030));李金瀚(第一军医大学南方医院(广州510515)※通讯作者;Δ项目负责单位;)
关键词:健择/治疗应用;非小细胞肺癌;临床试验
癌症990302
【摘要】目的:评价Gemcitabine(中文译名:健择)单药及其与顺氯铵铂联合化疗方案治疗III、IV期非小细胞肺癌(NSCLC)的临床疗效及其不良反应。材料与方法:1.健择单药研究:从1997年9月至1998年5月入选III、IV期NSCLC病人21例,以前未接受过任何化疗、放疗。III期病人11例,IV期病人10例。健择1000mg/m2,第1,8,15天各注一次,每28天为一疗程。2.健择与顺氯铵铂联合化疗研究:从1997年10月至1998年7月入选III、IV期NSCLC病人48例,以前未接受过任何化疗、放疗。III期病人19例,IV期病人29例。健择1000mg/m2,第1,8,15天各注一次;顺氯铵铂100mg/m2,第一天用,每28天为一疗程。结果:1.健择单药研究:可评价疗效的有19例,6例获部分缓解(PR),其中2例(10.5%)经4周以上复查证实。总有效率31.5%[95%CI,9.4%~45.15%]。全组均可评价不良反应,少数病人发生轻微胃肠道反应、白细胞下降、血红蛋白下降和血小板下降,只有4.8%(各1例)患者发生III度的恶心呕吐及白细胞下降,有1例患者发生III度感染。全组中位生存期6.13月。2.健择与顺氯铵铂联合化疗研究:可评价疗效的有41例,23例获部分缓解(PR),其中18例(43.9%)经4周以上复查证实。总有效率56.1%[95%CI,39.8%~71.5%]。48例可评价不良反应。约1/3分别发生III、IV度的恶心呕吐、白细胞下降和血红蛋白下降,18.75%(9例)病人发生III度血小板下降。其它毒副作用皆轻度可耐受。因毒性反应而健择减量和停药次数有39次(24.37%)。全组中位生存期8.9月。结论:健择单药治疗晚期NSCLC有一定的客观疗效,不良反应轻微。健择与顺氯铵铂联合治疗晚期NSCLC有较好的疗效,毒副作用可耐受,是治疗NSCLC较理想的治疗方案。
, 百拇医药
中图号:R734.2;R730.53 文献标识码:A 文章编号:1000-467X(1999)03-0241-05
Gemcitabine in the treatment of advanced non-small-cell lung cancer
GUAN Zhong-zhen, CHEN Ru-qin, XU Guang-chuan, et al.
Medical Oncology Department of Cancer Center, Sun Yat-sen University of
Medical Sciences, Guangzhou 510060,China
【Abstract】 Objective:The aim of the study was to evaluate the clinical efficacy and toxicity of Gemcitabine single-drug and gemcitabine-cisplatin combination in advanced non-small-cell lung cancer (NSCLC). Methods:1. gemcitabine single-drug study:Twenty-one previously untreated NSCLC patients entered the trial from September 1997 to May 1998. gemcitabine 1000 mg/m2 was administeredon days 1,8 and 15 in each 28-day cycle. 2. Gemcitabine-Cisplatin combination study:Forty-eight previously untreated NSCLC patients entered the trial from October 1997 to July 1998. Gemcitabine 1000 mg/m2 was administered on days 1,8 and 15 and Cisplatin 100 mg/m2, on day 1 in each 28-day cycle. Results:1. Gemcitabine single-drug study:Of 19 assessable patients, 6 achieved a partial response (PR), and among them 2(10.5%) were confirmed PR. The overall response rate was 31.6% (95% confidence interval [CI], 9.4% to 45.15%). 21 patients can be evaluated the toxicity. A minor proportion of patients experienced mild G-I reaction, leukopenia, thrombocytopenia and decreased hemoglobin levels. Only 4.8% (1 patient each) of the patients experience grade III leukopenia and nausea/ vomiting. One patient experienced grade III infection. The median survival of the whole group was 6.13 months. 2. Gemcitabine-cisplatin combination study:Of 41 assessable patients, 23 achieved a partial response (PR), and among them 18(43.9%) were confirmed PR. The overall response rate was 56.1% (95% confidence interval [CI], 39.8% to 71.5%). 48 patients can be evaluated for toxicity. About 1/3 of the patients experienced grade III-IV nausea/vomiting and leukopenia and decreased hemoglobin. 18.75% (9 patients) experienced grade III thrombocytopenia. The other toxicity was mild and tolerable. 39 cycles (24.37%) of gemcitabine injections were dose-reduced or omitted due to toxicity. The median survival of the whole group was 8.9 months. Conclusion:The single-drug gemcitabine induced an objective efficacy in advanced NSCLC, with modest side effects. The gemcitabine-cisqlatin combination regime was effective and well tolerated in the treatment of advanced NSCLC, it could be considered as one of the recommended standard regime.
, 百拇医药
Key words:Gemcitabine/Therapeutic Use; Non Small Cell Lung Cancer (NSCLC);Clinical Trial
健择是阿糖胞苷类似物,属抗代谢类抗癌药。它在体内被转化为dFdCTP(双氟脱氧三磷酸胞苷),可掺入DNA使DNA链断裂,从而起到细胞毒作用。本产品系由美国EliLilly药厂研究开发,已获准在美国、欧盟15国、澳大利亚和南非等地上市,国外临床研究〔1~6〕证明对非小细胞肺癌、胰腺癌等有效。Anderson等〔7〕报告本产品单药治疗非小细胞肺癌332例,客观缓解(PR)率20%。主要不良反应为中性粒细胞减少,III-IV度者约25%,另有12%患者发生短暂的转氨酶升高。
本产品申请在中国注册,卫生部药政局于1997年6月23日下达A96029533-163号文件批准进行60例临床验证,并指定由中山医科大学肿瘤医院部属临床试验基地为负责单位。
, 百拇医药
根据卫生部下达任务,我们组织了临床研究协作组,参加单位有第一军医大学南方医院、上海医科大学肿瘤医院、上海胸科医院、北京协和医院、北京市肿瘤医院5家医院。并制定了临床验证方案,对健择治疗非小细胞型肺癌的疗效及毒性进行验证研究。本项研究开始前,曾报请中山医科大学医学伦理委员会审核批准。所有受试者均签署了《知情同意书》。
为了客观准确地验证本产品对中国非小细胞肺癌病人的疗效与安全性,又兼顾受试者的治疗需要,研究计划分为两部分:计划收治20例(实际入组21例)患者单用健择治疗;另收治40例(实际入组48例)采用健择合并顺氯氨铂(CDDP)治疗。现分别报告如下。
1 健择单药治疗研究
1.1 收治标准
(1)组织学/细胞学证实的III~IV期非小细胞型肺癌,已不适宜手术或放疗者;
, 百拇医药
(2)过去未经化疗(包括健择治疗);
(3)过去未经或曾经放疗(总量<60Gy),但放疗部位必须非唯一可测病灶部位,且已停用放疗至少3周;
(4)身体功能状况(P.S)卡氏70分以上;
(5)有可测肿瘤病灶;
(6)预期寿命12周以上;
(7)患者依从性好,便于随诊;
(8)骨髓造血功能无明显受损(白细胞≥3.5×109/L,血小板≥100×109/L,Hb≥9.0g/dL,肝肾功能正常,无脑转移);
(9)性别不限,年龄18岁以上;
, http://www.100md.com
(10)签署<知情同意书>;
(11)试验中及试验结束后3个月,生育可能被手术、放射、绝经所终止;或使用可靠的避孕方法(IUD,避孕药或避孕设施)减少怀孕可能。
1.2 排除标准
(1)活动性感染(根据研究者的判断)
(2)临床证据显示中枢神经系统(CNS)转移或预防性中枢放射,肝功能异常:胆红素>正常值上限1.5倍,转氨酶ALT/AST>正常值上限3倍(ALT及AST在已有肝转移病人中可升高5倍;
(3)肾功能异常:血清肌酐值>正常上限值1.25倍;
(4)孕妇或哺乳期妇女;
(5)合并重要脏器功能障碍,不能耐受本研究(由研究者判断);
, http://www.100md.com
(6)合并第二种恶性肿瘤。但以下情况例外:宫颈原位癌、便于治疗的皮肤基底细胞癌或恶性肿瘤治愈超过5年且入组前没有复发的;
(7)同时合并其它试验性药物或正参加其它的临床试验。
1.3 试验药物剂量和给药方式
健择在第1,8和15天各用一次,每28天为一周期。一个周期定义为连续3个星期的治疗及1周的休息。健择1000mg/m2在约30~60分钟(30分钟的输注认为是理想的)内静脉输注。病人的体表面积在每一周期开始时根据其身高及实际体重计算得出。最少应用4周期,除非病人明显不能从本治疗得益。
1.4 周期内剂量调整
周期内剂量调整应根据表1及表2中的指导原则进行。在接受研究药物治疗前24小时内,根据每周白细胞、血小板计数及非血液学毒性的临床评估进行剂量调整。
, 百拇医药
表1 血液学毒性 白细胞总数
(×109/L)
血小板(109/L)
用药剂量占全量的%
>2.5
和
>75
100
1.0~2.5
或
50~75
75
, 百拇医药
<1.0
或
<50
取消
表2 非血液学毒性 WHO分级
用药剂量占全量的%
0~2度(以及3度的恶心/恶心)
100
3度(恶心/呕吐除外)
75或取消*
4度
取消
, http://www.100md.com
*应由非血液学毒性的类型决定及医生研究者判断取消哪一次给药最合理.#脱发(任何等级)均不是剂量减少的指征。
1.5 治疗计划
(1)本项研究为III期开放临床试验,不设对照组。
(2)符合入选标准的患者,在完成病史/体检、P.S.评定,影像学检查并记录病灶测量,全血象,肝肾功能,心电图,体重测量后,给患者静脉注射健择。
(3)每周期注射前复查血象及血液生化检查,每2周期影像学复查及作肿瘤病灶测量。
(4)治疗后复查:按WHO标准,评定治疗反应:CR,PR,SD或PD。以CR及PR患者计算总缓解率。
(5)已取得CR或PR患者,应在相距至少4周后再作临床及/或影像学检查,测量肿瘤病灶,如仍达CR或PR标准,则CR或PR被认为<证实>(Confirmed)。治疗后SD的患者,至少应接受4周期的治疗。治疗后达到PD标准者,即出组,考虑其他治疗。
, http://www.100md.com
(6)治疗后尚应观察血象、血液生化及心电图和临床表现,按WHO急性、亚急性毒性反应分级标准记录不良反应。出现明显血象下降或非血液毒性反应者,按试验计划规定调整剂量或终止治疗。
1.6 结果
1.6.1 收治人数:共收治21例,均可评价不良反应。能评价疗效者19例,2例不能评价疗效。其中1例系在用健择1次后,发现患者已有脑转移,不符合入选标准而中止试验。另1例73岁女性患者治疗2周期后尚未作病灶复查突发急性心脏病死亡,无法对病灶评价,负责医师认为此例死亡与验证药物无关。
1.6.2 患者一般资料:男14例,女7例。年龄范围43~77岁,中位年龄60岁。KPS70分1例,80分10例,90分10例。病理类型:鳞癌5例,腺癌14例,腺鳞癌1例,“非小细胞肺癌”未分型1例。过去治疗:全部未经手术(活检除外)、放疗或化疗。分期及病灶情况:III期11例,IV期10例;单病灶者10例,多病灶者11例;可测量病灶共38处,除肺内21处外,锁上淋巴结9处,纵隔肺门淋巴结4处,其他4处;不可测量病灶,包括胸水4例,骨转移4例,其他11例。
, http://www.100md.com
1.6.3 用药剂量及周期数:除1例仅用健择1次即出组外,余20例,每例用药1~6周期不等,平均用药4周期。各周期均能按计划全剂量给药。
1.6.4 辅助用药:有13例曾使用5-HT3受体抑制剂预防呕吐。无1例使用G-CSF或输白细胞/血小板。
1.6.5 疗效:全组能评价疗效的19例中,6例获PR(31.5%),其中2例(10.5%)经4周以上复查证实。无1例获CR。6例治疗后病情稳定(SD),7例病情进展(PD)。总结时8例已死亡,存活时间1~6个月;13例仍存活,至末次随访时间存活1~9个月。全组中位存活时间(MedianSurvival)6.13月。本组患者KaplanMeier存活曲线见图1。
图1 健择单药治疗Kaplan-Meier生存曲线
, 百拇医药
1.6.6 不良反应:本组病例不良反应轻微,只有4.8%患者发生III度白细胞下降及恶心呕吐,详见表3。
表3 单用键择组的不良反应(n=21) 毒副反应
毒副反应分级
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅲ+Ⅳ(%)
恶心/呕吐
12
3
, 百拇医药
5
1
0
4.8
食欲不振
16
5
0
0
0
0
腹泻
18
2
, 百拇医药
1
0
0
0
口腔炎
20
0
1
0
0
0
静脉炎
20
1
, 百拇医药
0
0
0
0
皮疹、搔痒
13
7
1
0
0
0
头晕
20
1
, http://www.100md.com
0
0
0
0
肢端麻木
21
0
0
0
0
0
血红蛋白
11
7
, http://www.100md.com
3
0
0
0
白细胞↓
8
9
3
1
0
4.8
中性粒
细胞↓
16
, 百拇医药
3
2
0
0
0
血小板↓
18
2
1
0
0
0
出血症状
21
, 百拇医药
0
0
0
0
0
发热
11
4
6
0
0
0
合并感染
18
, 百拇医药
1
1
1
0
4.8
肝功改变
18
3
0
0
0
0
肾功改变
19
, http://www.100md.com
2
0
0
0
0
心脏毒性
21
0
0
0
0
0
脱发
20
, http://www.100md.com
1
0
0
0
0
腹痛
20
1
0
0
0
0
呼吸困难
20
, 百拇医药
0
1
0
0
0
支气管痉挛
20
0
1
0
0
0
1.6.7 小结:21例晚期非小细胞肺癌患者,过去均未经化疗,试用健择单药治疗后,19例可评价疗效。试验结果表明使用健择单药化疗,每周一次,每次1000mg/m2静脉滴注,连用3周,每28天为一周期的重复治疗的方案,易于耐受,毒副反应轻微,只有少数患者发生且多为I~II级的恶心呕吐及血象下降。31.5%患者治疗后达到PR,其中10.5%为疗效证实持续4周以上的PR(ConfirmedPR)。
, 百拇医药
2 健择联合化疗研究
2.1 收治标准排除标准
与单药研究相同。
2.2 剂量和给药方式
每28天为一周期。每周期第1,8,15日静脉滴注健择1000mg/m2,30~60分钟内滴完。第1日滴完健择后,再静脉滴注Cisplatin100mg/m2,用30~120分钟滴完,同时应适当给予治疗前后水化。
除上述治疗药物改变外,其余与单药研究相同。
2.3 周期内剂量调整
与健择单药研究相同。
2.4 研究计划
, 百拇医药
与健择单药研究相同。
2.5 结果
2.5.1 收治人数:共入组48例,均可评价不良反应。其中41例可评价疗效,7例不能评价疗效,原因分别为:1例无可测量病灶,1例并用了干扰素治疗,均不符合入组标准;2例第一疗程后发现有脑转移,1例仅用药1次后发生急性肾衰退出研究,2例系患者因经济等原因要求退出,且病灶均未作复查。
2.5.2 患者一般情况:男35例,女13例。年龄范围34~76岁,中位年龄58岁。KPS评分均在70分以上,其中30例90分,2例100分。鳞癌13例,腺癌33例,腺鳞癌2例。全部未经手术或放疗、化疗。入组时III期为19例,IV期为29例。单病灶者21例,多病灶26例,可测量病灶共96处。可测病灶部位,除肺内44例,锁上淋巴结9例,肺门纵隔淋巴结11例,其他部位淋巴结10例外,尚有皮下结节1例,肝内病灶3例,其他1例。不可测量病灶包括胸水2例,骨转移18例,其他15例(主要为肺和淋巴结的不可测量病灶)。
, 百拇医药
2.5.3 用药剂量及周期数:每例用药1~8个周期不等,平均3个周期。所用剂量,健择121周期使用全量,39周期需减量,实际每周期平均用量为934.32mg/m2。DDP153周期可用全量,7个周期需减量,实际每周期平均用量为99.5mg/m2。
2.5.4 辅助用药:22例曾使用G-CSF,47例曾使用5-HT3受体抑制剂,37例曾使用胃复安。没有病人输白细胞或血小板。
2.5.5 疗效:全组可评价疗效的41例中,无人获CR,23例曾达PR(56.1%),其中间隔4周以上复查证实达PR疗效者(ConfirmedPR)共18例,占43.9%。95%可信区间为28.5%~60.3%,中位缓解时间174±18.5天(见图2)。9例治疗后病情稳定(SD),9例病情进展(PD)。总结时11例已死亡,存活时间75~267天,37例仍存活,计算至末次随访,存活17天(失访)至345天,全组中位存活时间267天。本组患者KaplanMeier存活曲线见图3。从图3中可见,约80%患者存活时间达200天以上。全组中位病变进展时间229±24.18天(见图4)。
, http://www.100md.com
图2 健择与顺铂联合化疗缓解时间曲线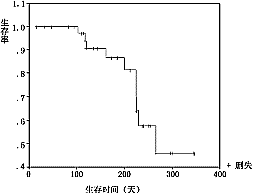
图3 健择与顺铂联合化疗生存曲线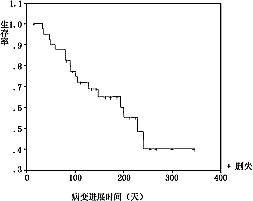
图4 健择与顺铂联合化疗病变进展时间
2.5.6 不良反应:详见表4。从表中可见,约1/3患者分别发生III-IV度的恶心呕吐及白细胞和血红蛋白的下降。1例病人发生急性肾衰,负责医生认为与健择无关,可能与DDP的毒性有关。
表4 健择+DDP组的不良反应(n=48) 毒副反应
毒副反应分级
0
, http://www.100md.com
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅲ+Ⅳ(%)
恶心/呕吐
7
9
16
12
4
33.3
食欲不振
44
, 百拇医药
4
0
0
0
0
腹泻
42
4
0
2
0
6.25
口腔炎
45
, 百拇医药
0
30
0
0
0
静脉炎
44
4
0
0
0
0
皮疹
38
, 百拇医药
2
8
0
0
0
头晕
44
4
0
0
0
0
肢端麻木
47
, http://www.100md.com
1
0
0
0
0
血红蛋白
9
8
14
14
3
35.4
白细胞
6
, http://www.100md.com
9
17
14
2
33.3
中性粒细胞
8
9
14
13
4
35.4
血小板
20
, 百拇医药
8
11
8
1
18.75
出血症状
45
1
1
1
0
2.1
发热
34
, 百拇医药
6
8
0
0
0
合并感染
37
4
5
2
0
4.2
ALT、AST
改变
, 百拇医药
42
2
3
1
0
2.1
ALP改变
38
9
1
0
0
0
BILIRUBIN改变
, http://www.100md.com
46
2
0
0
0
0
肾功能改变
42
4
1
0
1(肾衰)
2.1
心脏毒性
, 百拇医药
46
1
1
0
0
0
脱发
20
22
5
1
0
2.1
精神状态
, 百拇医药
46
2
0
0
0
0
例秘
32
13
3
0
0
0
肺
, http://www.100md.com
44
3
0
1
1
2.1
血尿
45
2
1
0
0
0
蛋白尿
, http://www.100md.com
40
4
4
0
0
0
听力
45
1
2
0
0
0
低血压
, 百拇医药
47
1
0
0
0
0
胸痛
47
1
0
0
0
0
血痰
, http://www.100md.com
47
1
0
0
0
0
流感综合症
47
1
0
0
0
0
耳鸣
, http://www.100md.com
47
1
0
0
0
0
烦躁不安
47
1
0
0
0
0
失眠
, 百拇医药
47
1
0
0
0
0
疲倦
45
3
0
0
0
0
衰弱
, 百拇医药
46
2
0
0
0
0
脸红
46
2
0
0
0
0
2.5.7 小结:本项联合化疗研究显示,DDP加Gemcitabine方案患者较易耐受,主要不良反应为恶心呕吐及白细胞/血红蛋白下降。41例可评价疗效的病例中,23例(56.1%)获PR,其中18例(43.9%)为ConfirmedPR,疗效较为满意。
, http://www.100md.com
3 结论
本项研究共入选69例晚期非小细胞肺癌患者,其中单用健择治疗21例,健择合并DDP治疗48例。结果显示:健择毒副反应较缓和,病者易于耐受,单药治疗对非小细胞肺癌有一定疗效,31.5%获PR,其中10.5%为确证PR(ConfirmedPR)。健择合并DDP治疗非小细胞肺癌48例,毒副作用可耐受,疗效较明显,56.1%可获PR,其中43.9%为确证PR(ConfirmedPR)。以上研究结果证实,健择是治疗非小细胞肺癌较安全有效的抗癌药物,Gemzar+DDP是治疗非小细胞肺癌较理想的治疗方案,副反应易耐受,疗效满意。
参考文献:
1 Castellano D, Lianes P, Paz-Ares L, et al. A phase II study of a novel gemcitabine plus cisplatin regimen administered every three weeks for advanced non small cell lung cancer〔J〕. Ann Oncol, 1998,9(4): 457~ 459.
, http://www.100md.com
2 Abratt RP, Bezwoda WR, Goedhals L, et al. Weekly gemcitabine with monthly cisplatin: effective chemotherapy for advanced non-small-cell lung cancer〔J〕. J Clin Oncol, 1997,15(2):744~749.
3 Crino L, Scagliotti G, Marangolo M, et al. Cisplatin-gemcitabine combination in advanced non- small-cell lung cancer:a phase II study〔J〕. J Clin Oncol, 1997, 15(1):297~ 303.
4 Gonzalez-Baron M, Ordonez A, Gracia M, et al. Gemcitabine and cisplatin in advanced non-small cell lung cancer (NSCLC):results from a phase II study (Meeting abstract)〔J〕. Proc Annu Meet Am Soc Clin Oncol, 1997, 16:A1687.
, http://www.100md.com
5 Crino L, Mosconi AM, Scagliotti GV, et al. Gemcitabine as second-line treatment for relapsing or refractory advanced non-small cell lung cancer:a phase II trial〔J〕. Semin Oncol, 1998,25(4 Suppl.):23~26.
6 Fukuoka M, Takada M, Yokohama A, et al. Phase II studies of gemcitabine for non-small cell lung cancer in Japan〔J〕. Semin Oncol, 1997,24(2 Suppl. 7):S742~ S746.
7 She pherd FA,RP, Anderson H, et al. Gemcitabine in the treat ment of elderly patients with advanced non-smdll-cell lung cancer〔J〕. Seminars in Oncology,1997,24(2 Suppl 7):S7-50~S7-55.
收稿日期:1999-05-05;修回日期:1999-05-10, 百拇医药
单位:管忠震 陈茹琴 徐光川 李宇红(中山医科大学肿瘤防治中心Δ(广州510060));许立功(上海医科大学肿瘤医院(上海,200030));李龙云(北京协和医院(北京,100021));刘叙仪(北京市肿瘤医院(北京,100036));廖美琳(上海胸科医院(上海,200030));李金瀚(第一军医大学南方医院(广州510515)※通讯作者;Δ项目负责单位;)
关键词:健择/治疗应用;非小细胞肺癌;临床试验
癌症990302
【摘要】目的:评价Gemcitabine(中文译名:健择)单药及其与顺氯铵铂联合化疗方案治疗III、IV期非小细胞肺癌(NSCLC)的临床疗效及其不良反应。材料与方法:1.健择单药研究:从1997年9月至1998年5月入选III、IV期NSCLC病人21例,以前未接受过任何化疗、放疗。III期病人11例,IV期病人10例。健择1000mg/m2,第1,8,15天各注一次,每28天为一疗程。2.健择与顺氯铵铂联合化疗研究:从1997年10月至1998年7月入选III、IV期NSCLC病人48例,以前未接受过任何化疗、放疗。III期病人19例,IV期病人29例。健择1000mg/m2,第1,8,15天各注一次;顺氯铵铂100mg/m2,第一天用,每28天为一疗程。结果:1.健择单药研究:可评价疗效的有19例,6例获部分缓解(PR),其中2例(10.5%)经4周以上复查证实。总有效率31.5%[95%CI,9.4%~45.15%]。全组均可评价不良反应,少数病人发生轻微胃肠道反应、白细胞下降、血红蛋白下降和血小板下降,只有4.8%(各1例)患者发生III度的恶心呕吐及白细胞下降,有1例患者发生III度感染。全组中位生存期6.13月。2.健择与顺氯铵铂联合化疗研究:可评价疗效的有41例,23例获部分缓解(PR),其中18例(43.9%)经4周以上复查证实。总有效率56.1%[95%CI,39.8%~71.5%]。48例可评价不良反应。约1/3分别发生III、IV度的恶心呕吐、白细胞下降和血红蛋白下降,18.75%(9例)病人发生III度血小板下降。其它毒副作用皆轻度可耐受。因毒性反应而健择减量和停药次数有39次(24.37%)。全组中位生存期8.9月。结论:健择单药治疗晚期NSCLC有一定的客观疗效,不良反应轻微。健择与顺氯铵铂联合治疗晚期NSCLC有较好的疗效,毒副作用可耐受,是治疗NSCLC较理想的治疗方案。
, 百拇医药
中图号:R734.2;R730.53 文献标识码:A 文章编号:1000-467X(1999)03-0241-05
Gemcitabine in the treatment of advanced non-small-cell lung cancer
GUAN Zhong-zhen, CHEN Ru-qin, XU Guang-chuan, et al.
Medical Oncology Department of Cancer Center, Sun Yat-sen University of
Medical Sciences, Guangzhou 510060,China
【Abstract】 Objective:The aim of the study was to evaluate the clinical efficacy and toxicity of Gemcitabine single-drug and gemcitabine-cisplatin combination in advanced non-small-cell lung cancer (NSCLC). Methods:1. gemcitabine single-drug study:Twenty-one previously untreated NSCLC patients entered the trial from September 1997 to May 1998. gemcitabine 1000 mg/m2 was administeredon days 1,8 and 15 in each 28-day cycle. 2. Gemcitabine-Cisplatin combination study:Forty-eight previously untreated NSCLC patients entered the trial from October 1997 to July 1998. Gemcitabine 1000 mg/m2 was administered on days 1,8 and 15 and Cisplatin 100 mg/m2, on day 1 in each 28-day cycle. Results:1. Gemcitabine single-drug study:Of 19 assessable patients, 6 achieved a partial response (PR), and among them 2(10.5%) were confirmed PR. The overall response rate was 31.6% (95% confidence interval [CI], 9.4% to 45.15%). 21 patients can be evaluated the toxicity. A minor proportion of patients experienced mild G-I reaction, leukopenia, thrombocytopenia and decreased hemoglobin levels. Only 4.8% (1 patient each) of the patients experience grade III leukopenia and nausea/ vomiting. One patient experienced grade III infection. The median survival of the whole group was 6.13 months. 2. Gemcitabine-cisplatin combination study:Of 41 assessable patients, 23 achieved a partial response (PR), and among them 18(43.9%) were confirmed PR. The overall response rate was 56.1% (95% confidence interval [CI], 39.8% to 71.5%). 48 patients can be evaluated for toxicity. About 1/3 of the patients experienced grade III-IV nausea/vomiting and leukopenia and decreased hemoglobin. 18.75% (9 patients) experienced grade III thrombocytopenia. The other toxicity was mild and tolerable. 39 cycles (24.37%) of gemcitabine injections were dose-reduced or omitted due to toxicity. The median survival of the whole group was 8.9 months. Conclusion:The single-drug gemcitabine induced an objective efficacy in advanced NSCLC, with modest side effects. The gemcitabine-cisqlatin combination regime was effective and well tolerated in the treatment of advanced NSCLC, it could be considered as one of the recommended standard regime.
, 百拇医药
Key words:Gemcitabine/Therapeutic Use; Non Small Cell Lung Cancer (NSCLC);Clinical Trial
健择是阿糖胞苷类似物,属抗代谢类抗癌药。它在体内被转化为dFdCTP(双氟脱氧三磷酸胞苷),可掺入DNA使DNA链断裂,从而起到细胞毒作用。本产品系由美国EliLilly药厂研究开发,已获准在美国、欧盟15国、澳大利亚和南非等地上市,国外临床研究〔1~6〕证明对非小细胞肺癌、胰腺癌等有效。Anderson等〔7〕报告本产品单药治疗非小细胞肺癌332例,客观缓解(PR)率20%。主要不良反应为中性粒细胞减少,III-IV度者约25%,另有12%患者发生短暂的转氨酶升高。
本产品申请在中国注册,卫生部药政局于1997年6月23日下达A96029533-163号文件批准进行60例临床验证,并指定由中山医科大学肿瘤医院部属临床试验基地为负责单位。
, 百拇医药
根据卫生部下达任务,我们组织了临床研究协作组,参加单位有第一军医大学南方医院、上海医科大学肿瘤医院、上海胸科医院、北京协和医院、北京市肿瘤医院5家医院。并制定了临床验证方案,对健择治疗非小细胞型肺癌的疗效及毒性进行验证研究。本项研究开始前,曾报请中山医科大学医学伦理委员会审核批准。所有受试者均签署了《知情同意书》。
为了客观准确地验证本产品对中国非小细胞肺癌病人的疗效与安全性,又兼顾受试者的治疗需要,研究计划分为两部分:计划收治20例(实际入组21例)患者单用健择治疗;另收治40例(实际入组48例)采用健择合并顺氯氨铂(CDDP)治疗。现分别报告如下。
1 健择单药治疗研究
1.1 收治标准
(1)组织学/细胞学证实的III~IV期非小细胞型肺癌,已不适宜手术或放疗者;
, 百拇医药
(2)过去未经化疗(包括健择治疗);
(3)过去未经或曾经放疗(总量<60Gy),但放疗部位必须非唯一可测病灶部位,且已停用放疗至少3周;
(4)身体功能状况(P.S)卡氏70分以上;
(5)有可测肿瘤病灶;
(6)预期寿命12周以上;
(7)患者依从性好,便于随诊;
(8)骨髓造血功能无明显受损(白细胞≥3.5×109/L,血小板≥100×109/L,Hb≥9.0g/dL,肝肾功能正常,无脑转移);
(9)性别不限,年龄18岁以上;
, http://www.100md.com
(10)签署<知情同意书>;
(11)试验中及试验结束后3个月,生育可能被手术、放射、绝经所终止;或使用可靠的避孕方法(IUD,避孕药或避孕设施)减少怀孕可能。
1.2 排除标准
(1)活动性感染(根据研究者的判断)
(2)临床证据显示中枢神经系统(CNS)转移或预防性中枢放射,肝功能异常:胆红素>正常值上限1.5倍,转氨酶ALT/AST>正常值上限3倍(ALT及AST在已有肝转移病人中可升高5倍;
(3)肾功能异常:血清肌酐值>正常上限值1.25倍;
(4)孕妇或哺乳期妇女;
(5)合并重要脏器功能障碍,不能耐受本研究(由研究者判断);
, http://www.100md.com
(6)合并第二种恶性肿瘤。但以下情况例外:宫颈原位癌、便于治疗的皮肤基底细胞癌或恶性肿瘤治愈超过5年且入组前没有复发的;
(7)同时合并其它试验性药物或正参加其它的临床试验。
1.3 试验药物剂量和给药方式
健择在第1,8和15天各用一次,每28天为一周期。一个周期定义为连续3个星期的治疗及1周的休息。健择1000mg/m2在约30~60分钟(30分钟的输注认为是理想的)内静脉输注。病人的体表面积在每一周期开始时根据其身高及实际体重计算得出。最少应用4周期,除非病人明显不能从本治疗得益。
1.4 周期内剂量调整
周期内剂量调整应根据表1及表2中的指导原则进行。在接受研究药物治疗前24小时内,根据每周白细胞、血小板计数及非血液学毒性的临床评估进行剂量调整。
, 百拇医药
表1 血液学毒性 白细胞总数
(×109/L)
血小板(109/L)
用药剂量占全量的%
>2.5
和
>75
100
1.0~2.5
或
50~75
75
, 百拇医药
<1.0
或
<50
取消
表2 非血液学毒性 WHO分级
用药剂量占全量的%
0~2度(以及3度的恶心/恶心)
100
3度(恶心/呕吐除外)
75或取消*
4度
取消
, http://www.100md.com
*应由非血液学毒性的类型决定及医生研究者判断取消哪一次给药最合理.#脱发(任何等级)均不是剂量减少的指征。
1.5 治疗计划
(1)本项研究为III期开放临床试验,不设对照组。
(2)符合入选标准的患者,在完成病史/体检、P.S.评定,影像学检查并记录病灶测量,全血象,肝肾功能,心电图,体重测量后,给患者静脉注射健择。
(3)每周期注射前复查血象及血液生化检查,每2周期影像学复查及作肿瘤病灶测量。
(4)治疗后复查:按WHO标准,评定治疗反应:CR,PR,SD或PD。以CR及PR患者计算总缓解率。
(5)已取得CR或PR患者,应在相距至少4周后再作临床及/或影像学检查,测量肿瘤病灶,如仍达CR或PR标准,则CR或PR被认为<证实>(Confirmed)。治疗后SD的患者,至少应接受4周期的治疗。治疗后达到PD标准者,即出组,考虑其他治疗。
, http://www.100md.com
(6)治疗后尚应观察血象、血液生化及心电图和临床表现,按WHO急性、亚急性毒性反应分级标准记录不良反应。出现明显血象下降或非血液毒性反应者,按试验计划规定调整剂量或终止治疗。
1.6 结果
1.6.1 收治人数:共收治21例,均可评价不良反应。能评价疗效者19例,2例不能评价疗效。其中1例系在用健择1次后,发现患者已有脑转移,不符合入选标准而中止试验。另1例73岁女性患者治疗2周期后尚未作病灶复查突发急性心脏病死亡,无法对病灶评价,负责医师认为此例死亡与验证药物无关。
1.6.2 患者一般资料:男14例,女7例。年龄范围43~77岁,中位年龄60岁。KPS70分1例,80分10例,90分10例。病理类型:鳞癌5例,腺癌14例,腺鳞癌1例,“非小细胞肺癌”未分型1例。过去治疗:全部未经手术(活检除外)、放疗或化疗。分期及病灶情况:III期11例,IV期10例;单病灶者10例,多病灶者11例;可测量病灶共38处,除肺内21处外,锁上淋巴结9处,纵隔肺门淋巴结4处,其他4处;不可测量病灶,包括胸水4例,骨转移4例,其他11例。
, http://www.100md.com
1.6.3 用药剂量及周期数:除1例仅用健择1次即出组外,余20例,每例用药1~6周期不等,平均用药4周期。各周期均能按计划全剂量给药。
1.6.4 辅助用药:有13例曾使用5-HT3受体抑制剂预防呕吐。无1例使用G-CSF或输白细胞/血小板。
1.6.5 疗效:全组能评价疗效的19例中,6例获PR(31.5%),其中2例(10.5%)经4周以上复查证实。无1例获CR。6例治疗后病情稳定(SD),7例病情进展(PD)。总结时8例已死亡,存活时间1~6个月;13例仍存活,至末次随访时间存活1~9个月。全组中位存活时间(MedianSurvival)6.13月。本组患者KaplanMeier存活曲线见图1。

图1 健择单药治疗Kaplan-Meier生存曲线
, 百拇医药
1.6.6 不良反应:本组病例不良反应轻微,只有4.8%患者发生III度白细胞下降及恶心呕吐,详见表3。
表3 单用键择组的不良反应(n=21) 毒副反应
毒副反应分级
0
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅲ+Ⅳ(%)
恶心/呕吐
12
3
, 百拇医药
5
1
0
4.8
食欲不振
16
5
0
0
0
0
腹泻
18
2
, 百拇医药
1
0
0
0
口腔炎
20
0
1
0
0
0
静脉炎
20
1
, 百拇医药
0
0
0
0
皮疹、搔痒
13
7
1
0
0
0
头晕
20
1
, http://www.100md.com
0
0
0
0
肢端麻木
21
0
0
0
0
0
血红蛋白
11
7
, http://www.100md.com
3
0
0
0
白细胞↓
8
9
3
1
0
4.8
中性粒
细胞↓
16
, 百拇医药
3
2
0
0
0
血小板↓
18
2
1
0
0
0
出血症状
21
, 百拇医药
0
0
0
0
0
发热
11
4
6
0
0
0
合并感染
18
, 百拇医药
1
1
1
0
4.8
肝功改变
18
3
0
0
0
0
肾功改变
19
, http://www.100md.com
2
0
0
0
0
心脏毒性
21
0
0
0
0
0
脱发
20
, http://www.100md.com
1
0
0
0
0
腹痛
20
1
0
0
0
0
呼吸困难
20
, 百拇医药
0
1
0
0
0
支气管痉挛
20
0
1
0
0
0
1.6.7 小结:21例晚期非小细胞肺癌患者,过去均未经化疗,试用健择单药治疗后,19例可评价疗效。试验结果表明使用健择单药化疗,每周一次,每次1000mg/m2静脉滴注,连用3周,每28天为一周期的重复治疗的方案,易于耐受,毒副反应轻微,只有少数患者发生且多为I~II级的恶心呕吐及血象下降。31.5%患者治疗后达到PR,其中10.5%为疗效证实持续4周以上的PR(ConfirmedPR)。
, 百拇医药
2 健择联合化疗研究
2.1 收治标准排除标准
与单药研究相同。
2.2 剂量和给药方式
每28天为一周期。每周期第1,8,15日静脉滴注健择1000mg/m2,30~60分钟内滴完。第1日滴完健择后,再静脉滴注Cisplatin100mg/m2,用30~120分钟滴完,同时应适当给予治疗前后水化。
除上述治疗药物改变外,其余与单药研究相同。
2.3 周期内剂量调整
与健择单药研究相同。
2.4 研究计划
, 百拇医药
与健择单药研究相同。
2.5 结果
2.5.1 收治人数:共入组48例,均可评价不良反应。其中41例可评价疗效,7例不能评价疗效,原因分别为:1例无可测量病灶,1例并用了干扰素治疗,均不符合入组标准;2例第一疗程后发现有脑转移,1例仅用药1次后发生急性肾衰退出研究,2例系患者因经济等原因要求退出,且病灶均未作复查。
2.5.2 患者一般情况:男35例,女13例。年龄范围34~76岁,中位年龄58岁。KPS评分均在70分以上,其中30例90分,2例100分。鳞癌13例,腺癌33例,腺鳞癌2例。全部未经手术或放疗、化疗。入组时III期为19例,IV期为29例。单病灶者21例,多病灶26例,可测量病灶共96处。可测病灶部位,除肺内44例,锁上淋巴结9例,肺门纵隔淋巴结11例,其他部位淋巴结10例外,尚有皮下结节1例,肝内病灶3例,其他1例。不可测量病灶包括胸水2例,骨转移18例,其他15例(主要为肺和淋巴结的不可测量病灶)。
, 百拇医药
2.5.3 用药剂量及周期数:每例用药1~8个周期不等,平均3个周期。所用剂量,健择121周期使用全量,39周期需减量,实际每周期平均用量为934.32mg/m2。DDP153周期可用全量,7个周期需减量,实际每周期平均用量为99.5mg/m2。
2.5.4 辅助用药:22例曾使用G-CSF,47例曾使用5-HT3受体抑制剂,37例曾使用胃复安。没有病人输白细胞或血小板。
2.5.5 疗效:全组可评价疗效的41例中,无人获CR,23例曾达PR(56.1%),其中间隔4周以上复查证实达PR疗效者(ConfirmedPR)共18例,占43.9%。95%可信区间为28.5%~60.3%,中位缓解时间174±18.5天(见图2)。9例治疗后病情稳定(SD),9例病情进展(PD)。总结时11例已死亡,存活时间75~267天,37例仍存活,计算至末次随访,存活17天(失访)至345天,全组中位存活时间267天。本组患者KaplanMeier存活曲线见图3。从图3中可见,约80%患者存活时间达200天以上。全组中位病变进展时间229±24.18天(见图4)。

, http://www.100md.com
图2 健择与顺铂联合化疗缓解时间曲线

图3 健择与顺铂联合化疗生存曲线

图4 健择与顺铂联合化疗病变进展时间
2.5.6 不良反应:详见表4。从表中可见,约1/3患者分别发生III-IV度的恶心呕吐及白细胞和血红蛋白的下降。1例病人发生急性肾衰,负责医生认为与健择无关,可能与DDP的毒性有关。
表4 健择+DDP组的不良反应(n=48) 毒副反应
毒副反应分级
0
, http://www.100md.com
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅲ+Ⅳ(%)
恶心/呕吐
7
9
16
12
4
33.3
食欲不振
44
, 百拇医药
4
0
0
0
0
腹泻
42
4
0
2
0
6.25
口腔炎
45
, 百拇医药
0
30
0
0
0
静脉炎
44
4
0
0
0
0
皮疹
38
, 百拇医药
2
8
0
0
0
头晕
44
4
0
0
0
0
肢端麻木
47
, http://www.100md.com
1
0
0
0
0
血红蛋白
9
8
14
14
3
35.4
白细胞
6
, http://www.100md.com
9
17
14
2
33.3
中性粒细胞
8
9
14
13
4
35.4
血小板
20
, 百拇医药
8
11
8
1
18.75
出血症状
45
1
1
1
0
2.1
发热
34
, 百拇医药
6
8
0
0
0
合并感染
37
4
5
2
0
4.2
ALT、AST
改变
, 百拇医药
42
2
3
1
0
2.1
ALP改变
38
9
1
0
0
0
BILIRUBIN改变
, http://www.100md.com
46
2
0
0
0
0
肾功能改变
42
4
1
0
1(肾衰)
2.1
心脏毒性
, 百拇医药
46
1
1
0
0
0
脱发
20
22
5
1
0
2.1
精神状态
, 百拇医药
46
2
0
0
0
0
例秘
32
13
3
0
0
0
肺
, http://www.100md.com
44
3
0
1
1
2.1
血尿
45
2
1
0
0
0
蛋白尿
, http://www.100md.com
40
4
4
0
0
0
听力
45
1
2
0
0
0
低血压
, 百拇医药
47
1
0
0
0
0
胸痛
47
1
0
0
0
0
血痰
, http://www.100md.com
47
1
0
0
0
0
流感综合症
47
1
0
0
0
0
耳鸣
, http://www.100md.com
47
1
0
0
0
0
烦躁不安
47
1
0
0
0
0
失眠
, 百拇医药
47
1
0
0
0
0
疲倦
45
3
0
0
0
0
衰弱
, 百拇医药
46
2
0
0
0
0
脸红
46
2
0
0
0
0
2.5.7 小结:本项联合化疗研究显示,DDP加Gemcitabine方案患者较易耐受,主要不良反应为恶心呕吐及白细胞/血红蛋白下降。41例可评价疗效的病例中,23例(56.1%)获PR,其中18例(43.9%)为ConfirmedPR,疗效较为满意。
, http://www.100md.com
3 结论
本项研究共入选69例晚期非小细胞肺癌患者,其中单用健择治疗21例,健择合并DDP治疗48例。结果显示:健择毒副反应较缓和,病者易于耐受,单药治疗对非小细胞肺癌有一定疗效,31.5%获PR,其中10.5%为确证PR(ConfirmedPR)。健择合并DDP治疗非小细胞肺癌48例,毒副作用可耐受,疗效较明显,56.1%可获PR,其中43.9%为确证PR(ConfirmedPR)。以上研究结果证实,健择是治疗非小细胞肺癌较安全有效的抗癌药物,Gemzar+DDP是治疗非小细胞肺癌较理想的治疗方案,副反应易耐受,疗效满意。
参考文献:
1 Castellano D, Lianes P, Paz-Ares L, et al. A phase II study of a novel gemcitabine plus cisplatin regimen administered every three weeks for advanced non small cell lung cancer〔J〕. Ann Oncol, 1998,9(4): 457~ 459.
, http://www.100md.com
2 Abratt RP, Bezwoda WR, Goedhals L, et al. Weekly gemcitabine with monthly cisplatin: effective chemotherapy for advanced non-small-cell lung cancer〔J〕. J Clin Oncol, 1997,15(2):744~749.
3 Crino L, Scagliotti G, Marangolo M, et al. Cisplatin-gemcitabine combination in advanced non- small-cell lung cancer:a phase II study〔J〕. J Clin Oncol, 1997, 15(1):297~ 303.
4 Gonzalez-Baron M, Ordonez A, Gracia M, et al. Gemcitabine and cisplatin in advanced non-small cell lung cancer (NSCLC):results from a phase II study (Meeting abstract)〔J〕. Proc Annu Meet Am Soc Clin Oncol, 1997, 16:A1687.
, http://www.100md.com
5 Crino L, Mosconi AM, Scagliotti GV, et al. Gemcitabine as second-line treatment for relapsing or refractory advanced non-small cell lung cancer:a phase II trial〔J〕. Semin Oncol, 1998,25(4 Suppl.):23~26.
6 Fukuoka M, Takada M, Yokohama A, et al. Phase II studies of gemcitabine for non-small cell lung cancer in Japan〔J〕. Semin Oncol, 1997,24(2 Suppl. 7):S742~ S746.
7 She pherd FA,RP, Anderson H, et al. Gemcitabine in the treat ment of elderly patients with advanced non-smdll-cell lung cancer〔J〕. Seminars in Oncology,1997,24(2 Suppl 7):S7-50~S7-55.
收稿日期:1999-05-05;修回日期:1999-05-10, 百拇医药