硫代硫酸钠在体内、外辅佐抗癌药药效学初步研究
作者:杨善民 陈福 郑耘 王光华 曹苏伟 陈炳煌
单位:杨善民 陈福 郑耘(厦门大学抗癌研究中心(厦门,361005));王光华 曹苏伟 陈炳煌(厦门市第一医院)
关键词:肿瘤;硫代硫酸钠;经皮导管化疗;药效学;MTT法
New Page 1
【摘要】目的:研究硫代硫酸钠(STS)是否能在体内、外作为化疗药的辅药。方法:应用MTT法研究STS分别与ADM、MMC和CDDP等6种抗癌单药合用时对BEL-7402和MGc80-3细胞的细胞毒性作用;应用小鼠肝癌腹水瘤(H22)模型判断STS与ADM等3种药合用时的抗癌疗效;20例人原发性肝癌病人肝动脉插管化疗(ADM、MMC和CDDP)前30min静脉推注STS(1.25~2.5g/m2)考察STS作为化疗药辅药的作用。结果:除了CDDP以外,STS(500μg/ml)与ADM等5种抗癌单药合用时对抗癌药的抗肿瘤细胞活性无明显影响(P>0.05)。当不同剂量STS(350mg/kg、35mg/kg)分别与ADM(6mg/kg)、MMC(1.4mg/kg)和CDDP(45mg/kg)合用或仅这3种化疗药合用时,这3组腹水瘤小鼠的存活期比对照组者显著延长(P<0.001),但3组之间无明显区别(P>0.05)。人肝癌肝动脉插管化疗时,STS与ADM、MMC和CDDP抗癌药合用,肝癌治疗总有效率达60%,且可减少70%病人的恶心、呕吐等副作用。结论:在体内,低浓度的STS(1.25~2.5g/m2)可与ADM,MMC,包括CDDP,等抗癌药合用起抗癌药辅剂作用,且能减轻恶心、呕吐等副作用,特别是采用经皮导管给予化疗药物的方法。
, http://www.100md.com
中图号:R969.2 文献标识码:A 文章编号:1000-467X(1999)03-0288-04
Preliminary pharmacodynamic study of STS as an adjuvant of
the chemotherapy drugs in Vitro and in Vivo
YANG Shan-min, CHEN Fu, ZHENG Yun,et al
Cancer Research Center, Xiamen University, Xiamen 361005, China
【Abstract】Objective:To study whether sodium thiosulfate (STS) can be used as an adjuvant of the chemotherapy drugs. Methods:The cytotoxicity of STS combined with ADM, MMC, CDDP, 5Fu, MTX and VCR (1× PPC/ml) respectively on the cells of BEL-7402 and MGc80-3 was studied by MTT test in vitro. The ascitic hepatoma (H22) in mice were adopted to determine the anticancer effect of STS adjuvant of ADM、MMC and CDDP. Being treated with STS(1.25~2.5g/m2) 30 min before drug administration,20 patients of hepatocellular carcinoma (HCC) were carried on transcatheter arterial chemoembolization with ADM、MMC and CDDP to observe the adjuvant effect of STS. Results:The anticancer activity of ADM and the other agents respectively adjuvant with STS (500μg/ml) were not obviously influented (P >0.05), but that for CDDP was influented . It was proven that the survival time of ascitic hepatoma treated with ADM (6 mg/kg),MMC (1.4 mg/kg) and CDDP (45 mg/kg) alone or three drugs in addition to STS (350 mg/kg,35 mg/kg) respectively was not significantly different (P >0.05). The survival time of each groups was significantly longer than that of control group (P<0.001). It have also been proven that STS adjuvant of ADM, MMC and CDDP was not decreased the chemotherapry effect (RR="60%" ) by transcatheter arterial chemoembolization in HCC, simultaneously it alleviated the nausea and vomiting in 70% patients. Conclusion:The study provides evidence that in vivo, STS (1.25~2.5 g/m2) can be used as an adjuvant of chemotherapy drugs,such as ADM,MMC, including CDDP, and so on , for decreasing nausea and vomiting effects, espacially for transcatheter chemotherapy .
, 百拇医药
Key words:Tumor; Sodium thiosulfate; Transcatheter chemotherapy; Adjuvant; Pharmacodynamic; MTT method
采用导管经皮穿刺股动脉到肝固有动脉灌注大剂量化疗药,多以顺氯氨铂为首选药物〔1〕,它已成为晚期肝癌患者非手术疗法的首选方案。大剂量、多种抗癌药的动脉导管介入可提高疗效,但也使患者产生严重的毒副作用。铂类抗癌药如顺氯氨铂(CDDP)与阿霉素(ADM)、丝裂霉素C(MMC)等药合用时,除引起心脏、肾脏和周围神经等毒性外,常引起胃肠道剧烈反应,如恶心、呕吐等〔2〕。国外已报告动脉插管用大剂量CDDP,结合STS“双路化疗”1991年国内陈明津等〔3〕报告治疗晚期肝癌亦取得较好疗效。硫代硫酸钠(STS)会拮抗CDDP抗肿瘤活性,但合理应用能减轻毒副反应。鉴于CDDP常与其他抗癌药联合应用,而STS与CDDP以外的其他抗癌药合用是否有拮抗作用国内外尚未见详细报告〔4〕。我们应用细胞活性MTT检测法和小鼠肝癌(H22)腹水瘤模型抑瘤实验,研究STS与ADM、MMC、CDDP等6种抗癌药合用的药效学,现报告如下。
, http://www.100md.com
1 材料和方法
1.1 药品与试剂
阿霉素为意大利FarmitaliaCarloErba,丝裂霉素C为日本KYOWA公司,顺氯氨铂为云南个旧生物制药厂,5-氟尿嘧啶(5-FU)为广州明兴制药厂,甲氨喋呤(MTX)为上海第十二制药厂,长春新碱(VCR)为天津和平制药厂,平阳霉素(PYM)为江苏海门制药厂产品。这7种抗癌药均为临床上注射用的针剂,母液按各药血浆峰值浓度的一千倍配制(1000×PPC/ml),-20℃储存备用(保存一周或现配现用)。硫代硫酸钠为上海新亚制药厂产品。3-(4,5)-二甲基-2-唑噻(2.5)-苯基溴化四唑氮蓝(MTT)为Sigma产品,二甲基亚砜(DMSO)为上海金山化工厂产品,RPMI1640为Gibco产品,其他试剂均为分析纯。
1.2 方法
1.2.1 药物对瘤细胞生长作用的MTT法测定:
, 百拇医药
按前文献〔5〕方法培养人肝癌BEL-7402和人胃癌MGc80-3细胞。细胞消化后,活细胞计数以1×104/孔(180μl)接种于96孔培养板,5%CO2常规细胞培养,次日加入不同浓度STS,终浓度分别为10μg~20000μg/ml,每个浓度设3个样品孔,3天后用光密度比色法(570nm)于DG3022(南京电子管厂)酶标仪上计读〔5〕。取不同浓度STS分别加入10倍血浆峰值浓度(10×PPC/ml)和1倍血浆峰值浓度(1×PPC/ml)的ADM、MMC、CDDP抗癌单药,作用于培养的两种癌细胞,3天后用MTT法检测。从实验中找出STS与ADM、MMC,特别是CDDP合用后仍有一定(40%)抑癌作用的最佳STS药物浓度(≤500μg/ml)。取STS(终浓度500μg/ml)分别与ADM、MMC、CDDP、5-FU、MTX和VCR(药物终浓度分别为1×PPC/ml)合用,作用于肝癌和胃癌2种癌细胞,依上述法测定OD值,实验各重复三次。
, 百拇医药 1.2.2 小鼠肝癌腹水瘤模型:小鼠腹水型肝癌(H22)(上海药物研究所引进)以1.2×107量接种于5~6周龄BALB/C小鼠(清洁Ⅰ级,抗癌中心医学实验动物室提供)。实验分6组(7只/组,见表1)。次日,抗癌药组按小鼠体重分别从腹腔注入ADM(6mg/kg)、MMC(1.4mg/kg)和CDDP(4.5mg/kg)或卡铂(CAP)(12.5mg/kg);抗癌药与STS合用组的小鼠则提前45分钟从腹腔内分别注射不同浓度的STS(35mg/kg或350mg/kg)后再按上述抗癌药剂量给药,观察计算小鼠存活期。实验重复两次。实验结果和数据采用均数抽样误差t检验处理。
1.2.3 肝癌肝动脉栓塞化疗:本组病例共40例性别:男38例,女2例。年龄29~85岁。所有病例经临床生化,B超和CT诊断为无手术指征的中晚期肝癌,其中Ⅱ期27例、Ⅲ期13例。病人肝动脉灌注化疗(部分病例加明胶海棉栓塞)前经肝、肾功能,血像检查,正常者才进行化疗。采用Seldinger技术,经皮股动脉穿刺插管,选择性进入肝固有动脉,碘油造影证实肝肿块充盈,灌注ADM50mg/m2、MMC5mg/m2和CDDP50mg/m2。40例病人随机分成两组:一组在介入化疗前30分钟从静脉推注1.25~2.5g/m2STS;另一组在介入化疗前30分钟肌注灭吐灵(0.4mg/kg)。治疗疗效评判标准参照文献〔3〕进行。病人发生恶心、呕吐程度的评判标准参照1979年世界卫生组织WHO关于抗癌药毒副反应的分级标准〔4〕进行。
, http://www.100md.com
2 结果
2.1 瘤细胞数与MTT法测定OD值的关系
BEL-7402和MGc80-3癌细胞在7×103/孔~5×104/孔时与所测得OD值呈较好得线性关系(资料未显示)。
2.2 STS对癌细胞活性的影响
人肝癌BEL-7402和人胃癌MGc80-3细胞以7×103/孔接种于96孔板培养,次日加入不同浓度STS再培养3天。当STS浓度≤500μg/ml时,STS对两种癌细胞的生长无明显抑制(P>0.05)(图1)。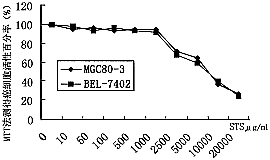
, 百拇医药
图1 不同浓度STS对BEL-7402和MGc80-3癌细胞生长的影响
2.3 STS与ADM、MMC和CDDP等药合用时对癌细胞的影响
不同浓度STS(1μg/ml~10000μg/ml)分别与ADM、MMC和CDDP(1×PPC/ml、10×PPC/ml)合用对MGc80-3和BEL-7402细胞(7×103/孔)作用3天后,显示不同程度的生长抑制作用(图2)。在体外,当STS(500μg/ml),除与CDDP合用有影响外(P<0.001),与ADM等6种单药(1×PPC/ml)合用对MGc80-3细胞的生长作用无明显影响(P>0.05)(图3);对BEL-7402癌细胞也有相似的作用结果(资料未显示)。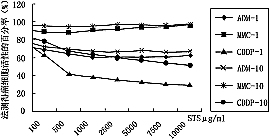
, http://www.100md.com
图2不同浓度STS与抗癌药(1×PPC/ml,10×PPC/ml)合用时对MGc80-3细胞生长的影响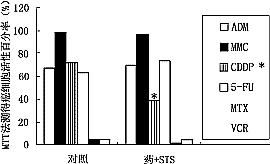
图3STS(500μg/ml)与6种抗癌药(1×PPC/ml)合用时各自对MGc80-3细胞的影响
※P<0.001,其余各组P<0.05
2.4 STS与抗癌药合用小鼠肝癌腹水瘤模型的作用
小鼠腹水型肝癌(H22)细胞以1.2×107量接种BALB/C小鼠腹腔后,小鼠迅速产生腹水,第10~13天开始死亡。采用ADM、MMC和CDDP联合用药或它们与不同浓度STS(35mg/kg或350mg/kg,提前给药)合用,这3组小鼠存活期比对照组明显延长(表1),但3组之间无显著差别(P>0.05),联合用药下的小鼠体重无明显减轻,无体毛脱落等现象。以CAP代替CDDP的联合用药亦取得同样的治疗效果(表1)。
, 百拇医药
表1 STS与抗癌药合用对H22腹水瘤模型的抗肿瘤作用
组别
药物(mg/kg)
存活期(天)
用药前
小鼠(只)
用药后
小鼠(只)
1.
不加用STS(0)
对照组(生理盐水)
11.8±1.37
, 百拇医药
7
7
ADM(6),MMC(1.4),CDDP(4.5)
30.0±6.0*
7
7
2.
加用STS(35)
ADM(6),MMC(1.4),CDDP(4.5)
31.5±7.8*
7
, 百拇医药 7
ADM(6),MMC(1.4),CAP(12.5)
34.2±4.9*
7
7
3.
加用STS(350)
ADM(6),MMC(1.4),CDDP(4.5)
36.5±4.2*
7
6
ADM(6),MMC(1.4)CAP(12.5)
, http://www.100md.com
36.0±4.5*
7
7
2.5 STS与ADM、MMC和CDDP合用对肝癌病人治疗的影响
20例肝癌病人肝动脉介入化疗采用STS与ADM、MMC和CDDP药物合用后病情有不同程度的缓解,肿瘤缩小,其中完全缓解者有3例,部分缓解有9例,稳定5例,进展3例,总有效率为60%(12/20)。这结果与不加STS治疗组(20例)相仿(资料未显示)。根据临床护理观察,肝动脉介入化疗前应用1.25~2.5g/m2的STS对减轻病人的恶心、呕吐的程度效果显著(表2)。
表2 介入化疗时STS与ADM,MMC和CDDP合用对病人恶心、呕吐的影响
, 百拇医药 组别
总例数
评判标准与结果(%)
O度
Ⅰ度
Ⅱ度
Ⅲ度
Ⅳ度
灭吐灵
20
2(10)
3(15)
4(20)
, 百拇医药
3(15)
8(40)
(0.4mg/kgim)
STS
20
14(70)
2(10)
4(20)
0(0)
0(0)
(1.25~2.5g/m2iv)
3 讨论
, 百拇医药
1980年Howell和Taetle首先在小鼠动物实验中证实:STS与CDDP合用能有效地防止CDDP对肾脏的毒性作用。嗣后,他们对人卵巢癌从腹腔内给予大剂量CDDP,从静脉内给予STS能有效地防止肾脏〔6〕和周围神经的毒性。肝癌的肝动脉灌注或加栓塞化疗常用ADM和/或MMC加上CDDP等多种抗癌药,STS与CDDP以外的其他抗癌药合用有无拮抗或相加作用,国内外尚未见到详细报道。
在体外,高浓度STS(>1000μg/ml)对肿瘤细胞的生长有抑制作用,而500μg/ml的STS则无明显影响(P>0.05)。低浓度的STS(500μg/ml)与ADM,MMC等5种化疗药(1×PPC/ml)合用时,各自的抗肿瘤活性无明显影响(P>0.05),但对CDDP有显著的影响(P<0.001,但仍有36%~42%抑瘤作用)。我们的体外试验表明:ADM、MMC、CDDP和5-FU有较好的抗胃癌、肝癌细胞生长的作用,与临床研究介入化疗报道的常用药物基本相似〔7〕。我们选其中的ADM、MMC和CDDP与STS合用进一步做动物实验。H22小鼠腹水瘤模型的实验表明:提前给予不同浓度的STS(35mg/kg或350mg/kg,相当于成人用药量的0.14g/m2和1.4g/m2)〔8〕后,再与ADM、MMC和CDDP联合用药和仅这3种抗癌药合用,这3组小鼠的生存期与对照组者有显著性差别(P<0.001),而这3组间小鼠的生存期无显著性差别(P>0.05)。
, 百拇医药
Howell〔6〕等对STS药物代谢动力学研究表明:从静脉推注STS4g/m2后加每小时2.13g/m2静脉滴注能使正常人血浆中STS浓度保持在410μg/ml左右,并可维持4小时。我们在肝动脉介入化疗前静脉推注STS1.25~2.5g/m2,推断病人血浆STS水平将大大低于500μg/ml,不会影响以ADM、MMC为主,包括CDDP的多种抗癌药联合应用。STS的应用,特别是不同途径、伴有较大剂量的CDDP联合用药,能防止介入后CDDP抗癌药外流到体循环引起的肾脏、肝脏和心脏损伤。
我们初步的临床研究表明:介入化疗前静脉推注STS(1.25~2.5g/m2)能使肝癌治疗的总有效率达60%,又能有效地控制70%病人的恶心、呕吐及化疗后迟缓发作的胃肠道反应。STS价格低廉,副作用小,它作为导管化疗中的抗癌药辅助剂值得进一步推广试用。有关STS能减轻胃肠道反应的机理尚未明了。以CDDP(500mg/m2)为主的抗癌药联合应用常引起患者剧烈呕吐,严重者导致脱水,食道破裂等〔9〕。化疗药使小肠嗜铬细胞释放出5-羟色胺在动物实验中已得到证实〔10〕。5-羟色胺的过多释放剌激了内脏迷走神经的传入纤维的5-羟色胺受体,导致恶心、呕吐。近年来STS曾被作为细胞膜稳定剂来抑制实验性胰腺炎的发生,推测它可能稳定肠道嗜铬细胞质膜,减少5-羟色胺的释放,其机理有待进一步研究。
, 百拇医药
基金项目:福建省“八五”肝癌攻关课题(850003-0115)
参考文献
1 汤钊猷.原发性肝癌〔A〕,汤钊猷主编:现代肿瘤学〔M〕.上海:上海医科大学出版社,1993:553.
2 Graves T. Emesis as complication of cancer chemotherapy:pathophysiology, importance, and treatment 〔J〕. Pharmacotherapy, 1992,12:337.
3 陈明津,张灿珍,蒋绍诚,等.肝动脉插管大剂量顺铂“双路化疗”治疗晚期肝癌〔J〕.中国肿瘤临床,1991,18:343.
4 周际昌.抗肿瘤药物的毒副作用及其处理〔A〕.韩锐主编:肿瘤化学预防与治疗〔M〕.北京:北京医科大学.中国协和医科大学联合出版社,1991:707
, 百拇医药
5 杨善民,郑耘,颜江华,等.MTT法检测裸鼠实体瘤药物敏感试验研究〔J〕.中国实验动物学报,1996,4:21.
6 Howell SB, Pfeifle CE,Wung WE,et al. Intraperitoneal cis-diamminedichloroplatinum with systemic thiosulfate protection〔J〕. Cancer Res, 1983,43:1426.
7 石木兰,史仲华.肝癌的介入化疗〔A〕.张荫昌主编:中国癌症研究〔M〕.北京:北京医科大学.中国协和医科大学联合出版社,1996:14.
8 于庆海.实验动物与人用药量的换算〔A〕.陈奇主编:中药药理学研究方法学〔M〕.北京:人民卫生出版社,1993:1103.
9 Markham A, Sorkin E M.Ondansetron. An update of its therapeutic use in chemotherapy-induced and postoperative nausea and vomiting 〔J〕. Drugs, 1993, 45:931.
10 Schworer H, Racke K, Kilbinger H.Cisplatin increases the release of 5-hydroxytryptamine(5-HT)from the isolated vascularly perfused small intestine of the guinea pig :involvement of 5-HT3 receptors 〔J〕. Naunyn Schmiedebergs Arch Pharmacol 1991, 344:143.
收稿日期:1998-08-24;收回日期:1998-12-28, 百拇医药
单位:杨善民 陈福 郑耘(厦门大学抗癌研究中心(厦门,361005));王光华 曹苏伟 陈炳煌(厦门市第一医院)
关键词:肿瘤;硫代硫酸钠;经皮导管化疗;药效学;MTT法
New Page 1
【摘要】目的:研究硫代硫酸钠(STS)是否能在体内、外作为化疗药的辅药。方法:应用MTT法研究STS分别与ADM、MMC和CDDP等6种抗癌单药合用时对BEL-7402和MGc80-3细胞的细胞毒性作用;应用小鼠肝癌腹水瘤(H22)模型判断STS与ADM等3种药合用时的抗癌疗效;20例人原发性肝癌病人肝动脉插管化疗(ADM、MMC和CDDP)前30min静脉推注STS(1.25~2.5g/m2)考察STS作为化疗药辅药的作用。结果:除了CDDP以外,STS(500μg/ml)与ADM等5种抗癌单药合用时对抗癌药的抗肿瘤细胞活性无明显影响(P>0.05)。当不同剂量STS(350mg/kg、35mg/kg)分别与ADM(6mg/kg)、MMC(1.4mg/kg)和CDDP(45mg/kg)合用或仅这3种化疗药合用时,这3组腹水瘤小鼠的存活期比对照组者显著延长(P<0.001),但3组之间无明显区别(P>0.05)。人肝癌肝动脉插管化疗时,STS与ADM、MMC和CDDP抗癌药合用,肝癌治疗总有效率达60%,且可减少70%病人的恶心、呕吐等副作用。结论:在体内,低浓度的STS(1.25~2.5g/m2)可与ADM,MMC,包括CDDP,等抗癌药合用起抗癌药辅剂作用,且能减轻恶心、呕吐等副作用,特别是采用经皮导管给予化疗药物的方法。
, http://www.100md.com
中图号:R969.2 文献标识码:A 文章编号:1000-467X(1999)03-0288-04
Preliminary pharmacodynamic study of STS as an adjuvant of
the chemotherapy drugs in Vitro and in Vivo
YANG Shan-min, CHEN Fu, ZHENG Yun,et al
Cancer Research Center, Xiamen University, Xiamen 361005, China
【Abstract】Objective:To study whether sodium thiosulfate (STS) can be used as an adjuvant of the chemotherapy drugs. Methods:The cytotoxicity of STS combined with ADM, MMC, CDDP, 5Fu, MTX and VCR (1× PPC/ml) respectively on the cells of BEL-7402 and MGc80-3 was studied by MTT test in vitro. The ascitic hepatoma (H22) in mice were adopted to determine the anticancer effect of STS adjuvant of ADM、MMC and CDDP. Being treated with STS(1.25~2.5g/m2) 30 min before drug administration,20 patients of hepatocellular carcinoma (HCC) were carried on transcatheter arterial chemoembolization with ADM、MMC and CDDP to observe the adjuvant effect of STS. Results:The anticancer activity of ADM and the other agents respectively adjuvant with STS (500μg/ml) were not obviously influented (P >0.05), but that for CDDP was influented . It was proven that the survival time of ascitic hepatoma treated with ADM (6 mg/kg),MMC (1.4 mg/kg) and CDDP (45 mg/kg) alone or three drugs in addition to STS (350 mg/kg,35 mg/kg) respectively was not significantly different (P >0.05). The survival time of each groups was significantly longer than that of control group (P<0.001). It have also been proven that STS adjuvant of ADM, MMC and CDDP was not decreased the chemotherapry effect (RR="60%" ) by transcatheter arterial chemoembolization in HCC, simultaneously it alleviated the nausea and vomiting in 70% patients. Conclusion:The study provides evidence that in vivo, STS (1.25~2.5 g/m2) can be used as an adjuvant of chemotherapy drugs,such as ADM,MMC, including CDDP, and so on , for decreasing nausea and vomiting effects, espacially for transcatheter chemotherapy .
, 百拇医药
Key words:Tumor; Sodium thiosulfate; Transcatheter chemotherapy; Adjuvant; Pharmacodynamic; MTT method
采用导管经皮穿刺股动脉到肝固有动脉灌注大剂量化疗药,多以顺氯氨铂为首选药物〔1〕,它已成为晚期肝癌患者非手术疗法的首选方案。大剂量、多种抗癌药的动脉导管介入可提高疗效,但也使患者产生严重的毒副作用。铂类抗癌药如顺氯氨铂(CDDP)与阿霉素(ADM)、丝裂霉素C(MMC)等药合用时,除引起心脏、肾脏和周围神经等毒性外,常引起胃肠道剧烈反应,如恶心、呕吐等〔2〕。国外已报告动脉插管用大剂量CDDP,结合STS“双路化疗”1991年国内陈明津等〔3〕报告治疗晚期肝癌亦取得较好疗效。硫代硫酸钠(STS)会拮抗CDDP抗肿瘤活性,但合理应用能减轻毒副反应。鉴于CDDP常与其他抗癌药联合应用,而STS与CDDP以外的其他抗癌药合用是否有拮抗作用国内外尚未见详细报告〔4〕。我们应用细胞活性MTT检测法和小鼠肝癌(H22)腹水瘤模型抑瘤实验,研究STS与ADM、MMC、CDDP等6种抗癌药合用的药效学,现报告如下。
, http://www.100md.com
1 材料和方法
1.1 药品与试剂
阿霉素为意大利FarmitaliaCarloErba,丝裂霉素C为日本KYOWA公司,顺氯氨铂为云南个旧生物制药厂,5-氟尿嘧啶(5-FU)为广州明兴制药厂,甲氨喋呤(MTX)为上海第十二制药厂,长春新碱(VCR)为天津和平制药厂,平阳霉素(PYM)为江苏海门制药厂产品。这7种抗癌药均为临床上注射用的针剂,母液按各药血浆峰值浓度的一千倍配制(1000×PPC/ml),-20℃储存备用(保存一周或现配现用)。硫代硫酸钠为上海新亚制药厂产品。3-(4,5)-二甲基-2-唑噻(2.5)-苯基溴化四唑氮蓝(MTT)为Sigma产品,二甲基亚砜(DMSO)为上海金山化工厂产品,RPMI1640为Gibco产品,其他试剂均为分析纯。
1.2 方法
1.2.1 药物对瘤细胞生长作用的MTT法测定:
, 百拇医药
按前文献〔5〕方法培养人肝癌BEL-7402和人胃癌MGc80-3细胞。细胞消化后,活细胞计数以1×104/孔(180μl)接种于96孔培养板,5%CO2常规细胞培养,次日加入不同浓度STS,终浓度分别为10μg~20000μg/ml,每个浓度设3个样品孔,3天后用光密度比色法(570nm)于DG3022(南京电子管厂)酶标仪上计读〔5〕。取不同浓度STS分别加入10倍血浆峰值浓度(10×PPC/ml)和1倍血浆峰值浓度(1×PPC/ml)的ADM、MMC、CDDP抗癌单药,作用于培养的两种癌细胞,3天后用MTT法检测。从实验中找出STS与ADM、MMC,特别是CDDP合用后仍有一定(40%)抑癌作用的最佳STS药物浓度(≤500μg/ml)。取STS(终浓度500μg/ml)分别与ADM、MMC、CDDP、5-FU、MTX和VCR(药物终浓度分别为1×PPC/ml)合用,作用于肝癌和胃癌2种癌细胞,依上述法测定OD值,实验各重复三次。
, 百拇医药 1.2.2 小鼠肝癌腹水瘤模型:小鼠腹水型肝癌(H22)(上海药物研究所引进)以1.2×107量接种于5~6周龄BALB/C小鼠(清洁Ⅰ级,抗癌中心医学实验动物室提供)。实验分6组(7只/组,见表1)。次日,抗癌药组按小鼠体重分别从腹腔注入ADM(6mg/kg)、MMC(1.4mg/kg)和CDDP(4.5mg/kg)或卡铂(CAP)(12.5mg/kg);抗癌药与STS合用组的小鼠则提前45分钟从腹腔内分别注射不同浓度的STS(35mg/kg或350mg/kg)后再按上述抗癌药剂量给药,观察计算小鼠存活期。实验重复两次。实验结果和数据采用均数抽样误差t检验处理。
1.2.3 肝癌肝动脉栓塞化疗:本组病例共40例性别:男38例,女2例。年龄29~85岁。所有病例经临床生化,B超和CT诊断为无手术指征的中晚期肝癌,其中Ⅱ期27例、Ⅲ期13例。病人肝动脉灌注化疗(部分病例加明胶海棉栓塞)前经肝、肾功能,血像检查,正常者才进行化疗。采用Seldinger技术,经皮股动脉穿刺插管,选择性进入肝固有动脉,碘油造影证实肝肿块充盈,灌注ADM50mg/m2、MMC5mg/m2和CDDP50mg/m2。40例病人随机分成两组:一组在介入化疗前30分钟从静脉推注1.25~2.5g/m2STS;另一组在介入化疗前30分钟肌注灭吐灵(0.4mg/kg)。治疗疗效评判标准参照文献〔3〕进行。病人发生恶心、呕吐程度的评判标准参照1979年世界卫生组织WHO关于抗癌药毒副反应的分级标准〔4〕进行。
, http://www.100md.com
2 结果
2.1 瘤细胞数与MTT法测定OD值的关系
BEL-7402和MGc80-3癌细胞在7×103/孔~5×104/孔时与所测得OD值呈较好得线性关系(资料未显示)。
2.2 STS对癌细胞活性的影响
人肝癌BEL-7402和人胃癌MGc80-3细胞以7×103/孔接种于96孔板培养,次日加入不同浓度STS再培养3天。当STS浓度≤500μg/ml时,STS对两种癌细胞的生长无明显抑制(P>0.05)(图1)。

, 百拇医药
图1 不同浓度STS对BEL-7402和MGc80-3癌细胞生长的影响
2.3 STS与ADM、MMC和CDDP等药合用时对癌细胞的影响
不同浓度STS(1μg/ml~10000μg/ml)分别与ADM、MMC和CDDP(1×PPC/ml、10×PPC/ml)合用对MGc80-3和BEL-7402细胞(7×103/孔)作用3天后,显示不同程度的生长抑制作用(图2)。在体外,当STS(500μg/ml),除与CDDP合用有影响外(P<0.001),与ADM等6种单药(1×PPC/ml)合用对MGc80-3细胞的生长作用无明显影响(P>0.05)(图3);对BEL-7402癌细胞也有相似的作用结果(资料未显示)。

, http://www.100md.com
图2不同浓度STS与抗癌药(1×PPC/ml,10×PPC/ml)合用时对MGc80-3细胞生长的影响

图3STS(500μg/ml)与6种抗癌药(1×PPC/ml)合用时各自对MGc80-3细胞的影响
※P<0.001,其余各组P<0.05
2.4 STS与抗癌药合用小鼠肝癌腹水瘤模型的作用
小鼠腹水型肝癌(H22)细胞以1.2×107量接种BALB/C小鼠腹腔后,小鼠迅速产生腹水,第10~13天开始死亡。采用ADM、MMC和CDDP联合用药或它们与不同浓度STS(35mg/kg或350mg/kg,提前给药)合用,这3组小鼠存活期比对照组明显延长(表1),但3组之间无显著差别(P>0.05),联合用药下的小鼠体重无明显减轻,无体毛脱落等现象。以CAP代替CDDP的联合用药亦取得同样的治疗效果(表1)。
, 百拇医药
表1 STS与抗癌药合用对H22腹水瘤模型的抗肿瘤作用
组别
药物(mg/kg)
存活期(天)
用药前
小鼠(只)
用药后
小鼠(只)
1.
不加用STS(0)
对照组(生理盐水)
11.8±1.37
, 百拇医药
7
7
ADM(6),MMC(1.4),CDDP(4.5)
30.0±6.0*
7
7
2.
加用STS(35)
ADM(6),MMC(1.4),CDDP(4.5)
31.5±7.8*
7
, 百拇医药 7
ADM(6),MMC(1.4),CAP(12.5)
34.2±4.9*
7
7
3.
加用STS(350)
ADM(6),MMC(1.4),CDDP(4.5)
36.5±4.2*
7
6
ADM(6),MMC(1.4)CAP(12.5)
, http://www.100md.com
36.0±4.5*
7
7
2.5 STS与ADM、MMC和CDDP合用对肝癌病人治疗的影响
20例肝癌病人肝动脉介入化疗采用STS与ADM、MMC和CDDP药物合用后病情有不同程度的缓解,肿瘤缩小,其中完全缓解者有3例,部分缓解有9例,稳定5例,进展3例,总有效率为60%(12/20)。这结果与不加STS治疗组(20例)相仿(资料未显示)。根据临床护理观察,肝动脉介入化疗前应用1.25~2.5g/m2的STS对减轻病人的恶心、呕吐的程度效果显著(表2)。
表2 介入化疗时STS与ADM,MMC和CDDP合用对病人恶心、呕吐的影响
, 百拇医药 组别
总例数
评判标准与结果(%)
O度
Ⅰ度
Ⅱ度
Ⅲ度
Ⅳ度
灭吐灵
20
2(10)
3(15)
4(20)
, 百拇医药
3(15)
8(40)
(0.4mg/kgim)
STS
20
14(70)
2(10)
4(20)
0(0)
0(0)
(1.25~2.5g/m2iv)
3 讨论
, 百拇医药
1980年Howell和Taetle首先在小鼠动物实验中证实:STS与CDDP合用能有效地防止CDDP对肾脏的毒性作用。嗣后,他们对人卵巢癌从腹腔内给予大剂量CDDP,从静脉内给予STS能有效地防止肾脏〔6〕和周围神经的毒性。肝癌的肝动脉灌注或加栓塞化疗常用ADM和/或MMC加上CDDP等多种抗癌药,STS与CDDP以外的其他抗癌药合用有无拮抗或相加作用,国内外尚未见到详细报道。
在体外,高浓度STS(>1000μg/ml)对肿瘤细胞的生长有抑制作用,而500μg/ml的STS则无明显影响(P>0.05)。低浓度的STS(500μg/ml)与ADM,MMC等5种化疗药(1×PPC/ml)合用时,各自的抗肿瘤活性无明显影响(P>0.05),但对CDDP有显著的影响(P<0.001,但仍有36%~42%抑瘤作用)。我们的体外试验表明:ADM、MMC、CDDP和5-FU有较好的抗胃癌、肝癌细胞生长的作用,与临床研究介入化疗报道的常用药物基本相似〔7〕。我们选其中的ADM、MMC和CDDP与STS合用进一步做动物实验。H22小鼠腹水瘤模型的实验表明:提前给予不同浓度的STS(35mg/kg或350mg/kg,相当于成人用药量的0.14g/m2和1.4g/m2)〔8〕后,再与ADM、MMC和CDDP联合用药和仅这3种抗癌药合用,这3组小鼠的生存期与对照组者有显著性差别(P<0.001),而这3组间小鼠的生存期无显著性差别(P>0.05)。
, 百拇医药
Howell〔6〕等对STS药物代谢动力学研究表明:从静脉推注STS4g/m2后加每小时2.13g/m2静脉滴注能使正常人血浆中STS浓度保持在410μg/ml左右,并可维持4小时。我们在肝动脉介入化疗前静脉推注STS1.25~2.5g/m2,推断病人血浆STS水平将大大低于500μg/ml,不会影响以ADM、MMC为主,包括CDDP的多种抗癌药联合应用。STS的应用,特别是不同途径、伴有较大剂量的CDDP联合用药,能防止介入后CDDP抗癌药外流到体循环引起的肾脏、肝脏和心脏损伤。
我们初步的临床研究表明:介入化疗前静脉推注STS(1.25~2.5g/m2)能使肝癌治疗的总有效率达60%,又能有效地控制70%病人的恶心、呕吐及化疗后迟缓发作的胃肠道反应。STS价格低廉,副作用小,它作为导管化疗中的抗癌药辅助剂值得进一步推广试用。有关STS能减轻胃肠道反应的机理尚未明了。以CDDP(500mg/m2)为主的抗癌药联合应用常引起患者剧烈呕吐,严重者导致脱水,食道破裂等〔9〕。化疗药使小肠嗜铬细胞释放出5-羟色胺在动物实验中已得到证实〔10〕。5-羟色胺的过多释放剌激了内脏迷走神经的传入纤维的5-羟色胺受体,导致恶心、呕吐。近年来STS曾被作为细胞膜稳定剂来抑制实验性胰腺炎的发生,推测它可能稳定肠道嗜铬细胞质膜,减少5-羟色胺的释放,其机理有待进一步研究。
, 百拇医药
基金项目:福建省“八五”肝癌攻关课题(850003-0115)
参考文献
1 汤钊猷.原发性肝癌〔A〕,汤钊猷主编:现代肿瘤学〔M〕.上海:上海医科大学出版社,1993:553.
2 Graves T. Emesis as complication of cancer chemotherapy:pathophysiology, importance, and treatment 〔J〕. Pharmacotherapy, 1992,12:337.
3 陈明津,张灿珍,蒋绍诚,等.肝动脉插管大剂量顺铂“双路化疗”治疗晚期肝癌〔J〕.中国肿瘤临床,1991,18:343.
4 周际昌.抗肿瘤药物的毒副作用及其处理〔A〕.韩锐主编:肿瘤化学预防与治疗〔M〕.北京:北京医科大学.中国协和医科大学联合出版社,1991:707
, 百拇医药
5 杨善民,郑耘,颜江华,等.MTT法检测裸鼠实体瘤药物敏感试验研究〔J〕.中国实验动物学报,1996,4:21.
6 Howell SB, Pfeifle CE,Wung WE,et al. Intraperitoneal cis-diamminedichloroplatinum with systemic thiosulfate protection〔J〕. Cancer Res, 1983,43:1426.
7 石木兰,史仲华.肝癌的介入化疗〔A〕.张荫昌主编:中国癌症研究〔M〕.北京:北京医科大学.中国协和医科大学联合出版社,1996:14.
8 于庆海.实验动物与人用药量的换算〔A〕.陈奇主编:中药药理学研究方法学〔M〕.北京:人民卫生出版社,1993:1103.
9 Markham A, Sorkin E M.Ondansetron. An update of its therapeutic use in chemotherapy-induced and postoperative nausea and vomiting 〔J〕. Drugs, 1993, 45:931.
10 Schworer H, Racke K, Kilbinger H.Cisplatin increases the release of 5-hydroxytryptamine(5-HT)from the isolated vascularly perfused small intestine of the guinea pig :involvement of 5-HT3 receptors 〔J〕. Naunyn Schmiedebergs Arch Pharmacol 1991, 344:143.
收稿日期:1998-08-24;收回日期:1998-12-28, 百拇医药