颅内肿瘤患者血清唾液酸含量的测定及其临床意义
作者:曹国彬 曾白云 周 强
单位:曹国彬 曾白云 广州医学院第二附属医院神经外科(510260);周 强 广州医学院检验系(510182)
关键词:血清;唾液酸;颅内肿瘤
广东医学990311 【摘要】 目的 探讨血清唾液酸含量在颅内肿瘤定性诊断、手术预后及术后复发监测中的价值。方法 用快速测定法测定40例颅内良性肿瘤,45例颅内恶性肿瘤及12例复发性脑瘤患者的血清唾液酸含量,并与正常对照组比较。结果 颅内良恶性肿瘤与正常对照三组间血清唾液酸含量两两比较差异均有显著性。复发性脑瘤患者再次手术切除后血清唾液酸含量可恢复正常。结论 血清唾液酸含量测定对颅内肿瘤诊断、良恶性肿瘤鉴别、脑瘤手术预后判断及术后复发监测均有一定的实用价值。
唾液酸(sialic acid,SA)是9碳糖神经氨酸的一族复合物总称。在人体组织中其主要的衍生物是N-乙酸神经氨酸,它位于糖蛋白、糖脂结构的末端,而糖蛋白、糖脂则是细胞膜的重要成分,细胞膜糖蛋白和糖脂的改变与肿瘤细胞的侵入和破坏行为有关[1]。因此SA对于维持细胞表面的功能起着决定性的作用。已有资料表明:乳腺癌、肺癌、胃癌、结肠癌与肝癌患者血清SA含量明显增高[2,3]。为了探讨颅内肿瘤患者血清SA含量变化与其肿瘤恶性程度的关系及复发性脑瘤患者再次手术前后其血清SA含量的改变,我们测定了颅内肿瘤患者及复发性脑瘤患者再次手术前后其血清SA含量,并与正常对照组比较,现将结果报道如下。
, http://www.100md.com
1 对象与方法
1.1 研究对象 ①正常对照组(Ⅰ组):45例,为体检正常者,无肝炎、结核及神经系统病史者。②颅内良性肿瘤组(Ⅱ组):40例,其中脑膜瘤17例,神经鞘瘤8例,良性胶质瘤(Ⅰ~Ⅱ级)8例,垂体腺瘤5例,颅咽管瘤2例。均经病理证实。③颅内恶性肿瘤组(Ⅲ组):45例,其中恶性胶质瘤(Ⅲ~Ⅳ级)39例,转移瘤5例,生殖细胞瘤1例。均经病理证实。④复发性颅内肿瘤组:12例,其中复发良性脑瘤6例(包括复发性垂体腺瘤3例,复发性脑膜瘤2例,复发性听神经瘤1例);复发性恶性脑瘤6例(包括复发恶性胶质瘤4例,复发室管膜母细胞瘤1例,复发髓母细胞瘤1例)。均经病理证实。
1.2 实验方法 经CT或MR确定的颅内肿瘤患者于入院次晨,健康人于就诊当天,复发性脑瘤患者于再次手术前1 d及术后3个月,空腹取静脉血2 mL,及时分离血清,离心后取上清液,采用快速测定法,测定血清SA含量。操作严格按试剂盒说明书进行。
, 百拇医药
1.3 统计学分析 血清SA含量以 ±s表示,采用t检验。
±s表示,采用t检验。
2 结果
2.1 各组唾液酸的检测结果 见表1。
表1 各组血清SA含量(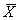 ±s,mmol/L) 组 别
±s,mmol/L) 组 别
例数
血清SA含量
正常对照组
45
1.383±0.216
, 百拇医药
颅内良性肿瘤组
40
1.858±0.304
颅内恶性肿瘤组
45
2.166±0.544△
注:与正常对照组比较P<0.001,△与颅内良性肿瘤组比较P<0.01
2.2 颅内肿瘤SA阳性率 以1.383+1.96×0.216 mmol/L的结果作为正常参考值的上限,则颅内肿瘤的阳性率为67.1%;其中颅内良性肿瘤阳性率为50.0%,颅内恶性肿瘤阳性率为82.2%。
2.3 复发脑瘤患者再手术前后血清SA含量 见表2。表2 12例复发脑瘤患者再手术前后血清SA含量(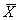 ±s,mmol/L) 复发脑瘤性质
±s,mmol/L) 复发脑瘤性质
, 百拇医药
血清SA含量
再手术前
再手术后
良性
2.212±0.141
1.448±0.066
恶性
2.717±0.213
1.498±0.134
12例复发脑瘤患者按前述标准全部阳性。复发良性脑瘤患者血清SA含量显著高于非复发良性脑瘤患者(P<0.001);复发恶性脑瘤患者血清SA含量显著高于非复发恶性脑瘤患者(P<0.001);复发恶性脑瘤患者血清SA含量显著高于复发良性脑瘤患者(P<0.01);而复发脑瘤患者再手术后3个月查血清SA与正常对照组间差异无统计学意义。
, 百拇医药
3 讨论
本研究中,颅内良性肿瘤患者血清SA含量为1.858±0.304 mmol/L,颅内恶性肿瘤患者血清SA含量为2.166±0.544mmol/L,显著高于正常对照组1.383±0.216mmol/L。颅内肿瘤阳性率67.1%,其中颅内良性肿瘤为50.0%,颅内恶性肿瘤为82.2%,与近年来国内外学者报道基本一致[45]。
SA广泛分布于体内的细胞膜上,是细胞膜糖蛋白和糖脂的重要成分,对机体的物质代谢和生理功能起调节、控制作用。一旦脑组织发生瘤变,尤其是癌化后的细胞,其表面富含SA粘蛋白;其含量可达细胞膜上蛋白含量的0.5%,这可能是肿瘤细胞膜上唾液酸转移酶活性的明显增强,导致肿瘤细胞膜上含SA的大分子糖蛋白异常增多所致[6,7]。此外,细胞结构损害、变性,细胞膜上糖蛋白和糖脂大量脱落进入血循环,因而脑瘤患者血清SA都明显高于健康人[8]。本研究中,颅内良恶性肿瘤患者血清SA含量均显著高于正常对照组(P<0.01)也证实了这一点。
, 百拇医药
已有实验资料表明:肿瘤细胞表面的SA浓度与其肿瘤的恶性程度及免疫源性密切相关[9],但与颅内肿瘤的部位及大小无关[10]。我们的实验结果也证实了这一点。本研究中,颅内良恶性肿瘤患者血清SA含量均显著高于正常对照组,而颅内恶性肿瘤组又显著高于颅内良性肿瘤组(P<0.01)。故可认为颅内肿瘤患者血清SA含量增加的程度与肿瘤细胞的分化程度相关。分化程度愈低,其肿瘤细胞生长速度愈快,恶性程度愈高,患者血清中SA含量也愈高。因此,我们在临床诊断中可以借助于血清SA含量的改变判断CT或MR上占位性病变的性质。血清中的SA含量愈高,恶性病变的可能性也愈大。此外,在贫困、缺乏CT或MR检查的地区,根据血清SA的含量,结合患者的临床症状和体征,对颅内肿瘤的诊断也有一定的帮助。
本研究中,12例复发性脑瘤患者血清SA含量均阳性;且复发良性脑瘤患者血清SA高于非复发良性脑瘤患者,复发恶性脑瘤患者血清SA高于非复发恶性脑瘤患者,这可能与复发性脑瘤患者其肿瘤包膜较不完整相关[10]。复发恶性脑瘤患者血清SA高于复发良性脑瘤患者,这与肿瘤的恶性程度相关。12例复发脑瘤患者其脑瘤均在再手术时予肉眼或显微镜下全切除,术后3个月复查血清SA均阴性,与正常对照组比较无统计学上的差异。这表明,脑瘤患者复发时其血清SA显著升高,再手术全切除后其血清SA可降至正常,且手术前其SA含量的高低与肿瘤恶性程度相关。故我们可通过动态监测血清SA含量变化,判断脑瘤预后,并可监测其复发可能。
, 百拇医药
4 参考文献
[1] Lndberg G,Eklund GA,Gullbery B,et al.Serum sialic acid concentration and cardiovasculat mortality.BMJ,1991,302(19):143
[2] Katopodis N,Hirsshant Y,Gelller NL,et al.Lipid-associateel sialic acid test for the detecation of human cancer.Cancer Res,1982,42:5270
[3] Colli A,Buccino G,Cocciolo M,et al.Diagnositic acuracy of sialic acid in the daugnosis of malignant ascities.Cancer,1989,63:912
, 百拇医药
[4] 周 强,张子学,曹予明,等.唾液酸的检测及临床意义.医学检验进修杂志,1997,4(4):156
[5] Yamamoto H,Kaneko Y,Vandermulen D,et al.The expression of CMP-NeuAc:Gal beta 1,4 Glc NAC alpha 2,6 sialytuansferase [EC2.4.99.1] and glycoproteins bearing alpha 2,6-linked sialic acid in human brain tumours.Glycoconj J,1995,12(6):848
[6] Henderson W,Kessel D.Alterations in plasma sialytransferase levels in patients with neoplastic disease.Cancer,1977,38:1129
, http://www.100md.com
[7] Khanderia U,Keller J,Grossman B.Serum sialic acid is a biological marker for malignant disease.J Surg Oncol,1983,23:163
[8] Kokoglu E,Suer S,Ozyurt E,et al.Plasma fibronection sialic acid levels in various types of human brain tumors.Cancer Biochem Biophys,1995,15(1):35
[9] Khadpkar SV,Sheth NA,Bhide SV,et al.Independence of sialic acid levels in normal and malignant growth.Cancer Res,1975,35:1520
[10] 王天然,张富强,胡 娟,等.颅内肿瘤患者血清LSA含量及其意义.肿瘤防治研究,1994,21(6):355, http://www.100md.com
单位:曹国彬 曾白云 广州医学院第二附属医院神经外科(510260);周 强 广州医学院检验系(510182)
关键词:血清;唾液酸;颅内肿瘤
广东医学990311 【摘要】 目的 探讨血清唾液酸含量在颅内肿瘤定性诊断、手术预后及术后复发监测中的价值。方法 用快速测定法测定40例颅内良性肿瘤,45例颅内恶性肿瘤及12例复发性脑瘤患者的血清唾液酸含量,并与正常对照组比较。结果 颅内良恶性肿瘤与正常对照三组间血清唾液酸含量两两比较差异均有显著性。复发性脑瘤患者再次手术切除后血清唾液酸含量可恢复正常。结论 血清唾液酸含量测定对颅内肿瘤诊断、良恶性肿瘤鉴别、脑瘤手术预后判断及术后复发监测均有一定的实用价值。
唾液酸(sialic acid,SA)是9碳糖神经氨酸的一族复合物总称。在人体组织中其主要的衍生物是N-乙酸神经氨酸,它位于糖蛋白、糖脂结构的末端,而糖蛋白、糖脂则是细胞膜的重要成分,细胞膜糖蛋白和糖脂的改变与肿瘤细胞的侵入和破坏行为有关[1]。因此SA对于维持细胞表面的功能起着决定性的作用。已有资料表明:乳腺癌、肺癌、胃癌、结肠癌与肝癌患者血清SA含量明显增高[2,3]。为了探讨颅内肿瘤患者血清SA含量变化与其肿瘤恶性程度的关系及复发性脑瘤患者再次手术前后其血清SA含量的改变,我们测定了颅内肿瘤患者及复发性脑瘤患者再次手术前后其血清SA含量,并与正常对照组比较,现将结果报道如下。
, http://www.100md.com
1 对象与方法
1.1 研究对象 ①正常对照组(Ⅰ组):45例,为体检正常者,无肝炎、结核及神经系统病史者。②颅内良性肿瘤组(Ⅱ组):40例,其中脑膜瘤17例,神经鞘瘤8例,良性胶质瘤(Ⅰ~Ⅱ级)8例,垂体腺瘤5例,颅咽管瘤2例。均经病理证实。③颅内恶性肿瘤组(Ⅲ组):45例,其中恶性胶质瘤(Ⅲ~Ⅳ级)39例,转移瘤5例,生殖细胞瘤1例。均经病理证实。④复发性颅内肿瘤组:12例,其中复发良性脑瘤6例(包括复发性垂体腺瘤3例,复发性脑膜瘤2例,复发性听神经瘤1例);复发性恶性脑瘤6例(包括复发恶性胶质瘤4例,复发室管膜母细胞瘤1例,复发髓母细胞瘤1例)。均经病理证实。
1.2 实验方法 经CT或MR确定的颅内肿瘤患者于入院次晨,健康人于就诊当天,复发性脑瘤患者于再次手术前1 d及术后3个月,空腹取静脉血2 mL,及时分离血清,离心后取上清液,采用快速测定法,测定血清SA含量。操作严格按试剂盒说明书进行。
, 百拇医药
1.3 统计学分析 血清SA含量以
 ±s表示,采用t检验。
±s表示,采用t检验。2 结果
2.1 各组唾液酸的检测结果 见表1。
表1 各组血清SA含量(
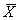 ±s,mmol/L) 组 别
±s,mmol/L) 组 别例数
血清SA含量
正常对照组
45
1.383±0.216
, 百拇医药
颅内良性肿瘤组
40
1.858±0.304
颅内恶性肿瘤组
45
2.166±0.544△
注:与正常对照组比较P<0.001,△与颅内良性肿瘤组比较P<0.01
2.2 颅内肿瘤SA阳性率 以1.383+1.96×0.216 mmol/L的结果作为正常参考值的上限,则颅内肿瘤的阳性率为67.1%;其中颅内良性肿瘤阳性率为50.0%,颅内恶性肿瘤阳性率为82.2%。
2.3 复发脑瘤患者再手术前后血清SA含量 见表2。表2 12例复发脑瘤患者再手术前后血清SA含量(
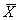 ±s,mmol/L) 复发脑瘤性质
±s,mmol/L) 复发脑瘤性质, 百拇医药
血清SA含量
再手术前
再手术后
良性
2.212±0.141
1.448±0.066
恶性
2.717±0.213
1.498±0.134
12例复发脑瘤患者按前述标准全部阳性。复发良性脑瘤患者血清SA含量显著高于非复发良性脑瘤患者(P<0.001);复发恶性脑瘤患者血清SA含量显著高于非复发恶性脑瘤患者(P<0.001);复发恶性脑瘤患者血清SA含量显著高于复发良性脑瘤患者(P<0.01);而复发脑瘤患者再手术后3个月查血清SA与正常对照组间差异无统计学意义。
, 百拇医药
3 讨论
本研究中,颅内良性肿瘤患者血清SA含量为1.858±0.304 mmol/L,颅内恶性肿瘤患者血清SA含量为2.166±0.544mmol/L,显著高于正常对照组1.383±0.216mmol/L。颅内肿瘤阳性率67.1%,其中颅内良性肿瘤为50.0%,颅内恶性肿瘤为82.2%,与近年来国内外学者报道基本一致[45]。
SA广泛分布于体内的细胞膜上,是细胞膜糖蛋白和糖脂的重要成分,对机体的物质代谢和生理功能起调节、控制作用。一旦脑组织发生瘤变,尤其是癌化后的细胞,其表面富含SA粘蛋白;其含量可达细胞膜上蛋白含量的0.5%,这可能是肿瘤细胞膜上唾液酸转移酶活性的明显增强,导致肿瘤细胞膜上含SA的大分子糖蛋白异常增多所致[6,7]。此外,细胞结构损害、变性,细胞膜上糖蛋白和糖脂大量脱落进入血循环,因而脑瘤患者血清SA都明显高于健康人[8]。本研究中,颅内良恶性肿瘤患者血清SA含量均显著高于正常对照组(P<0.01)也证实了这一点。
, 百拇医药
已有实验资料表明:肿瘤细胞表面的SA浓度与其肿瘤的恶性程度及免疫源性密切相关[9],但与颅内肿瘤的部位及大小无关[10]。我们的实验结果也证实了这一点。本研究中,颅内良恶性肿瘤患者血清SA含量均显著高于正常对照组,而颅内恶性肿瘤组又显著高于颅内良性肿瘤组(P<0.01)。故可认为颅内肿瘤患者血清SA含量增加的程度与肿瘤细胞的分化程度相关。分化程度愈低,其肿瘤细胞生长速度愈快,恶性程度愈高,患者血清中SA含量也愈高。因此,我们在临床诊断中可以借助于血清SA含量的改变判断CT或MR上占位性病变的性质。血清中的SA含量愈高,恶性病变的可能性也愈大。此外,在贫困、缺乏CT或MR检查的地区,根据血清SA的含量,结合患者的临床症状和体征,对颅内肿瘤的诊断也有一定的帮助。
本研究中,12例复发性脑瘤患者血清SA含量均阳性;且复发良性脑瘤患者血清SA高于非复发良性脑瘤患者,复发恶性脑瘤患者血清SA高于非复发恶性脑瘤患者,这可能与复发性脑瘤患者其肿瘤包膜较不完整相关[10]。复发恶性脑瘤患者血清SA高于复发良性脑瘤患者,这与肿瘤的恶性程度相关。12例复发脑瘤患者其脑瘤均在再手术时予肉眼或显微镜下全切除,术后3个月复查血清SA均阴性,与正常对照组比较无统计学上的差异。这表明,脑瘤患者复发时其血清SA显著升高,再手术全切除后其血清SA可降至正常,且手术前其SA含量的高低与肿瘤恶性程度相关。故我们可通过动态监测血清SA含量变化,判断脑瘤预后,并可监测其复发可能。
, 百拇医药
4 参考文献
[1] Lndberg G,Eklund GA,Gullbery B,et al.Serum sialic acid concentration and cardiovasculat mortality.BMJ,1991,302(19):143
[2] Katopodis N,Hirsshant Y,Gelller NL,et al.Lipid-associateel sialic acid test for the detecation of human cancer.Cancer Res,1982,42:5270
[3] Colli A,Buccino G,Cocciolo M,et al.Diagnositic acuracy of sialic acid in the daugnosis of malignant ascities.Cancer,1989,63:912
, 百拇医药
[4] 周 强,张子学,曹予明,等.唾液酸的检测及临床意义.医学检验进修杂志,1997,4(4):156
[5] Yamamoto H,Kaneko Y,Vandermulen D,et al.The expression of CMP-NeuAc:Gal beta 1,4 Glc NAC alpha 2,6 sialytuansferase [EC2.4.99.1] and glycoproteins bearing alpha 2,6-linked sialic acid in human brain tumours.Glycoconj J,1995,12(6):848
[6] Henderson W,Kessel D.Alterations in plasma sialytransferase levels in patients with neoplastic disease.Cancer,1977,38:1129
, http://www.100md.com
[7] Khanderia U,Keller J,Grossman B.Serum sialic acid is a biological marker for malignant disease.J Surg Oncol,1983,23:163
[8] Kokoglu E,Suer S,Ozyurt E,et al.Plasma fibronection sialic acid levels in various types of human brain tumors.Cancer Biochem Biophys,1995,15(1):35
[9] Khadpkar SV,Sheth NA,Bhide SV,et al.Independence of sialic acid levels in normal and malignant growth.Cancer Res,1975,35:1520
[10] 王天然,张富强,胡 娟,等.颅内肿瘤患者血清LSA含量及其意义.肿瘤防治研究,1994,21(6):355, http://www.100md.com