手术创伤对炎性细胞因子的影响
作者:宋新明 王吉甫 赵继宗 詹煌南
单位:宋新明 广州军区广州总医院普外科(510010);王吉甫 赵继宗 詹煌南中山医科大学附属第一医院外科(510080)
关键词:白细胞介素6;白细胞介素8;肿瘤坏死因子α;手术
广东医学990304 【摘要】 目的 探讨围手术期细胞因子的变化规律及临床意义。方法 Ⅱ、Ⅲ期胃癌(A组)、低位直肠癌(B组)各13例和食管贲门癌(C组)11例,均接受根治性切除术,对照组(10例)为择期小手术。所有患者于术前1 d、术后2 h、1 d、6 d取血,测定血浆IL-6、IL-8和TNF-α含量,及体外内毒素(LPS)刺激全血释放IL-6、IL-8和TNF-α含量的变化。结果 ①A、B、C三组患者术后2 h IL-6、IL-8含量均显著升高(P<0.05),术后1 d则明显回落,出现并发症患者IL-6和IL-8呈过度升高;②各组手术前后TNF-α无显著改变(P>0.05);③全血受LPS刺激后,A、B、C三组术后2 h TNF-α释放量较其它时点及对照组显著降低(P<0.05),但各时点及各组间IL-6和IL-8释放量差异均无显著性(P>0.05)。结论 监测术后血浆IL-6和IL-8含量及LPS刺激全血TNF-α释放量的变化有利于创伤程度和预后的判断,具有显著的临床意义。
, http://www.100md.com
Responses of inflammatory cytokines in patients undergoing major thoracic-abdominal surgery: experimental and clinical trial
Song Xinming, Wang Jipu, Zhao Jizong, et al.
General Surgery Department, Guangzhou General Hospital of PLA, Guangzhou 510010
【Abstract】 Objective To investigate the changing characters of cytokines in vivo and in vitro during perioperative period and its clinical significance.Methods 13 cases of gastric carcinoma (group A), 13 of rectal carcinoma (group B) and 11 of esoghagus or cardia carcinoma (group C) who were treated by radical resection were eligible for the study. The control group was 10 of elective minus operation. Measurements of IL-6, IL-8 and TNF-α, and releases of these cytokines from endotoxin-stimulated whole blood in vitro were carried out before surgery and at the 2nd h and on the 1st d and the 6th d postoperatively. Results ①The levels of IL-6 and IL-8 in patients of A, B and C groups at the 2nd h postoperatively were significantly higher than those before surgery and those in control group (P<0.05). The levels in a patient with severe complication were exaggerated higher than those in uncomplicated patients. ②No significant change in TNF-α level was found in all patients throughout perioperative period. ③The increments of TNF-α released from LPS-spiked whole blood at the 2nd h postoperatively in patients of A, B and C groups reduced significantly compared with those of other points and the control group (P<0.05), but the increments of IL-6 and IL-8 had not significantly changed between each group throughout perioperative period. Conclusion Monitoring the levels of IL-6, IL-8 and the increment of TNF-α from LPS-spiked whole blood in perioperative period may evaluate severity of stress response to surgical insult and have prognostic significance.
, 百拇医药
【Key words】 Interleukin-6 Interleukin-8 Tumor necrosis factor-alpha Surgery
手术创伤、失血、大量输血及麻醉等因素,构成对机体的打击,通过刺激炎性细胞释放大量的细胞因子(Cytokine),形成自身损伤性全身炎性反应(SIRS)。白介素-6(IL-6)、白介素-8(IL-8)和肿瘤坏死因子(TNF)被认为是最重要的炎性介质。本研究从临床和实验角度探讨细胞因子的变化规律及其临床意义。
1 资料与方法
1.1 一般资料 1996年3~12月中山医科大学附属第一医院胃肠外科胃癌、低位直肠癌和食管贲门癌37例。男24例,女13例,年龄30~74岁,平均年龄56.7岁。根据不同的诊断分为三组:A组为胃癌组(13例),B组为低位直肠癌组(13例),C组为食管贲门癌组(11例),均接受根治性切除术。D组为对照组(10例),系同期慢性阑尾炎和腹股沟疝接受手术治疗患者。
, 百拇医药
1.2 方法 所有患者均按常规进行术前准备,记录手术时间、术中失血量、输血量及补液量。术后即行APACHE Ⅱ评分。于手术前1 d,术后2 h、1 d、6 d,空腹取外周血,测定IL-6、IL-8和TNF-α。
体外LPS刺激全血细胞释放细胞因子实验:取肝素抗凝血0.9 mL,分别加入两支无热原试管,一支加入50 μg/mL LPS(SIGMA)0.1 mL,另一支加入生理盐水0.1 mL作对照,37℃孵化3 h。离心取上清液置-70℃,备测IL-6、IL-8和TNF-α。
IL-6、IL-8和TNF-α采用ELISA方法(Genzym,美国),单位ng/L,μg/L。ACTH和Cortisol采用RIA方法(DPC,美国),单位pmol/L,nmol/L。
1.3 统计学处理 采用非参数方差分析和相关分析。由SPSS统计软件处理,数据以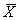 ±s表示。
±s表示。
, 百拇医药
2 结果
2.1 临床结果 37例患者中,仅B组1例因术中大出血,术后并发ARDS和MOF,于术后第7天死亡。余患者术中术后均未出现明显并发症。手术时间、失血量、输血量、补液量及APACHE Ⅱ积分,A、B、C三组间差异无显著性(P>0.05),但均显著高于对照组(P<0.01)。
2.2 血浆IL-6含量分析(表1) A、B、C三组患者术后2 h IL-6均明显升高,与术前、术后1 d、6 d及对照组比较差异非常显著(P<0.01)。C组术后IL-6升高最为显著。1例并发MOF患者术后IL-6呈过度升高,分别为126.8 ng/L,70.6 ng/L,6.9 ng/L。
表1 IL-6含量分析(ng/L,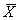 ±s) n
±s) n
, http://www.100md.com 术前
术后2 h
术后1 d
术后6 d
A组 13
4.8±1.6
25.0±15.3*△+★
12.1±7.3
5.2±2.2
B组 12
6.4±2.8
25.0±9.2*△+★
, http://www.100md.com
9.2±3.8
7.4±4.3
C组 11
6.3±3.5
36.2±20.1*△+★▲×
16.9±6.0★△▲×
9.3±3.4
D组 10
8.5±3.6
8.0±2.9
9.8±3.3
, 百拇医药 7.2±3.1
*与术前比较P<0.01; △与术后1 d比较P<0.01;+与术后6 d比较P<0.01;★与D组比较P<0.01;▲与B组比较P<0.01;×与A组比较P<0.05
2.3 血浆IL-8含量分析 A、B、C三组患者术后2 h IL-8含量均显著升高,与术前和对照组比较差异有显著性(P<0.05)。A组术后升高更为显著。术后1 d IL-8明显回落。1例并发MOF患者IL-8术后呈过度升高,分别为226.3,73.9,23.6 ng/L。见表2。表2 IL-8含量分析(ng/L,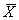 ±s) n
±s) n
术前
术后2 h
术后1 d
, 百拇医药
术后6 d
A组 13
10.2±7.2
30.6±26.3**★
18.4±13.3★
18.5±11.7
B组 12
8.2±4.3
19.9±16.4*△+★
11.0±8.0
9.6±5.1
, 百拇医药
C组 11
11.9±5.5
21.4±14.5*★
15.4±7.7
15.9±10.9
D组 10
13.6±9.1
8.6±4.9
7.8±3.3
10.3±8.6
*与术前比较P<0.05,P<0.01;△与术后1 d比较P<0.05;+与术后6 d比较P<0.05;★与D组比较P<0.05
, 百拇医药
2.4 血浆TNF-α含量分析 A、B、C、D四组患者TNF-α含量手术前后比较差异均无显著性(P>0.05)。
2.5 体外LPS刺激全血细胞释放TNF-α含量分析 人血细胞受LPS刺激后,TNF-α释放量呈数十倍、数百倍增加,无内毒素刺激的对照管TNF-α并不增加。A、B、C三组患者术后2 h全血细胞TNF-α释放量较术前、术后1 d、6 d及对照组比较显著降低(P<0.01),以C组降低最为显著。
表3 LPS刺激全血细胞释放TNF-α含量分析(μg/L,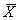 ±s) n
±s) n
术前
术后2 h
术后1 d
, http://www.100md.com
术后6 d
A组 7
4.49±1.45
0.73±0.61*△+★
3.21±1.14
4.31±1.01
B组 7
4.42±2.18
0.29±0.25*△+★
3.20±1.93
4.04±2.62
, 百拇医药
C组 7
2.15±1.45
0.20±0.18*+★★
0.84±0.99★▲×
2.42±2.35
D组 6
3.05±2.85
2.83±2.35
3.24±1.55
2.36±1.64
*与术前比较P<0.01;△与术后1 d比较P<0.01;+与术后6 d比较P<0.01;★与同一时点D组比较P<0.05,★★P<0.01;▲与同一时点B组比较P<0.05;×与同一时点A组比较P<0.05
, 百拇医药
2.6 体外LPS刺激全血细胞释放IL-6、IL-8含量分析 A、B、C、D四组患者手术前后全血细胞受LPS刺激后,IL-6、IL-8释放量呈数十倍增加,但各时点及各组间比较均无显著差异(P>0.05)。
3 讨论
3.1 手术创伤对血浆IL-6和IL-8的影响 90年代以来,人们发现手术创伤使血浆IL-6和IL-8升高。文献报道手术开始4 h后IL-6和IL-8开始上升,6~8 h达到高峰,24~48 h内显著下降[1,2]。本研究发现,三组不同手术方式的患者,术后2 h(即手术开始6~8 h)血浆IL-6和IL-8均急骤升高,显著高于对照组患者,不同手术方式其上升幅度不同,术后24 h则显著回落。术后有严重并发症患者术后早期IL-6和IL-8呈过度升高,但术后24 h也显著下降,并未出现随病情加重呈进行性上升的情况。由此表明,手术创伤后IL-6和IL-8升高具有显著的时间效应,且上升幅度与手术本身损伤程度和应激强度有关。因此,在掌握IL-6和IL-8变化的时间效应特性后,可利用其监测创伤应激强度及预后判断。
, 百拇医药
3.2 手术创伤对TNF-α产生的影响 早期研究表明,TNF-α能引起内毒素样休克和多器官组织损伤[3]。应用TNF-α多克隆或单克隆抗体可使动物免于由细菌感染或内毒素引起的死亡[4],因而将TNF-α作为最重要的炎性介质。新近研究表明TNF-α单独作用并不能引起机体的严重损害,但是在严重感染或内毒素存在的条件下,会引起组织器官的严重损伤和动物的死亡[5,6]。说明早期研究结果可能因TNF-α不纯、含有内毒素所致。创伤患者在伴有IL-6和IL-8升高的同时,而TNF-α检测不到或无显著变化[7]。本研究发现所有患者手术前后TNF-α均无显著改变,说明手术应激并不能使血浆TNF-α含量升高。并发MOF死亡的患者,也未见TNF-α有明显升高,可见监测血中TNF-α含量不能反映手术创伤的程度和预后。
3.3 手术创伤对内毒素刺激全血细胞释放细胞因子的影响 全血是一个理想的培养基,用内毒素刺激全血产生细胞因子更接近于体内生理状态,避免了分离单核细胞或淋巴细胞造成的人为干扰,易于临床推广应用。本研究结果显示,所有全血经LPS刺激后,TNF-α释放量呈数十倍、上百倍增加,而无内毒素刺激的对照管TNF-α并不增加。三组大手术患者术后2 h TNF-α释放量较术前和术后6 d TNF-α释放量显著降低,以开胸手术组最为明显,腹会阴直肠癌根治手术组次之。小手术对照组TNF-α释放量手术前后无显著改变。所有患者手术前后全血细胞受LPS刺激后,IL-6和IL-8释放量呈数十倍增加,但各时间点及各组间比较差异均无显著性,无内毒素刺激的对照管IL-6和IL-8含量仅轻度升高。
, http://www.100md.com
创伤使LPS刺激全血细胞释放细胞因子的量减少,直到最近才有报道[8],而手术创伤是否有此方面的作用尚未见报道。本研究结果表明,手术创伤早期(24 h内)全血细胞(主要为单核细胞)对LPS刺激释放TNF-α有一过性耐受作用,其耐受作用的强度和时间与手术创伤的程度密切相关,与血浆IL-6含量升高反映的临床结果一致,但二者含量无明显相关性。手术创伤对LPS刺激全血细胞释放IL-6和IL-8无显著影响。监测术后早期血浆IL-6和IL-8含量及LPS刺激全血细胞TNF-α释放量的变化有利于创伤程度和预后的判断,具有显著的临床意义。 4 参考文献
[1] Baigrie RJ, Lamont PM, Kwiatkowski D, et al. Systemic cytokine response after major surgery. Br J Surg, 1992, 79:757
[2] Kawahito K, Kawakami M, Fujiwara T, et al. Interleukin-8 and monocyte chemotactic activating factor responses to cardiopulmonary bypass. J Thorac Cardiovasc Surg, 1995, 10:99
, http://www.100md.com
[3] Tracey KJ, Beutler B, Lowry SF, et al. Shock and tissue injury by recombinant human cachectin. Science, 1986, 234:470
[4] Beutler B, Milsark IW, Cerami AC. Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin. Science, 1985, 229:869
[5] 宋新明,白 涛,凌 云,等.肿瘤坏死因子静脉注入对大鼠多器官功能影响的实验观察.中国病理生理杂志,1995,11:349
[6] Neilson IR, Neilson KA, Junis EJ, et al. Failure of tumor necrosis factor to produce hypotensive shock in the absence of endotoxin. Surgery, 1989, 106:439
, 百拇医药
[7] Donnelly TJ, Meade P, Jagels M, et al. Cytokine complement and endotoxin profiles associated with the development of the adult respiratory distress syndrome after severe injury. Crit Care Med, 1994, 22:768
[8] Fabian TC, Croce MA, Fabian KJ, et al. Reduced tumor necrosis factor product in endotoxin-spiked whole blood after trauma: experimental results and clinical correlation. Surgery, 1995,118:430, 百拇医药
单位:宋新明 广州军区广州总医院普外科(510010);王吉甫 赵继宗 詹煌南中山医科大学附属第一医院外科(510080)
关键词:白细胞介素6;白细胞介素8;肿瘤坏死因子α;手术
广东医学990304 【摘要】 目的 探讨围手术期细胞因子的变化规律及临床意义。方法 Ⅱ、Ⅲ期胃癌(A组)、低位直肠癌(B组)各13例和食管贲门癌(C组)11例,均接受根治性切除术,对照组(10例)为择期小手术。所有患者于术前1 d、术后2 h、1 d、6 d取血,测定血浆IL-6、IL-8和TNF-α含量,及体外内毒素(LPS)刺激全血释放IL-6、IL-8和TNF-α含量的变化。结果 ①A、B、C三组患者术后2 h IL-6、IL-8含量均显著升高(P<0.05),术后1 d则明显回落,出现并发症患者IL-6和IL-8呈过度升高;②各组手术前后TNF-α无显著改变(P>0.05);③全血受LPS刺激后,A、B、C三组术后2 h TNF-α释放量较其它时点及对照组显著降低(P<0.05),但各时点及各组间IL-6和IL-8释放量差异均无显著性(P>0.05)。结论 监测术后血浆IL-6和IL-8含量及LPS刺激全血TNF-α释放量的变化有利于创伤程度和预后的判断,具有显著的临床意义。
, http://www.100md.com
Responses of inflammatory cytokines in patients undergoing major thoracic-abdominal surgery: experimental and clinical trial
Song Xinming, Wang Jipu, Zhao Jizong, et al.
General Surgery Department, Guangzhou General Hospital of PLA, Guangzhou 510010
【Abstract】 Objective To investigate the changing characters of cytokines in vivo and in vitro during perioperative period and its clinical significance.Methods 13 cases of gastric carcinoma (group A), 13 of rectal carcinoma (group B) and 11 of esoghagus or cardia carcinoma (group C) who were treated by radical resection were eligible for the study. The control group was 10 of elective minus operation. Measurements of IL-6, IL-8 and TNF-α, and releases of these cytokines from endotoxin-stimulated whole blood in vitro were carried out before surgery and at the 2nd h and on the 1st d and the 6th d postoperatively. Results ①The levels of IL-6 and IL-8 in patients of A, B and C groups at the 2nd h postoperatively were significantly higher than those before surgery and those in control group (P<0.05). The levels in a patient with severe complication were exaggerated higher than those in uncomplicated patients. ②No significant change in TNF-α level was found in all patients throughout perioperative period. ③The increments of TNF-α released from LPS-spiked whole blood at the 2nd h postoperatively in patients of A, B and C groups reduced significantly compared with those of other points and the control group (P<0.05), but the increments of IL-6 and IL-8 had not significantly changed between each group throughout perioperative period. Conclusion Monitoring the levels of IL-6, IL-8 and the increment of TNF-α from LPS-spiked whole blood in perioperative period may evaluate severity of stress response to surgical insult and have prognostic significance.
, 百拇医药
【Key words】 Interleukin-6 Interleukin-8 Tumor necrosis factor-alpha Surgery
手术创伤、失血、大量输血及麻醉等因素,构成对机体的打击,通过刺激炎性细胞释放大量的细胞因子(Cytokine),形成自身损伤性全身炎性反应(SIRS)。白介素-6(IL-6)、白介素-8(IL-8)和肿瘤坏死因子(TNF)被认为是最重要的炎性介质。本研究从临床和实验角度探讨细胞因子的变化规律及其临床意义。
1 资料与方法
1.1 一般资料 1996年3~12月中山医科大学附属第一医院胃肠外科胃癌、低位直肠癌和食管贲门癌37例。男24例,女13例,年龄30~74岁,平均年龄56.7岁。根据不同的诊断分为三组:A组为胃癌组(13例),B组为低位直肠癌组(13例),C组为食管贲门癌组(11例),均接受根治性切除术。D组为对照组(10例),系同期慢性阑尾炎和腹股沟疝接受手术治疗患者。
, 百拇医药
1.2 方法 所有患者均按常规进行术前准备,记录手术时间、术中失血量、输血量及补液量。术后即行APACHE Ⅱ评分。于手术前1 d,术后2 h、1 d、6 d,空腹取外周血,测定IL-6、IL-8和TNF-α。
体外LPS刺激全血细胞释放细胞因子实验:取肝素抗凝血0.9 mL,分别加入两支无热原试管,一支加入50 μg/mL LPS(SIGMA)0.1 mL,另一支加入生理盐水0.1 mL作对照,37℃孵化3 h。离心取上清液置-70℃,备测IL-6、IL-8和TNF-α。
IL-6、IL-8和TNF-α采用ELISA方法(Genzym,美国),单位ng/L,μg/L。ACTH和Cortisol采用RIA方法(DPC,美国),单位pmol/L,nmol/L。
1.3 统计学处理 采用非参数方差分析和相关分析。由SPSS统计软件处理,数据以
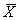 ±s表示。
±s表示。, 百拇医药
2 结果
2.1 临床结果 37例患者中,仅B组1例因术中大出血,术后并发ARDS和MOF,于术后第7天死亡。余患者术中术后均未出现明显并发症。手术时间、失血量、输血量、补液量及APACHE Ⅱ积分,A、B、C三组间差异无显著性(P>0.05),但均显著高于对照组(P<0.01)。
2.2 血浆IL-6含量分析(表1) A、B、C三组患者术后2 h IL-6均明显升高,与术前、术后1 d、6 d及对照组比较差异非常显著(P<0.01)。C组术后IL-6升高最为显著。1例并发MOF患者术后IL-6呈过度升高,分别为126.8 ng/L,70.6 ng/L,6.9 ng/L。
表1 IL-6含量分析(ng/L,
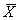 ±s) n
±s) n, http://www.100md.com 术前
术后2 h
术后1 d
术后6 d
A组 13
4.8±1.6
25.0±15.3*△+★
12.1±7.3
5.2±2.2
B组 12
6.4±2.8
25.0±9.2*△+★
, http://www.100md.com
9.2±3.8
7.4±4.3
C组 11
6.3±3.5
36.2±20.1*△+★▲×
16.9±6.0★△▲×
9.3±3.4
D组 10
8.5±3.6
8.0±2.9
9.8±3.3
, 百拇医药 7.2±3.1
*与术前比较P<0.01; △与术后1 d比较P<0.01;+与术后6 d比较P<0.01;★与D组比较P<0.01;▲与B组比较P<0.01;×与A组比较P<0.05
2.3 血浆IL-8含量分析 A、B、C三组患者术后2 h IL-8含量均显著升高,与术前和对照组比较差异有显著性(P<0.05)。A组术后升高更为显著。术后1 d IL-8明显回落。1例并发MOF患者IL-8术后呈过度升高,分别为226.3,73.9,23.6 ng/L。见表2。表2 IL-8含量分析(ng/L,
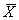 ±s) n
±s) n术前
术后2 h
术后1 d
, 百拇医药
术后6 d
A组 13
10.2±7.2
30.6±26.3**★
18.4±13.3★
18.5±11.7
B组 12
8.2±4.3
19.9±16.4*△+★
11.0±8.0
9.6±5.1
, 百拇医药
C组 11
11.9±5.5
21.4±14.5*★
15.4±7.7
15.9±10.9
D组 10
13.6±9.1
8.6±4.9
7.8±3.3
10.3±8.6
*与术前比较P<0.05,P<0.01;△与术后1 d比较P<0.05;+与术后6 d比较P<0.05;★与D组比较P<0.05
, 百拇医药
2.4 血浆TNF-α含量分析 A、B、C、D四组患者TNF-α含量手术前后比较差异均无显著性(P>0.05)。
2.5 体外LPS刺激全血细胞释放TNF-α含量分析 人血细胞受LPS刺激后,TNF-α释放量呈数十倍、数百倍增加,无内毒素刺激的对照管TNF-α并不增加。A、B、C三组患者术后2 h全血细胞TNF-α释放量较术前、术后1 d、6 d及对照组比较显著降低(P<0.01),以C组降低最为显著。
表3 LPS刺激全血细胞释放TNF-α含量分析(μg/L,
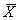 ±s) n
±s) n术前
术后2 h
术后1 d
, http://www.100md.com
术后6 d
A组 7
4.49±1.45
0.73±0.61*△+★
3.21±1.14
4.31±1.01
B组 7
4.42±2.18
0.29±0.25*△+★
3.20±1.93
4.04±2.62
, 百拇医药
C组 7
2.15±1.45
0.20±0.18*+★★
0.84±0.99★▲×
2.42±2.35
D组 6
3.05±2.85
2.83±2.35
3.24±1.55
2.36±1.64
*与术前比较P<0.01;△与术后1 d比较P<0.01;+与术后6 d比较P<0.01;★与同一时点D组比较P<0.05,★★P<0.01;▲与同一时点B组比较P<0.05;×与同一时点A组比较P<0.05
, 百拇医药
2.6 体外LPS刺激全血细胞释放IL-6、IL-8含量分析 A、B、C、D四组患者手术前后全血细胞受LPS刺激后,IL-6、IL-8释放量呈数十倍增加,但各时点及各组间比较均无显著差异(P>0.05)。
3 讨论
3.1 手术创伤对血浆IL-6和IL-8的影响 90年代以来,人们发现手术创伤使血浆IL-6和IL-8升高。文献报道手术开始4 h后IL-6和IL-8开始上升,6~8 h达到高峰,24~48 h内显著下降[1,2]。本研究发现,三组不同手术方式的患者,术后2 h(即手术开始6~8 h)血浆IL-6和IL-8均急骤升高,显著高于对照组患者,不同手术方式其上升幅度不同,术后24 h则显著回落。术后有严重并发症患者术后早期IL-6和IL-8呈过度升高,但术后24 h也显著下降,并未出现随病情加重呈进行性上升的情况。由此表明,手术创伤后IL-6和IL-8升高具有显著的时间效应,且上升幅度与手术本身损伤程度和应激强度有关。因此,在掌握IL-6和IL-8变化的时间效应特性后,可利用其监测创伤应激强度及预后判断。
, 百拇医药
3.2 手术创伤对TNF-α产生的影响 早期研究表明,TNF-α能引起内毒素样休克和多器官组织损伤[3]。应用TNF-α多克隆或单克隆抗体可使动物免于由细菌感染或内毒素引起的死亡[4],因而将TNF-α作为最重要的炎性介质。新近研究表明TNF-α单独作用并不能引起机体的严重损害,但是在严重感染或内毒素存在的条件下,会引起组织器官的严重损伤和动物的死亡[5,6]。说明早期研究结果可能因TNF-α不纯、含有内毒素所致。创伤患者在伴有IL-6和IL-8升高的同时,而TNF-α检测不到或无显著变化[7]。本研究发现所有患者手术前后TNF-α均无显著改变,说明手术应激并不能使血浆TNF-α含量升高。并发MOF死亡的患者,也未见TNF-α有明显升高,可见监测血中TNF-α含量不能反映手术创伤的程度和预后。
3.3 手术创伤对内毒素刺激全血细胞释放细胞因子的影响 全血是一个理想的培养基,用内毒素刺激全血产生细胞因子更接近于体内生理状态,避免了分离单核细胞或淋巴细胞造成的人为干扰,易于临床推广应用。本研究结果显示,所有全血经LPS刺激后,TNF-α释放量呈数十倍、上百倍增加,而无内毒素刺激的对照管TNF-α并不增加。三组大手术患者术后2 h TNF-α释放量较术前和术后6 d TNF-α释放量显著降低,以开胸手术组最为明显,腹会阴直肠癌根治手术组次之。小手术对照组TNF-α释放量手术前后无显著改变。所有患者手术前后全血细胞受LPS刺激后,IL-6和IL-8释放量呈数十倍增加,但各时间点及各组间比较差异均无显著性,无内毒素刺激的对照管IL-6和IL-8含量仅轻度升高。
, http://www.100md.com
创伤使LPS刺激全血细胞释放细胞因子的量减少,直到最近才有报道[8],而手术创伤是否有此方面的作用尚未见报道。本研究结果表明,手术创伤早期(24 h内)全血细胞(主要为单核细胞)对LPS刺激释放TNF-α有一过性耐受作用,其耐受作用的强度和时间与手术创伤的程度密切相关,与血浆IL-6含量升高反映的临床结果一致,但二者含量无明显相关性。手术创伤对LPS刺激全血细胞释放IL-6和IL-8无显著影响。监测术后早期血浆IL-6和IL-8含量及LPS刺激全血细胞TNF-α释放量的变化有利于创伤程度和预后的判断,具有显著的临床意义。 4 参考文献
[1] Baigrie RJ, Lamont PM, Kwiatkowski D, et al. Systemic cytokine response after major surgery. Br J Surg, 1992, 79:757
[2] Kawahito K, Kawakami M, Fujiwara T, et al. Interleukin-8 and monocyte chemotactic activating factor responses to cardiopulmonary bypass. J Thorac Cardiovasc Surg, 1995, 10:99
, http://www.100md.com
[3] Tracey KJ, Beutler B, Lowry SF, et al. Shock and tissue injury by recombinant human cachectin. Science, 1986, 234:470
[4] Beutler B, Milsark IW, Cerami AC. Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin. Science, 1985, 229:869
[5] 宋新明,白 涛,凌 云,等.肿瘤坏死因子静脉注入对大鼠多器官功能影响的实验观察.中国病理生理杂志,1995,11:349
[6] Neilson IR, Neilson KA, Junis EJ, et al. Failure of tumor necrosis factor to produce hypotensive shock in the absence of endotoxin. Surgery, 1989, 106:439
, 百拇医药
[7] Donnelly TJ, Meade P, Jagels M, et al. Cytokine complement and endotoxin profiles associated with the development of the adult respiratory distress syndrome after severe injury. Crit Care Med, 1994, 22:768
[8] Fabian TC, Croce MA, Fabian KJ, et al. Reduced tumor necrosis factor product in endotoxin-spiked whole blood after trauma: experimental results and clinical correlation. Surgery, 1995,118:430, 百拇医药