小鼠睾丸Ⅳ型胶原的合成与分布△
作者:宋阳 许增禄 崔丽 刘霄 徐健 钱晓菁 黄玉苓
单位:宋阳 许增禄 刘霄 徐健 钱晓菁 黄玉苓 (中国医学科学院 中国协和医科大学 基础医学研究所组织胚胎学室,北京 100005);崔丽 (白求恩医科大学组织胚胎学教研室)
关键词:胶原;睾丸;间接免疫荧光;原位杂交
小鼠睾丸 摘要 目的 研究小鼠睾丸内Ⅳ型胶原的合成与分布。方法 应用生物素-抗生物素蛋白DCS体系间接免疫荧光法和原位杂交法检测幼年、成年及老年小鼠睾丸内Ⅳ型胶原的合成与分布的变化。结果 小鼠睾丸支持细胞具有合成Ⅳ型胶原的功能,小鼠睾丸曲细精管基膜内Ⅳ型胶原的含量及支持细胞内Ⅳ型胶原mRNA水平随小鼠年龄的增加而变化。15天幼鼠睾丸内含量最高,成年及老年小鼠睾丸内含量依次减少。结论 睾丸内的细胞外基质可能在生精过程中起重要作用。
中图号 R322.6+4 Q512.6
, http://www.100md.com
Synthesis and Distribution of Type Ⅳ Collagen in Mice Testes
Song Yang Xu Zenglu Cui Li Liu Xiao Xu Jian,et al
(Department of Histology and Embryology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective The variations of the synthesis and distribution type Ⅳ collagen in the testes of young,adult,and old mice were studied.Methods Biotin-avidin DCS system indirect immunofluorescence technique and in situ hybridization method were used.Results Sertoli cell could synthesize type Ⅳ collagen.Type Ⅳ collagen was present in the basement membrane of seminiferous tubules in mouse testis.Type Ⅳ collagen mRNA signal was seen in the Sertoli cells.The content of type Ⅳ collagen and type Ⅳ collagen mRNA peaked at day 15,and then declined successively to adult value and the aged value.Conclusions The results suggest that the extracellular matrix of testis might play an important role in the process of spermatogenesis.
, 百拇医药
Key words collagen; testis; indirect immunofluorescence; in situ hybridization
睾丸内的细胞外基质(extracellular matrix,ECM)主要包括纤维粘连蛋白(fibronectin,FN)、层粘连蛋白(laminin,LN)、巢蛋白(entactin)、SPARC(secreted protein,acidic,and rich in cysteine)、蛋白多糖和Ⅰ型、Ⅲ型、Ⅳ型胶原等[1~4],与精子发生和生精细胞的分化具有密切关系,曲细精管基膜是睾丸内ECM的主要分布位置,Ⅳ型胶原是基膜内含量最丰富的ECM成分。在睾丸内,支持细胞(Sertoli cell,SC)和管周肌样细胞(Peritublar cell,PC)可以产生ECM[5]。本研究采用生物素-抗生物素蛋白DCS(avidin D cell sorter)体系间接免疫荧光法和原位杂交法检测各年龄段小鼠睾丸内Ⅳ型胶原的合成与分布,以阐明ECM在生精过程中的重要作用,并试图对其作用机制进行初步探讨。
, 百拇医药
1 材料和方法
实验分组 体内实验:实验动物为昆明小鼠,按年龄分为4组:(1)新生鼠,出生后5 d; (2) 幼鼠,出生后15 d; (3) 成年鼠,3个月; (4) 老年鼠,18个月。体外实验:培养的支持细胞来自出生后10 d的昆明小鼠。各年龄段使用动物数8~12只。
支持细胞的分离与培养 支持细胞分离参照Hadley等[6]方法进行。用培养液悬浮细胞,用吸管将细胞接种在有盖玻片的培养瓶内,于31℃,5%CO2条件下培养10~14 d。分离培养的细胞存在核卫星小体,可鉴定为支持细胞。
生物素-抗生物素蛋白DCS体系间接免疫荧光染色
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色:参照许增禄[7]法。应用兔抗小鼠Ⅳ型胶原为第一抗体,生物素化的山羊抗兔IgG为第二抗体。染色后滴加甘油封片剂(含10%PBS和1%对苯基二胺)封片,OLYMPUS反射式荧光显微镜下观察,Kodak 400ASA胶卷照相。
, 百拇医药
体外培养的SC生物素-抗生物素蛋白DCS体系间接免疫荧光染色:将长有SC的盖玻片从培养瓶内取出,D-Hank液洗1次,放入丙酮固定20 s,PBS洗2次,每次5 min,然后加用PBS配制的10%山羊血清于4℃孵育20 min,以下操作同上。
原位杂交
cDNA探针的制备:含小鼠α1(Ⅳ)cDNA(1.8 kb)的重组质粒PE123由预防医学科学院劳动卫生研究所刘秉慈教授惠赠。按文献[8]方法转染细菌后,大量制备质粒,用相应内切酶酶解质粒后,再用低融点琼脂糖法回收cDNA片段。
缺口平移法标记探针:应用缺口平移试剂盒(华美公司),依照说明书将α-35S-dATP标记到探针上,标记探针经Sephadex G-50柱层析后回收,标记探针的比活性达2.78×106Bq/μg。
, http://www.100md.com
组织cDNA-mRNA原位杂交:采用林月珍等[9]方法。
新鲜睾丸组织制成冰冻切片,经原位杂交后,放射自显影及HE复染,树胶封片,OLYMPUS光学显微镜观察,Kodak 100ASA胶卷照相。
体外培养的SC的原位杂交:将长有SC的盖玻片从培养瓶内取出,直接放入PBS配制的4%多聚甲醛中固定20 min,以下操作同组织cDNA-mRNA原位杂交。
阴性对照标本的设置:
A.杂交液中无标记探针的空白对照。
B.以标记的λDNA代替目的探针。
原位杂交结果的半定量及统计学处理:每个动物取1张切片,则每个年龄组为8张切片,在每张切片上取左上、右上、中、左下、右下5个区域(n=40),在400×下计数银颗粒数,结果以银颗粒数/10000 μm2表示。实验数据以均数±标准差(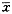 ±s)表示,用t检验进行组间比较,P<0.05为差异有显著性意义。
±s)表示,用t检验进行组间比较,P<0.05为差异有显著性意义。
, http://www.100md.com
2 结果
细胞免疫化学结果
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:5天小鼠曲细精管基膜内Ⅳ型胶原的荧光最弱,呈薄层状围绕曲细精管,血管基膜处亦有荧光存在(图1a),15天小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光最强(图1b),3及18个月小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光依次减弱(图1c)。对照染色标本未见荧光。

图1 Ⅳ型胶原抗体在小鼠睾丸冰冻切片上的间接免疫荧光染色结果
, 百拇医药
Fig 1 Immunofluorescent photomicrograph of frozen section of testis in mouse stained with antibody
against type Ⅳ collagen ×200
a.5-day-old mouse; b.15-day-old mouse; c.18-month-old mouse
体外培养SC的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:体外培养的SC胞质内和胞膜上可见中等强度的Ⅳ型胶原的荧光,胞核处无荧光(图2)。对照染色标本未见荧光。
, http://www.100md.com
图2 Ⅳ型胶原抗体在培养小鼠睾丸SC上间接免疫荧光染色结果
Fig 2 Immunofluorescent photomicrograph of cultured SC stained with antibody against type Ⅳ collagen ×200
原位杂交结果
组织切片的原位杂交结果:杂交银颗粒主要位于小鼠睾丸支持细胞胞质内。15天小鼠睾丸内Ⅳ型胶原cDNA-mRNA杂交银颗粒密度最高(图3a),3和18个月小鼠睾丸内杂交银颗粒密度依次减弱(图3b)。阴性对照实验几乎看不见杂交银颗粒。
, 百拇医药 图3 原位杂交法显示小鼠睾丸内Ⅳ型胶原α1(Ⅳ)mRNA的分布(以Ⅳ型胶原α1(Ⅳ)cDNA为探针)
Fig 3 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in testis in mouse,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ) cDNA probe ×400
a.15-day old mouse; b.18-month old mouse
体外培养的SC的原位杂交结果:体外培养的SC胞质内可见较高密度的Ⅳ型胶原cDNA-mRNA杂交银颗粒(图4a),阴性对照实验几乎看不见杂交银颗粒(图4b)。
, http://www.100md.com
图4 原位杂交法显示培养小鼠睾丸支持细胞内Ⅳ型胶原α1(Ⅳ) mRNA的分布(以Ⅳ型胶原α1(Ⅳ) cDNA为探针)
Fig 4 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in cultured SC,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ)cDNA probe ×400
a.positive signals; b.negative control
原位杂交结果的半定量及统计学处理:15天、3和18个月小鼠银颗粒数分别为(492.98±63.48)、(248.85±42.70)和(177.53±40.54)/10000 μm2,3个月与15天比较P<0.001,18个月与3个月比较P<0.001。
, 百拇医药
3 讨论
Ⅳ型胶原为小鼠睾丸基膜中含量最丰富的ECM成分,它形成基膜的结构网架。基膜中最常见的分子组成是[α1(Ⅳ)]2 α2(Ⅳ),为三螺旋型的三聚体[10]。由于基膜中Ⅳ型胶原分子含两条α1(Ⅳ)链,所以本研究原位杂交所用的探针为α1(Ⅳ) cDNA探针,这样可以较高效率地检测出小鼠睾丸基膜中Ⅳ型胶原的mRNA水平。Ⅳ型胶原是基膜中最主要,也是含量最丰富的ECM成分,而基膜又是ECM的特殊型,本研究进一步探讨小鼠睾丸中基膜的组成和功能是否随年龄而变化。
小鼠睾丸中ECM随小鼠的年龄而变化,小鼠睾丸的发育、生长、成熟、衰老都离不开ECM的参与和作用。胚胎12.5 d时,SC和前精原细胞一起从生精索分化出来。此时,发育着的生精索通过位于生精上皮基底面的基板与间充质分开。已证明此第一基板包括LN、Ⅲ和Ⅳ型胶原、FN和硫酸乙酰肝素(heparin sulfate,HS)[11]。由此可见,SC的分化和ECM的产生是同时进行的。生后10 d左右,电镜观察到第二基板位于分化着的PC和淋巴内皮细胞间[12]。15 d小鼠睾丸内Ⅳ型胶原mRNA的水平处于高峰,这是由于此时小鼠处于青春前期,生殖系统发育迅速,需要合成足量的Ⅳ型胶原来满足生殖系统发育的需求。3个月小鼠睾丸内Ⅳ型胶原mRNA的含量又回到较低水平,这可能是由于此时小鼠处于性成熟期,睾丸内曲细精管的管径已达到顶峰,不再增粗,睾丸的各项生理功能及各种结构已经稳定,合成与降解达到平衡,对ECM合成的需求与青春前期相比有所降低。
, 百拇医药
本研究体外实验部分证明:SC具有合成和分泌Ⅳ型胶原的功能,这与以前的研究结果[6]一致。在小鼠发育的不同年龄阶段,SC的功能与Ⅳ型胶原的合成量密切相关,并随着小鼠年龄的变化而变化。如上所述,在小鼠胚胎12.5 d时,SC和前精原细胞一起从生精索中分化出来,此时由ECM组成的第一基板出现[11];在小鼠睾丸发育的新生阶段PC分化出来,含有ECM成分的第二基板也随后出现[12]。由此可见,SC和PC的分化与ECM的产生密切相关,并在小鼠的睾丸发育、生精上皮的形成及生精功能的启动过程中起重要作用。
ECM具有重要的生物活性,参与细胞的迁移、粘附、增殖和分化,介导细胞与细胞间、细胞与生物大分子间的相互作用,从而在各种生理和病理过程中发挥重要作用[10]。睾丸中的ECM作为曲细精管基膜的组成成分而参与血睾屏障的构成,它还作为细胞间传递信息的信号,介导SC、PC和睾丸间质细胞间的相互作用,睾丸中ECM与精子的发生和生精细胞的分化有着密切的关系[1,5]。另外,ECM具有促进迁移和粘附的功能,它可以促进生精细胞从管壁移向管腔,逐渐走向成熟[5]。可见ECM对精子生成具有重要的作用,其作用机制还有待进一步深入研究。
, 百拇医药
△国家自然科学基金(39270380)资助
许增禄为通讯作者
参考文献
1 Hadley MA,Dym M.Immunocytochemistry of extracellular matrix in the lamina propria of the rat testis: electron microscopic localization.Biol Reprod,1987,37(5): 1283~1289
2 Vernon RB,Sage H.The calcium-binding protein SPARC is secreted by Leydig and Sertoli cells of the adult mouse testis.Biol Reprod,1989,40(6): 1329~1340
, 百拇医药
3 Lian G,Miller KA,Enders GC.Localization and synthesis of entactin in seminiferous tubules of the mouse.Biol Reprod,1992,47(2): 316~325
4 Paranko J.Expression of type Ⅰ and Ⅲ collagen during morphogensis of fetal rat testis and ovary.Anat Rec,1987,219(1): 91~101
5 Skinner MK,Tung PS,Fritz IB.Cooperativity between Sertoli cells and testicular peritubular cells in the production and deposition of extracellular matrix components.J Cell Biol,1985,100(5); 1941~1947
, 百拇医药
6 Hadely MA,Byers SW,Suarez-Quian CA,et al.Extracellular matrix regulates Sertoli cell differentiation,testicular cord formation,and germ cell development in vitro.J Cell Biol,1985,101(6): 1511~1522
7 Xu Zenglu,Parker SB,Minkoff R.Distribution of type Ⅳ collagen,laminin and fibronectin during maxillary process formation in the chick embryo.Am J Anat,1990,187(3): 232~246
8 卢圣栋.现代分子生物学实验技术.北京:高等教育出版社,1993.95~155
, 百拇医药
9 林月珍,丁 濂,阿晋彦.一种简化的原位核酸杂交法.中华病理学杂志,1993,22(5): 305~306
10 李玉瑞主编.细胞外间质的生物化学及研究方法.北京:人民卫生出版社,1988.1~44
11 Pelliniemi LJ,Frojdman K,Paranko J.Embryological and prenatal development and functions of Sertoli cells.In: Russell LD,Griswold MD eds.The Sertoli cell clearwater.FL: Cache River Press,1993.87~114
12 Leeson CR,Leeson TS.The postnatal development and differentiation of the boundary tissue of the seminiferous tubule of the rat.Anat Rec,1963,147(3):243~259
, http://www.100md.com
(1997-07-06收稿)
小鼠睾丸Ⅳ型胶原的合成与分布△
宋阳 许增禄 崔丽 刘霄 徐健 钱晓菁 黄玉苓
摘要 目的 研究小鼠睾丸内Ⅳ型胶原的合成与分布。方法 应用生物素-抗生物素蛋白DCS体系间接免疫荧光法和原位杂交法检测幼年、成年及老年小鼠睾丸内Ⅳ型胶原的合成与分布的变化。结果 小鼠睾丸支持细胞具有合成Ⅳ型胶原的功能,小鼠睾丸曲细精管基膜内Ⅳ型胶原的含量及支持细胞内Ⅳ型胶原mRNA水平随小鼠年龄的增加而变化。15天幼鼠睾丸内含量最高,成年及老年小鼠睾丸内含量依次减少。结论 睾丸内的细胞外基质可能在生精过程中起重要作用。
关键词 胶原 睾丸 间接免疫荧光 原位杂交
中图号 R322.6+4 Q512.6
, 百拇医药
Synthesis and Distribution of Type Ⅳ Collagen in Mice Testes
Song Yang Xu Zenglu Cui Li Liu Xiao Xu Jian,et al
(Department of Histology and Embryology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective The variations of the synthesis and distribution type Ⅳ collagen in the testes of young,adult,and old mice were studied.Methods Biotin-avidin DCS system indirect immunofluorescence technique and in situ hybridization method were used.Results Sertoli cell could synthesize type Ⅳ collagen.Type Ⅳ collagen was present in the basement membrane of seminiferous tubules in mouse testis.Type Ⅳ collagen mRNA signal was seen in the Sertoli cells.The content of type Ⅳ collagen and type Ⅳ collagen mRNA peaked at day 15,and then declined successively to adult value and the aged value.Conclusions The results suggest that the extracellular matrix of testis might play an important role in the process of spermatogenesis.
, 百拇医药
Key words collagen; testis; indirect immunofluorescence; in situ hybridization
睾丸内的细胞外基质(extracellular matrix,ECM)主要包括纤维粘连蛋白(fibronectin,FN)、层粘连蛋白(laminin,LN)、巢蛋白(entactin)、SPARC(secreted protein,acidic,and rich in cysteine)、蛋白多糖和Ⅰ型、Ⅲ型、Ⅳ型胶原等[1~4],与精子发生和生精细胞的分化具有密切关系,曲细精管基膜是睾丸内ECM的主要分布位置,Ⅳ型胶原是基膜内含量最丰富的ECM成分。在睾丸内,支持细胞(Sertoli cell,SC)和管周肌样细胞(Peritublar cell,PC)可以产生ECM[5]。本研究采用生物素-抗生物素蛋白DCS(avidin D cell sorter)体系间接免疫荧光法和原位杂交法检测各年龄段小鼠睾丸内Ⅳ型胶原的合成与分布,以阐明ECM在生精过程中的重要作用,并试图对其作用机制进行初步探讨。
, http://www.100md.com
1 材料和方法
实验分组 体内实验:实验动物为昆明小鼠,按年龄分为4组:(1)新生鼠,出生后5 d; (2) 幼鼠,出生后15 d; (3) 成年鼠,3个月; (4) 老年鼠,18个月。体外实验:培养的支持细胞来自出生后10 d的昆明小鼠。各年龄段使用动物数8~12只。
支持细胞的分离与培养 支持细胞分离参照Hadley等[6]方法进行。用培养液悬浮细胞,用吸管将细胞接种在有盖玻片的培养瓶内,于31℃,5%CO2条件下培养10~14 d。分离培养的细胞存在核卫星小体,可鉴定为支持细胞。
生物素-抗生物素蛋白DCS体系间接免疫荧光染色
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色:参照许增禄[7]法。应用兔抗小鼠Ⅳ型胶原为第一抗体,生物素化的山羊抗兔IgG为第二抗体。染色后滴加甘油封片剂(含10%PBS和1%对苯基二胺)封片,OLYMPUS反射式荧光显微镜下观察,Kodak 400ASA胶卷照相。
, http://www.100md.com
体外培养的SC生物素-抗生物素蛋白DCS体系间接免疫荧光染色:将长有SC的盖玻片从培养瓶内取出,D-Hank液洗1次,放入丙酮固定20 s,PBS洗2次,每次5 min,然后加用PBS配制的10%山羊血清于4℃孵育20 min,以下操作同上。
原位杂交
cDNA探针的制备:含小鼠α1(Ⅳ)cDNA(1.8 kb)的重组质粒PE123由预防医学科学院劳动卫生研究所刘秉慈教授惠赠。按文献[8]方法转染细菌后,大量制备质粒,用相应内切酶酶解质粒后,再用低融点琼脂糖法回收cDNA片段。
缺口平移法标记探针:应用缺口平移试剂盒(华美公司),依照说明书将α-35S-dATP标记到探针上,标记探针经Sephadex G-50柱层析后回收,标记探针的比活性达2.78×106Bq/μg。
, 百拇医药
组织cDNA-mRNA原位杂交:采用林月珍等[9]方法。
新鲜睾丸组织制成冰冻切片,经原位杂交后,放射自显影及HE复染,树胶封片,OLYMPUS光学显微镜观察,Kodak 100ASA胶卷照相。
体外培养的SC的原位杂交:将长有SC的盖玻片从培养瓶内取出,直接放入PBS配制的4%多聚甲醛中固定20 min,以下操作同组织cDNA-mRNA原位杂交。
阴性对照标本的设置:
A.杂交液中无标记探针的空白对照。
B.以标记的λDNA代替目的探针。
原位杂交结果的半定量及统计学处理:每个动物取1张切片,则每个年龄组为8张切片,在每张切片上取左上、右上、中、左下、右下5个区域(n=40),在400×下计数银颗粒数,结果以银颗粒数/10000 μm2表示。实验数据以均数±标准差(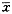 ±s)表示,用t检验进行组间比较,P<0.05为差异有显著性意义。
±s)表示,用t检验进行组间比较,P<0.05为差异有显著性意义。
, 百拇医药
2 结果
细胞免疫化学结果
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:5天小鼠曲细精管基膜内Ⅳ型胶原的荧光最弱,呈薄层状围绕曲细精管,血管基膜处亦有荧光存在(图1a),15天小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光最强(图1b),3及18个月小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光依次减弱(图1c)。对照染色标本未见荧光。

图1 Ⅳ型胶原抗体在小鼠睾丸冰冻切片上的间接免疫荧光染色结果
, 百拇医药
Fig 1 Immunofluorescent photomicrograph of frozen section of testis in mouse stained with antibody
against type Ⅳ collagen ×200
a.5-day-old mouse; b.15-day-old mouse; c.18-month-old mouse
体外培养SC的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:体外培养的SC胞质内和胞膜上可见中等强度的Ⅳ型胶原的荧光,胞核处无荧光(图2)。对照染色标本未见荧光。
, 百拇医药
图2 Ⅳ型胶原抗体在培养小鼠睾丸SC上间接免疫荧光染色结果
Fig 2 Immunofluorescent photomicrograph of cultured SC stained with antibody against type Ⅳ collagen ×200
原位杂交结果
组织切片的原位杂交结果:杂交银颗粒主要位于小鼠睾丸支持细胞胞质内。15天小鼠睾丸内Ⅳ型胶原cDNA-mRNA杂交银颗粒密度最高(图3a),3和18个月小鼠睾丸内杂交银颗粒密度依次减弱(图3b)。阴性对照实验几乎看不见杂交银颗粒。
, 百拇医药 图3 原位杂交法显示小鼠睾丸内Ⅳ型胶原α1(Ⅳ)mRNA的分布(以Ⅳ型胶原α1(Ⅳ)cDNA为探针)
Fig 3 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in testis in mouse,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ) cDNA probe ×400
a.15-day old mouse; b.18-month old mouse
体外培养的SC的原位杂交结果:体外培养的SC胞质内可见较高密度的Ⅳ型胶原cDNA-mRNA杂交银颗粒(图4a),阴性对照实验几乎看不见杂交银颗粒(图4b)。
, 百拇医药
图4 原位杂交法显示培养小鼠睾丸支持细胞内Ⅳ型胶原α1(Ⅳ) mRNA的分布(以Ⅳ型胶原α1(Ⅳ) cDNA为探针)
Fig 4 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in cultured SC,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ)cDNA probe ×400
a.positive signals; b.negative control
原位杂交结果的半定量及统计学处理:15天、3和18个月小鼠银颗粒数分别为(492.98±63.48)、(248.85±42.70)和(177.53±40.54)/10000 μm2,3个月与15天比较P<0.001,18个月与3个月比较P<0.001。
, 百拇医药
3 讨论
Ⅳ型胶原为小鼠睾丸基膜中含量最丰富的ECM成分,它形成基膜的结构网架。基膜中最常见的分子组成是[α1(Ⅳ)]2 α2(Ⅳ),为三螺旋型的三聚体[10]。由于基膜中Ⅳ型胶原分子含两条α1(Ⅳ)链,所以本研究原位杂交所用的探针为α1(Ⅳ) cDNA探针,这样可以较高效率地检测出小鼠睾丸基膜中Ⅳ型胶原的mRNA水平。Ⅳ型胶原是基膜中最主要,也是含量最丰富的ECM成分,而基膜又是ECM的特殊型,本研究进一步探讨小鼠睾丸中基膜的组成和功能是否随年龄而变化。
小鼠睾丸中ECM随小鼠的年龄而变化,小鼠睾丸的发育、生长、成熟、衰老都离不开ECM的参与和作用。胚胎12.5 d时,SC和前精原细胞一起从生精索分化出来。此时,发育着的生精索通过位于生精上皮基底面的基板与间充质分开。已证明此第一基板包括LN、Ⅲ和Ⅳ型胶原、FN和硫酸乙酰肝素(heparin sulfate,HS)[11]。由此可见,SC的分化和ECM的产生是同时进行的。生后10 d左右,电镜观察到第二基板位于分化着的PC和淋巴内皮细胞间[12]。15 d小鼠睾丸内Ⅳ型胶原mRNA的水平处于高峰,这是由于此时小鼠处于青春前期,生殖系统发育迅速,需要合成足量的Ⅳ型胶原来满足生殖系统发育的需求。3个月小鼠睾丸内Ⅳ型胶原mRNA的含量又回到较低水平,这可能是由于此时小鼠处于性成熟期,睾丸内曲细精管的管径已达到顶峰,不再增粗,睾丸的各项生理功能及各种结构已经稳定,合成与降解达到平衡,对ECM合成的需求与青春前期相比有所降低。
, http://www.100md.com
本研究体外实验部分证明:SC具有合成和分泌Ⅳ型胶原的功能,这与以前的研究结果[6]一致。在小鼠发育的不同年龄阶段,SC的功能与Ⅳ型胶原的合成量密切相关,并随着小鼠年龄的变化而变化。如上所述,在小鼠胚胎12.5 d时,SC和前精原细胞一起从生精索中分化出来,此时由ECM组成的第一基板出现[11];在小鼠睾丸发育的新生阶段PC分化出来,含有ECM成分的第二基板也随后出现[12]。由此可见,SC和PC的分化与ECM的产生密切相关,并在小鼠的睾丸发育、生精上皮的形成及生精功能的启动过程中起重要作用。
ECM具有重要的生物活性,参与细胞的迁移、粘附、增殖和分化,介导细胞与细胞间、细胞与生物大分子间的相互作用,从而在各种生理和病理过程中发挥重要作用[10]。睾丸中的ECM作为曲细精管基膜的组成成分而参与血睾屏障的构成,它还作为细胞间传递信息的信号,介导SC、PC和睾丸间质细胞间的相互作用,睾丸中ECM与精子的发生和生精细胞的分化有着密切的关系[1,5]。另外,ECM具有促进迁移和粘附的功能,它可以促进生精细胞从管壁移向管腔,逐渐走向成熟[5]。可见ECM对精子生成具有重要的作用,其作用机制还有待进一步深入研究。
, 百拇医药
△国家自然科学基金(39270380)资助
许增禄为通讯作者
作者单位:宋阳 许增禄 刘霄 徐健 钱晓菁 黄玉苓 (中国医学科学院 中国协和医科大学 基础医学研究所组织胚胎学室,北京 100005)
崔丽 (白求恩医科大学组织胚胎学教研室)
参考文献
1 Hadley MA,Dym M.Immunocytochemistry of extracellular matrix in the lamina propria of the rat testis: electron microscopic localization.Biol Reprod,1987,37(5): 1283~1289
, 百拇医药
2 Vernon RB,Sage H.The calcium-binding protein SPARC is secreted by Leydig and Sertoli cells of the adult mouse testis.Biol Reprod,1989,40(6): 1329~1340
3 Lian G,Miller KA,Enders GC.Localization and synthesis of entactin in seminiferous tubules of the mouse.Biol Reprod,1992,47(2): 316~325
4 Paranko J.Expression of type Ⅰ and Ⅲ collagen during morphogensis of fetal rat testis and ovary.Anat Rec,1987,219(1): 91~101
, 百拇医药
5 Skinner MK,Tung PS,Fritz IB.Cooperativity between Sertoli cells and testicular peritubular cells in the production and deposition of extracellular matrix components.J Cell Biol,1985,100(5); 1941~1947
6 Hadely MA,Byers SW,Suarez-Quian CA,et al.Extracellular matrix regulates Sertoli cell differentiation,testicular cord formation,and germ cell development in vitro.J Cell Biol,1985,101(6): 1511~1522
7 Xu Zenglu,Parker SB,Minkoff R.Distribution of type Ⅳ collagen,laminin and fibronectin during maxillary process formation in the chick embryo.Am J Anat,1990,187(3): 232~246
, http://www.100md.com
8 卢圣栋.现代分子生物学实验技术.北京:高等教育出版社,1993.95~155
9 林月珍,丁 濂,阿晋彦.一种简化的原位核酸杂交法.中华病理学杂志,1993,22(5): 305~306
10 李玉瑞主编.细胞外间质的生物化学及研究方法.北京:人民卫生出版社,1988.1~44
11 Pelliniemi LJ,Frojdman K,Paranko J.Embryological and prenatal development and functions of Sertoli cells.In: Russell LD,Griswold MD eds.The Sertoli cell clearwater.FL: Cache River Press,1993.87~114
12 Leeson CR,Leeson TS.The postnatal development and differentiation of the boundary tissue of the seminiferous tubule of the rat.Anat Rec,1963,147(3):243~259
(1997-07-06收稿), http://www.100md.com
单位:宋阳 许增禄 刘霄 徐健 钱晓菁 黄玉苓 (中国医学科学院 中国协和医科大学 基础医学研究所组织胚胎学室,北京 100005);崔丽 (白求恩医科大学组织胚胎学教研室)
关键词:胶原;睾丸;间接免疫荧光;原位杂交
小鼠睾丸 摘要 目的 研究小鼠睾丸内Ⅳ型胶原的合成与分布。方法 应用生物素-抗生物素蛋白DCS体系间接免疫荧光法和原位杂交法检测幼年、成年及老年小鼠睾丸内Ⅳ型胶原的合成与分布的变化。结果 小鼠睾丸支持细胞具有合成Ⅳ型胶原的功能,小鼠睾丸曲细精管基膜内Ⅳ型胶原的含量及支持细胞内Ⅳ型胶原mRNA水平随小鼠年龄的增加而变化。15天幼鼠睾丸内含量最高,成年及老年小鼠睾丸内含量依次减少。结论 睾丸内的细胞外基质可能在生精过程中起重要作用。
中图号 R322.6+4 Q512.6
, http://www.100md.com
Synthesis and Distribution of Type Ⅳ Collagen in Mice Testes
Song Yang Xu Zenglu Cui Li Liu Xiao Xu Jian,et al
(Department of Histology and Embryology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective The variations of the synthesis and distribution type Ⅳ collagen in the testes of young,adult,and old mice were studied.Methods Biotin-avidin DCS system indirect immunofluorescence technique and in situ hybridization method were used.Results Sertoli cell could synthesize type Ⅳ collagen.Type Ⅳ collagen was present in the basement membrane of seminiferous tubules in mouse testis.Type Ⅳ collagen mRNA signal was seen in the Sertoli cells.The content of type Ⅳ collagen and type Ⅳ collagen mRNA peaked at day 15,and then declined successively to adult value and the aged value.Conclusions The results suggest that the extracellular matrix of testis might play an important role in the process of spermatogenesis.
, 百拇医药
Key words collagen; testis; indirect immunofluorescence; in situ hybridization
睾丸内的细胞外基质(extracellular matrix,ECM)主要包括纤维粘连蛋白(fibronectin,FN)、层粘连蛋白(laminin,LN)、巢蛋白(entactin)、SPARC(secreted protein,acidic,and rich in cysteine)、蛋白多糖和Ⅰ型、Ⅲ型、Ⅳ型胶原等[1~4],与精子发生和生精细胞的分化具有密切关系,曲细精管基膜是睾丸内ECM的主要分布位置,Ⅳ型胶原是基膜内含量最丰富的ECM成分。在睾丸内,支持细胞(Sertoli cell,SC)和管周肌样细胞(Peritublar cell,PC)可以产生ECM[5]。本研究采用生物素-抗生物素蛋白DCS(avidin D cell sorter)体系间接免疫荧光法和原位杂交法检测各年龄段小鼠睾丸内Ⅳ型胶原的合成与分布,以阐明ECM在生精过程中的重要作用,并试图对其作用机制进行初步探讨。
, 百拇医药
1 材料和方法
实验分组 体内实验:实验动物为昆明小鼠,按年龄分为4组:(1)新生鼠,出生后5 d; (2) 幼鼠,出生后15 d; (3) 成年鼠,3个月; (4) 老年鼠,18个月。体外实验:培养的支持细胞来自出生后10 d的昆明小鼠。各年龄段使用动物数8~12只。
支持细胞的分离与培养 支持细胞分离参照Hadley等[6]方法进行。用培养液悬浮细胞,用吸管将细胞接种在有盖玻片的培养瓶内,于31℃,5%CO2条件下培养10~14 d。分离培养的细胞存在核卫星小体,可鉴定为支持细胞。
生物素-抗生物素蛋白DCS体系间接免疫荧光染色
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色:参照许增禄[7]法。应用兔抗小鼠Ⅳ型胶原为第一抗体,生物素化的山羊抗兔IgG为第二抗体。染色后滴加甘油封片剂(含10%PBS和1%对苯基二胺)封片,OLYMPUS反射式荧光显微镜下观察,Kodak 400ASA胶卷照相。
, 百拇医药
体外培养的SC生物素-抗生物素蛋白DCS体系间接免疫荧光染色:将长有SC的盖玻片从培养瓶内取出,D-Hank液洗1次,放入丙酮固定20 s,PBS洗2次,每次5 min,然后加用PBS配制的10%山羊血清于4℃孵育20 min,以下操作同上。
原位杂交
cDNA探针的制备:含小鼠α1(Ⅳ)cDNA(1.8 kb)的重组质粒PE123由预防医学科学院劳动卫生研究所刘秉慈教授惠赠。按文献[8]方法转染细菌后,大量制备质粒,用相应内切酶酶解质粒后,再用低融点琼脂糖法回收cDNA片段。
缺口平移法标记探针:应用缺口平移试剂盒(华美公司),依照说明书将α-35S-dATP标记到探针上,标记探针经Sephadex G-50柱层析后回收,标记探针的比活性达2.78×106Bq/μg。
, http://www.100md.com
组织cDNA-mRNA原位杂交:采用林月珍等[9]方法。
新鲜睾丸组织制成冰冻切片,经原位杂交后,放射自显影及HE复染,树胶封片,OLYMPUS光学显微镜观察,Kodak 100ASA胶卷照相。
体外培养的SC的原位杂交:将长有SC的盖玻片从培养瓶内取出,直接放入PBS配制的4%多聚甲醛中固定20 min,以下操作同组织cDNA-mRNA原位杂交。
阴性对照标本的设置:
A.杂交液中无标记探针的空白对照。
B.以标记的λDNA代替目的探针。
原位杂交结果的半定量及统计学处理:每个动物取1张切片,则每个年龄组为8张切片,在每张切片上取左上、右上、中、左下、右下5个区域(n=40),在400×下计数银颗粒数,结果以银颗粒数/10000 μm2表示。实验数据以均数±标准差(
, http://www.100md.com
2 结果
细胞免疫化学结果
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:5天小鼠曲细精管基膜内Ⅳ型胶原的荧光最弱,呈薄层状围绕曲细精管,血管基膜处亦有荧光存在(图1a),15天小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光最强(图1b),3及18个月小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光依次减弱(图1c)。对照染色标本未见荧光。


图1 Ⅳ型胶原抗体在小鼠睾丸冰冻切片上的间接免疫荧光染色结果
, 百拇医药
Fig 1 Immunofluorescent photomicrograph of frozen section of testis in mouse stained with antibody
against type Ⅳ collagen ×200
a.5-day-old mouse; b.15-day-old mouse; c.18-month-old mouse
体外培养SC的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:体外培养的SC胞质内和胞膜上可见中等强度的Ⅳ型胶原的荧光,胞核处无荧光(图2)。对照染色标本未见荧光。

, http://www.100md.com
图2 Ⅳ型胶原抗体在培养小鼠睾丸SC上间接免疫荧光染色结果
Fig 2 Immunofluorescent photomicrograph of cultured SC stained with antibody against type Ⅳ collagen ×200
原位杂交结果
组织切片的原位杂交结果:杂交银颗粒主要位于小鼠睾丸支持细胞胞质内。15天小鼠睾丸内Ⅳ型胶原cDNA-mRNA杂交银颗粒密度最高(图3a),3和18个月小鼠睾丸内杂交银颗粒密度依次减弱(图3b)。阴性对照实验几乎看不见杂交银颗粒。

, 百拇医药 图3 原位杂交法显示小鼠睾丸内Ⅳ型胶原α1(Ⅳ)mRNA的分布(以Ⅳ型胶原α1(Ⅳ)cDNA为探针)
Fig 3 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in testis in mouse,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ) cDNA probe ×400
a.15-day old mouse; b.18-month old mouse
体外培养的SC的原位杂交结果:体外培养的SC胞质内可见较高密度的Ⅳ型胶原cDNA-mRNA杂交银颗粒(图4a),阴性对照实验几乎看不见杂交银颗粒(图4b)。

, http://www.100md.com
图4 原位杂交法显示培养小鼠睾丸支持细胞内Ⅳ型胶原α1(Ⅳ) mRNA的分布(以Ⅳ型胶原α1(Ⅳ) cDNA为探针)
Fig 4 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in cultured SC,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ)cDNA probe ×400
a.positive signals; b.negative control
原位杂交结果的半定量及统计学处理:15天、3和18个月小鼠银颗粒数分别为(492.98±63.48)、(248.85±42.70)和(177.53±40.54)/10000 μm2,3个月与15天比较P<0.001,18个月与3个月比较P<0.001。
, 百拇医药
3 讨论
Ⅳ型胶原为小鼠睾丸基膜中含量最丰富的ECM成分,它形成基膜的结构网架。基膜中最常见的分子组成是[α1(Ⅳ)]2 α2(Ⅳ),为三螺旋型的三聚体[10]。由于基膜中Ⅳ型胶原分子含两条α1(Ⅳ)链,所以本研究原位杂交所用的探针为α1(Ⅳ) cDNA探针,这样可以较高效率地检测出小鼠睾丸基膜中Ⅳ型胶原的mRNA水平。Ⅳ型胶原是基膜中最主要,也是含量最丰富的ECM成分,而基膜又是ECM的特殊型,本研究进一步探讨小鼠睾丸中基膜的组成和功能是否随年龄而变化。
小鼠睾丸中ECM随小鼠的年龄而变化,小鼠睾丸的发育、生长、成熟、衰老都离不开ECM的参与和作用。胚胎12.5 d时,SC和前精原细胞一起从生精索分化出来。此时,发育着的生精索通过位于生精上皮基底面的基板与间充质分开。已证明此第一基板包括LN、Ⅲ和Ⅳ型胶原、FN和硫酸乙酰肝素(heparin sulfate,HS)[11]。由此可见,SC的分化和ECM的产生是同时进行的。生后10 d左右,电镜观察到第二基板位于分化着的PC和淋巴内皮细胞间[12]。15 d小鼠睾丸内Ⅳ型胶原mRNA的水平处于高峰,这是由于此时小鼠处于青春前期,生殖系统发育迅速,需要合成足量的Ⅳ型胶原来满足生殖系统发育的需求。3个月小鼠睾丸内Ⅳ型胶原mRNA的含量又回到较低水平,这可能是由于此时小鼠处于性成熟期,睾丸内曲细精管的管径已达到顶峰,不再增粗,睾丸的各项生理功能及各种结构已经稳定,合成与降解达到平衡,对ECM合成的需求与青春前期相比有所降低。
, 百拇医药
本研究体外实验部分证明:SC具有合成和分泌Ⅳ型胶原的功能,这与以前的研究结果[6]一致。在小鼠发育的不同年龄阶段,SC的功能与Ⅳ型胶原的合成量密切相关,并随着小鼠年龄的变化而变化。如上所述,在小鼠胚胎12.5 d时,SC和前精原细胞一起从生精索中分化出来,此时由ECM组成的第一基板出现[11];在小鼠睾丸发育的新生阶段PC分化出来,含有ECM成分的第二基板也随后出现[12]。由此可见,SC和PC的分化与ECM的产生密切相关,并在小鼠的睾丸发育、生精上皮的形成及生精功能的启动过程中起重要作用。
ECM具有重要的生物活性,参与细胞的迁移、粘附、增殖和分化,介导细胞与细胞间、细胞与生物大分子间的相互作用,从而在各种生理和病理过程中发挥重要作用[10]。睾丸中的ECM作为曲细精管基膜的组成成分而参与血睾屏障的构成,它还作为细胞间传递信息的信号,介导SC、PC和睾丸间质细胞间的相互作用,睾丸中ECM与精子的发生和生精细胞的分化有着密切的关系[1,5]。另外,ECM具有促进迁移和粘附的功能,它可以促进生精细胞从管壁移向管腔,逐渐走向成熟[5]。可见ECM对精子生成具有重要的作用,其作用机制还有待进一步深入研究。
, 百拇医药
△国家自然科学基金(39270380)资助
许增禄为通讯作者
参考文献
1 Hadley MA,Dym M.Immunocytochemistry of extracellular matrix in the lamina propria of the rat testis: electron microscopic localization.Biol Reprod,1987,37(5): 1283~1289
2 Vernon RB,Sage H.The calcium-binding protein SPARC is secreted by Leydig and Sertoli cells of the adult mouse testis.Biol Reprod,1989,40(6): 1329~1340
, 百拇医药
3 Lian G,Miller KA,Enders GC.Localization and synthesis of entactin in seminiferous tubules of the mouse.Biol Reprod,1992,47(2): 316~325
4 Paranko J.Expression of type Ⅰ and Ⅲ collagen during morphogensis of fetal rat testis and ovary.Anat Rec,1987,219(1): 91~101
5 Skinner MK,Tung PS,Fritz IB.Cooperativity between Sertoli cells and testicular peritubular cells in the production and deposition of extracellular matrix components.J Cell Biol,1985,100(5); 1941~1947
, 百拇医药
6 Hadely MA,Byers SW,Suarez-Quian CA,et al.Extracellular matrix regulates Sertoli cell differentiation,testicular cord formation,and germ cell development in vitro.J Cell Biol,1985,101(6): 1511~1522
7 Xu Zenglu,Parker SB,Minkoff R.Distribution of type Ⅳ collagen,laminin and fibronectin during maxillary process formation in the chick embryo.Am J Anat,1990,187(3): 232~246
8 卢圣栋.现代分子生物学实验技术.北京:高等教育出版社,1993.95~155
, 百拇医药
9 林月珍,丁 濂,阿晋彦.一种简化的原位核酸杂交法.中华病理学杂志,1993,22(5): 305~306
10 李玉瑞主编.细胞外间质的生物化学及研究方法.北京:人民卫生出版社,1988.1~44
11 Pelliniemi LJ,Frojdman K,Paranko J.Embryological and prenatal development and functions of Sertoli cells.In: Russell LD,Griswold MD eds.The Sertoli cell clearwater.FL: Cache River Press,1993.87~114
12 Leeson CR,Leeson TS.The postnatal development and differentiation of the boundary tissue of the seminiferous tubule of the rat.Anat Rec,1963,147(3):243~259
, http://www.100md.com
(1997-07-06收稿)
小鼠睾丸Ⅳ型胶原的合成与分布△
宋阳 许增禄 崔丽 刘霄 徐健 钱晓菁 黄玉苓
摘要 目的 研究小鼠睾丸内Ⅳ型胶原的合成与分布。方法 应用生物素-抗生物素蛋白DCS体系间接免疫荧光法和原位杂交法检测幼年、成年及老年小鼠睾丸内Ⅳ型胶原的合成与分布的变化。结果 小鼠睾丸支持细胞具有合成Ⅳ型胶原的功能,小鼠睾丸曲细精管基膜内Ⅳ型胶原的含量及支持细胞内Ⅳ型胶原mRNA水平随小鼠年龄的增加而变化。15天幼鼠睾丸内含量最高,成年及老年小鼠睾丸内含量依次减少。结论 睾丸内的细胞外基质可能在生精过程中起重要作用。
关键词 胶原 睾丸 间接免疫荧光 原位杂交
中图号 R322.6+4 Q512.6
, 百拇医药
Synthesis and Distribution of Type Ⅳ Collagen in Mice Testes
Song Yang Xu Zenglu Cui Li Liu Xiao Xu Jian,et al
(Department of Histology and Embryology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective The variations of the synthesis and distribution type Ⅳ collagen in the testes of young,adult,and old mice were studied.Methods Biotin-avidin DCS system indirect immunofluorescence technique and in situ hybridization method were used.Results Sertoli cell could synthesize type Ⅳ collagen.Type Ⅳ collagen was present in the basement membrane of seminiferous tubules in mouse testis.Type Ⅳ collagen mRNA signal was seen in the Sertoli cells.The content of type Ⅳ collagen and type Ⅳ collagen mRNA peaked at day 15,and then declined successively to adult value and the aged value.Conclusions The results suggest that the extracellular matrix of testis might play an important role in the process of spermatogenesis.
, 百拇医药
Key words collagen; testis; indirect immunofluorescence; in situ hybridization
睾丸内的细胞外基质(extracellular matrix,ECM)主要包括纤维粘连蛋白(fibronectin,FN)、层粘连蛋白(laminin,LN)、巢蛋白(entactin)、SPARC(secreted protein,acidic,and rich in cysteine)、蛋白多糖和Ⅰ型、Ⅲ型、Ⅳ型胶原等[1~4],与精子发生和生精细胞的分化具有密切关系,曲细精管基膜是睾丸内ECM的主要分布位置,Ⅳ型胶原是基膜内含量最丰富的ECM成分。在睾丸内,支持细胞(Sertoli cell,SC)和管周肌样细胞(Peritublar cell,PC)可以产生ECM[5]。本研究采用生物素-抗生物素蛋白DCS(avidin D cell sorter)体系间接免疫荧光法和原位杂交法检测各年龄段小鼠睾丸内Ⅳ型胶原的合成与分布,以阐明ECM在生精过程中的重要作用,并试图对其作用机制进行初步探讨。
, http://www.100md.com
1 材料和方法
实验分组 体内实验:实验动物为昆明小鼠,按年龄分为4组:(1)新生鼠,出生后5 d; (2) 幼鼠,出生后15 d; (3) 成年鼠,3个月; (4) 老年鼠,18个月。体外实验:培养的支持细胞来自出生后10 d的昆明小鼠。各年龄段使用动物数8~12只。
支持细胞的分离与培养 支持细胞分离参照Hadley等[6]方法进行。用培养液悬浮细胞,用吸管将细胞接种在有盖玻片的培养瓶内,于31℃,5%CO2条件下培养10~14 d。分离培养的细胞存在核卫星小体,可鉴定为支持细胞。
生物素-抗生物素蛋白DCS体系间接免疫荧光染色
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色:参照许增禄[7]法。应用兔抗小鼠Ⅳ型胶原为第一抗体,生物素化的山羊抗兔IgG为第二抗体。染色后滴加甘油封片剂(含10%PBS和1%对苯基二胺)封片,OLYMPUS反射式荧光显微镜下观察,Kodak 400ASA胶卷照相。
, http://www.100md.com
体外培养的SC生物素-抗生物素蛋白DCS体系间接免疫荧光染色:将长有SC的盖玻片从培养瓶内取出,D-Hank液洗1次,放入丙酮固定20 s,PBS洗2次,每次5 min,然后加用PBS配制的10%山羊血清于4℃孵育20 min,以下操作同上。
原位杂交
cDNA探针的制备:含小鼠α1(Ⅳ)cDNA(1.8 kb)的重组质粒PE123由预防医学科学院劳动卫生研究所刘秉慈教授惠赠。按文献[8]方法转染细菌后,大量制备质粒,用相应内切酶酶解质粒后,再用低融点琼脂糖法回收cDNA片段。
缺口平移法标记探针:应用缺口平移试剂盒(华美公司),依照说明书将α-35S-dATP标记到探针上,标记探针经Sephadex G-50柱层析后回收,标记探针的比活性达2.78×106Bq/μg。
, 百拇医药
组织cDNA-mRNA原位杂交:采用林月珍等[9]方法。
新鲜睾丸组织制成冰冻切片,经原位杂交后,放射自显影及HE复染,树胶封片,OLYMPUS光学显微镜观察,Kodak 100ASA胶卷照相。
体外培养的SC的原位杂交:将长有SC的盖玻片从培养瓶内取出,直接放入PBS配制的4%多聚甲醛中固定20 min,以下操作同组织cDNA-mRNA原位杂交。
阴性对照标本的设置:
A.杂交液中无标记探针的空白对照。
B.以标记的λDNA代替目的探针。
原位杂交结果的半定量及统计学处理:每个动物取1张切片,则每个年龄组为8张切片,在每张切片上取左上、右上、中、左下、右下5个区域(n=40),在400×下计数银颗粒数,结果以银颗粒数/10000 μm2表示。实验数据以均数±标准差(
, 百拇医药
2 结果
细胞免疫化学结果
组织切片的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:5天小鼠曲细精管基膜内Ⅳ型胶原的荧光最弱,呈薄层状围绕曲细精管,血管基膜处亦有荧光存在(图1a),15天小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光最强(图1b),3及18个月小鼠睾丸曲细精管基膜内Ⅳ型胶原的荧光依次减弱(图1c)。对照染色标本未见荧光。


图1 Ⅳ型胶原抗体在小鼠睾丸冰冻切片上的间接免疫荧光染色结果
, 百拇医药
Fig 1 Immunofluorescent photomicrograph of frozen section of testis in mouse stained with antibody
against type Ⅳ collagen ×200
a.5-day-old mouse; b.15-day-old mouse; c.18-month-old mouse
体外培养SC的生物素-抗生物素蛋白DCS体系间接免疫荧光染色结果:体外培养的SC胞质内和胞膜上可见中等强度的Ⅳ型胶原的荧光,胞核处无荧光(图2)。对照染色标本未见荧光。

, 百拇医药
图2 Ⅳ型胶原抗体在培养小鼠睾丸SC上间接免疫荧光染色结果
Fig 2 Immunofluorescent photomicrograph of cultured SC stained with antibody against type Ⅳ collagen ×200
原位杂交结果
组织切片的原位杂交结果:杂交银颗粒主要位于小鼠睾丸支持细胞胞质内。15天小鼠睾丸内Ⅳ型胶原cDNA-mRNA杂交银颗粒密度最高(图3a),3和18个月小鼠睾丸内杂交银颗粒密度依次减弱(图3b)。阴性对照实验几乎看不见杂交银颗粒。

, 百拇医药 图3 原位杂交法显示小鼠睾丸内Ⅳ型胶原α1(Ⅳ)mRNA的分布(以Ⅳ型胶原α1(Ⅳ)cDNA为探针)
Fig 3 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in testis in mouse,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ) cDNA probe ×400
a.15-day old mouse; b.18-month old mouse
体外培养的SC的原位杂交结果:体外培养的SC胞质内可见较高密度的Ⅳ型胶原cDNA-mRNA杂交银颗粒(图4a),阴性对照实验几乎看不见杂交银颗粒(图4b)。

, 百拇医药
图4 原位杂交法显示培养小鼠睾丸支持细胞内Ⅳ型胶原α1(Ⅳ) mRNA的分布(以Ⅳ型胶原α1(Ⅳ) cDNA为探针)
Fig 4 Distribution of type Ⅳ collagen α1(Ⅳ) mRNA in cultured SC,as detected by in situ hybridization with type Ⅳ collagen α1(Ⅳ)cDNA probe ×400
a.positive signals; b.negative control
原位杂交结果的半定量及统计学处理:15天、3和18个月小鼠银颗粒数分别为(492.98±63.48)、(248.85±42.70)和(177.53±40.54)/10000 μm2,3个月与15天比较P<0.001,18个月与3个月比较P<0.001。
, 百拇医药
3 讨论
Ⅳ型胶原为小鼠睾丸基膜中含量最丰富的ECM成分,它形成基膜的结构网架。基膜中最常见的分子组成是[α1(Ⅳ)]2 α2(Ⅳ),为三螺旋型的三聚体[10]。由于基膜中Ⅳ型胶原分子含两条α1(Ⅳ)链,所以本研究原位杂交所用的探针为α1(Ⅳ) cDNA探针,这样可以较高效率地检测出小鼠睾丸基膜中Ⅳ型胶原的mRNA水平。Ⅳ型胶原是基膜中最主要,也是含量最丰富的ECM成分,而基膜又是ECM的特殊型,本研究进一步探讨小鼠睾丸中基膜的组成和功能是否随年龄而变化。
小鼠睾丸中ECM随小鼠的年龄而变化,小鼠睾丸的发育、生长、成熟、衰老都离不开ECM的参与和作用。胚胎12.5 d时,SC和前精原细胞一起从生精索分化出来。此时,发育着的生精索通过位于生精上皮基底面的基板与间充质分开。已证明此第一基板包括LN、Ⅲ和Ⅳ型胶原、FN和硫酸乙酰肝素(heparin sulfate,HS)[11]。由此可见,SC的分化和ECM的产生是同时进行的。生后10 d左右,电镜观察到第二基板位于分化着的PC和淋巴内皮细胞间[12]。15 d小鼠睾丸内Ⅳ型胶原mRNA的水平处于高峰,这是由于此时小鼠处于青春前期,生殖系统发育迅速,需要合成足量的Ⅳ型胶原来满足生殖系统发育的需求。3个月小鼠睾丸内Ⅳ型胶原mRNA的含量又回到较低水平,这可能是由于此时小鼠处于性成熟期,睾丸内曲细精管的管径已达到顶峰,不再增粗,睾丸的各项生理功能及各种结构已经稳定,合成与降解达到平衡,对ECM合成的需求与青春前期相比有所降低。
, http://www.100md.com
本研究体外实验部分证明:SC具有合成和分泌Ⅳ型胶原的功能,这与以前的研究结果[6]一致。在小鼠发育的不同年龄阶段,SC的功能与Ⅳ型胶原的合成量密切相关,并随着小鼠年龄的变化而变化。如上所述,在小鼠胚胎12.5 d时,SC和前精原细胞一起从生精索中分化出来,此时由ECM组成的第一基板出现[11];在小鼠睾丸发育的新生阶段PC分化出来,含有ECM成分的第二基板也随后出现[12]。由此可见,SC和PC的分化与ECM的产生密切相关,并在小鼠的睾丸发育、生精上皮的形成及生精功能的启动过程中起重要作用。
ECM具有重要的生物活性,参与细胞的迁移、粘附、增殖和分化,介导细胞与细胞间、细胞与生物大分子间的相互作用,从而在各种生理和病理过程中发挥重要作用[10]。睾丸中的ECM作为曲细精管基膜的组成成分而参与血睾屏障的构成,它还作为细胞间传递信息的信号,介导SC、PC和睾丸间质细胞间的相互作用,睾丸中ECM与精子的发生和生精细胞的分化有着密切的关系[1,5]。另外,ECM具有促进迁移和粘附的功能,它可以促进生精细胞从管壁移向管腔,逐渐走向成熟[5]。可见ECM对精子生成具有重要的作用,其作用机制还有待进一步深入研究。
, 百拇医药
△国家自然科学基金(39270380)资助
许增禄为通讯作者
作者单位:宋阳 许增禄 刘霄 徐健 钱晓菁 黄玉苓 (中国医学科学院 中国协和医科大学 基础医学研究所组织胚胎学室,北京 100005)
崔丽 (白求恩医科大学组织胚胎学教研室)
参考文献
1 Hadley MA,Dym M.Immunocytochemistry of extracellular matrix in the lamina propria of the rat testis: electron microscopic localization.Biol Reprod,1987,37(5): 1283~1289
, 百拇医药
2 Vernon RB,Sage H.The calcium-binding protein SPARC is secreted by Leydig and Sertoli cells of the adult mouse testis.Biol Reprod,1989,40(6): 1329~1340
3 Lian G,Miller KA,Enders GC.Localization and synthesis of entactin in seminiferous tubules of the mouse.Biol Reprod,1992,47(2): 316~325
4 Paranko J.Expression of type Ⅰ and Ⅲ collagen during morphogensis of fetal rat testis and ovary.Anat Rec,1987,219(1): 91~101
, 百拇医药
5 Skinner MK,Tung PS,Fritz IB.Cooperativity between Sertoli cells and testicular peritubular cells in the production and deposition of extracellular matrix components.J Cell Biol,1985,100(5); 1941~1947
6 Hadely MA,Byers SW,Suarez-Quian CA,et al.Extracellular matrix regulates Sertoli cell differentiation,testicular cord formation,and germ cell development in vitro.J Cell Biol,1985,101(6): 1511~1522
7 Xu Zenglu,Parker SB,Minkoff R.Distribution of type Ⅳ collagen,laminin and fibronectin during maxillary process formation in the chick embryo.Am J Anat,1990,187(3): 232~246
, http://www.100md.com
8 卢圣栋.现代分子生物学实验技术.北京:高等教育出版社,1993.95~155
9 林月珍,丁 濂,阿晋彦.一种简化的原位核酸杂交法.中华病理学杂志,1993,22(5): 305~306
10 李玉瑞主编.细胞外间质的生物化学及研究方法.北京:人民卫生出版社,1988.1~44
11 Pelliniemi LJ,Frojdman K,Paranko J.Embryological and prenatal development and functions of Sertoli cells.In: Russell LD,Griswold MD eds.The Sertoli cell clearwater.FL: Cache River Press,1993.87~114
12 Leeson CR,Leeson TS.The postnatal development and differentiation of the boundary tissue of the seminiferous tubule of the rat.Anat Rec,1963,147(3):243~259
(1997-07-06收稿), http://www.100md.com