大鼠脑缺血再灌后NMDA受体、NO及cGMP含量的变化△
作者:强文安 左萍萍 刘景生
单位:中国医学科学院 中国协和医科大学 基础医学研究所药理室, 北京 100005
关键词:脑缺血;再灌损伤;N-甲基-D-天冬氨酸受体-一氧化氮-cGMP通路大鼠
中国医学科学院学报990304 摘要 目的 观察大鼠脑缺血再灌后N-甲基-D-天冬氨酸(NMDA)受体-一氧化氮(NO)-cGMP通路变化。方法 采用大鼠双侧颈总动脉阻断和尾部放血并重复缺血再灌的脑缺血模型,观察术后不同时间动物大脑皮层、海马、纹状体、中脑和下丘脑5个部位的NMDA受体活性(3H-MK801结合)、一氧化氮合酶(NOS)活性及cGMP含量变化。结果 3H-MK801结合在海马、纹状体两部位呈持续性明显增加;原生型NOS(cNOS)于缺血后3天在海马、大脑皮层、纹状体达高峰;而诱导型(iNOS)活性及cGMP含量仅在海马呈持续上升,两者在增加幅度与趋势上也很相似。结论 在海马缺血性神经损伤过程中,NMDA受体-NO-cGMP通路激活可能起重要作用。
, 百拇医药
中图号 R743.3
Role of N-methyl-D-aspartat Receptor-Nitric Oxide-cyclic Guanosin Monophosphate Pathway in Ischemic Brain Injury
Qiang Wenan Zuo Pingping Liu Jingsheng
(Department of Pharmacology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective To observe the role of NMDA receptor-Nitric Oxide(NOS)-cGMP pathway in ischemic brain injury.Methods The common cervical arteries of the rats were transient blocked bilaterally,in association with bleeding from their tails and followed by reperfusion.The procedures were repeated once again as above to establish a stable ischemic brain injury model.3H-MK801 binding,cNOS activity,iNOS activity,and the cGMP content were measured at different time intervals after ischemic injury.Results The results indicated that the change of 3H-MK801 binding varied among the cerebral cortex and hippocampus.cNOS activity began to rise in all parts of the brain 24 hours after operation and reached its peak in 3 days.The regions where iNOS and cNOS activity and cGMP content all increased significantly include the hippocamus,striatum and cortex,especially in hippocampus.Conclusions The tendency and degree of increase of those four indixes were cosistent during ischemic injury,indicating an important role of NMDA receptor-NO-cGMP in ischemic injury of the hippocampus.
, 百拇医药
Key words brain ischemia; reperfusion injury; N-methyl-D-aspartat receptor-nitric oxide-cGMP pathway; rat
近年来,许多学者对脑缺血神经损伤机制进行了大量研究,并证明一氧化氮(NO)参与该损伤过程[1]。在脑缺血时,NO可介导皮层、海马神经元谷氨酸(Glu)神经毒作用[2],因此谷氨酸受体重要亚型N-甲基-D-天冬氨酸(NMDA)受体及NO-cGMP通路在脑缺血损伤中的作用引起了人们极大的兴趣并得到一些实验的支持。目前认为原生型一氧化氮合酶(cNOS)瞬时产生的NO主要与细胞信息传递有关,而诱导型一氧化氮合酶(iNOS)持续产生的NO与细胞毒作用有关[2]。两者在脑缺血损伤过程中的详细作用机制尚待阐明。本实验采用大鼠双颈总动脉缺血再灌模型,观察大鼠脑在不同时间和不同部位上述通路的变化。
, 百拇医药 1 材料和方法
模型制作 选用Wistar大鼠,雌雄各半,体重180~250 g,由本院实验动物研究所提供。参考文献[3]方法,用20%乌拉坦腹腔注射(1 g/kg)麻醉后,颈中切口分离双侧颈总动脉并结扎造成脑缺血,同时在距尾尖0.3 cm处剪断放血0.8 ml,以热凝止血。缺血30 min后,解开结扎扣恢复脑血流,即再灌20 min; 然后再次结扎,缺血30 min后恢复血供。对照组只进行手术分离双侧颈总动脉。两组动物分别于术后12 h、24 h、3 d、7 d断头取脑,分离大脑皮层、海马、纹状体、中脑和下丘脑,置液氮速冻后于-70℃保存待用。
生化测定 3H-MK801结合实验:采用Yoneda[4]方法取脑突触膜,加入50 mmol/L Tris醋酸buffer(TAB),21000r/min离心洗涤20 min后,调整蛋白浓度为100~200 μg/100 μl。取100μl膜稀释液加入200 μl TAB,在非特异结合管中加入100 μmol/L非标记MK801,然后每管加入3.7kBq 3H-MK801,每个样品3个复管,于30℃水浴孵育30 min,反应结束后加入预冷的TAB 5 ml,抽滤在纤维素膜上,用冷 TAB 20 ml洗涤。将滤膜置闪烁杯中75℃烘干,加入甲苯闪烁液7 ml,于液闪计数仪上测放射活性。
, http://www.100md.com
cNOS和iNOS活性测定:用3H-精氨酸转化生成3H-胍氨酸测定法[5],即取50 μl NOS提取液,加50 μl反应液(含0.1 mmol/L NADPH,30 μmol/L BH4,10 nmol/L CaM,1.25 mmol/L CaCl2,1mmol/L EGTA,pH7.4; iNOS测定管中不加CaM和CaCl2,而加3 mmol/L EGTA)和7.4 kBq 3H-精氨酸,反应管中加入1 mmol/L L-nitro arginine 作为本底,于37℃水浴反应15 min;用2ml预冷的buffer(含0.5 mmol/L Tris-HCl,pH7.5)中止反应,再经0.5~0.7 ml Dowex 50WX8(Na+型)阳离子交换树脂层析分离3H-精氨酸及新生成的3H-胍氨酸。上样后收集2 ml流出液和2 ml蒸馏水洗脱液,将收集的样品混匀后取出1 ml置闪烁杯中,加甲苯Triton X-100闪烁液7ml,在液体闪烁液计数仪上测定样品的放射活性,计算3H-胍氨酸的生成量。
, 百拇医药
cGMP含量测定:按本室已建立的方法进行[6]。即称取冷冻脑组织100 mg,加入预冷的10%三氯醋酸2 ml匀浆,3 000 r/min离心10 min,取上清,用4倍量水饱和乙醚抽提4次,吸去乙醚,将上清置60℃水浴蒸干,0~4℃保存。测定时溶于200 μl 50 mmol/L醋酸钠buffer(pH6.2)。各试管加不同浓度的cGMP标准液或样品50 μl,再加3H-cGMP 50 μl,最后加抗血清100 μl,于4℃反应4 h。反应结束后加预冷的10 mmol/L磷酸buffer(pH6.0)3 ml,终止反应,加至微孔滤膜上减压抽滤,再加同一buffer 20 ml冲洗3次,滤膜置闪烁杯中于75℃烘干加7ml甲苯闪烁液测定。
统计学处理 用Microsoft公司Excel 5.0版软件进行统计学处理,采用单因素方差分析和非配对组间双侧t检验,结果以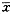 ±s表示。
±s表示。
, 百拇医药
2 结果
大鼠脑缺血反复再灌后,脑5个部位中下丘脑和中脑的各项指标因变化幅度较小,未见明显差异,故附图显示的是具有代表性的大脑皮层、海马和纹状体3个部位各项指标的变化。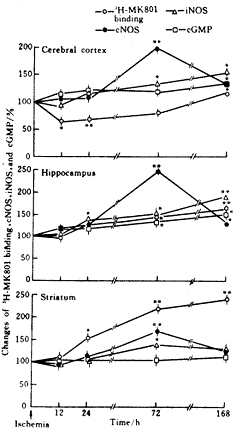
附图 大鼠脑缺血术后大脑皮层、海马和纹状体3H-MK801结合、cNOS、iNOS活性及cGMP含量的变化
Fig Time coures of 3H-MK801 binding,cNOS,iNOS activity,and cGMP content in the cerebral cortex,hippocampus,and striatum after brain ischemia in rat
* P<0.05,** P<0.01 compared with those before ischemia
, 百拇医药
3H-MK801结合的变化:缺血后大脑皮层3H-MK801呈先下降(12和24 h)后恢复(3 d),然后显著升高(7 d);海马和纹状体在缺血12 h时无明显变化,到24 h、3和7 d则进行性显著增高。
cNOS活性变化:缺血24 h后,海马cNOS活性明显升高。3个部位在缺血3 d时cNOS显著升高达峰值;7 d时有所下降,但海马和大脑皮层仍明显高于正常水平。
iNOS活性变化:缺血24 h海马iNOS活性明显升高, 72 h时3个部位均明显增高,7 d时大脑皮层和海马的iNOS活性仍居高不降,其中海马iNOS呈进行性升高。
cGMP含量变化:cGMP含量在脑缺血初期(12 h)无明显变化,缺血24 h时大脑皮层、海马cGMP开始升高并持续至7 d;而纹状体未见明显变化。
, 百拇医药
3 讨论
本实验研究大鼠重复性脑缺血再灌注对脑内多个部位NMDA受体-NO-cGMP通路的影响。结果表明,各部位对缺血再灌的反应不尽相同,以海马变化最为明显,大脑皮层和纹状体次之,中脑和下丘脑不明显。与文献报道大鼠全脑缺血选择性易感区和分布[2]基本一致。文献报道,短暂性全脑缺血后3~4 d海马等敏感区的神经元才发生死亡[7,8],这种迟发性神经损伤的机制尚不十分清楚。体外神经元培养实验证明,短暂(5 min)接触Glu或NMDA后24 h才发生明显的神经元死亡[9],因此整体实验中缺血及再灌早期短暂性积聚的Glu可能与迟发性神经元死亡有关。至于大脑皮层NMDA受体活性在缺血早期(12和24 h)明显下降的原因尚不清楚,可能是缺血再灌后神经细胞释放大量Glu占领受体后的一种自动下调机制,也可能与脑缺血时大量Glu造成的脑内酸性环境使H+浓度上升而影响通道部位3H-MK801的结合,对NMDA受体产生负反馈抑制作用有关[10]。
, http://www.100md.com
cNOS活性受细胞内Ca2+瞬息调节,激活后产生脉冲式NO,但反复激活也可引起持续性NO升高。本实验观察到大脑皮层、海马和纹状体在脑缺血后3 d cNOS活性持续升高达峰值,且与NMDA受体活化同步,提示这一过程可能与受体激活Ca2+相关。本研究还观察到脑缺血后7 d 3个脑区的cNOS活性均有所下降,与文献报道[11]一致,这可能与神经元死亡有关。
iNOS受基因转录水平调控,不依赖于Ca2+,一旦形成则缓慢而持久地大量产生NO。本实验观察到脑缺血再灌后iNOS活性升高,特别是海马部位的持续性增高,表明它在中枢神经损伤过程中起重要作用。但其细胞来源尚不清楚,Endoh等[12]认为主要来源于星形胶质细胞。
NO作为一种不典型的神经递质,其作用特点是不储存在突触小泡中,也不是以量子方式释放而是以扩散方式到达靶细胞,其受体不在细胞膜上而位于胞浆中的鸟苷酸环化酶(GC)活性位点上的铁离子,因此NO可激活GC产生cGMP。本实验观察到大脑皮层和海马cGMP可随NOS活性而变化,但cGMP是否参与神经损伤过程尚无定论。Dawson[2]在皮层神经元培养实验中证明GC抑制剂和cGMP衍生物均不能对抗NMDA或NO神经毒性,而且cGMP可能对小脑片的神经毒损害具有保护作用。
, http://www.100md.com
值得注意的是,NOS抑制剂比NMDA受体拮抗剂对缺血性脑损伤具有更好的保护作用[13],提示NO可能是导致神经元缺血性坏死的重要环节。NO的过量生成除与NMDA受体被过度刺激而引起外,可能还存在其他途径。对NMDA受体-NO-cGMP通路作用的深入研究,将为阐明神经损伤机制及发现新的治疗药物提供有用的线索。
△国家自然科学基金(39470706)资助
左萍萍为通讯作者
参考文献
1 Pulsinelli WA,Brierley LB,Plum FC.Temporal profile of neuronal damage in a model of transient ischemia.Ann Neural,1982,11:491~498
, 百拇医药
2 Dawso VL,Dawson TM,Batley DA,et al.Mechanism of nitric oxide-mediated neurotoxity in primary brain cultures.J Neurosic,1993,13(6): 2651~2661
3 张世仪,刘 洁,何利明.山莨菪碱对实验性脑损害所致认知障碍的改善作用.中国医学科学院学报,1995,17(4):254~258
4 Yoneda Y,Ogita K.Labeling of NMDA receptor channels by 3H-MK801 in brain synaptic membranes treated with Triton X-100.Brain Res,1989,499:305~314
5 强文安,刘景生.3H-精氨酸转化测定一氧化氮合酶活性.中华医学杂志,1996,76(8):567~571
, http://www.100md.com
6 刘景生,李越明,王振纲,等.环鸟苷酸(cGMP)放射免疫测定方法.中国药理学报,1981,2:67~70
7 Kirino T.Delayed neuronal death in the gerbil hippocampus following ischemia.Brain Res,1982,239: 57~69
8 Kirino T,Sano K.Selective vulnerability in the gerbil hippocampus following transient ischemia.Acta Neurophathol,1984,11:491~498
9 Choi DW,Peters S,Viseskul V.Dextrophan and levorphanol selectively block N-methyl-D-Aspartate receptor-mediated neurotoxicity on cortical neurons.J Pharmacol Exp,1987,242: 713~720
, http://www.100md.com
10 左萍萍.NMDA受体的神经生化学研究.中国药理学通报,1992,8(4):241~245
11 Iadecola C,Xu XH,Zhang FY,et al.Marked induction of calcium-independent nitric oxide synthase activity after focal cerebral ischemia.J Cere Blood Flow Met,1995,15: 52~59
12 Endoh M,Maiese K,Wagner J.Expresion of the inducible form of nitri oxid synthase by reactive astrocytes after transient global ischemia.Brain Res,1994,651: 92~100
13 Nowicki JP,Duval D,Poignet H,et al.Nitric oxide mediates neuronal death after focal cerebral ischemia in the mouse.Eur J Pharmacol,1991,204: 339~340
(1997-04-11收稿), http://www.100md.com
单位:中国医学科学院 中国协和医科大学 基础医学研究所药理室, 北京 100005
关键词:脑缺血;再灌损伤;N-甲基-D-天冬氨酸受体-一氧化氮-cGMP通路大鼠
中国医学科学院学报990304 摘要 目的 观察大鼠脑缺血再灌后N-甲基-D-天冬氨酸(NMDA)受体-一氧化氮(NO)-cGMP通路变化。方法 采用大鼠双侧颈总动脉阻断和尾部放血并重复缺血再灌的脑缺血模型,观察术后不同时间动物大脑皮层、海马、纹状体、中脑和下丘脑5个部位的NMDA受体活性(3H-MK801结合)、一氧化氮合酶(NOS)活性及cGMP含量变化。结果 3H-MK801结合在海马、纹状体两部位呈持续性明显增加;原生型NOS(cNOS)于缺血后3天在海马、大脑皮层、纹状体达高峰;而诱导型(iNOS)活性及cGMP含量仅在海马呈持续上升,两者在增加幅度与趋势上也很相似。结论 在海马缺血性神经损伤过程中,NMDA受体-NO-cGMP通路激活可能起重要作用。
, 百拇医药
中图号 R743.3
Role of N-methyl-D-aspartat Receptor-Nitric Oxide-cyclic Guanosin Monophosphate Pathway in Ischemic Brain Injury
Qiang Wenan Zuo Pingping Liu Jingsheng
(Department of Pharmacology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective To observe the role of NMDA receptor-Nitric Oxide(NOS)-cGMP pathway in ischemic brain injury.Methods The common cervical arteries of the rats were transient blocked bilaterally,in association with bleeding from their tails and followed by reperfusion.The procedures were repeated once again as above to establish a stable ischemic brain injury model.3H-MK801 binding,cNOS activity,iNOS activity,and the cGMP content were measured at different time intervals after ischemic injury.Results The results indicated that the change of 3H-MK801 binding varied among the cerebral cortex and hippocampus.cNOS activity began to rise in all parts of the brain 24 hours after operation and reached its peak in 3 days.The regions where iNOS and cNOS activity and cGMP content all increased significantly include the hippocamus,striatum and cortex,especially in hippocampus.Conclusions The tendency and degree of increase of those four indixes were cosistent during ischemic injury,indicating an important role of NMDA receptor-NO-cGMP in ischemic injury of the hippocampus.
, 百拇医药
Key words brain ischemia; reperfusion injury; N-methyl-D-aspartat receptor-nitric oxide-cGMP pathway; rat
近年来,许多学者对脑缺血神经损伤机制进行了大量研究,并证明一氧化氮(NO)参与该损伤过程[1]。在脑缺血时,NO可介导皮层、海马神经元谷氨酸(Glu)神经毒作用[2],因此谷氨酸受体重要亚型N-甲基-D-天冬氨酸(NMDA)受体及NO-cGMP通路在脑缺血损伤中的作用引起了人们极大的兴趣并得到一些实验的支持。目前认为原生型一氧化氮合酶(cNOS)瞬时产生的NO主要与细胞信息传递有关,而诱导型一氧化氮合酶(iNOS)持续产生的NO与细胞毒作用有关[2]。两者在脑缺血损伤过程中的详细作用机制尚待阐明。本实验采用大鼠双颈总动脉缺血再灌模型,观察大鼠脑在不同时间和不同部位上述通路的变化。
, 百拇医药 1 材料和方法
模型制作 选用Wistar大鼠,雌雄各半,体重180~250 g,由本院实验动物研究所提供。参考文献[3]方法,用20%乌拉坦腹腔注射(1 g/kg)麻醉后,颈中切口分离双侧颈总动脉并结扎造成脑缺血,同时在距尾尖0.3 cm处剪断放血0.8 ml,以热凝止血。缺血30 min后,解开结扎扣恢复脑血流,即再灌20 min; 然后再次结扎,缺血30 min后恢复血供。对照组只进行手术分离双侧颈总动脉。两组动物分别于术后12 h、24 h、3 d、7 d断头取脑,分离大脑皮层、海马、纹状体、中脑和下丘脑,置液氮速冻后于-70℃保存待用。
生化测定 3H-MK801结合实验:采用Yoneda[4]方法取脑突触膜,加入50 mmol/L Tris醋酸buffer(TAB),21000r/min离心洗涤20 min后,调整蛋白浓度为100~200 μg/100 μl。取100μl膜稀释液加入200 μl TAB,在非特异结合管中加入100 μmol/L非标记MK801,然后每管加入3.7kBq 3H-MK801,每个样品3个复管,于30℃水浴孵育30 min,反应结束后加入预冷的TAB 5 ml,抽滤在纤维素膜上,用冷 TAB 20 ml洗涤。将滤膜置闪烁杯中75℃烘干,加入甲苯闪烁液7 ml,于液闪计数仪上测放射活性。
, http://www.100md.com
cNOS和iNOS活性测定:用3H-精氨酸转化生成3H-胍氨酸测定法[5],即取50 μl NOS提取液,加50 μl反应液(含0.1 mmol/L NADPH,30 μmol/L BH4,10 nmol/L CaM,1.25 mmol/L CaCl2,1mmol/L EGTA,pH7.4; iNOS测定管中不加CaM和CaCl2,而加3 mmol/L EGTA)和7.4 kBq 3H-精氨酸,反应管中加入1 mmol/L L-nitro arginine 作为本底,于37℃水浴反应15 min;用2ml预冷的buffer(含0.5 mmol/L Tris-HCl,pH7.5)中止反应,再经0.5~0.7 ml Dowex 50WX8(Na+型)阳离子交换树脂层析分离3H-精氨酸及新生成的3H-胍氨酸。上样后收集2 ml流出液和2 ml蒸馏水洗脱液,将收集的样品混匀后取出1 ml置闪烁杯中,加甲苯Triton X-100闪烁液7ml,在液体闪烁液计数仪上测定样品的放射活性,计算3H-胍氨酸的生成量。
, 百拇医药
cGMP含量测定:按本室已建立的方法进行[6]。即称取冷冻脑组织100 mg,加入预冷的10%三氯醋酸2 ml匀浆,3 000 r/min离心10 min,取上清,用4倍量水饱和乙醚抽提4次,吸去乙醚,将上清置60℃水浴蒸干,0~4℃保存。测定时溶于200 μl 50 mmol/L醋酸钠buffer(pH6.2)。各试管加不同浓度的cGMP标准液或样品50 μl,再加3H-cGMP 50 μl,最后加抗血清100 μl,于4℃反应4 h。反应结束后加预冷的10 mmol/L磷酸buffer(pH6.0)3 ml,终止反应,加至微孔滤膜上减压抽滤,再加同一buffer 20 ml冲洗3次,滤膜置闪烁杯中于75℃烘干加7ml甲苯闪烁液测定。
统计学处理 用Microsoft公司Excel 5.0版软件进行统计学处理,采用单因素方差分析和非配对组间双侧t检验,结果以
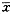 ±s表示。
±s表示。, 百拇医药
2 结果
大鼠脑缺血反复再灌后,脑5个部位中下丘脑和中脑的各项指标因变化幅度较小,未见明显差异,故附图显示的是具有代表性的大脑皮层、海马和纹状体3个部位各项指标的变化。

附图 大鼠脑缺血术后大脑皮层、海马和纹状体3H-MK801结合、cNOS、iNOS活性及cGMP含量的变化
Fig Time coures of 3H-MK801 binding,cNOS,iNOS activity,and cGMP content in the cerebral cortex,hippocampus,and striatum after brain ischemia in rat
* P<0.05,** P<0.01 compared with those before ischemia
, 百拇医药
3H-MK801结合的变化:缺血后大脑皮层3H-MK801呈先下降(12和24 h)后恢复(3 d),然后显著升高(7 d);海马和纹状体在缺血12 h时无明显变化,到24 h、3和7 d则进行性显著增高。
cNOS活性变化:缺血24 h后,海马cNOS活性明显升高。3个部位在缺血3 d时cNOS显著升高达峰值;7 d时有所下降,但海马和大脑皮层仍明显高于正常水平。
iNOS活性变化:缺血24 h海马iNOS活性明显升高, 72 h时3个部位均明显增高,7 d时大脑皮层和海马的iNOS活性仍居高不降,其中海马iNOS呈进行性升高。
cGMP含量变化:cGMP含量在脑缺血初期(12 h)无明显变化,缺血24 h时大脑皮层、海马cGMP开始升高并持续至7 d;而纹状体未见明显变化。
, 百拇医药
3 讨论
本实验研究大鼠重复性脑缺血再灌注对脑内多个部位NMDA受体-NO-cGMP通路的影响。结果表明,各部位对缺血再灌的反应不尽相同,以海马变化最为明显,大脑皮层和纹状体次之,中脑和下丘脑不明显。与文献报道大鼠全脑缺血选择性易感区和分布[2]基本一致。文献报道,短暂性全脑缺血后3~4 d海马等敏感区的神经元才发生死亡[7,8],这种迟发性神经损伤的机制尚不十分清楚。体外神经元培养实验证明,短暂(5 min)接触Glu或NMDA后24 h才发生明显的神经元死亡[9],因此整体实验中缺血及再灌早期短暂性积聚的Glu可能与迟发性神经元死亡有关。至于大脑皮层NMDA受体活性在缺血早期(12和24 h)明显下降的原因尚不清楚,可能是缺血再灌后神经细胞释放大量Glu占领受体后的一种自动下调机制,也可能与脑缺血时大量Glu造成的脑内酸性环境使H+浓度上升而影响通道部位3H-MK801的结合,对NMDA受体产生负反馈抑制作用有关[10]。
, http://www.100md.com
cNOS活性受细胞内Ca2+瞬息调节,激活后产生脉冲式NO,但反复激活也可引起持续性NO升高。本实验观察到大脑皮层、海马和纹状体在脑缺血后3 d cNOS活性持续升高达峰值,且与NMDA受体活化同步,提示这一过程可能与受体激活Ca2+相关。本研究还观察到脑缺血后7 d 3个脑区的cNOS活性均有所下降,与文献报道[11]一致,这可能与神经元死亡有关。
iNOS受基因转录水平调控,不依赖于Ca2+,一旦形成则缓慢而持久地大量产生NO。本实验观察到脑缺血再灌后iNOS活性升高,特别是海马部位的持续性增高,表明它在中枢神经损伤过程中起重要作用。但其细胞来源尚不清楚,Endoh等[12]认为主要来源于星形胶质细胞。
NO作为一种不典型的神经递质,其作用特点是不储存在突触小泡中,也不是以量子方式释放而是以扩散方式到达靶细胞,其受体不在细胞膜上而位于胞浆中的鸟苷酸环化酶(GC)活性位点上的铁离子,因此NO可激活GC产生cGMP。本实验观察到大脑皮层和海马cGMP可随NOS活性而变化,但cGMP是否参与神经损伤过程尚无定论。Dawson[2]在皮层神经元培养实验中证明GC抑制剂和cGMP衍生物均不能对抗NMDA或NO神经毒性,而且cGMP可能对小脑片的神经毒损害具有保护作用。
, http://www.100md.com
值得注意的是,NOS抑制剂比NMDA受体拮抗剂对缺血性脑损伤具有更好的保护作用[13],提示NO可能是导致神经元缺血性坏死的重要环节。NO的过量生成除与NMDA受体被过度刺激而引起外,可能还存在其他途径。对NMDA受体-NO-cGMP通路作用的深入研究,将为阐明神经损伤机制及发现新的治疗药物提供有用的线索。
△国家自然科学基金(39470706)资助
左萍萍为通讯作者
参考文献
1 Pulsinelli WA,Brierley LB,Plum FC.Temporal profile of neuronal damage in a model of transient ischemia.Ann Neural,1982,11:491~498
, 百拇医药
2 Dawso VL,Dawson TM,Batley DA,et al.Mechanism of nitric oxide-mediated neurotoxity in primary brain cultures.J Neurosic,1993,13(6): 2651~2661
3 张世仪,刘 洁,何利明.山莨菪碱对实验性脑损害所致认知障碍的改善作用.中国医学科学院学报,1995,17(4):254~258
4 Yoneda Y,Ogita K.Labeling of NMDA receptor channels by 3H-MK801 in brain synaptic membranes treated with Triton X-100.Brain Res,1989,499:305~314
5 强文安,刘景生.3H-精氨酸转化测定一氧化氮合酶活性.中华医学杂志,1996,76(8):567~571
, http://www.100md.com
6 刘景生,李越明,王振纲,等.环鸟苷酸(cGMP)放射免疫测定方法.中国药理学报,1981,2:67~70
7 Kirino T.Delayed neuronal death in the gerbil hippocampus following ischemia.Brain Res,1982,239: 57~69
8 Kirino T,Sano K.Selective vulnerability in the gerbil hippocampus following transient ischemia.Acta Neurophathol,1984,11:491~498
9 Choi DW,Peters S,Viseskul V.Dextrophan and levorphanol selectively block N-methyl-D-Aspartate receptor-mediated neurotoxicity on cortical neurons.J Pharmacol Exp,1987,242: 713~720
, http://www.100md.com
10 左萍萍.NMDA受体的神经生化学研究.中国药理学通报,1992,8(4):241~245
11 Iadecola C,Xu XH,Zhang FY,et al.Marked induction of calcium-independent nitric oxide synthase activity after focal cerebral ischemia.J Cere Blood Flow Met,1995,15: 52~59
12 Endoh M,Maiese K,Wagner J.Expresion of the inducible form of nitri oxid synthase by reactive astrocytes after transient global ischemia.Brain Res,1994,651: 92~100
13 Nowicki JP,Duval D,Poignet H,et al.Nitric oxide mediates neuronal death after focal cerebral ischemia in the mouse.Eur J Pharmacol,1991,204: 339~340
(1997-04-11收稿), http://www.100md.com