雌激素与骨质疏松症
作者:安胜军 杨学辉 李恩
单位:050017 石家庄,河北医科大学生化教研室
关键词:
中国骨质疏松杂志990325 骨质疏松症(Osteoporosis)早在19世纪初就已经被德意志病理学家同骨软化症、纤维性骨炎等代谢性骨病等一起使用,当时因缺乏有效的检测手段,未能明确定义。Osteoporosis的基本意义是:osteo是“骨的”,poro是“孔”,sis意思之一是“状态”,所以osteoporosis最初的意思是“骨多孔症”;1941年Albright[1]针对正常骨,骨软化症,纤维性骨炎,骨质疏松的特点,基于骨质疏松多发生于绝经后妇女的事实,在JAMA杂志上发表了题为:“绝经后骨质疏松症及其临床特点”的文章,首次明确了骨质疏松症的概念。基本内容是:成骨降低,类骨形成及钙、磷沉积少,骨矿质、有机质的比例与正常骨无差别,组织学可见骨小梁变窄、变薄、中断,推知骨量减少。成为当今骨质疏松症定义的基本内核。1996年WHO定义:骨质疏松症是一种全身代谢性骨病,其特点是骨量减少和骨组织的微细结构受损,因而骨的脆性增加,易于发生骨折。
, http://www.100md.com
骨质疏松症分为继发性骨质疏松和原发性的骨质疏松。前者病因明确,容易治愈,临床病例较少;后者病因不明确,临床患者较多,治愈较困难。在人类所患的疾病当中,原发性骨质疏松症发病率最高,被称为是无声无息的流行病。绝经后女性骨质疏松发病率可高达25%~50%,并随着年龄增大发病率增高,绝经20年以上者可达53.62%~57.89%,平均为56.76%[2]。由于绝经后女性骨量的急剧变化,骨质疏松好发于绝经后女性,所以绝经后骨质疏松已成为原发性骨质疏松的同义语。为维护老年女性的健康,提高她们的生命质量,防治骨质疏松是非常迫切的。雌激素是女性的主要生殖激素,对骨代谢起着重要的调节作用,下面,对雌激素与骨质疏松的关系做一论述。
1 雌激素水平降低是绝经后骨质疏松发病的首要因素
男女共同的生理现象之一是随年龄增加骨量减少,但女性与男性相比,骨峰值低且有绝经史,绝经后骨量丢失显著,易患骨质疏松和引起骨折;与女性相比,相同年龄的男性这种现象较少。本世纪40年代Albright就提出骨质疏松发病与雌激素水平降低有着密切的关系,称之为绝经后骨质疏松。雌激素水平降低,对成骨细胞的刺激减弱,是最重要的原因。他对27例自然绝经妇女和10例人工绝经妇女进行对比观察发现:从绝经到脊柱变形,前者平均9.5年,后者平均13.4年,两者间差异无显著性,提出老化因素并不是骨质疏松发病的主要因素,而雌激素水平降低才是其发病的首要因素,并首先提出雌激素可用于防治绝经后骨质疏松症[1]。这一科学的论断,在当时引起了广泛关注,为绝经后骨质疏松病因、发病机制及治疗的研究开辟了新的航程。后来,人们进行了大量的实验证明了这一观点。随着生物化学的进步,各种检测手段的提高,用放射免疫分析的方法测定血中雌激素水平已成为事实,从而揭示了雌激素水平降低与绝经后骨质疏松发病的必然联系(图1)。有人对绝经后妇女(自然或人工)给以雌激素替代治疗,可降低骨质疏松的发病率,有效地预防骨质疏松性骨折。80年代初精确测定骨密度方法已成为现实,外源性雌激素抑制骨吸收,降低骨的重建率,可阻止绝经后妇女骨量丢失已得到证实。雌激素补充疗法还可以保持腰椎、髋部、前臂等的骨量,可减少全身各部位骨折发生危险约50%。动物实验也证明这一点,切除大鼠卵巢,血中雌激素水平显著降低,并出现骨质疏松病理变化,该法已成为制造绝经后骨质疏松症动物模型的有效方法。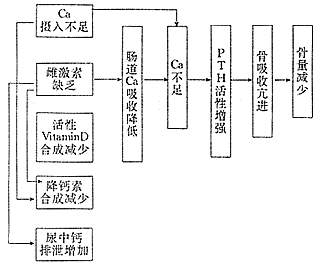
, http://www.100md.com
图1 骨质疏松的病因-雌激素缺乏和钙不足
2 雌激素是维持骨吸收和骨形成平衡的重要因素
骨骼成熟后,在一生中仍不断进行更新与改造,这就是骨再建。骨再建过程是旧骨的吸收,新骨的形成的复杂过程。主要有两种细胞在发生作用:一种是通过分解代谢促使骨质吸收的破骨细胞,一种是通过合成代谢促进骨形成的成骨细胞。正常的骨再建过程有赖于这两种细胞作用的平衡。在骨表面同时存在着破骨细胞和各个分化阶段的成骨细胞,无论在组织学上,还是在功能上都做为一个生理单位发生作用,这一系列的细胞群被称为基本的多细胞单位(basic multicelluar unit,BMU)。任何一种可以改变破骨细胞活性和成骨细胞分泌能力的因素均可对骨的再建产生深刻的影响。雌激素对维持骨吸收和骨形成的平衡具有着极其重要的作用。雌激素属类固醇激素,通过细胞内受体发挥作用,随着免疫学、分子生物学的进步,1980年就有人针对雌激素对骨代谢的影响提出:在骨骼中一定有雌激素受体的存在,并且于1986年运用分子生物学的方法,分离出了雌激素受体,大大推进了人们对雌激素与骨代谢之间关系的认识。根据高敏感度雌激素结合位点检测方法的引入,进一步在成骨细胞上发现了雌激素受体的存在。1987年Gray等人首先在体外培养的成骨细胞上发现了雌激素受体[3]。揭示了雌激素作用于骨的靶细胞,可直接作用于成骨细胞。1988年Komm和Erikson在蛋白水平和mRNA水平上证明了成骨细胞中雌激素受体的存在,并发现雌激素对成骨细胞的作用是通过调节骨基质蛋白(酸溶原胶原蛋白等)、细胞因子(TGF-β等)和转录因子(孕激素受体等)的产生来实现的[4]。与其它类固醇受体一样,雌激素受体上也有雌激素结合域,雌激素直接扩散入核内与雌激素受体结合而发挥作用。实验证明17β- estradiol能促进成骨细胞的增殖和胶原的合成,经雌激素刺激后,成骨细胞Ⅰ型胶原mRNA水平提高一倍。1991年Oursler等人在鸡的破骨细胞及从人的巨噬细胞得到的破骨细胞上发现了雌激素受体的存在,并同时证明了雌激素与破骨细胞上的雌激素受体相应答有抑制骨吸收的作用[5]。 1996年Mano等人在兔的破骨细胞上用高纯度的方法得到了雌激素受体,并发现兔的破骨细胞上存在着大小不一的雌激素受体,雌激素对兔的破骨细胞的作用是抑制蛋白水解酶的产生和骨吸收[6]。以上从体外细胞培养发现雌激素具有直接刺激成骨细胞和抑制破骨细胞的机能。所以,雌激素水平降低导致骨形成抑制、骨吸收亢进。但从骨代谢整体来看,雌激素缺乏的骨质疏松是骨形成和骨吸收都亢进的高转换型骨质疏松,雌激素能同时抑制两者的代谢转换,维持骨密度。
, http://www.100md.com
3 雌激素与骨代谢过程中细胞因子的关系
3.1 骨形成过程中雌激素的作用与细胞因子的关系。
雌激素对骨的作用,经典的观点认为是通过钙调节激素间接地作用。雌激素对甲状旁腺素(PTH)、维生素D、降钙素(CT)等激素的分泌及其作用也有重要影响,但是仅通过间接作用来说明雌激素对骨的作用太局限。1989年Takano-Yamamoto等人用切除卵巢的方法成功地造成大鼠双侧股骨部分骨量丢失的模型,然后对其中一侧股骨持续局部注射17β-estradiol后,该侧股骨中破骨细胞数量减少,成骨细胞数量及松质骨骨量增加[7],这一实验说明雌激素对骨具有直接作用,这种直接作用不是通过钙调节激素等全身因素的作用来实现的。目前,雌激素对骨的直接作用,特别是通过各种细胞因子等局部因素的作用及其作用机制受到重视。
自从1988年Komm和Eriksen证明了成骨细胞中有雌激素受体存在之后,Ernst发现外源性雌激素可促进大鼠成骨细胞产生IGF-I(insulin-like growth factor-I),由于IGF-I的产生增强,使雌激素受体过度表达;还发现雌激素能促进成骨细胞中TGF-β(transforming growth facfor-β)的产生[4];表明这些生长因子对骨形成都有促进作用,所以在雌激素能增加骨量的作用中至少有一部分作用可能是通过这些生长因子的产生,促进骨形成来实现的(图2)。体外细胞培养也发现:雌激素的作用促进成骨细胞中生长因子的产生;在体内,雌激素促进骨形成的作用也已被证实,其作用机制尚不清楚,所以,进一步阐明雌激素与生长因子间的关系,是揭示雌激素促进骨形成过程作用机制的关键。但另一方面,当雌激素缺乏时,骨吸收、骨形成都处于亢进状态,那么雌激素缺乏时,是否存在骨形成障碍?如果存在其程度与骨量减少的关系如何?目前尚不明确,大量事实证明,无论是整体实验,还是体外细胞实验,都发现雌激素对骨形成有促进作用;但是,大量临床实验也证实,绝经后女性雌激素水平降低时,骨吸收亢进的同时,骨形成也亢进,说明体内存在着一种复杂的调节系统(包括整体的和局部的),目前尚不清楚,是今后研究的重点。
, 百拇医药
图2 绝经后骨质疏松症的病理生理
3.2 骨吸收过程中雌激素的作用与细胞因子的关系
雌激素缺乏,骨代谢转换亢进,但骨吸收超过骨形成,从而导致骨量减少;此时补充雌激素,骨量减少明显受到抑制。实验表明,雌激素缺乏,骨髓单核细胞分泌IL-1(interleukin-1)和间质细胞分泌IL-6都增多[8],可见IL-1和IL-6对骨吸收有促进作用。雌激素缺乏,局部细胞产生骨吸收性细胞因子与骨吸收亢进的关系见图3。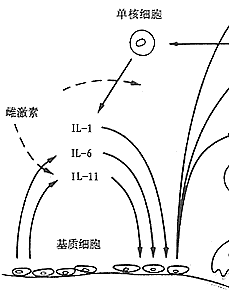
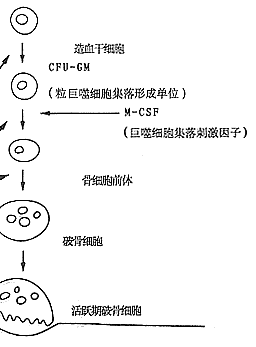
图3 细胞因子和雌激素对破骨细胞的形成及骨吸收的影响
Pacifici等人对绝经后骨质疏松患者末梢血中的单核细胞进行培养,48小时后从培养液中检测到IL-1的浓度明显高于对照组,对绝经后骨质疏松患者用雌激素治疗组中,用上述同样的方法检测IL-1水平,发现亢进的IL-1降低到对照组水平[9],说明单核细胞产生IL-1增多是绝经后骨质疏松的发病因素之一。Pioli和Matsuda在重复上述实验的基础上又进一步对切除卵巢大鼠体内给阻碍IL-1作用的IL-1ra(IL-1 receptor antagonist)后,与补充雌激素组相比,骨量减少情况及破骨细胞的骨吸收作用恢复到相同水平[10],表明由IL-1及IL-1诱导的物质是雌激素缺乏状态下的骨质疏松发病因素之一。Pacifici等人除发现IL-1对骨代谢的影响之外,还发现在培养的末梢血单核细胞中能产生TNF-α(tumor necrosis factor-α)和GM-CSF;切除卵巢的患者体内TNF -α和GM-CSF水平升高,接受雌激素治疗的患者TNF-α和GM-CSF恢复到正常水平[11]。在观察切除卵巢大鼠的骨髓细胞中破骨细胞的形成情况和骨吸收过程时,发现IL-1ra和TNF结合蛋白(TNF binding protein)对大鼠和对体外培养的大鼠破骨细胞的形成及骨吸收过程都有抑制作用,而抗IL-6抗体则无这种抑制作用[12],Gowen等人在培养末梢血单核细胞及成骨细胞时发现,卵巢切除组TNF-α的产生增多,加用雌激素补充治疗组TNF-α恢复到正常水平[13]。
, 百拇医药
Manolagas等人实验发现:17β-estradiol可抑制培养的骨髓间质细胞和成骨细胞产生IL-6;培养切除卵巢小鼠的骨髓细胞和成骨细胞与正常对照组相比IL-6水平增高,同时补充雌激素组中IL-6则处于正常水平。他进一步以切除卵巢小鼠为模型,观察切除卵巢后在体内和离体的破骨细胞形成情况时表明,体内使用IL-6抗体组与体内补充雌激素组同样都能抑制破骨细胞的形成[14]。还有实验表明对人工破坏IL-6基因的小鼠即使切除卵巢骨量也不减少[15]。在人工破坏特定基因的小鼠(破坏雌激素受体基因)中,即使不切除卵巢骨代谢转换也亢进。关于骨代谢的动态变化有待于进一步探讨。有人对Manolagas等人提出的关于17β-estradiol能抑制培养的成骨细胞中IL-6的产生的观点提出异议,指出即使抗IL-6抗体在体外能抑制破骨细胞的分化,但也不能抑制骨量减少[13],IL-6对骨吸收的促进作用仅限于富含低分化的破骨细胞前驱细胞的实验研究[16],即使是未分化的胎鼠骨,从小鼠和大鼠的骨组织培养中未发现对45Ca的游离有促进作用,所以IL-6的促进骨吸收作用尚有疑问。
, 百拇医药
大家知道在各种组织中IL-1、TNF、IL-6等细胞因子的产生和作用相互调节。骨代谢过程中,即使在雌激素水平降低的情况下,IL-1、TNF、IL-6等细胞因子对骨吸收的促进作用,在破骨细胞分化、活化的各个时期,都可能发挥着调节作用,此种情况下IL-6可能在分化的初期阶段发挥主要作用,IL-1在以后各阶段中发挥主要作用[11,16],也可能在同一时期内他们共存而发挥重要作用。
Miyaura等人观察用切除卵巢小鼠的骨髓液对培养中的骨组织的骨吸收促进作用时发现,消炎痛具有抑制骨髓液中骨吸收促进因子的作用,所以他推论,由于前列腺素(PG)的产生导致对骨吸收具有促进作用,他们在体内及体外进行了研究,雌激素缺乏后骨髓细胞产生的因子使IL-1α作用增强,诱导PG在骨中主要的合成酶Cyclooxygenase-2(cox-2)产生、合成增多,促进骨吸收[17],所以局部细胞因子的相互作用,全身激素和PG等的作用及这些因素相互联系的研究是阐明雌激素水平降低时,骨吸收亢进机制的重要内容。
, 百拇医药
4 雌激素受体基因与骨质疏松症
4.1 雌激素受体与骨代谢
人在发育期,骨密度(BMD)迅速持续增加,30~40岁达峰值,以后随年龄增加,骨量逐渐降低,特别是绝经后的几年间,骨量丢失速度最快,说明雌激素对维持骨量起着非常重要的作用。临床观察已经证实,绝经后,骨量丢失速度加快,补充雌激素后,骨量丢失受到有效的抑制。长期以来,人们一直认为雌激素对骨的作用是间接的,1988年Komm在成骨细胞上发现了雌激素受体,明确了雌激素对骨细胞的直接作用[4]。1990年Penlser又在破骨细胞上发现了雌激素受体,更加明确了雌激素与骨细胞的直接作用关系[18]。为了阐明雌激素在骨代谢中的作用机理,人们对骨细胞,成骨细胞和破骨细胞进行了多方面的研究取得了较大的进展,发现在成骨细胞中雌激素受体依赖于细胞周期[19]。还发现除骨细胞以外,雌激素对其他组织细胞,特别是产生细胞因子的细胞的作用,间接对绝经后骨代谢产生重要的影响。
, 百拇医药
4.2 从人工破坏特定基因小鼠和基因突变病例分析骨代谢中雌激素受体基因的意义
为了从根本上寻找雌激素在骨代谢调节中的作用机制,发生学和分子生物学的研究取得了重大突破。用同源重组的方法,抑制雌激素受体基因的表达,即所谓人工破坏特定基因。破坏雌激素受体基因与破坏其他类固醇受体基因(雄激素、PTH、肾上腺皮质激素等)相比较为困难,破坏雌激素受体基因宜在受精后极早期发现雌激素受体基因[20]。1993年Korach首先研制成功了人工破坏雌激素受体基因小鼠(ERKO)[21],他为了抑制雌激素受体基因,在雌激素受体基因第二外显子的终止密码子(stop codon)和聚腺苷酸序列(polyadenylation sequence)上同时插入新霉素耐性基因,这些基因经同源重组后,胚胎干细胞(embryonic stem cell,ES细胞)的获得率极低,1800个中才能获得2个,用该法制成了ERKO,ERKO不论是雄性还是雌性,其骨密度都比正常鼠低20%~25%。
, 百拇医药
1994年根据Korach的研究结果,Smith首次报道了雌激素受体基因突变的一男性病例[22],该患者,骨龄延迟(相当于15岁的骨发育),骨端线未闭,以骨发育障碍和高度的骨密度降低为特征,骨密度与15岁的骨密度相当,比正常青年骨峰值低2SD以下,说明雌激素不仅影响骨密度而且影响骨的发育;另一方面从该患者骨代谢指标看,骨形成和骨吸收都亢进,骨代谢处于高转换状态,从这一病例可以看出,即使是男性,骨的正常发育,特别是正常的矿化,雌激素的作用都是非常必要的,仅雄激素是不够的,显示了雌激素在骨代谢中的重要性。该患者的双亲突变基因是杂合的,是近亲结婚(堂兄妹),患者是纯合的,是常染色体隐性遗传形成。今后对以低骨密度、高身长,骨端线未闭为特征的有遗传背景的病例进行基因筛选,进一步阐明雌激素受体基因突变与骨质疏松的关系。
4.3 雌激素受体基因多态性与骨质疏松
骨质疏松的发病因素大体可分为遗传因素和环境因素两类。近年来,正在用分子生物学的方法研究各种疾病与遗传因素的关系,对骨质疏松的研究相对较晚。1994年Morrison等人对维生素D3受体基因的多态性进行了研究,基本上阐明了骨质疏松与遗传因素有关,引起了人们的重视。由于雌激素在骨代谢调节中的重要性,特别是前面所述的人工破坏雌激素受体基因小鼠(ERKO)研制的成功和雌激素受体基因突变病例的发现[23],进一步明确了雌激素受体基因在骨质疏松发病中的重要性。所以雌激素受体基因的多态性及其与骨质疏松的关系引起人们的广泛关注。
, http://www.100md.com
在雌激素受体结构基因及其上游有多种多态性(polymorphism)位点存在,其中2个限制性酶切片段长度多态(restriction fragment length polymorphism,RFLP)的确切酶切位点已被确定,在内含子1中,存在着是否能被限制性内切酶pvu Ⅱ或xbaⅠ切断的多态性[24],另一方面,在雌激素受体基因的上游约1kb的部位存在着T(thymine),A(adenine)的重复序列,其重复次数也有多态性[25](图4、图5)。
图4 雌激素受体基因的结构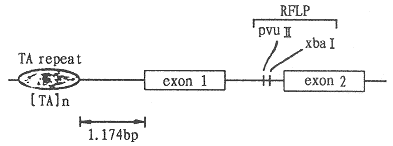
图5 雌激素受体基因多态性的部位
对健康绝经后女性,检查其骨密度(DXA法),测其血/尿中骨代谢指标,从末梢血白细胞中提出DNA,根据RFLP进行雌激素受体多态性分析具有重要的理论意义。内含子1中,在pvuⅡ位点和xbaⅠ位点之间的DNA部分插入特异的引物,进行PCR (polymerase chain reaction)扩增,得到的DNA片段经过pvuⅡ或xbaⅠ酶切处理进行RFLP分类,被酶切断时命名为p或x,没有被酶切断时命名为P或X;或者两组组合分类;比较各组间年龄、身高、体重、骨密度及各种骨代谢生化指标有无显著差异。结果发现骨密度因基因型不同而有显著性变化,腰椎和全身骨密度PP型比pp型低,XX型比xx型低。
, 百拇医药
pvuⅡ和xbaⅠ酶切点之间大约只有50bp,能用两个RFLP组合分析或单膜标本分析,结果PPxx组比其他任何一组骨密度明显降低,阐明了雌激素受体基因的多态性和骨质疏松发病的关系[26]。
另外,关于雌激素受体基因上游的TATA序列重复(dinucleotide repeat)次数多态性的判定,有重复次数组和其他组在年龄、身高、体重、骨密度和在骨代谢生化指标上相比,重复12次结构组比其他组骨密度明显降低,尿中脱氧吡啶啉(deoxypyridinolines,D-pyr)增高[27]。
5 骨质疏松症的治疗和选择性雌激素受体调节剂
目前,国际上通用的治疗骨质疏松的药物有7种:A钙制剂,B:二膦酸盐,C:降钙素,D:活性维生素D,E:雌激素,F:异丙氧黄酮,G:维生素K2。这7类药物各有特点,治疗目的都是增加骨量,增大骨强度,预防骨折[28](图6)。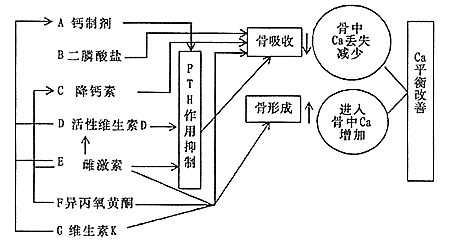
, http://www.100md.com
图6 骨质疏松的治疗
骨吸收比骨形成相对亢进,骨量则减少,所以治疗骨质疏松的第一步是抑制骨吸收。降钙素的生理作用是抑制骨吸收,但这种抑制作用并不持久,随后是这种抑制的脱逸现象,所以降钙素短期治疗效果好,长期治疗的效果和预防价值尚不确定。双膦酸盐类药物的主要药理作用为抑制骨吸收,其作用机制尚未完全阐明,为防治以破骨细胞性骨吸收为主的各种代谢性骨病及高转换型(以骨吸收为主)骨质疏松症的主要药物,目前主要推荐用于高转换型骨质疏松患者,特别是那些绝经早期有雌激素替代治疗禁忌症患者,如乳腺癌,子宫内膜癌或有癌症家族史的患者,对不愿意接受雌激素替代治疗的女性,双膦酸盐药物可作为首选。对类固醇性骨质疏松症,双膦酸盐列为首选药物。雌激素一方面能直接抑制骨吸收,另一方面通过抑制骨吸收性细胞因子而抑制骨吸收,除此之外对骨形成还具有促进作用。依普拉芬可通过增加骨细胞数量而增加骨形成和抑制前破骨细胞的募集和分化而抑制骨吸收。对绝经后骨质疏松,雌激素替代治疗与依普拉芬治疗的效果相同;但依普拉芬治疗的绝经后妇女中,无血清促性腺激素、雌激素或促乳素水平变化。推测依普拉芬和雌激素对骨细胞可能有着同样的作用机理,而无雌激素样作用。阻碍骨吸收的药物一般是阻止骨钙丢失,达到增加骨量的目的,雌激素能促进肠钙的吸收,减少尿钙的排出,防止钙缺乏引起的继发性甲状旁腺机能亢进,使骨对PTH感受性降低,促进降钙素的分泌等,间接地抑制因钙缺乏后,PTH分泌亢进,CT分泌不足引起的骨吸收亢进[29]。活性维生素D能促进肠钙的吸收,抑制继发性甲状旁腺机能亢进引起的骨吸收,雌激素能提高1α-羟化酶(1α-hydroxylaser)的活性,促进血中25-(OH)D3到活性维生素D3即1,25-(OH)2D3的转化,雌激素还作用于肠粘膜上1,25-(OH)2D3受体,提高对钙的吸收。维生素K2能直接抑制骨吸收,促进骨形成,还与维生素协同作用,促进肠钙的吸收。
, http://www.100md.com
由此可见,雌激素对骨质疏松症具有多重治疗作用,是治疗绝经后骨质疏松最有效的药物,也是任何其它防治骨质疏松的措施所无法比拟的。目前,已经肯定了雌激素替代治疗(ERT)在预防骨质疏松中的作用,并强调早期应用。但是长期应用雌激素的安全性(乳癌发生率及已患癌症复发率的影响),可耐受性(因子宫出血停药)等问题仍在研究之中,虽然与孕激素合用在理论上可能解决了该问题,但对于患者依然感到不安。最近,阻碍雌激素与其受体结合的物质,即选择性雌激素受体调节剂对骨有类似雌激素样作用的观点,引起了人们的关注,即具有拮抗和协同双重作用的功能。雌激素疗法,对骨质疏松虽有治疗作用,但是还有很多雌激素本身所无法克服的副反应,选择性雌激素受体调节剂就是在保留雌激素治疗作用的同时,去除在治疗过程中的副反应,尤其是拮抗雌激素对子宫内膜的刺激成为可能,对不同脏器的选择性(拮抗作用和协同作用)是选择性雌激素受体调节剂治疗骨质疏松的特点。他莫昔芬(Tamoxifen)是选择性雌激素受体调节剂的代表药物。用之治疗乳腺癌早已被广泛应用于临床,Tamoxifen同时具有拮抗和协同两个方面的作用,即同时具有抑制乳癌细胞增殖的拮抗作用和促进子宫内膜、骨、肝等细胞增殖,提高骨密度,降低胆固醇的协同作用。Tamoxifen对摘除卵巢大鼠的骨吸收和骨形成都有抑制作用,可以防止骨量减少[30],但在对子宫的刺激作用和癌变关系上成了难题,所以理想的对骨和心脑血管具有促进作用,对子宫内膜增生有抑制作用的药物Raloxifene被开发应用[31]。Raloxifen与雌激素受体结合后,对骨的作用具有较强的选择性,动物实验证明,对摘除卵巢大鼠给以Raloxifen治疗后,未见子宫内膜增厚,可明显地抑制胆固醇的升高和骨量减少。但是,Raloxifen对骨的作用与雌激素不同,Raloxifen只抑制骨吸收,不抑制制骨形成[32],认为Raloxifen与雌激素受体结合,发生了微小的变化。实际上,最近TGF-β3基因的发现,观察到了Raloxifen和雌激素的不同,Raloxifen能够促进TGF-β的产生,可是,在TGF-β3基因的上游没有雌激素和受体复合体能识别的DNA序列,而Raloxifene与雌激素受体结合后,通过与核蛋白结合能够识别TGF-β基因上的特定的DNA序列(raloxifene response element,RRE)[33],强烈地抑制破骨细胞的分化,Raloxifen对各脏器不同作用的机制正在研究中,现在,西方国家正在进行Raloxifen的临床试验。
, 百拇医药
以上从5个方面论述了雌激素在骨质疏松发病、病理机制、诊断、防治中的作用,说明雌激素水平降低是骨形成和骨吸收平衡失调的首要因素,由于在成骨细胞和破骨细胞上有雌激素受体的存在,阐明了雌激素对成骨细胞和破骨细胞直接作用的机制。对雌激素水平降低时骨再建过程中为什么骨吸收占优势,这种不平衡性为什么在补充雌激素治疗后可恢复正常平衡状态等问题的研究提供了理论依据。雌激素与细胞因子的关系,在最近的骨代谢研究领域倍受学者们的重视,特别是IL-1、TNF、IL-6之间的关系的研究和讨论,成为该领域研究的主要内容,可是,大部分将细胞因子各自以一种单一的因素加以研究,而绝经后骨质疏松的发病是由于包括细胞因子在内的各种因素之间的复杂作用结果所致,所以从整体和局部出发,分析各因子作用的联系是非常重要的。在这些细胞因子的基因上未发现雌激素的应答部位,可知雌激素间接地调节细胞因子的增减。雌激素受体基因的多态性分析从遗传角度早期筛选骨质疏松的高危人群,为在临床进行基因诊断和治疗提供理论依据。雌激素对骨质疏松的治疗被一致认定。目前开发的选择性雌激素受体调节剂吸取了雌激素优势,避免了劣势,更具有选择性。目前,该药正在临床试验阶段。希望该药是理想的治疗骨质疏松症的药物。雌激素对骨代谢的调节还有很多问题不明确,希望今后从基础和临床研究有更大的突破。
, 百拇医药
参考文献
1 Albright F.Postmenopausal osteoporosis.JAMA,1941,116:2465-2474.
2 李恩.原发性骨质疏松发病的相关因素.中国骨质疏松杂志,1997,3(2):1.
3 Gray TK.13 β-esdtradiol acts directly on the clonal osteoblast cell line UMR 160.Proc Natl Acad Sci USA,1987,84:6267-6271.
4 Komm BS.Estrogen binding receptor mRNA and biologic response in osteoblast- like osteosarcoma cells.Science,1988,241:81-84.
, http://www.100md.com
5 Oursle MJ,Osdoby P,Pyfferoen J,et al.Avian osteoclast as estrogen target cells.Proc Natl Acad Sci USA,1991,88:6613-6617.
6 Mano H,Yuasa T,Kameda T,et al.Mammalian mature osteoclast as estrogen target cells.Biochem Biophys Res Commun,1996,223:637-642.
7 Takano-Yamamoto T,Rodan GA.Direct effects of 17 β-estradiol on trabecular bone in ovariectomized rat.Proc Natl Acad Sci USA,1989,86:2172.
8 Ralston SH.Analysis of gene expression in human bone biopsies by polymerase chain reaction:evidence of enhanced cytokine expression in postmenopausal osteoporosis.J Bone Miner Res,1994,9:883.
, 百拇医药
9 Pacifici R.Is there a causal role of IL-Ⅰ in postmenopausal bone loss?Calcif Tissue Int,1992,50:295.
10 Kimble RB,Vannice JL,Bloedow DC, et al.Interleukin-1 receptor antagonist decreases bone loss and bone resorption in ovariectomized rats.J Clin Invest, 1994,93:1959.
11 Pacifici R,Brown C,Puscheck E,et al.The effects of surgical menopause and estrogen replacement on cytokine release from human blood monocytes.Proc Natl Acad Sci USA,1991,88:5134.
, 百拇医药
12 Kitazawa R,Kimble RB,Vannice JL,et al.Interkeukin-1 receptor antagonist and tumor necrosis factor binding protein decrease osteoclast formation and bone resorption in ovariectomized mice.J Clin Invest,1994,94:2397.
13 Ralston SH,Russel RGG,Gowen M.Estrogen inhibits release of tumor necrosis factor from peripheral blood mononuclear cells in postmenopausal women.J Bone Miner Res,1990,5:983.
14 Jika RL,Hangoc G,Girasole G,et al.Increased osteoclast development after estrogen loss:mediation by interleukin-6.Science,1992,257:88.
, http://www.100md.com
15 Poli V,Balena R,Fattori E,et al.Interleukin-6 deficient mice are protected from bone loss caused by estrogen depletion.EMBO J,1994,13:1189.
16 Roodman GD.Interleukin-6:an osteoporotic factor? J Bone Miner Res,1992,7:475.
17 Kawaguchi H,Pilbeam CC,Vargas SJ, et al.Ovariectomy enhances and estrogen replacement inhibits the activity of marrow factors which stimulate prostaglandin production in cultured mouse calvariae.J Clin Invest,1995,96:539-548.
, 百拇医药
18 Pensler JM,Radosevich JA,Higbee R,et al.Osteoclast isolated from membranous bone in children exhibited nuclear estrogen and progesterone receptors.J Bone Miner Res,1990,5:797-802.
19 Ikegami A,Inoue S,Hosoi T,et al.Cell cycle dependent expression and function of estrogen receptor in human osteoblastic cells.Endocrinology,1994,135:782-789.
20 Hou Q,Gorski J.Estrogen receptor and progesterone receptor genes are expressed differentially in mouse embryos during preimplantation development.Proc Natl Acad Sci USA,1993,90:9460-9464.
, http://www.100md.com
21 Lubahn DB,Moyer JS,Golding TS, et al.Alteration of reproductive function but not prenatal sexual development after insertional disruption of the mouse estrogen receptor gene.Proc Natl Acad Sci USA,1993,90:11162-11166.
22 Smith EP,Boyd J,Frank GR, et al.Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man.N Engl Med,1994,331:1056-1061.
23 Morrison NA,Qi JC,Tokita A,et al.Prediction of bone density from vitamin D receptor alleles.Nature,1994,367:284-287.
, 百拇医药
24 Piva R,Gambari R,Zorzato F,et al.Analysis of upstream sequences of the human estrogen receptor gene.Biochem Biophys Res Commun,1993,183:996-1002.
25 Yaich L,Dupont WD,Cavener DR, et al.Analysis of the Pvu Ⅱ restriction fragment-length polymorphism and exon structure of the estrogen receptor gene in breast cancer and peripheral blood.Cancer Res,1992,52:77-83.
26 Kobayashi S,Inoue S,Hosoi T,et al.Association of bone mineral density with polymorphism of the estrogen receptor gene.J Bone Miner Res,1996,11:306-311.
, http://www.100md.com
27 Sano M,Inoue S,Hosoi T,et al.Association of estrogen receptor dinucleotid repeat polymorphism with osteoporosis.Biochem Biophys Res Commun,1995,217:378-383.
28 Fujita T.Clinical guidelines for the treatment of osteoporosis in Japan.Calcif Tissue Int,1996,59(Suppl):s 34-37.
29 Fujita T.Vitamin D in the treatment of osteoporosis.Proc Soc Exp Biol Med, 1992,199:394-399.
30 Turner RT.Tamoxifen prevents the skeletal effects of ovarian hormone difficiency in rats.J Bone Miner Res,1987,2:449-456.
, 百拇医药
31 Black LJ.Raloxifene(LY139481 HCl) prevents bone loss and reduces serum cholesterol without causing uterine hypertrophy in ovariectomized rats.J Clin Invest,1994,93:63-69.
32 Evans G.The effects of raloxifene on tibia histomorphometry in ovariectomized rats.Endocrinology,1994,134:2283-2288.
33 Yang NN,Venugopalan M,Hardikar S,et al.Identification of an estrogen response element activated by metabolites of 17 β-estradiol and raloxifene.Science,1996, 273:1222-1225., 百拇医药
单位:050017 石家庄,河北医科大学生化教研室
关键词:
中国骨质疏松杂志990325 骨质疏松症(Osteoporosis)早在19世纪初就已经被德意志病理学家同骨软化症、纤维性骨炎等代谢性骨病等一起使用,当时因缺乏有效的检测手段,未能明确定义。Osteoporosis的基本意义是:osteo是“骨的”,poro是“孔”,sis意思之一是“状态”,所以osteoporosis最初的意思是“骨多孔症”;1941年Albright[1]针对正常骨,骨软化症,纤维性骨炎,骨质疏松的特点,基于骨质疏松多发生于绝经后妇女的事实,在JAMA杂志上发表了题为:“绝经后骨质疏松症及其临床特点”的文章,首次明确了骨质疏松症的概念。基本内容是:成骨降低,类骨形成及钙、磷沉积少,骨矿质、有机质的比例与正常骨无差别,组织学可见骨小梁变窄、变薄、中断,推知骨量减少。成为当今骨质疏松症定义的基本内核。1996年WHO定义:骨质疏松症是一种全身代谢性骨病,其特点是骨量减少和骨组织的微细结构受损,因而骨的脆性增加,易于发生骨折。
, http://www.100md.com
骨质疏松症分为继发性骨质疏松和原发性的骨质疏松。前者病因明确,容易治愈,临床病例较少;后者病因不明确,临床患者较多,治愈较困难。在人类所患的疾病当中,原发性骨质疏松症发病率最高,被称为是无声无息的流行病。绝经后女性骨质疏松发病率可高达25%~50%,并随着年龄增大发病率增高,绝经20年以上者可达53.62%~57.89%,平均为56.76%[2]。由于绝经后女性骨量的急剧变化,骨质疏松好发于绝经后女性,所以绝经后骨质疏松已成为原发性骨质疏松的同义语。为维护老年女性的健康,提高她们的生命质量,防治骨质疏松是非常迫切的。雌激素是女性的主要生殖激素,对骨代谢起着重要的调节作用,下面,对雌激素与骨质疏松的关系做一论述。
1 雌激素水平降低是绝经后骨质疏松发病的首要因素
男女共同的生理现象之一是随年龄增加骨量减少,但女性与男性相比,骨峰值低且有绝经史,绝经后骨量丢失显著,易患骨质疏松和引起骨折;与女性相比,相同年龄的男性这种现象较少。本世纪40年代Albright就提出骨质疏松发病与雌激素水平降低有着密切的关系,称之为绝经后骨质疏松。雌激素水平降低,对成骨细胞的刺激减弱,是最重要的原因。他对27例自然绝经妇女和10例人工绝经妇女进行对比观察发现:从绝经到脊柱变形,前者平均9.5年,后者平均13.4年,两者间差异无显著性,提出老化因素并不是骨质疏松发病的主要因素,而雌激素水平降低才是其发病的首要因素,并首先提出雌激素可用于防治绝经后骨质疏松症[1]。这一科学的论断,在当时引起了广泛关注,为绝经后骨质疏松病因、发病机制及治疗的研究开辟了新的航程。后来,人们进行了大量的实验证明了这一观点。随着生物化学的进步,各种检测手段的提高,用放射免疫分析的方法测定血中雌激素水平已成为事实,从而揭示了雌激素水平降低与绝经后骨质疏松发病的必然联系(图1)。有人对绝经后妇女(自然或人工)给以雌激素替代治疗,可降低骨质疏松的发病率,有效地预防骨质疏松性骨折。80年代初精确测定骨密度方法已成为现实,外源性雌激素抑制骨吸收,降低骨的重建率,可阻止绝经后妇女骨量丢失已得到证实。雌激素补充疗法还可以保持腰椎、髋部、前臂等的骨量,可减少全身各部位骨折发生危险约50%。动物实验也证明这一点,切除大鼠卵巢,血中雌激素水平显著降低,并出现骨质疏松病理变化,该法已成为制造绝经后骨质疏松症动物模型的有效方法。

, http://www.100md.com
图1 骨质疏松的病因-雌激素缺乏和钙不足
2 雌激素是维持骨吸收和骨形成平衡的重要因素
骨骼成熟后,在一生中仍不断进行更新与改造,这就是骨再建。骨再建过程是旧骨的吸收,新骨的形成的复杂过程。主要有两种细胞在发生作用:一种是通过分解代谢促使骨质吸收的破骨细胞,一种是通过合成代谢促进骨形成的成骨细胞。正常的骨再建过程有赖于这两种细胞作用的平衡。在骨表面同时存在着破骨细胞和各个分化阶段的成骨细胞,无论在组织学上,还是在功能上都做为一个生理单位发生作用,这一系列的细胞群被称为基本的多细胞单位(basic multicelluar unit,BMU)。任何一种可以改变破骨细胞活性和成骨细胞分泌能力的因素均可对骨的再建产生深刻的影响。雌激素对维持骨吸收和骨形成的平衡具有着极其重要的作用。雌激素属类固醇激素,通过细胞内受体发挥作用,随着免疫学、分子生物学的进步,1980年就有人针对雌激素对骨代谢的影响提出:在骨骼中一定有雌激素受体的存在,并且于1986年运用分子生物学的方法,分离出了雌激素受体,大大推进了人们对雌激素与骨代谢之间关系的认识。根据高敏感度雌激素结合位点检测方法的引入,进一步在成骨细胞上发现了雌激素受体的存在。1987年Gray等人首先在体外培养的成骨细胞上发现了雌激素受体[3]。揭示了雌激素作用于骨的靶细胞,可直接作用于成骨细胞。1988年Komm和Erikson在蛋白水平和mRNA水平上证明了成骨细胞中雌激素受体的存在,并发现雌激素对成骨细胞的作用是通过调节骨基质蛋白(酸溶原胶原蛋白等)、细胞因子(TGF-β等)和转录因子(孕激素受体等)的产生来实现的[4]。与其它类固醇受体一样,雌激素受体上也有雌激素结合域,雌激素直接扩散入核内与雌激素受体结合而发挥作用。实验证明17β- estradiol能促进成骨细胞的增殖和胶原的合成,经雌激素刺激后,成骨细胞Ⅰ型胶原mRNA水平提高一倍。1991年Oursler等人在鸡的破骨细胞及从人的巨噬细胞得到的破骨细胞上发现了雌激素受体的存在,并同时证明了雌激素与破骨细胞上的雌激素受体相应答有抑制骨吸收的作用[5]。 1996年Mano等人在兔的破骨细胞上用高纯度的方法得到了雌激素受体,并发现兔的破骨细胞上存在着大小不一的雌激素受体,雌激素对兔的破骨细胞的作用是抑制蛋白水解酶的产生和骨吸收[6]。以上从体外细胞培养发现雌激素具有直接刺激成骨细胞和抑制破骨细胞的机能。所以,雌激素水平降低导致骨形成抑制、骨吸收亢进。但从骨代谢整体来看,雌激素缺乏的骨质疏松是骨形成和骨吸收都亢进的高转换型骨质疏松,雌激素能同时抑制两者的代谢转换,维持骨密度。
, http://www.100md.com
3 雌激素与骨代谢过程中细胞因子的关系
3.1 骨形成过程中雌激素的作用与细胞因子的关系。
雌激素对骨的作用,经典的观点认为是通过钙调节激素间接地作用。雌激素对甲状旁腺素(PTH)、维生素D、降钙素(CT)等激素的分泌及其作用也有重要影响,但是仅通过间接作用来说明雌激素对骨的作用太局限。1989年Takano-Yamamoto等人用切除卵巢的方法成功地造成大鼠双侧股骨部分骨量丢失的模型,然后对其中一侧股骨持续局部注射17β-estradiol后,该侧股骨中破骨细胞数量减少,成骨细胞数量及松质骨骨量增加[7],这一实验说明雌激素对骨具有直接作用,这种直接作用不是通过钙调节激素等全身因素的作用来实现的。目前,雌激素对骨的直接作用,特别是通过各种细胞因子等局部因素的作用及其作用机制受到重视。
自从1988年Komm和Eriksen证明了成骨细胞中有雌激素受体存在之后,Ernst发现外源性雌激素可促进大鼠成骨细胞产生IGF-I(insulin-like growth factor-I),由于IGF-I的产生增强,使雌激素受体过度表达;还发现雌激素能促进成骨细胞中TGF-β(transforming growth facfor-β)的产生[4];表明这些生长因子对骨形成都有促进作用,所以在雌激素能增加骨量的作用中至少有一部分作用可能是通过这些生长因子的产生,促进骨形成来实现的(图2)。体外细胞培养也发现:雌激素的作用促进成骨细胞中生长因子的产生;在体内,雌激素促进骨形成的作用也已被证实,其作用机制尚不清楚,所以,进一步阐明雌激素与生长因子间的关系,是揭示雌激素促进骨形成过程作用机制的关键。但另一方面,当雌激素缺乏时,骨吸收、骨形成都处于亢进状态,那么雌激素缺乏时,是否存在骨形成障碍?如果存在其程度与骨量减少的关系如何?目前尚不明确,大量事实证明,无论是整体实验,还是体外细胞实验,都发现雌激素对骨形成有促进作用;但是,大量临床实验也证实,绝经后女性雌激素水平降低时,骨吸收亢进的同时,骨形成也亢进,说明体内存在着一种复杂的调节系统(包括整体的和局部的),目前尚不清楚,是今后研究的重点。

, 百拇医药
图2 绝经后骨质疏松症的病理生理
3.2 骨吸收过程中雌激素的作用与细胞因子的关系
雌激素缺乏,骨代谢转换亢进,但骨吸收超过骨形成,从而导致骨量减少;此时补充雌激素,骨量减少明显受到抑制。实验表明,雌激素缺乏,骨髓单核细胞分泌IL-1(interleukin-1)和间质细胞分泌IL-6都增多[8],可见IL-1和IL-6对骨吸收有促进作用。雌激素缺乏,局部细胞产生骨吸收性细胞因子与骨吸收亢进的关系见图3。


图3 细胞因子和雌激素对破骨细胞的形成及骨吸收的影响
Pacifici等人对绝经后骨质疏松患者末梢血中的单核细胞进行培养,48小时后从培养液中检测到IL-1的浓度明显高于对照组,对绝经后骨质疏松患者用雌激素治疗组中,用上述同样的方法检测IL-1水平,发现亢进的IL-1降低到对照组水平[9],说明单核细胞产生IL-1增多是绝经后骨质疏松的发病因素之一。Pioli和Matsuda在重复上述实验的基础上又进一步对切除卵巢大鼠体内给阻碍IL-1作用的IL-1ra(IL-1 receptor antagonist)后,与补充雌激素组相比,骨量减少情况及破骨细胞的骨吸收作用恢复到相同水平[10],表明由IL-1及IL-1诱导的物质是雌激素缺乏状态下的骨质疏松发病因素之一。Pacifici等人除发现IL-1对骨代谢的影响之外,还发现在培养的末梢血单核细胞中能产生TNF-α(tumor necrosis factor-α)和GM-CSF;切除卵巢的患者体内TNF -α和GM-CSF水平升高,接受雌激素治疗的患者TNF-α和GM-CSF恢复到正常水平[11]。在观察切除卵巢大鼠的骨髓细胞中破骨细胞的形成情况和骨吸收过程时,发现IL-1ra和TNF结合蛋白(TNF binding protein)对大鼠和对体外培养的大鼠破骨细胞的形成及骨吸收过程都有抑制作用,而抗IL-6抗体则无这种抑制作用[12],Gowen等人在培养末梢血单核细胞及成骨细胞时发现,卵巢切除组TNF-α的产生增多,加用雌激素补充治疗组TNF-α恢复到正常水平[13]。
, 百拇医药
Manolagas等人实验发现:17β-estradiol可抑制培养的骨髓间质细胞和成骨细胞产生IL-6;培养切除卵巢小鼠的骨髓细胞和成骨细胞与正常对照组相比IL-6水平增高,同时补充雌激素组中IL-6则处于正常水平。他进一步以切除卵巢小鼠为模型,观察切除卵巢后在体内和离体的破骨细胞形成情况时表明,体内使用IL-6抗体组与体内补充雌激素组同样都能抑制破骨细胞的形成[14]。还有实验表明对人工破坏IL-6基因的小鼠即使切除卵巢骨量也不减少[15]。在人工破坏特定基因的小鼠(破坏雌激素受体基因)中,即使不切除卵巢骨代谢转换也亢进。关于骨代谢的动态变化有待于进一步探讨。有人对Manolagas等人提出的关于17β-estradiol能抑制培养的成骨细胞中IL-6的产生的观点提出异议,指出即使抗IL-6抗体在体外能抑制破骨细胞的分化,但也不能抑制骨量减少[13],IL-6对骨吸收的促进作用仅限于富含低分化的破骨细胞前驱细胞的实验研究[16],即使是未分化的胎鼠骨,从小鼠和大鼠的骨组织培养中未发现对45Ca的游离有促进作用,所以IL-6的促进骨吸收作用尚有疑问。
, 百拇医药
大家知道在各种组织中IL-1、TNF、IL-6等细胞因子的产生和作用相互调节。骨代谢过程中,即使在雌激素水平降低的情况下,IL-1、TNF、IL-6等细胞因子对骨吸收的促进作用,在破骨细胞分化、活化的各个时期,都可能发挥着调节作用,此种情况下IL-6可能在分化的初期阶段发挥主要作用,IL-1在以后各阶段中发挥主要作用[11,16],也可能在同一时期内他们共存而发挥重要作用。
Miyaura等人观察用切除卵巢小鼠的骨髓液对培养中的骨组织的骨吸收促进作用时发现,消炎痛具有抑制骨髓液中骨吸收促进因子的作用,所以他推论,由于前列腺素(PG)的产生导致对骨吸收具有促进作用,他们在体内及体外进行了研究,雌激素缺乏后骨髓细胞产生的因子使IL-1α作用增强,诱导PG在骨中主要的合成酶Cyclooxygenase-2(cox-2)产生、合成增多,促进骨吸收[17],所以局部细胞因子的相互作用,全身激素和PG等的作用及这些因素相互联系的研究是阐明雌激素水平降低时,骨吸收亢进机制的重要内容。
, 百拇医药
4 雌激素受体基因与骨质疏松症
4.1 雌激素受体与骨代谢
人在发育期,骨密度(BMD)迅速持续增加,30~40岁达峰值,以后随年龄增加,骨量逐渐降低,特别是绝经后的几年间,骨量丢失速度最快,说明雌激素对维持骨量起着非常重要的作用。临床观察已经证实,绝经后,骨量丢失速度加快,补充雌激素后,骨量丢失受到有效的抑制。长期以来,人们一直认为雌激素对骨的作用是间接的,1988年Komm在成骨细胞上发现了雌激素受体,明确了雌激素对骨细胞的直接作用[4]。1990年Penlser又在破骨细胞上发现了雌激素受体,更加明确了雌激素与骨细胞的直接作用关系[18]。为了阐明雌激素在骨代谢中的作用机理,人们对骨细胞,成骨细胞和破骨细胞进行了多方面的研究取得了较大的进展,发现在成骨细胞中雌激素受体依赖于细胞周期[19]。还发现除骨细胞以外,雌激素对其他组织细胞,特别是产生细胞因子的细胞的作用,间接对绝经后骨代谢产生重要的影响。
, 百拇医药
4.2 从人工破坏特定基因小鼠和基因突变病例分析骨代谢中雌激素受体基因的意义
为了从根本上寻找雌激素在骨代谢调节中的作用机制,发生学和分子生物学的研究取得了重大突破。用同源重组的方法,抑制雌激素受体基因的表达,即所谓人工破坏特定基因。破坏雌激素受体基因与破坏其他类固醇受体基因(雄激素、PTH、肾上腺皮质激素等)相比较为困难,破坏雌激素受体基因宜在受精后极早期发现雌激素受体基因[20]。1993年Korach首先研制成功了人工破坏雌激素受体基因小鼠(ERKO)[21],他为了抑制雌激素受体基因,在雌激素受体基因第二外显子的终止密码子(stop codon)和聚腺苷酸序列(polyadenylation sequence)上同时插入新霉素耐性基因,这些基因经同源重组后,胚胎干细胞(embryonic stem cell,ES细胞)的获得率极低,1800个中才能获得2个,用该法制成了ERKO,ERKO不论是雄性还是雌性,其骨密度都比正常鼠低20%~25%。
, 百拇医药
1994年根据Korach的研究结果,Smith首次报道了雌激素受体基因突变的一男性病例[22],该患者,骨龄延迟(相当于15岁的骨发育),骨端线未闭,以骨发育障碍和高度的骨密度降低为特征,骨密度与15岁的骨密度相当,比正常青年骨峰值低2SD以下,说明雌激素不仅影响骨密度而且影响骨的发育;另一方面从该患者骨代谢指标看,骨形成和骨吸收都亢进,骨代谢处于高转换状态,从这一病例可以看出,即使是男性,骨的正常发育,特别是正常的矿化,雌激素的作用都是非常必要的,仅雄激素是不够的,显示了雌激素在骨代谢中的重要性。该患者的双亲突变基因是杂合的,是近亲结婚(堂兄妹),患者是纯合的,是常染色体隐性遗传形成。今后对以低骨密度、高身长,骨端线未闭为特征的有遗传背景的病例进行基因筛选,进一步阐明雌激素受体基因突变与骨质疏松的关系。
4.3 雌激素受体基因多态性与骨质疏松
骨质疏松的发病因素大体可分为遗传因素和环境因素两类。近年来,正在用分子生物学的方法研究各种疾病与遗传因素的关系,对骨质疏松的研究相对较晚。1994年Morrison等人对维生素D3受体基因的多态性进行了研究,基本上阐明了骨质疏松与遗传因素有关,引起了人们的重视。由于雌激素在骨代谢调节中的重要性,特别是前面所述的人工破坏雌激素受体基因小鼠(ERKO)研制的成功和雌激素受体基因突变病例的发现[23],进一步明确了雌激素受体基因在骨质疏松发病中的重要性。所以雌激素受体基因的多态性及其与骨质疏松的关系引起人们的广泛关注。
, http://www.100md.com
在雌激素受体结构基因及其上游有多种多态性(polymorphism)位点存在,其中2个限制性酶切片段长度多态(restriction fragment length polymorphism,RFLP)的确切酶切位点已被确定,在内含子1中,存在着是否能被限制性内切酶pvu Ⅱ或xbaⅠ切断的多态性[24],另一方面,在雌激素受体基因的上游约1kb的部位存在着T(thymine),A(adenine)的重复序列,其重复次数也有多态性[25](图4、图5)。

图4 雌激素受体基因的结构

图5 雌激素受体基因多态性的部位
对健康绝经后女性,检查其骨密度(DXA法),测其血/尿中骨代谢指标,从末梢血白细胞中提出DNA,根据RFLP进行雌激素受体多态性分析具有重要的理论意义。内含子1中,在pvuⅡ位点和xbaⅠ位点之间的DNA部分插入特异的引物,进行PCR (polymerase chain reaction)扩增,得到的DNA片段经过pvuⅡ或xbaⅠ酶切处理进行RFLP分类,被酶切断时命名为p或x,没有被酶切断时命名为P或X;或者两组组合分类;比较各组间年龄、身高、体重、骨密度及各种骨代谢生化指标有无显著差异。结果发现骨密度因基因型不同而有显著性变化,腰椎和全身骨密度PP型比pp型低,XX型比xx型低。
, 百拇医药
pvuⅡ和xbaⅠ酶切点之间大约只有50bp,能用两个RFLP组合分析或单膜标本分析,结果PPxx组比其他任何一组骨密度明显降低,阐明了雌激素受体基因的多态性和骨质疏松发病的关系[26]。
另外,关于雌激素受体基因上游的TATA序列重复(dinucleotide repeat)次数多态性的判定,有重复次数组和其他组在年龄、身高、体重、骨密度和在骨代谢生化指标上相比,重复12次结构组比其他组骨密度明显降低,尿中脱氧吡啶啉(deoxypyridinolines,D-pyr)增高[27]。
5 骨质疏松症的治疗和选择性雌激素受体调节剂
目前,国际上通用的治疗骨质疏松的药物有7种:A钙制剂,B:二膦酸盐,C:降钙素,D:活性维生素D,E:雌激素,F:异丙氧黄酮,G:维生素K2。这7类药物各有特点,治疗目的都是增加骨量,增大骨强度,预防骨折[28](图6)。

, http://www.100md.com
图6 骨质疏松的治疗
骨吸收比骨形成相对亢进,骨量则减少,所以治疗骨质疏松的第一步是抑制骨吸收。降钙素的生理作用是抑制骨吸收,但这种抑制作用并不持久,随后是这种抑制的脱逸现象,所以降钙素短期治疗效果好,长期治疗的效果和预防价值尚不确定。双膦酸盐类药物的主要药理作用为抑制骨吸收,其作用机制尚未完全阐明,为防治以破骨细胞性骨吸收为主的各种代谢性骨病及高转换型(以骨吸收为主)骨质疏松症的主要药物,目前主要推荐用于高转换型骨质疏松患者,特别是那些绝经早期有雌激素替代治疗禁忌症患者,如乳腺癌,子宫内膜癌或有癌症家族史的患者,对不愿意接受雌激素替代治疗的女性,双膦酸盐药物可作为首选。对类固醇性骨质疏松症,双膦酸盐列为首选药物。雌激素一方面能直接抑制骨吸收,另一方面通过抑制骨吸收性细胞因子而抑制骨吸收,除此之外对骨形成还具有促进作用。依普拉芬可通过增加骨细胞数量而增加骨形成和抑制前破骨细胞的募集和分化而抑制骨吸收。对绝经后骨质疏松,雌激素替代治疗与依普拉芬治疗的效果相同;但依普拉芬治疗的绝经后妇女中,无血清促性腺激素、雌激素或促乳素水平变化。推测依普拉芬和雌激素对骨细胞可能有着同样的作用机理,而无雌激素样作用。阻碍骨吸收的药物一般是阻止骨钙丢失,达到增加骨量的目的,雌激素能促进肠钙的吸收,减少尿钙的排出,防止钙缺乏引起的继发性甲状旁腺机能亢进,使骨对PTH感受性降低,促进降钙素的分泌等,间接地抑制因钙缺乏后,PTH分泌亢进,CT分泌不足引起的骨吸收亢进[29]。活性维生素D能促进肠钙的吸收,抑制继发性甲状旁腺机能亢进引起的骨吸收,雌激素能提高1α-羟化酶(1α-hydroxylaser)的活性,促进血中25-(OH)D3到活性维生素D3即1,25-(OH)2D3的转化,雌激素还作用于肠粘膜上1,25-(OH)2D3受体,提高对钙的吸收。维生素K2能直接抑制骨吸收,促进骨形成,还与维生素协同作用,促进肠钙的吸收。
, http://www.100md.com
由此可见,雌激素对骨质疏松症具有多重治疗作用,是治疗绝经后骨质疏松最有效的药物,也是任何其它防治骨质疏松的措施所无法比拟的。目前,已经肯定了雌激素替代治疗(ERT)在预防骨质疏松中的作用,并强调早期应用。但是长期应用雌激素的安全性(乳癌发生率及已患癌症复发率的影响),可耐受性(因子宫出血停药)等问题仍在研究之中,虽然与孕激素合用在理论上可能解决了该问题,但对于患者依然感到不安。最近,阻碍雌激素与其受体结合的物质,即选择性雌激素受体调节剂对骨有类似雌激素样作用的观点,引起了人们的关注,即具有拮抗和协同双重作用的功能。雌激素疗法,对骨质疏松虽有治疗作用,但是还有很多雌激素本身所无法克服的副反应,选择性雌激素受体调节剂就是在保留雌激素治疗作用的同时,去除在治疗过程中的副反应,尤其是拮抗雌激素对子宫内膜的刺激成为可能,对不同脏器的选择性(拮抗作用和协同作用)是选择性雌激素受体调节剂治疗骨质疏松的特点。他莫昔芬(Tamoxifen)是选择性雌激素受体调节剂的代表药物。用之治疗乳腺癌早已被广泛应用于临床,Tamoxifen同时具有拮抗和协同两个方面的作用,即同时具有抑制乳癌细胞增殖的拮抗作用和促进子宫内膜、骨、肝等细胞增殖,提高骨密度,降低胆固醇的协同作用。Tamoxifen对摘除卵巢大鼠的骨吸收和骨形成都有抑制作用,可以防止骨量减少[30],但在对子宫的刺激作用和癌变关系上成了难题,所以理想的对骨和心脑血管具有促进作用,对子宫内膜增生有抑制作用的药物Raloxifene被开发应用[31]。Raloxifen与雌激素受体结合后,对骨的作用具有较强的选择性,动物实验证明,对摘除卵巢大鼠给以Raloxifen治疗后,未见子宫内膜增厚,可明显地抑制胆固醇的升高和骨量减少。但是,Raloxifen对骨的作用与雌激素不同,Raloxifen只抑制骨吸收,不抑制制骨形成[32],认为Raloxifen与雌激素受体结合,发生了微小的变化。实际上,最近TGF-β3基因的发现,观察到了Raloxifen和雌激素的不同,Raloxifen能够促进TGF-β的产生,可是,在TGF-β3基因的上游没有雌激素和受体复合体能识别的DNA序列,而Raloxifene与雌激素受体结合后,通过与核蛋白结合能够识别TGF-β基因上的特定的DNA序列(raloxifene response element,RRE)[33],强烈地抑制破骨细胞的分化,Raloxifen对各脏器不同作用的机制正在研究中,现在,西方国家正在进行Raloxifen的临床试验。
, 百拇医药
以上从5个方面论述了雌激素在骨质疏松发病、病理机制、诊断、防治中的作用,说明雌激素水平降低是骨形成和骨吸收平衡失调的首要因素,由于在成骨细胞和破骨细胞上有雌激素受体的存在,阐明了雌激素对成骨细胞和破骨细胞直接作用的机制。对雌激素水平降低时骨再建过程中为什么骨吸收占优势,这种不平衡性为什么在补充雌激素治疗后可恢复正常平衡状态等问题的研究提供了理论依据。雌激素与细胞因子的关系,在最近的骨代谢研究领域倍受学者们的重视,特别是IL-1、TNF、IL-6之间的关系的研究和讨论,成为该领域研究的主要内容,可是,大部分将细胞因子各自以一种单一的因素加以研究,而绝经后骨质疏松的发病是由于包括细胞因子在内的各种因素之间的复杂作用结果所致,所以从整体和局部出发,分析各因子作用的联系是非常重要的。在这些细胞因子的基因上未发现雌激素的应答部位,可知雌激素间接地调节细胞因子的增减。雌激素受体基因的多态性分析从遗传角度早期筛选骨质疏松的高危人群,为在临床进行基因诊断和治疗提供理论依据。雌激素对骨质疏松的治疗被一致认定。目前开发的选择性雌激素受体调节剂吸取了雌激素优势,避免了劣势,更具有选择性。目前,该药正在临床试验阶段。希望该药是理想的治疗骨质疏松症的药物。雌激素对骨代谢的调节还有很多问题不明确,希望今后从基础和临床研究有更大的突破。
, 百拇医药
参考文献
1 Albright F.Postmenopausal osteoporosis.JAMA,1941,116:2465-2474.
2 李恩.原发性骨质疏松发病的相关因素.中国骨质疏松杂志,1997,3(2):1.
3 Gray TK.13 β-esdtradiol acts directly on the clonal osteoblast cell line UMR 160.Proc Natl Acad Sci USA,1987,84:6267-6271.
4 Komm BS.Estrogen binding receptor mRNA and biologic response in osteoblast- like osteosarcoma cells.Science,1988,241:81-84.
, http://www.100md.com
5 Oursle MJ,Osdoby P,Pyfferoen J,et al.Avian osteoclast as estrogen target cells.Proc Natl Acad Sci USA,1991,88:6613-6617.
6 Mano H,Yuasa T,Kameda T,et al.Mammalian mature osteoclast as estrogen target cells.Biochem Biophys Res Commun,1996,223:637-642.
7 Takano-Yamamoto T,Rodan GA.Direct effects of 17 β-estradiol on trabecular bone in ovariectomized rat.Proc Natl Acad Sci USA,1989,86:2172.
8 Ralston SH.Analysis of gene expression in human bone biopsies by polymerase chain reaction:evidence of enhanced cytokine expression in postmenopausal osteoporosis.J Bone Miner Res,1994,9:883.
, 百拇医药
9 Pacifici R.Is there a causal role of IL-Ⅰ in postmenopausal bone loss?Calcif Tissue Int,1992,50:295.
10 Kimble RB,Vannice JL,Bloedow DC, et al.Interleukin-1 receptor antagonist decreases bone loss and bone resorption in ovariectomized rats.J Clin Invest, 1994,93:1959.
11 Pacifici R,Brown C,Puscheck E,et al.The effects of surgical menopause and estrogen replacement on cytokine release from human blood monocytes.Proc Natl Acad Sci USA,1991,88:5134.
, 百拇医药
12 Kitazawa R,Kimble RB,Vannice JL,et al.Interkeukin-1 receptor antagonist and tumor necrosis factor binding protein decrease osteoclast formation and bone resorption in ovariectomized mice.J Clin Invest,1994,94:2397.
13 Ralston SH,Russel RGG,Gowen M.Estrogen inhibits release of tumor necrosis factor from peripheral blood mononuclear cells in postmenopausal women.J Bone Miner Res,1990,5:983.
14 Jika RL,Hangoc G,Girasole G,et al.Increased osteoclast development after estrogen loss:mediation by interleukin-6.Science,1992,257:88.
, http://www.100md.com
15 Poli V,Balena R,Fattori E,et al.Interleukin-6 deficient mice are protected from bone loss caused by estrogen depletion.EMBO J,1994,13:1189.
16 Roodman GD.Interleukin-6:an osteoporotic factor? J Bone Miner Res,1992,7:475.
17 Kawaguchi H,Pilbeam CC,Vargas SJ, et al.Ovariectomy enhances and estrogen replacement inhibits the activity of marrow factors which stimulate prostaglandin production in cultured mouse calvariae.J Clin Invest,1995,96:539-548.
, 百拇医药
18 Pensler JM,Radosevich JA,Higbee R,et al.Osteoclast isolated from membranous bone in children exhibited nuclear estrogen and progesterone receptors.J Bone Miner Res,1990,5:797-802.
19 Ikegami A,Inoue S,Hosoi T,et al.Cell cycle dependent expression and function of estrogen receptor in human osteoblastic cells.Endocrinology,1994,135:782-789.
20 Hou Q,Gorski J.Estrogen receptor and progesterone receptor genes are expressed differentially in mouse embryos during preimplantation development.Proc Natl Acad Sci USA,1993,90:9460-9464.
, http://www.100md.com
21 Lubahn DB,Moyer JS,Golding TS, et al.Alteration of reproductive function but not prenatal sexual development after insertional disruption of the mouse estrogen receptor gene.Proc Natl Acad Sci USA,1993,90:11162-11166.
22 Smith EP,Boyd J,Frank GR, et al.Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man.N Engl Med,1994,331:1056-1061.
23 Morrison NA,Qi JC,Tokita A,et al.Prediction of bone density from vitamin D receptor alleles.Nature,1994,367:284-287.
, 百拇医药
24 Piva R,Gambari R,Zorzato F,et al.Analysis of upstream sequences of the human estrogen receptor gene.Biochem Biophys Res Commun,1993,183:996-1002.
25 Yaich L,Dupont WD,Cavener DR, et al.Analysis of the Pvu Ⅱ restriction fragment-length polymorphism and exon structure of the estrogen receptor gene in breast cancer and peripheral blood.Cancer Res,1992,52:77-83.
26 Kobayashi S,Inoue S,Hosoi T,et al.Association of bone mineral density with polymorphism of the estrogen receptor gene.J Bone Miner Res,1996,11:306-311.
, http://www.100md.com
27 Sano M,Inoue S,Hosoi T,et al.Association of estrogen receptor dinucleotid repeat polymorphism with osteoporosis.Biochem Biophys Res Commun,1995,217:378-383.
28 Fujita T.Clinical guidelines for the treatment of osteoporosis in Japan.Calcif Tissue Int,1996,59(Suppl):s 34-37.
29 Fujita T.Vitamin D in the treatment of osteoporosis.Proc Soc Exp Biol Med, 1992,199:394-399.
30 Turner RT.Tamoxifen prevents the skeletal effects of ovarian hormone difficiency in rats.J Bone Miner Res,1987,2:449-456.
, 百拇医药
31 Black LJ.Raloxifene(LY139481 HCl) prevents bone loss and reduces serum cholesterol without causing uterine hypertrophy in ovariectomized rats.J Clin Invest,1994,93:63-69.
32 Evans G.The effects of raloxifene on tibia histomorphometry in ovariectomized rats.Endocrinology,1994,134:2283-2288.
33 Yang NN,Venugopalan M,Hardikar S,et al.Identification of an estrogen response element activated by metabolites of 17 β-estradiol and raloxifene.Science,1996, 273:1222-1225., 百拇医药