唾液富组蛋白的分离纯化及抗菌活性观察
作者:罗海燕 黄 宁 杨美薷 唐 彬 吴 琦 王伯瑶
单位:罗海燕 华西医科大学口腔医学院 (现在北京医科大学口腔医学院病理研究室,杨;美薷) 610041;黄 宁,唐 彬,吴 琦,王伯瑶 华西医科大学感染与免疫研究室
关键词:富组蛋白;聚丙烯酰胺凝胶电泳;抗菌活性;琼脂糖弥散抗菌实验
华西口腔医学杂志990310 摘要 目的:探索用电泳技术分离纯化腮腺唾液富组蛋白(HRPs),并观察其抗菌活性。方法:采用制备性酸性尿素聚丙烯酰胺凝胶电泳(AU-PAGE),从健康成人刺激性腮腺唾液中分离纯化3种主要富组蛋白(HRP-1、HRP-3、HRP-5);通过琼脂糖弥散抗菌实验,观察它们对变形链球菌、金黄色葡萄球菌、大肠杆菌、绿脓杆菌的抗菌活性。结果:分离纯化出的3种主要HRPs经AU-PAGE及Tricine-SDS-PAGE分析,均为单一的蛋白区带,分子量3~5 kD。3种主要HRPs对变形链球菌和金黄色葡萄球菌均有抗菌活性;HRP-3和HRP-5对大肠杆菌和绿脓杆菌有明显抗菌活性。结论:采用制备性AU-PAGE来分离HRPs,具有分辨率高、操作简便、纯化效果好等特点。HRPs为一组内源性广谱抗菌活性多肽,对革兰氏阳性和革兰氏阴性菌,包括一些抗生素耐药菌株,都有抗菌作用,可能是口腔抗微生物感染的重要分子,与口腔乃至全身健康密切相关。
, http://www.100md.com
Isolation, Purification and Antibacterial Activities of Salivary Histidine-rich Polypeptides
Luo Haiyan, Yang Meiru
College of Stomatology, West China University of Medical Sciences
Huang Ning, Tang Bin, Wu Qi, et al
aboratory of Infection and Immunology, West China University of Medical Sciences
Abstract Objective:To isolate and purify salivary histidine-rich-polypeptides (HRPs) and observe their antibacterial activities.Methods: By using of preparative acid urea polyacrylamide gel electrophoresis (AU-PAGE), three major HRPs(HRP-1, HRP-3 and HRP-5)were purified from parotid saliva collected from healthy adults. Their antibacterial activities were tested in the ultrasensitive antibacterial assay, named radial diffusion assay.Results: Each fraction of the three purified HRPs appeared as a single protein zone both in AU-PAGE and Tricine-SDS-PAGE. Their molecular weights are 3~5 kD as determined by Tricine-SDS-PAGE. All the three major HRPs showed potent bactericidal effects on Streptococcus mutans MT6R and Staphylococcus aureas ATCC25923. As to Escherichia coli ML-35P and Pseudomonas aeruginosa ATCC27853, HRP-3 and HRP-5 also demonstrated significant antibacterial activities, whereas HRP-1 did not show any inhibitory effects on the viability of them.Conclusion: The above results suggested that the method of preparative AU-PAGE we used in this study has the benefits of high resolution, simple manipulation and perfect results of purification. HRPs are important components to prevent oral tissue from bacterial infections, therefore play a potent role in the maintenance of the oral health.
, 百拇医药
Key words:histidine-rich-polypeptides(HRPs) polyacrylamide gel electrophoresis antibacterial activities radial diffusion assay
富组蛋白(histatins或histidine-rich-polypeptides,HRPs)是一族富含组氨酸的小分子、阳离子同源多肽,仅存在于灵长类动物腮腺及颌下腺分泌物中,现已分离出至少12种人HRPs(HRP1~12)。其中HRP-1、HRP-3、HRP-5为主要成分,称为主要富组蛋白。现有研究表明:HRPs具有多种活跃的生物学功能,其抗微生物作用尤为重要,如抑制、杀灭变形链球菌和白色念珠菌等。HRPs可能作为一组内源性抗菌肽,参与宿主非免疫防御系统,与多种口腔感染性疾病密切相关[1,2]。尽管近年来国外对HRPs研究较为活跃,但国内尚未见将HRPs各组分分纯制备,并分别研究其生物活性的报道。本实验经制备性酸性尿素聚丙烯酰胺凝胶电泳(acid urea polyacrylamide gel electrophoresis,AU-PAGE),从健康成人刺激性腮腺唾液中分离纯化3种主要富组蛋白,采用琼脂糖弥散抗菌实验,分别测定它们对变形链球菌这一主要致龋菌以及金黄色葡萄球菌等化脓性感染致病菌的抗菌活性。
, 百拇医药
1 材料和方法
1.1 试剂
聚丙烯酰胺凝胶电泳试剂及蛋白质分子量标准品为Gibco-BRL产品,鸡蛋白溶菌酶、牛血清白蛋白为Sigma产品,营养肉汤粉为卫生部上海生物制品研究所产品,兔中性粒细胞防御素(NP1)由华西医科大学感染与免疫研究室提供,其它试剂为国产分析纯。
1.2 腮腺唾液收集
腮腺唾液共100 ml采自4位健康成人(年龄24~32岁,口腔健康,无全身疾病,3个月内未服用抗菌药物)。在受试者腮腺导管开口处放置一金属收集器,舌尖处以5%枸橼酸液刺激唾液分泌。将收集到的新鲜唾液置于冰水浴中,收集完成后立即加入10%等体积乙酸,混匀,100℃水浴加热10 min,冷却后于4℃以5%乙酸透析48 h,10000 r/min离心10 min,取上清冻干。
, 百拇医药
1.3 HRPs制备
1.3.1 制备电泳 酸性尿素聚丙烯酰胺凝胶电泳(AU-PAGE)参照Panyim等[3]的方法并作部分修改。所用电泳装置为DYY-Ⅲ28型夹芯式垂直电泳槽(北京六一仪器厂)。12.5%的凝胶(3 mm×100 mm×145 mm)内含5 mol/L尿素,5.4%乙酸,电极缓冲液为5%乙酸,于150 V恒压预电泳4 h。将冻干样品溶于含3 mol/L尿素、5%乙酸的样品缓冲液中,加样后于150 V恒压电泳3 h。电泳后,将凝胶边缘纵切下一条进行考马斯亮蓝R250染色,可见泳动于最前方的成对出现的6个区带(即HRP1~6),以之为标准,分别切下板状凝胶上的HRP-1、HRP-3、HRP-5三条区带。
1.3.2 洗脱电泳 将切下的凝胶条分别置于分子截留量为3 kD的透析袋中,袋内含5%乙酸。透析袋置水平电泳槽内,电极缓冲液为5%乙酸,150 V恒压电泳90 min。收集袋内液体,以蒸溜水透析24 h,冻干后各溶于0.01%乙酸中。
, 百拇医药
1.4 HRPs的生化分析
1.4.1 AU-PAGE电泳分析 同上述制备性AU-PAGE,但所用电泳装置为mini-protein Ⅱ电泳系统(Bio-rad产品),胶厚0.75 mm,于150 V预电泳90 min,加样后150 V电泳60 min,考马斯亮蓝R250染色。
1.4.2 分子量测定 Tricine-SDS-PAGE参照Schagger等[4]的方法进行,浓缩胶浓度为4%,分离胶浓度为16.5%,于100 V恒压电泳3.5 h,考马斯亮蓝R250染色。
1.4.3 蛋白质含量测定 采用考马斯亮蓝G250微板法,以牛血清白蛋白(BSA)作标准。
1.5 抗菌实验
1.5.1 菌株 变形链球菌(MT6R)、金黄色葡萄球菌(ATCC25923)、大肠杆菌(ML-35P)和绿脓杆菌(ATCC27853)复苏后37℃普通孵箱培养过夜,再转种于含2.2%营养肉汤粉的液体培养基中振摇3 h。比浊管法测定细菌浓度。
, 百拇医药
1.5.2 琼脂糖弥散抗菌实验 参照Lehrer等[5]建立的方法进行。在培养皿上倾倒一层底层琼脂(10 ml)。底层琼脂含1%琼脂糖,0.022%营养肉汤粉,10 mmol/L PBS(pH7.4),及对数生长期细菌(1.0×106/ml)。在底层琼脂上打直径3 mm的圆孔,每孔加入5 μl HRPs样品,浓度分别为:25、50、100、200、500 μg/ml。200 μg/ml NP1作为阳性对照,0.01%乙酸作为阴性对照。倒置放入孵箱内孵育3 h后,在底层琼脂上覆盖一层2×营养琼脂,过夜孵育,测量抗菌环直径。
2 结 果
唾液蛋白冻干品经AU-PAGE分离后,显示有6条成对的区带泳动在凝胶的最前端(靠阴极端),其迁移距离均超过了溶菌酶;从阳极端起,分别为HRP1~6,其中HRP-1、HRP-3、HRP-5的区带较宽。经纯化后的3条区带的组分再用AU-PAGE和Tricine-SDS-PAGE分析,结果每个组分在两种凝胶上都呈单一区带,表明纯化效果良好。由图2还可看出,3个组分的分子量均在3~5 kD之间。蛋白含量测定结果显示,从100 ml刺激性腮腺唾液中得到HRP-1约70 μg,HRP-3约43 μg,HRP-5约44 μg(图1,2)。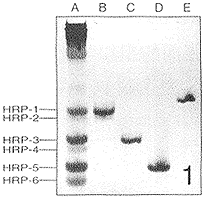
, 百拇医药
图 1 唾液蛋白及分纯制备的3种主要HRPs的AU-PAGE A 腮腺唾液蛋白,B HRP-1,C HRP-3,D HRP-5,E 鸡蛋白溶菌酶
图 2 唾液蛋白及分纯制备的3种主要HRPs的Tricine-SDS-PAGE A HRP-5,B HRP-3,C HRP-1,D蛋白质分子量标准,6条带的分子量从上至下分别为43.0,29.0,18.4,14.3,6.2和3.0 kD,E 腮腺唾液蛋白
3种主要HRPs在浓度为25 μg/ml时,对G+的变形链球菌和金黄色葡萄球菌即有明显抗菌环出现,且随浓度增高而增大。3种HRPs中,HRP-3和HRP-5的抗菌活性强于HRP-1。HRP-1在浓度达500 μg/ml时对G-的大肠杆菌和绿脓杆菌仍未显示抗菌活性。而HRP-3及HRP-5在浓度为25 μg/ml时对大肠杆菌即显示抗菌活性;而对绿脓杆菌在浓度达50 μg/ml时才开始有抗菌环出现;抗菌活性均随浓度增高而增大(图3,4)。
, 百拇医药
图 3 3种主要HRPs对变形链球菌的抗菌活性
A 25μg/m 1,B 50μg/m 1, C 100μ/ml,D 200μ/ml, E 500μg/ml
图 4 3种主要HRPs对大肠杆菌的抗菌活性
A 25μg/m 1,B 50μg/m 1, C 100μ/ml,D 200μ/ml, E 500μg/ml
HRP-1、HRP-3、HRP-5在不同浓度下对不同细菌产生的抗菌环直径不同。可以看出,HRPs的抗菌活性具有剂量依赖性,且不同细菌对HRPs的敏感性不同,表现为变形链球菌大于金黄色葡萄球菌大于大肠杆菌大于绿脓杆菌。NP1(200 μg/ml)作为阳性对照,对5种实验菌株均产生明显抗菌活性,加入0.01%乙酸的阴性对照孔均没有抗菌环出现(图5~7)。
, http://www.100md.com
图5 HRP-1的抗菌活性
图6 HRP-3的抗菌活性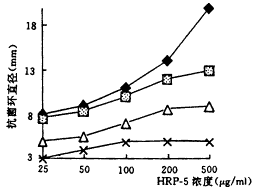
图7 HRP-5的抗菌活性
3 讨 论
根据Oppenheim等[6]所作的分析结果,HRPs为一组氨基酸序列相似的同源多肽,其3种主要成分HRP-1、HRP-3、HRP-5的分子量分别为4929 D、4063 D和3037 D,它们分别含38、32、24个氨基酸残基(其中约48%为碱性氨基酸),且都在相同的残基位上含有7个组氨酸(histidine)。该作者用阳离子PAGE分析,显示HRPs呈3对区带,分别为HRP-1和HRP-2、HRP-3和HRP-4、HRP-5和HRP-6,而HRP-1、HRP-3、HRP-5的区带较宽。作者纯化的HRPs经AU-PAGE分析结果与之一致,且不含其它杂蛋白区带;检测HRPs分子量为3~5 kD,与上述作者的报道相符合。以上结果说明,这些在分子组成上相差甚微的多肽组分在本实验恰当的电泳条件下,得到满意的分离。酸性尿素聚丙烯酰胺凝胶电泳用于分离阳离子蛋白,具有分辨率高、操作简便、纯化效果好等特点[7],对HRPs的分纯制备不失为一种简便实用的方法。但是采用这种提纯方法,HRPs的获得率较低。分析其原因,除了在样品处理过程中的丢失外,可能在洗脱电泳时电场力的作用下,属于线性分子的HRPs大量穿过透析袋的微孔,泳动到缓冲液中。因此,本实验所采用的方法还有待改进。
, 百拇医药
本实验采用Lehrer等建立的微量而敏感的琼脂糖弥散法研究HRPs的抗菌活性,结果显示HRPs对变形链球菌具有较强的抗菌活性。3种主要HRPs中,HRP-3及HRP-5的抗变形链球菌活性强于HRP-1,表明前二者是HRPs中的主要抗变形链球菌成分,这与国外学者的报道相一致[8]。且HRPs对变形链球菌的抗菌活性大于其它菌株,这可能是由于变形链球菌代谢产酸,而在低pH环境下,HRPs的杀菌活性增强[9]。这充分说明HRPs作为仅存在于唾液中的抗菌活性多肽,可能在宿主抗龋机制中发挥重要作用。
1997年,吴琦等[10]报道了人腮腺唾液对一些常见的化脓性感染致病菌的抗菌活性,并证实其中的有效抗菌分子主要是HRPs。本实验将3种主要HRPs分离纯化,进一步定量测试它们的抗菌活性,结果发现:HRP-1对金黄色葡萄球菌有抗菌活性,对大肠杆菌和绿脓杆菌无抗菌活性;而HRP-3及HRP-5对上述3株细菌均有明显抗菌活性。各种细菌对HRPs的敏感性为:金黄色葡萄球菌大于大肠杆菌大于绿脓杆菌。值得一提的是,本实验所采用的大肠杆菌ML-35 P株,是氨苄青霉素耐药株,但对HRPs这种内源性的抗菌肽却很敏感。
, 百拇医药
Dabbagh等[11]曾报道健康人全唾液中HRPs的含量为3~167 μg/ml,而本实验中HRPs发挥抗菌作用的浓度在口腔中的生理浓度范围之内。以上结果说明HRPs为一组内源性广谱抗菌活性多肽,对G+和G-菌,包括一些抗生素耐药株,都有抗菌作用,可能是宿主对抗口腔微生物感染的重要分子,在预防口腔内伤口化脓性感染及消化道感染方面也可能有一定意义。
从以上结果还可发现,HRPs的不同组分对不同属性的细菌具有不同的抗菌活性。HRP-1对G+的变形链球菌和金黄色葡萄球菌有抗菌活性,而对G-的大肠杆菌和绿脓杆菌无抗菌活性。HRP-3和HRP-5对上述4种细菌均有抗菌作用。因此,对于其抗菌作用机理,还值得进一步研究。
本实验为国家自然科学基金资助项目(编号 39670305)
参考文献
, http://www.100md.com
1 赵心臣综述.唾液富组蛋白.国外医学口腔医学分册,1995,22(1):24~27
2 胡云明综述.唾液富组蛋白在口腔疾病中的作用.国外医学口腔医学分册,1995,22(4):200~203
3 Panyim S, Chalkley R. High resolution acrylamide gel electrophoresis of histon. Arch Biochem Biophys, 1969, 130(1):337~346
4 Schagger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem, 1987, 166(2):368~379
, http://www.100md.com
5 Lehrer RI, Rosenman M,Harwig SS,et al.Ultrasensitive assays for endogenous antimicrobial peptides.J Immunol Meth,1991,137(2):167~173
6 Oppenheim FG, Xu T, McMillan FM, et al. Histatins, a novel family of histidine-rich proteins in human parotid secretion. isolation, characterization, primary structure and fungistatic effects on Candida albicans. J Biol Chem, 1988, 263(16):7472~7477
7 吴 琦,王伯瑶,王偕秀,等.兔中性粒细胞抗菌肽的纯化和鉴定.华西医科大学学报,1990,21(2):59~62
, 百拇医药
8 Payne JB, Iacono VJ, Crawford IT, et al. Selective effects of histidine-rich polypeptides on the aggregation and viability of Streptococcus mutans and Streptococcus sanguis. Oral Microbiol Immunol, 1991, 6(3):169~176
9 Xu T, Levitz SM, Diamond RD, et al. Anticandidal activity of major human salivary HRPs.Infect Immun, 1991, 59(8):2549~2554
10 吴 琦,杨美薷,钟德钰,等.腮腺唾液富组蛋白抗菌活性的研究.中华口腔医学杂志,1997,32(6):356~359
11 Dabbagh WK, Xu T, Oppenheim FG.Densitometric determination of histatin concentration in saliva. J Dent Res, 1993, 72(AADR Abstracts):322
(1998-07-28收稿,1999-04-17修回), 百拇医药
单位:罗海燕 华西医科大学口腔医学院 (现在北京医科大学口腔医学院病理研究室,杨;美薷) 610041;黄 宁,唐 彬,吴 琦,王伯瑶 华西医科大学感染与免疫研究室
关键词:富组蛋白;聚丙烯酰胺凝胶电泳;抗菌活性;琼脂糖弥散抗菌实验
华西口腔医学杂志990310 摘要 目的:探索用电泳技术分离纯化腮腺唾液富组蛋白(HRPs),并观察其抗菌活性。方法:采用制备性酸性尿素聚丙烯酰胺凝胶电泳(AU-PAGE),从健康成人刺激性腮腺唾液中分离纯化3种主要富组蛋白(HRP-1、HRP-3、HRP-5);通过琼脂糖弥散抗菌实验,观察它们对变形链球菌、金黄色葡萄球菌、大肠杆菌、绿脓杆菌的抗菌活性。结果:分离纯化出的3种主要HRPs经AU-PAGE及Tricine-SDS-PAGE分析,均为单一的蛋白区带,分子量3~5 kD。3种主要HRPs对变形链球菌和金黄色葡萄球菌均有抗菌活性;HRP-3和HRP-5对大肠杆菌和绿脓杆菌有明显抗菌活性。结论:采用制备性AU-PAGE来分离HRPs,具有分辨率高、操作简便、纯化效果好等特点。HRPs为一组内源性广谱抗菌活性多肽,对革兰氏阳性和革兰氏阴性菌,包括一些抗生素耐药菌株,都有抗菌作用,可能是口腔抗微生物感染的重要分子,与口腔乃至全身健康密切相关。
, http://www.100md.com
Isolation, Purification and Antibacterial Activities of Salivary Histidine-rich Polypeptides
Luo Haiyan, Yang Meiru
College of Stomatology, West China University of Medical Sciences
Huang Ning, Tang Bin, Wu Qi, et al
aboratory of Infection and Immunology, West China University of Medical Sciences
Abstract Objective:To isolate and purify salivary histidine-rich-polypeptides (HRPs) and observe their antibacterial activities.Methods: By using of preparative acid urea polyacrylamide gel electrophoresis (AU-PAGE), three major HRPs(HRP-1, HRP-3 and HRP-5)were purified from parotid saliva collected from healthy adults. Their antibacterial activities were tested in the ultrasensitive antibacterial assay, named radial diffusion assay.Results: Each fraction of the three purified HRPs appeared as a single protein zone both in AU-PAGE and Tricine-SDS-PAGE. Their molecular weights are 3~5 kD as determined by Tricine-SDS-PAGE. All the three major HRPs showed potent bactericidal effects on Streptococcus mutans MT6R and Staphylococcus aureas ATCC25923. As to Escherichia coli ML-35P and Pseudomonas aeruginosa ATCC27853, HRP-3 and HRP-5 also demonstrated significant antibacterial activities, whereas HRP-1 did not show any inhibitory effects on the viability of them.Conclusion: The above results suggested that the method of preparative AU-PAGE we used in this study has the benefits of high resolution, simple manipulation and perfect results of purification. HRPs are important components to prevent oral tissue from bacterial infections, therefore play a potent role in the maintenance of the oral health.
, 百拇医药
Key words:histidine-rich-polypeptides(HRPs) polyacrylamide gel electrophoresis antibacterial activities radial diffusion assay
富组蛋白(histatins或histidine-rich-polypeptides,HRPs)是一族富含组氨酸的小分子、阳离子同源多肽,仅存在于灵长类动物腮腺及颌下腺分泌物中,现已分离出至少12种人HRPs(HRP1~12)。其中HRP-1、HRP-3、HRP-5为主要成分,称为主要富组蛋白。现有研究表明:HRPs具有多种活跃的生物学功能,其抗微生物作用尤为重要,如抑制、杀灭变形链球菌和白色念珠菌等。HRPs可能作为一组内源性抗菌肽,参与宿主非免疫防御系统,与多种口腔感染性疾病密切相关[1,2]。尽管近年来国外对HRPs研究较为活跃,但国内尚未见将HRPs各组分分纯制备,并分别研究其生物活性的报道。本实验经制备性酸性尿素聚丙烯酰胺凝胶电泳(acid urea polyacrylamide gel electrophoresis,AU-PAGE),从健康成人刺激性腮腺唾液中分离纯化3种主要富组蛋白,采用琼脂糖弥散抗菌实验,分别测定它们对变形链球菌这一主要致龋菌以及金黄色葡萄球菌等化脓性感染致病菌的抗菌活性。
, 百拇医药
1 材料和方法
1.1 试剂
聚丙烯酰胺凝胶电泳试剂及蛋白质分子量标准品为Gibco-BRL产品,鸡蛋白溶菌酶、牛血清白蛋白为Sigma产品,营养肉汤粉为卫生部上海生物制品研究所产品,兔中性粒细胞防御素(NP1)由华西医科大学感染与免疫研究室提供,其它试剂为国产分析纯。
1.2 腮腺唾液收集
腮腺唾液共100 ml采自4位健康成人(年龄24~32岁,口腔健康,无全身疾病,3个月内未服用抗菌药物)。在受试者腮腺导管开口处放置一金属收集器,舌尖处以5%枸橼酸液刺激唾液分泌。将收集到的新鲜唾液置于冰水浴中,收集完成后立即加入10%等体积乙酸,混匀,100℃水浴加热10 min,冷却后于4℃以5%乙酸透析48 h,10000 r/min离心10 min,取上清冻干。
, 百拇医药
1.3 HRPs制备
1.3.1 制备电泳 酸性尿素聚丙烯酰胺凝胶电泳(AU-PAGE)参照Panyim等[3]的方法并作部分修改。所用电泳装置为DYY-Ⅲ28型夹芯式垂直电泳槽(北京六一仪器厂)。12.5%的凝胶(3 mm×100 mm×145 mm)内含5 mol/L尿素,5.4%乙酸,电极缓冲液为5%乙酸,于150 V恒压预电泳4 h。将冻干样品溶于含3 mol/L尿素、5%乙酸的样品缓冲液中,加样后于150 V恒压电泳3 h。电泳后,将凝胶边缘纵切下一条进行考马斯亮蓝R250染色,可见泳动于最前方的成对出现的6个区带(即HRP1~6),以之为标准,分别切下板状凝胶上的HRP-1、HRP-3、HRP-5三条区带。
1.3.2 洗脱电泳 将切下的凝胶条分别置于分子截留量为3 kD的透析袋中,袋内含5%乙酸。透析袋置水平电泳槽内,电极缓冲液为5%乙酸,150 V恒压电泳90 min。收集袋内液体,以蒸溜水透析24 h,冻干后各溶于0.01%乙酸中。
, 百拇医药
1.4 HRPs的生化分析
1.4.1 AU-PAGE电泳分析 同上述制备性AU-PAGE,但所用电泳装置为mini-protein Ⅱ电泳系统(Bio-rad产品),胶厚0.75 mm,于150 V预电泳90 min,加样后150 V电泳60 min,考马斯亮蓝R250染色。
1.4.2 分子量测定 Tricine-SDS-PAGE参照Schagger等[4]的方法进行,浓缩胶浓度为4%,分离胶浓度为16.5%,于100 V恒压电泳3.5 h,考马斯亮蓝R250染色。
1.4.3 蛋白质含量测定 采用考马斯亮蓝G250微板法,以牛血清白蛋白(BSA)作标准。
1.5 抗菌实验
1.5.1 菌株 变形链球菌(MT6R)、金黄色葡萄球菌(ATCC25923)、大肠杆菌(ML-35P)和绿脓杆菌(ATCC27853)复苏后37℃普通孵箱培养过夜,再转种于含2.2%营养肉汤粉的液体培养基中振摇3 h。比浊管法测定细菌浓度。
, 百拇医药
1.5.2 琼脂糖弥散抗菌实验 参照Lehrer等[5]建立的方法进行。在培养皿上倾倒一层底层琼脂(10 ml)。底层琼脂含1%琼脂糖,0.022%营养肉汤粉,10 mmol/L PBS(pH7.4),及对数生长期细菌(1.0×106/ml)。在底层琼脂上打直径3 mm的圆孔,每孔加入5 μl HRPs样品,浓度分别为:25、50、100、200、500 μg/ml。200 μg/ml NP1作为阳性对照,0.01%乙酸作为阴性对照。倒置放入孵箱内孵育3 h后,在底层琼脂上覆盖一层2×营养琼脂,过夜孵育,测量抗菌环直径。
2 结 果
唾液蛋白冻干品经AU-PAGE分离后,显示有6条成对的区带泳动在凝胶的最前端(靠阴极端),其迁移距离均超过了溶菌酶;从阳极端起,分别为HRP1~6,其中HRP-1、HRP-3、HRP-5的区带较宽。经纯化后的3条区带的组分再用AU-PAGE和Tricine-SDS-PAGE分析,结果每个组分在两种凝胶上都呈单一区带,表明纯化效果良好。由图2还可看出,3个组分的分子量均在3~5 kD之间。蛋白含量测定结果显示,从100 ml刺激性腮腺唾液中得到HRP-1约70 μg,HRP-3约43 μg,HRP-5约44 μg(图1,2)。

, 百拇医药
图 1 唾液蛋白及分纯制备的3种主要HRPs的AU-PAGE A 腮腺唾液蛋白,B HRP-1,C HRP-3,D HRP-5,E 鸡蛋白溶菌酶

图 2 唾液蛋白及分纯制备的3种主要HRPs的Tricine-SDS-PAGE A HRP-5,B HRP-3,C HRP-1,D蛋白质分子量标准,6条带的分子量从上至下分别为43.0,29.0,18.4,14.3,6.2和3.0 kD,E 腮腺唾液蛋白
3种主要HRPs在浓度为25 μg/ml时,对G+的变形链球菌和金黄色葡萄球菌即有明显抗菌环出现,且随浓度增高而增大。3种HRPs中,HRP-3和HRP-5的抗菌活性强于HRP-1。HRP-1在浓度达500 μg/ml时对G-的大肠杆菌和绿脓杆菌仍未显示抗菌活性。而HRP-3及HRP-5在浓度为25 μg/ml时对大肠杆菌即显示抗菌活性;而对绿脓杆菌在浓度达50 μg/ml时才开始有抗菌环出现;抗菌活性均随浓度增高而增大(图3,4)。

, 百拇医药
图 3 3种主要HRPs对变形链球菌的抗菌活性
A 25μg/m 1,B 50μg/m 1, C 100μ/ml,D 200μ/ml, E 500μg/ml

图 4 3种主要HRPs对大肠杆菌的抗菌活性
A 25μg/m 1,B 50μg/m 1, C 100μ/ml,D 200μ/ml, E 500μg/ml
HRP-1、HRP-3、HRP-5在不同浓度下对不同细菌产生的抗菌环直径不同。可以看出,HRPs的抗菌活性具有剂量依赖性,且不同细菌对HRPs的敏感性不同,表现为变形链球菌大于金黄色葡萄球菌大于大肠杆菌大于绿脓杆菌。NP1(200 μg/ml)作为阳性对照,对5种实验菌株均产生明显抗菌活性,加入0.01%乙酸的阴性对照孔均没有抗菌环出现(图5~7)。

, http://www.100md.com
图5 HRP-1的抗菌活性

图6 HRP-3的抗菌活性

图7 HRP-5的抗菌活性
3 讨 论
根据Oppenheim等[6]所作的分析结果,HRPs为一组氨基酸序列相似的同源多肽,其3种主要成分HRP-1、HRP-3、HRP-5的分子量分别为4929 D、4063 D和3037 D,它们分别含38、32、24个氨基酸残基(其中约48%为碱性氨基酸),且都在相同的残基位上含有7个组氨酸(histidine)。该作者用阳离子PAGE分析,显示HRPs呈3对区带,分别为HRP-1和HRP-2、HRP-3和HRP-4、HRP-5和HRP-6,而HRP-1、HRP-3、HRP-5的区带较宽。作者纯化的HRPs经AU-PAGE分析结果与之一致,且不含其它杂蛋白区带;检测HRPs分子量为3~5 kD,与上述作者的报道相符合。以上结果说明,这些在分子组成上相差甚微的多肽组分在本实验恰当的电泳条件下,得到满意的分离。酸性尿素聚丙烯酰胺凝胶电泳用于分离阳离子蛋白,具有分辨率高、操作简便、纯化效果好等特点[7],对HRPs的分纯制备不失为一种简便实用的方法。但是采用这种提纯方法,HRPs的获得率较低。分析其原因,除了在样品处理过程中的丢失外,可能在洗脱电泳时电场力的作用下,属于线性分子的HRPs大量穿过透析袋的微孔,泳动到缓冲液中。因此,本实验所采用的方法还有待改进。
, 百拇医药
本实验采用Lehrer等建立的微量而敏感的琼脂糖弥散法研究HRPs的抗菌活性,结果显示HRPs对变形链球菌具有较强的抗菌活性。3种主要HRPs中,HRP-3及HRP-5的抗变形链球菌活性强于HRP-1,表明前二者是HRPs中的主要抗变形链球菌成分,这与国外学者的报道相一致[8]。且HRPs对变形链球菌的抗菌活性大于其它菌株,这可能是由于变形链球菌代谢产酸,而在低pH环境下,HRPs的杀菌活性增强[9]。这充分说明HRPs作为仅存在于唾液中的抗菌活性多肽,可能在宿主抗龋机制中发挥重要作用。
1997年,吴琦等[10]报道了人腮腺唾液对一些常见的化脓性感染致病菌的抗菌活性,并证实其中的有效抗菌分子主要是HRPs。本实验将3种主要HRPs分离纯化,进一步定量测试它们的抗菌活性,结果发现:HRP-1对金黄色葡萄球菌有抗菌活性,对大肠杆菌和绿脓杆菌无抗菌活性;而HRP-3及HRP-5对上述3株细菌均有明显抗菌活性。各种细菌对HRPs的敏感性为:金黄色葡萄球菌大于大肠杆菌大于绿脓杆菌。值得一提的是,本实验所采用的大肠杆菌ML-35 P株,是氨苄青霉素耐药株,但对HRPs这种内源性的抗菌肽却很敏感。
, 百拇医药
Dabbagh等[11]曾报道健康人全唾液中HRPs的含量为3~167 μg/ml,而本实验中HRPs发挥抗菌作用的浓度在口腔中的生理浓度范围之内。以上结果说明HRPs为一组内源性广谱抗菌活性多肽,对G+和G-菌,包括一些抗生素耐药株,都有抗菌作用,可能是宿主对抗口腔微生物感染的重要分子,在预防口腔内伤口化脓性感染及消化道感染方面也可能有一定意义。
从以上结果还可发现,HRPs的不同组分对不同属性的细菌具有不同的抗菌活性。HRP-1对G+的变形链球菌和金黄色葡萄球菌有抗菌活性,而对G-的大肠杆菌和绿脓杆菌无抗菌活性。HRP-3和HRP-5对上述4种细菌均有抗菌作用。因此,对于其抗菌作用机理,还值得进一步研究。
本实验为国家自然科学基金资助项目(编号 39670305)
参考文献
, http://www.100md.com
1 赵心臣综述.唾液富组蛋白.国外医学口腔医学分册,1995,22(1):24~27
2 胡云明综述.唾液富组蛋白在口腔疾病中的作用.国外医学口腔医学分册,1995,22(4):200~203
3 Panyim S, Chalkley R. High resolution acrylamide gel electrophoresis of histon. Arch Biochem Biophys, 1969, 130(1):337~346
4 Schagger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem, 1987, 166(2):368~379
, http://www.100md.com
5 Lehrer RI, Rosenman M,Harwig SS,et al.Ultrasensitive assays for endogenous antimicrobial peptides.J Immunol Meth,1991,137(2):167~173
6 Oppenheim FG, Xu T, McMillan FM, et al. Histatins, a novel family of histidine-rich proteins in human parotid secretion. isolation, characterization, primary structure and fungistatic effects on Candida albicans. J Biol Chem, 1988, 263(16):7472~7477
7 吴 琦,王伯瑶,王偕秀,等.兔中性粒细胞抗菌肽的纯化和鉴定.华西医科大学学报,1990,21(2):59~62
, 百拇医药
8 Payne JB, Iacono VJ, Crawford IT, et al. Selective effects of histidine-rich polypeptides on the aggregation and viability of Streptococcus mutans and Streptococcus sanguis. Oral Microbiol Immunol, 1991, 6(3):169~176
9 Xu T, Levitz SM, Diamond RD, et al. Anticandidal activity of major human salivary HRPs.Infect Immun, 1991, 59(8):2549~2554
10 吴 琦,杨美薷,钟德钰,等.腮腺唾液富组蛋白抗菌活性的研究.中华口腔医学杂志,1997,32(6):356~359
11 Dabbagh WK, Xu T, Oppenheim FG.Densitometric determination of histatin concentration in saliva. J Dent Res, 1993, 72(AADR Abstracts):322
(1998-07-28收稿,1999-04-17修回), 百拇医药