维生素C在晶体蛋白光氧化中的作用及其机制△
作者:吴开力 潘苏华 李绍珍
单位:
广州中山医科大学 中山眼科中心,510060;△ 本文部分受到广东省自然科学基金资助
关键词:抗坏血酸;晶体蛋白类;紫外线
维生素C在晶体蛋白光氧化中的作用及其机制 摘 要 目的:观察维生素C(ASA)在晶体蛋白发生光氧化时的作用及其机制。方法:牛晶体蛋白溶液在加入或不加入ASA时,于5天内共接受200mJ/cm2紫外线B(UVB)照射,接着在37℃继续孵育至第3周,然后测定晶体蛋白的非色氨酸荧光、游离巯基和进行蛋白电泳分析。结果:ASA在溶液中易被氧化,蛋白溶液中加入ASA促使晶体蛋白的非色氨酸荧光产生明显增强,导致非二硫键聚合形成,对晶体蛋白的游离巯基减少有保护作用。有ASA时,UVB照射更易导致晶体蛋白形成非二硫键聚合。结论:体外溶液中的ASA易与晶体蛋白发生糖化作用,同时作为
, 百拇医药
抗氧化剂能保护晶体蛋白的游离巯基不被氧化。
分类号 R776.1
Effects of ascorbic acid on the photo-oxidation of crystallin
Wu Kaili...∥Ophthalmol CHN.-1999,8(3).-161~164(Zhongshan Ophthalmic
Center,Sun Yat-sen University of Medical Sciences,Guangzhou 510060)In order to explore the effects of ascorbic acis(ASA)on the photo
-oxidation of crystallin.Bovine crystalline solution mixed with or without ASA were irradiated with 200mJ/cm2 of UVB,and then incubated at 37℃ for three weeks.Measurement of non-tryptophan fluorescence,free sulfhydryl of protein and SDS-polyacrylamide electrophoresis were performed to compare with the alteration of lens protein under different treatments.The results showed that ASA is easy to be oxidized in solution.It promotes the production of the non-tryptophan fluorescence and the aggregation of crystallins.Irradiating the mixture of lens protein and ASA with UVB can result in obvious aggregation of crystallins through mainly non-disulfide bond.ASA can protect protein sulfhydryl against photo-oxidation.The present study suggests that ASA is easy to induce the glycation of crystallins in solution,and as an antioxidant,it can prevent the oxidation of protein sulfhydryls.
, 百拇医药
Subject terms Ascorbic acid;Crystallin;Ultraviolet rays
在人晶体老化或形成白内障时,晶体蛋白发生聚合、不溶化、变色(discoloration)、裂解(fragmentation)等,Maillard样反应是发生这类变化的机制之一[1]。维生素C(ascorbic acid,ASA)在人眼和昼行动物眼部含量很高,推测其与眼部的防御机制(如抗光氧化作用)有关[2]。同时也有相当多的体外研究显示ASA参与晶体蛋白的糖化作用,经Maillard样反应形成高级糖化终产物,但实际上与晶体蛋白发生反应的是ASA的氧化产物,如脱氢抗坏血酸(DHA)等[3,4]。晶体蛋白的巯基是易被氧化的基团,紫外线B(UVB)照射时发生光化学反应晶体蛋白的游离巯基氧化形成二硫键[5],参与构成晶体蛋白的高分子聚合物。
为探讨ASA在眼晶体内的作用,本文中拟观察体外牛晶体蛋白溶液在接受UVB照射时,ASA对晶体蛋白发生光氧化反应的效应,并探讨其体内作用机制。
, 百拇医药
1 材料与方法
1.1 试剂
还原型ASA、0.1M磷酸缓冲液为日本和光产品。其它试剂为Sigma或和光产品。
1.2 溶液中ASA的变化
以0.1M磷酸缓冲液(pH7.4)作溶剂配下列贮备液:2.5mM谷胱苷肽(GSH)、8mM二乙三胺五乙酸(DTPA)、4mMCuSO4、12mM还原型维生素C;然后按一定量混合使各溶液分别含10μMCuSO4、50μMGSH、100μMDTPA以及它们的混合液,最后加入1mM ASA(终浓度),置于37℃,避光。在加入ASA后立即取50μl溶液稀释至1ml,测定各溶液在265nm的光吸收值[6](岛津220可见紫外分光光度计)。以后每隔20分钟重复取样测定一次,共5次。
, 百拇医药
1.3 UVB照射晶体蛋白溶液
从当地屠宰场获得新鲜牛眼,取出晶体于-20℃保存。次日即用于分离可溶性晶体蛋白,用0.1M磷酸缓冲液(pH7.4)作晶体匀浆,离心(10 000g,1小时),取上清液作进一步处理。
将上述上清液用相同的磷酸缓冲液,稀释成约6.5mg/ml的晶体蛋白溶液,分成4组,其中2组加入4.4mM ASA(终浓度),之后将各组溶液置于石英杯中,封口。对加和未加ASA的蛋白溶液各一组进行UVB照射,不接受照射者则将其遮盖。UVB照射与我们以前的方法相同[5]。每天照射一次,每次40mJ/cm2,共照射5天(总量200mJ/cm2),之后继续孵育至第3周结束。不照射时的晶体蛋白溶液置于37℃二氧化碳培养箱,于照射前和开始照射后一周分别取部分蛋白溶液样品置于-20℃保存。
1.4 蛋白质分析
, 百拇医药
SDS-聚丙烯酰胺凝胶电泳、蛋白质游离巯基及蛋白质浓度测定的方法均与我们既往报道的相同[5]。晶体蛋白的非色氨酸荧光分析根据Swarmy的方法[7],将蛋白溶液稀释到0.1mg/ml,然后以360nm为激发波长,检测其在400~520nm的荧光发射谱。
2 结果
溶液中的还原型ASA易被氧化,图1示随观察时间延长,还原型ASA逐渐减少,在Cu++存在时,其降低速度很快,而在溶液中加入GSH或DTPA抗氧化剂时,其降低减慢。
图1磷酸缓冲液中还原型维生素C量的变化
, 百拇医药
晶体蛋白的非色氨酸荧光光谱(λem=360nm)在不同的处理中变化不相同。37℃孵育和UVB照射能促使该荧光产生(图2,b,c),加入ASA使其增加更甚(图2,d,e),UVB照射和ASA的联合作用(图2,f)与ASA的单独作用相近。提示ASA对晶体蛋白的糖化作用是很明显的。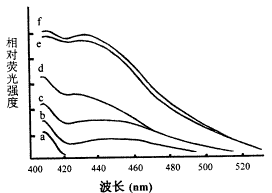
图2晶体蛋白的非色氨酸荧光光谱
图3示ASA对溶液中晶体蛋白光氧化聚合的影响。37℃孵育晶体蛋白3周后,见有高分子聚合带出现,这些带能够被二硫代苏糖醇(DTT)解开(图3-1),说明聚合是由二硫键构成;UVB照射所引起的聚合主要是二硫键和少部分非二硫键组成(图3-2);当加入ASA培育3周后,高分子晶体蛋白聚合带更明显,部分聚合能够被DTT还原(图3-3);在四种处理方法中,以加入ASA后又接受UVB照射的晶体蛋白所形成的聚合最明显,尤其是非二硫键聚合更甚,某些非二硫键的高分子蛋
, 百拇医药
白聚合物甚至不能进入分离胶(图3-4)。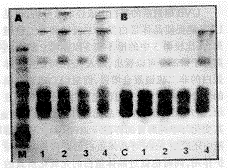
图3晶体蛋白溶液37℃孵育3周后的SDS聚丙烯酰胺凝胶电泳图
通过测定晶体蛋白的游离巯基可见(图4),无论在照射后的第一周或第三周的样本,UVB照射均引起蛋白的游离巯基减少,而加入的还原型ASA则使溶液中的游离巯基的变化与对照样品相同,其减少是孵育过程所致,说明ASA有保护蛋白巯基的作用。
图4晶体蛋白游离巯基的变化
, 百拇医药
3 讨论
与既往报道的相似,我们观察到还原型ASA在溶液中易于被氧化,当将其与晶体蛋白一起孵育时,则易使晶体蛋白发生糖化反应并形成交联。其机制在于ASA以其氧化型产物DHA与晶体蛋白发生反应,作用的部位主要在蛋白质分子的赖氨酸和精氨酸残基[3,8]。照射UVB可以促使蛋白聚合,并对晶体蛋白的色氨酸、组氨酸等残基产生影响[9],但从产生非色氨酸荧光而言,其作用不及ASA明显。
UVB照射后的蛋白溶液经电泳分析,可见UVB能促使晶体蛋白发生二硫键和非二硫键聚合,比较图3中的槽1和3以及槽2和4的高分子带部分可以看出,加入ASA可促使晶体蛋白的非二硫键聚合增强,而对以二硫键交联的聚合影响不大。通过测定蛋白质游离巯基显示,加入ASA的蛋白样品无论有否UVB照射,其变化与单纯孵育的样品一致(图4)。说明溶液中还原型ASA对晶体蛋白的游离巯基有保护作用,同时也促进晶体蛋白的光氧化所致的非二硫键交联,形成高分子蛋白聚合物。
, 百拇医药
正常昼行动物晶体中的ASA含量很高,绝大部分以还原型存在,推测高ASA含量的意义与抗氧化作用有关[2]。晶体上皮细胞能很易将被氧化的维生素C还原,从而保证其抗氧化功能的发挥,如对蛋白巯基的保护作用[2,8,10]。另一方面,本研究及既往体外实验显示ASA易使晶体蛋白产生非色氨酸荧光及形成蛋白聚合物,是由其氧化型产物(如DHA)所致[3]。已报道在正常晶体即存在一定量
的DHA,核型白内障晶体其还原型ASA减少,同时DHA增加可达总ASA的1/4[10,11]。体内老化和白内障时形成荧光物质和蛋白聚合物明显增多[1,7]。故结合本研究的结果可以推测,若晶体内还原型ASA被氧化,在某些致病因素作用下致使氧化型ASA增加,就会对晶体蛋白产生有害的糖化作用,促进晶体蛋白的高分子聚合物形成而产生白内障。
4 参考文献
, http://www.100md.com
1 李根林.Maillard反应与白内障(综述).国外医学眼科学分册,1993,17:284.
2 Garland DL.Ascorbic acid and the eye.Am J Clin Nutr,1991,54(suppl):1198.
3 Slight SH,Feather MS,Ortwerth BJ.Glycation of lens proteins by the oxidati on products of ascorbic acid.Biochim Biophys Acta,1990,1038:367.
4 Prabhakaram M,Ortwerth BJ.The glycation-associated crosslinking of lens cryst allins by ascorbic acid is not medicated by oxygen free radicals.Exp Eye Re s,1991,53:261.
, 百拇医药
5 Wu K,Kojima M,Shui YB,et al.In vitro UV-B effect on lens protein solut ions.Ophthalmic Res,1997,29:75.
6 Ortwerth BJ,Coots A,James HL,et al.UVA irradiation of human lens proteins produces residual oxidation of ascorbic acid even in the presence of high levels of glutathione.Arch Biochem
Biophys,1998,351:189.
7 Liang JN.Fluorescence study of the effects of aging and diabetes mellitus on human lens alpha-crystallin.Curr Eye Res,1987,6:351.
, 百拇医药
8 Saxena P,Saxena AK,Monnier VM.High galactose levels in vitro and in vivo impair ascorbate regen eration and increase ascorbate-mediated glycation in cultured rat lens.Exp Eye Res,1996,63:535.
9 Li DY,Borkman RF,Wang RH,et al.Mechanisms of photochemically produced turbidity in lens protein solutions .Exp Eye Res,1990,51:663.
10 Kern HL,Zolot SL.Transport of vitamin C in the lens.Curr Eye Res,1987,6:885.
11 Lohmann W,Schmehl W,Strobel J.Nuclear cataract:oxidative damage to the lens.Exp Eye Res,1986,43;859.
1998-11-23收稿, 百拇医药
单位:
广州中山医科大学 中山眼科中心,510060;△ 本文部分受到广东省自然科学基金资助
关键词:抗坏血酸;晶体蛋白类;紫外线
维生素C在晶体蛋白光氧化中的作用及其机制 摘 要 目的:观察维生素C(ASA)在晶体蛋白发生光氧化时的作用及其机制。方法:牛晶体蛋白溶液在加入或不加入ASA时,于5天内共接受200mJ/cm2紫外线B(UVB)照射,接着在37℃继续孵育至第3周,然后测定晶体蛋白的非色氨酸荧光、游离巯基和进行蛋白电泳分析。结果:ASA在溶液中易被氧化,蛋白溶液中加入ASA促使晶体蛋白的非色氨酸荧光产生明显增强,导致非二硫键聚合形成,对晶体蛋白的游离巯基减少有保护作用。有ASA时,UVB照射更易导致晶体蛋白形成非二硫键聚合。结论:体外溶液中的ASA易与晶体蛋白发生糖化作用,同时作为
, 百拇医药
抗氧化剂能保护晶体蛋白的游离巯基不被氧化。
分类号 R776.1
Effects of ascorbic acid on the photo-oxidation of crystallin
Wu Kaili...∥Ophthalmol CHN.-1999,8(3).-161~164(Zhongshan Ophthalmic
Center,Sun Yat-sen University of Medical Sciences,Guangzhou 510060)In order to explore the effects of ascorbic acis(ASA)on the photo
-oxidation of crystallin.Bovine crystalline solution mixed with or without ASA were irradiated with 200mJ/cm2 of UVB,and then incubated at 37℃ for three weeks.Measurement of non-tryptophan fluorescence,free sulfhydryl of protein and SDS-polyacrylamide electrophoresis were performed to compare with the alteration of lens protein under different treatments.The results showed that ASA is easy to be oxidized in solution.It promotes the production of the non-tryptophan fluorescence and the aggregation of crystallins.Irradiating the mixture of lens protein and ASA with UVB can result in obvious aggregation of crystallins through mainly non-disulfide bond.ASA can protect protein sulfhydryl against photo-oxidation.The present study suggests that ASA is easy to induce the glycation of crystallins in solution,and as an antioxidant,it can prevent the oxidation of protein sulfhydryls.
, 百拇医药
Subject terms Ascorbic acid;Crystallin;Ultraviolet rays
在人晶体老化或形成白内障时,晶体蛋白发生聚合、不溶化、变色(discoloration)、裂解(fragmentation)等,Maillard样反应是发生这类变化的机制之一[1]。维生素C(ascorbic acid,ASA)在人眼和昼行动物眼部含量很高,推测其与眼部的防御机制(如抗光氧化作用)有关[2]。同时也有相当多的体外研究显示ASA参与晶体蛋白的糖化作用,经Maillard样反应形成高级糖化终产物,但实际上与晶体蛋白发生反应的是ASA的氧化产物,如脱氢抗坏血酸(DHA)等[3,4]。晶体蛋白的巯基是易被氧化的基团,紫外线B(UVB)照射时发生光化学反应晶体蛋白的游离巯基氧化形成二硫键[5],参与构成晶体蛋白的高分子聚合物。
为探讨ASA在眼晶体内的作用,本文中拟观察体外牛晶体蛋白溶液在接受UVB照射时,ASA对晶体蛋白发生光氧化反应的效应,并探讨其体内作用机制。
, 百拇医药
1 材料与方法
1.1 试剂
还原型ASA、0.1M磷酸缓冲液为日本和光产品。其它试剂为Sigma或和光产品。
1.2 溶液中ASA的变化
以0.1M磷酸缓冲液(pH7.4)作溶剂配下列贮备液:2.5mM谷胱苷肽(GSH)、8mM二乙三胺五乙酸(DTPA)、4mMCuSO4、12mM还原型维生素C;然后按一定量混合使各溶液分别含10μMCuSO4、50μMGSH、100μMDTPA以及它们的混合液,最后加入1mM ASA(终浓度),置于37℃,避光。在加入ASA后立即取50μl溶液稀释至1ml,测定各溶液在265nm的光吸收值[6](岛津220可见紫外分光光度计)。以后每隔20分钟重复取样测定一次,共5次。
, 百拇医药
1.3 UVB照射晶体蛋白溶液
从当地屠宰场获得新鲜牛眼,取出晶体于-20℃保存。次日即用于分离可溶性晶体蛋白,用0.1M磷酸缓冲液(pH7.4)作晶体匀浆,离心(10 000g,1小时),取上清液作进一步处理。
将上述上清液用相同的磷酸缓冲液,稀释成约6.5mg/ml的晶体蛋白溶液,分成4组,其中2组加入4.4mM ASA(终浓度),之后将各组溶液置于石英杯中,封口。对加和未加ASA的蛋白溶液各一组进行UVB照射,不接受照射者则将其遮盖。UVB照射与我们以前的方法相同[5]。每天照射一次,每次40mJ/cm2,共照射5天(总量200mJ/cm2),之后继续孵育至第3周结束。不照射时的晶体蛋白溶液置于37℃二氧化碳培养箱,于照射前和开始照射后一周分别取部分蛋白溶液样品置于-20℃保存。
1.4 蛋白质分析
, 百拇医药
SDS-聚丙烯酰胺凝胶电泳、蛋白质游离巯基及蛋白质浓度测定的方法均与我们既往报道的相同[5]。晶体蛋白的非色氨酸荧光分析根据Swarmy的方法[7],将蛋白溶液稀释到0.1mg/ml,然后以360nm为激发波长,检测其在400~520nm的荧光发射谱。
2 结果
溶液中的还原型ASA易被氧化,图1示随观察时间延长,还原型ASA逐渐减少,在Cu++存在时,其降低速度很快,而在溶液中加入GSH或DTPA抗氧化剂时,其降低减慢。

图1磷酸缓冲液中还原型维生素C量的变化
, 百拇医药
晶体蛋白的非色氨酸荧光光谱(λem=360nm)在不同的处理中变化不相同。37℃孵育和UVB照射能促使该荧光产生(图2,b,c),加入ASA使其增加更甚(图2,d,e),UVB照射和ASA的联合作用(图2,f)与ASA的单独作用相近。提示ASA对晶体蛋白的糖化作用是很明显的。

图2晶体蛋白的非色氨酸荧光光谱
图3示ASA对溶液中晶体蛋白光氧化聚合的影响。37℃孵育晶体蛋白3周后,见有高分子聚合带出现,这些带能够被二硫代苏糖醇(DTT)解开(图3-1),说明聚合是由二硫键构成;UVB照射所引起的聚合主要是二硫键和少部分非二硫键组成(图3-2);当加入ASA培育3周后,高分子晶体蛋白聚合带更明显,部分聚合能够被DTT还原(图3-3);在四种处理方法中,以加入ASA后又接受UVB照射的晶体蛋白所形成的聚合最明显,尤其是非二硫键聚合更甚,某些非二硫键的高分子蛋
, 百拇医药
白聚合物甚至不能进入分离胶(图3-4)。

图3晶体蛋白溶液37℃孵育3周后的SDS聚丙烯酰胺凝胶电泳图
通过测定晶体蛋白的游离巯基可见(图4),无论在照射后的第一周或第三周的样本,UVB照射均引起蛋白的游离巯基减少,而加入的还原型ASA则使溶液中的游离巯基的变化与对照样品相同,其减少是孵育过程所致,说明ASA有保护蛋白巯基的作用。

图4晶体蛋白游离巯基的变化
, 百拇医药
3 讨论
与既往报道的相似,我们观察到还原型ASA在溶液中易于被氧化,当将其与晶体蛋白一起孵育时,则易使晶体蛋白发生糖化反应并形成交联。其机制在于ASA以其氧化型产物DHA与晶体蛋白发生反应,作用的部位主要在蛋白质分子的赖氨酸和精氨酸残基[3,8]。照射UVB可以促使蛋白聚合,并对晶体蛋白的色氨酸、组氨酸等残基产生影响[9],但从产生非色氨酸荧光而言,其作用不及ASA明显。
UVB照射后的蛋白溶液经电泳分析,可见UVB能促使晶体蛋白发生二硫键和非二硫键聚合,比较图3中的槽1和3以及槽2和4的高分子带部分可以看出,加入ASA可促使晶体蛋白的非二硫键聚合增强,而对以二硫键交联的聚合影响不大。通过测定蛋白质游离巯基显示,加入ASA的蛋白样品无论有否UVB照射,其变化与单纯孵育的样品一致(图4)。说明溶液中还原型ASA对晶体蛋白的游离巯基有保护作用,同时也促进晶体蛋白的光氧化所致的非二硫键交联,形成高分子蛋白聚合物。
, 百拇医药
正常昼行动物晶体中的ASA含量很高,绝大部分以还原型存在,推测高ASA含量的意义与抗氧化作用有关[2]。晶体上皮细胞能很易将被氧化的维生素C还原,从而保证其抗氧化功能的发挥,如对蛋白巯基的保护作用[2,8,10]。另一方面,本研究及既往体外实验显示ASA易使晶体蛋白产生非色氨酸荧光及形成蛋白聚合物,是由其氧化型产物(如DHA)所致[3]。已报道在正常晶体即存在一定量
的DHA,核型白内障晶体其还原型ASA减少,同时DHA增加可达总ASA的1/4[10,11]。体内老化和白内障时形成荧光物质和蛋白聚合物明显增多[1,7]。故结合本研究的结果可以推测,若晶体内还原型ASA被氧化,在某些致病因素作用下致使氧化型ASA增加,就会对晶体蛋白产生有害的糖化作用,促进晶体蛋白的高分子聚合物形成而产生白内障。
4 参考文献
, http://www.100md.com
1 李根林.Maillard反应与白内障(综述).国外医学眼科学分册,1993,17:284.
2 Garland DL.Ascorbic acid and the eye.Am J Clin Nutr,1991,54(suppl):1198.
3 Slight SH,Feather MS,Ortwerth BJ.Glycation of lens proteins by the oxidati on products of ascorbic acid.Biochim Biophys Acta,1990,1038:367.
4 Prabhakaram M,Ortwerth BJ.The glycation-associated crosslinking of lens cryst allins by ascorbic acid is not medicated by oxygen free radicals.Exp Eye Re s,1991,53:261.
, 百拇医药
5 Wu K,Kojima M,Shui YB,et al.In vitro UV-B effect on lens protein solut ions.Ophthalmic Res,1997,29:75.
6 Ortwerth BJ,Coots A,James HL,et al.UVA irradiation of human lens proteins produces residual oxidation of ascorbic acid even in the presence of high levels of glutathione.Arch Biochem
Biophys,1998,351:189.
7 Liang JN.Fluorescence study of the effects of aging and diabetes mellitus on human lens alpha-crystallin.Curr Eye Res,1987,6:351.
, 百拇医药
8 Saxena P,Saxena AK,Monnier VM.High galactose levels in vitro and in vivo impair ascorbate regen eration and increase ascorbate-mediated glycation in cultured rat lens.Exp Eye Res,1996,63:535.
9 Li DY,Borkman RF,Wang RH,et al.Mechanisms of photochemically produced turbidity in lens protein solutions .Exp Eye Res,1990,51:663.
10 Kern HL,Zolot SL.Transport of vitamin C in the lens.Curr Eye Res,1987,6:885.
11 Lohmann W,Schmehl W,Strobel J.Nuclear cataract:oxidative damage to the lens.Exp Eye Res,1986,43;859.
1998-11-23收稿, 百拇医药