原位逆转录多聚酶链反应技术的改进
作者:谢民强
单位:谢民强(中山医科大学附属第三医院耳鼻咽喉科,广州 510630)
关键词:聚合酶链反应;石蜡切片;鼻粘膜;神经生长因子;改良;大鼠
临床与实验病理学杂志990427
分类号 R365;R765.25 文献标识码 A
文章编号 1001-7399(1999)04-0348-03
原位逆转录多聚酶链反应(RT-PCR)技术问世以来〔1〕,虽然对实验方法和适应这一方法的热循环仪都进行了很大的改进,但由于该技术本身存在的一些问题以及仪器的昂贵,国内尚未能广泛应用。我们对该技术进行了一系列改进,获得满意结果。
, http://www.100md.com
1 材料和方法
1.1 标本制备 实验动物为2月龄Wistar大白鼠(韩国庆北大学医学院动物室提供),处死后取鼻腔外侧壁粘膜,中性福尔马林4℃固定,常规脱水,石蜡包埋,连续切片,HE染色,组织学检查。在另1张载玻片上,根据Nuovo〔1〕介绍的方法贴相同组织3块,按下述改良方法进行原位RT-PCR。
1.2 原位RT-PCR
1.2.1 NGF引物 按文献〔2〕报道的序列由韩国生物技术工程公司(Korean Biotech Inc)合成,P1,5′-CCAAGGACGCAGCTTTCTAT-3′。P2,5′-CTCCGGTGAGTCCTGTTGAA-3′。
1.2.2 组织预处理 组织切片脱蜡脱水空干,5 mg.L-1蛋白酶K(Sigma产品)37℃消化10 min,焦碳酸二乙酯(DEPC,Sigma产品)处理水终止酶反应5 min,换水1次,无水乙醇浸1 min,空干。
, http://www.100md.com
1.2.3 原位逆转录 如图1示,每块组织上加5 μl逆转录反应混合液(50 mmol.L-1 Tris-HCl, pH 8.3, 40 mmol.L-1 KCl, 10 mmol.L-1 DTT, 6 mmol.L-1 MgCl2, 1 mmol.L-1 dNTP, 1 μmol.L-1引物,5 U RNase抑制物,5U MMLV逆转录酶,均为Boehringer Mannheim产品),阴性对照以等量无离子DEPC处理水代替引物,加盖玻片,橡胶水封边,42℃水浴中孵育1 h,小心除去封胶,在无水乙醇中洗脱盖玻片,空干。
图1 原位逆转录示意图
, http://www.100md.com
P1、N、P2分别代表意义链引物,无引物,反意义链引物
1.2.4 原位PCR 如图2示,在载玻片四周用树胶粘上0.2 mm厚、3 mm宽的玻璃方框,室温下干燥2 h,框内加25 μl PCR混合液(1× Taq缓冲液,5 mmol.L-1 MgCl2,0.8 mmol.L-1 dNTP, 2.5 U Taq DNA多聚酶(均为Promega产品),0.8 g.L-1牛血清白蛋白(Sigma产品),1 μmol.L-1地高辛标记dUTP(Boehringer Mannheim产品),引物P1、P2各1 μmol.L-1),方框内置0.1 mm厚适当大小的盖玻片,周围用加热至80℃的石蜡油(Sigma产品)覆盖,上面再加一块大盖玻片覆盖方框,锡铂纸包裹,置空气冷却式热循环仪(Bio Oven Ⅲ Integrate Separation System),94℃预变性3 min,接着94℃ 1 min,55℃ 2 min,3~30个循环,扩增目的片段。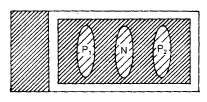
, http://www.100md.com
图2 原位PCR装置示意图
P1、N、P2代表3块相同组织,白色表示玻璃框
1.2.5 原位PCR产物的检测 经PCR扩增后的载玻片浸入丙酮内2 min,盖玻片自然脱落,入二甲苯内10 min,除去石蜡油和玻璃方框,等级乙醇脱二甲苯至水。2× SSC, pH 7.0,浸泡5 min。0.5×SSC/0.05% Tween-20浸泡5 min,加2%正常羊血清封闭15 min,加1∶500碱性磷酸酶标记的羊抗地高辛抗体(Boehringer Mannheim产品),4℃孵育过夜。Tris缓冲液漂洗3次,加底物缓冲液[0.1 mol.L-1 Tris-HCl, pH 9.5, 0.1 mol.L-1 NaCl, 0.05 mol.L-1MgCl2,NBT(四唑氮蓝)330 mg.L-1,BCIP(5-溴-4-氯-3-吲哚磷酸甲苯胺)165 mg.L-1, Sigma产品],室温下显色30~60 min,0.2%甲基绿衬染10 s,封片,光镜观察。
, 百拇医药
2 结果
以NGF特异性反义链引物进行原位逆转录的组织,经5次循环扩增,粘膜和粘膜下层组织内显示特异性放大信号,而且以粘膜下层为主。根据NGF细胞来源的文献报道〔3,5〕并参照HE染色分析,这些阳性细胞属于淋巴细胞或肥大细胞。相反,用意义链引物进行逆转录的组织则未显示可分辨的阳性细胞,无寡核苷酸引物的阴性对照,尽管在同样条件下进行原位PCR扩增,却未检测到任何放大信号。扩增小于3次循环者信号很弱,大于5次循环则出现非特异性着色。
3 讨论
3.1 原位RT-PCR的反应条件 自从Nuovo〔1〕1994年系统地介绍原位RT-PCR技术以来,全世界已有大量报道运用该技术在单细胞中成功地检测到经特异性放大的单拷贝核酸序列,但假阳性和假阴性的问题仍然没有得到很好解决。我们曾报道〔6〕采用该技术检测仓鼠口腔颊囊粘膜癌变过程中EGFR mRNA的表达,当时为了防止PCR扩增过程中非特异性DNA放大的干扰,按Nuovo的方法在逆转录前采用DNA酶消化过夜,尽管这起到了一定的作用,但消化程度难以掌握,过度则影响细胞形态,不足反而造成DNA缺口,产生更严重的非特异性信号。本研究在组织预处理过程中包括蛋白酶消化比原位PCR弱〔7〕,未消化DNA,获得良好的信号,组织细胞形态完整,无背景着色。这一结果表明福尔马林固定后在预处理过程中RNA的显露比DNA要容易些〔8〕;另一方面推测,逆转录产生的cDNA作模板比双链DNA效率要高得多。
, http://www.100md.com
值得提出的是组织脱蜡后至逆转录反应终止前,必须防止RNA酶污染,每一步都要用DEPC处理水;其次,cDNA扩增过程中,必须防止PCR混合液干燥。目前国内外采用专门的原位PCR扩增仪和相关的设备,如Nuovo〔1〕介绍的原位PCR装置,即使进行30次以上的循环仍然能有效地防止PCR混合液蒸发,但价格昂贵,国内一般的研究室,特别是基层实验室尚未配备。我们的方法简单,经多次实验证实同样有效。
关于循环次数,因所检测的基因和各实验室所建立的方法不同而不同。根据实验和计算已知,只要有约100个地高辛标记的核苷酸掺入到DNA中,并用碱性磷酸酶标记的抗体去检测,就能在光镜下分辨出信号,通常每20~25个核苷酸掺入一个地高辛标记物,故循环次数可根据产物大小推算并结合预实验决定。太少则信号弱,太多除背景着色外可能因产物过多导致脱落而失去信号。如果采用间接法,扩增后再用探针杂交,可适当增加循环次数。我们认为直接法更简便,只要控制好循环次数并不会影响特异性。
, http://www.100md.com
原位PCR所使用的引物最好设计成20个左右的碱基,GC占50%,浓度0.8~1 μmol.L-1,复性延伸温度55℃,可防止引物聚合、错误介导等非特异性扩增。我们曾在同一张切片上采用阴性和阳性对照进行原位PCR扩增,使实验结果的可靠性大大提高。如果没有合适的对照材料,在同一张切片上采用意义链引物、反义链引物和无引物进行原位逆转录作为阴性和阳性对照,同样可增加实验的可靠性。
3.2 NGF mRNA表达的意义 以前的研究证实参与变态反应的肥大细胞〔3〕、淋巴细胞〔4〕,特别是B淋巴细胞〔5〕具有合成、储存和释放NGF的能力。众所周知,变应性鼻炎的发病机制主要是IgE介导的肥大细胞脱颗粒反应。Bornini等〔9〕的研究发现过敏性哮喘和变应性鼻炎患者血清中NGF增高,与血清特异性IgE的增高显著相关,且患多种变应性疾病比患单种更高,提示NGF直接参与了变应性疾病包括变应性鼻炎的发病。本研究进一步证实大鼠鼻粘膜中浸润的淋巴细、肥大细胞表达NGF mRNA,但人鼻粘膜中是否存在NGF,它的改变是否与变应性鼻炎有关,有待进一步研究。
, 百拇医药
(韩国庆北大学医学院耳鼻咽喉科朴浚植、李相欣教授为本研究提供大部分试剂,谨致谢意)
基金项目:湖南省卫生厅重点项目资助课题(No 9403)
作者简介:谢民强,男,42岁,博士,副教授
参考文献
1,Nuovo GT. PCR in situ hybridization: Protocols and applications. 2nd ed, New York:Raven Press, 1994:247~306
2,Staecker H, Cammer M, Rubinstein R et al. A procedure for RT-PCR amplification of mRNA on histological specimens. Biotechniques, 1994;16:76
, 百拇医药
3,Leon A, Buriani A, DelToso R et al. Mast cell synthesize, store, and release nerve growth factor. Proc Natl Acad Sci USA, 1994:91:3739
4,Santambrogio L, Benedetli M, Chao MV et al. Nerve growth factor production by lymphocytes. J Immunol, 1994;153:4488
5,Torcia M, Bracci-Laudiero L, Lucibello M el al. Nerve growth factor is an autocrine survival factor for memory B lymphocytes. Cell, 1996;85:345
, 百拇医药
6,谢民强,朴浚植,李相淑.仓鼠口腔癌变过程中表皮细胞生长因子受体 mRNA的表达.中华口腔医学杂志,1998;33(4):243
7,谢民强.应用原位多聚酶链反应检测喉癌组织中p53基因.湖南医科大学学报,1997;22:459
8,谢民强,肖健云,朴浚植等. 用地高辛标记的染色体特异性DNA探针检测石蜡切片组织细胞中期核染色体异常的敏感方法. 中国耳鼻咽喉颅底外科杂志,1995;1:41
9,Bonini S, Lambiase A, Bonini S et al. Circulating nerve growth factor levels are increased in humans with allergic diseases and asthma. Prac Natl Acad Sci USA,1996;93:10955
收稿日期:1998-03-13, http://www.100md.com
单位:谢民强(中山医科大学附属第三医院耳鼻咽喉科,广州 510630)
关键词:聚合酶链反应;石蜡切片;鼻粘膜;神经生长因子;改良;大鼠
临床与实验病理学杂志990427
分类号 R365;R765.25 文献标识码 A
文章编号 1001-7399(1999)04-0348-03
原位逆转录多聚酶链反应(RT-PCR)技术问世以来〔1〕,虽然对实验方法和适应这一方法的热循环仪都进行了很大的改进,但由于该技术本身存在的一些问题以及仪器的昂贵,国内尚未能广泛应用。我们对该技术进行了一系列改进,获得满意结果。
, http://www.100md.com
1 材料和方法
1.1 标本制备 实验动物为2月龄Wistar大白鼠(韩国庆北大学医学院动物室提供),处死后取鼻腔外侧壁粘膜,中性福尔马林4℃固定,常规脱水,石蜡包埋,连续切片,HE染色,组织学检查。在另1张载玻片上,根据Nuovo〔1〕介绍的方法贴相同组织3块,按下述改良方法进行原位RT-PCR。
1.2 原位RT-PCR
1.2.1 NGF引物 按文献〔2〕报道的序列由韩国生物技术工程公司(Korean Biotech Inc)合成,P1,5′-CCAAGGACGCAGCTTTCTAT-3′。P2,5′-CTCCGGTGAGTCCTGTTGAA-3′。
1.2.2 组织预处理 组织切片脱蜡脱水空干,5 mg.L-1蛋白酶K(Sigma产品)37℃消化10 min,焦碳酸二乙酯(DEPC,Sigma产品)处理水终止酶反应5 min,换水1次,无水乙醇浸1 min,空干。
, http://www.100md.com
1.2.3 原位逆转录 如图1示,每块组织上加5 μl逆转录反应混合液(50 mmol.L-1 Tris-HCl, pH 8.3, 40 mmol.L-1 KCl, 10 mmol.L-1 DTT, 6 mmol.L-1 MgCl2, 1 mmol.L-1 dNTP, 1 μmol.L-1引物,5 U RNase抑制物,5U MMLV逆转录酶,均为Boehringer Mannheim产品),阴性对照以等量无离子DEPC处理水代替引物,加盖玻片,橡胶水封边,42℃水浴中孵育1 h,小心除去封胶,在无水乙醇中洗脱盖玻片,空干。

图1 原位逆转录示意图
, http://www.100md.com
P1、N、P2分别代表意义链引物,无引物,反意义链引物
1.2.4 原位PCR 如图2示,在载玻片四周用树胶粘上0.2 mm厚、3 mm宽的玻璃方框,室温下干燥2 h,框内加25 μl PCR混合液(1× Taq缓冲液,5 mmol.L-1 MgCl2,0.8 mmol.L-1 dNTP, 2.5 U Taq DNA多聚酶(均为Promega产品),0.8 g.L-1牛血清白蛋白(Sigma产品),1 μmol.L-1地高辛标记dUTP(Boehringer Mannheim产品),引物P1、P2各1 μmol.L-1),方框内置0.1 mm厚适当大小的盖玻片,周围用加热至80℃的石蜡油(Sigma产品)覆盖,上面再加一块大盖玻片覆盖方框,锡铂纸包裹,置空气冷却式热循环仪(Bio Oven Ⅲ Integrate Separation System),94℃预变性3 min,接着94℃ 1 min,55℃ 2 min,3~30个循环,扩增目的片段。

, http://www.100md.com
图2 原位PCR装置示意图
P1、N、P2代表3块相同组织,白色表示玻璃框
1.2.5 原位PCR产物的检测 经PCR扩增后的载玻片浸入丙酮内2 min,盖玻片自然脱落,入二甲苯内10 min,除去石蜡油和玻璃方框,等级乙醇脱二甲苯至水。2× SSC, pH 7.0,浸泡5 min。0.5×SSC/0.05% Tween-20浸泡5 min,加2%正常羊血清封闭15 min,加1∶500碱性磷酸酶标记的羊抗地高辛抗体(Boehringer Mannheim产品),4℃孵育过夜。Tris缓冲液漂洗3次,加底物缓冲液[0.1 mol.L-1 Tris-HCl, pH 9.5, 0.1 mol.L-1 NaCl, 0.05 mol.L-1MgCl2,NBT(四唑氮蓝)330 mg.L-1,BCIP(5-溴-4-氯-3-吲哚磷酸甲苯胺)165 mg.L-1, Sigma产品],室温下显色30~60 min,0.2%甲基绿衬染10 s,封片,光镜观察。
, 百拇医药
2 结果
以NGF特异性反义链引物进行原位逆转录的组织,经5次循环扩增,粘膜和粘膜下层组织内显示特异性放大信号,而且以粘膜下层为主。根据NGF细胞来源的文献报道〔3,5〕并参照HE染色分析,这些阳性细胞属于淋巴细胞或肥大细胞。相反,用意义链引物进行逆转录的组织则未显示可分辨的阳性细胞,无寡核苷酸引物的阴性对照,尽管在同样条件下进行原位PCR扩增,却未检测到任何放大信号。扩增小于3次循环者信号很弱,大于5次循环则出现非特异性着色。
3 讨论
3.1 原位RT-PCR的反应条件 自从Nuovo〔1〕1994年系统地介绍原位RT-PCR技术以来,全世界已有大量报道运用该技术在单细胞中成功地检测到经特异性放大的单拷贝核酸序列,但假阳性和假阴性的问题仍然没有得到很好解决。我们曾报道〔6〕采用该技术检测仓鼠口腔颊囊粘膜癌变过程中EGFR mRNA的表达,当时为了防止PCR扩增过程中非特异性DNA放大的干扰,按Nuovo的方法在逆转录前采用DNA酶消化过夜,尽管这起到了一定的作用,但消化程度难以掌握,过度则影响细胞形态,不足反而造成DNA缺口,产生更严重的非特异性信号。本研究在组织预处理过程中包括蛋白酶消化比原位PCR弱〔7〕,未消化DNA,获得良好的信号,组织细胞形态完整,无背景着色。这一结果表明福尔马林固定后在预处理过程中RNA的显露比DNA要容易些〔8〕;另一方面推测,逆转录产生的cDNA作模板比双链DNA效率要高得多。
, http://www.100md.com
值得提出的是组织脱蜡后至逆转录反应终止前,必须防止RNA酶污染,每一步都要用DEPC处理水;其次,cDNA扩增过程中,必须防止PCR混合液干燥。目前国内外采用专门的原位PCR扩增仪和相关的设备,如Nuovo〔1〕介绍的原位PCR装置,即使进行30次以上的循环仍然能有效地防止PCR混合液蒸发,但价格昂贵,国内一般的研究室,特别是基层实验室尚未配备。我们的方法简单,经多次实验证实同样有效。
关于循环次数,因所检测的基因和各实验室所建立的方法不同而不同。根据实验和计算已知,只要有约100个地高辛标记的核苷酸掺入到DNA中,并用碱性磷酸酶标记的抗体去检测,就能在光镜下分辨出信号,通常每20~25个核苷酸掺入一个地高辛标记物,故循环次数可根据产物大小推算并结合预实验决定。太少则信号弱,太多除背景着色外可能因产物过多导致脱落而失去信号。如果采用间接法,扩增后再用探针杂交,可适当增加循环次数。我们认为直接法更简便,只要控制好循环次数并不会影响特异性。
, http://www.100md.com
原位PCR所使用的引物最好设计成20个左右的碱基,GC占50%,浓度0.8~1 μmol.L-1,复性延伸温度55℃,可防止引物聚合、错误介导等非特异性扩增。我们曾在同一张切片上采用阴性和阳性对照进行原位PCR扩增,使实验结果的可靠性大大提高。如果没有合适的对照材料,在同一张切片上采用意义链引物、反义链引物和无引物进行原位逆转录作为阴性和阳性对照,同样可增加实验的可靠性。
3.2 NGF mRNA表达的意义 以前的研究证实参与变态反应的肥大细胞〔3〕、淋巴细胞〔4〕,特别是B淋巴细胞〔5〕具有合成、储存和释放NGF的能力。众所周知,变应性鼻炎的发病机制主要是IgE介导的肥大细胞脱颗粒反应。Bornini等〔9〕的研究发现过敏性哮喘和变应性鼻炎患者血清中NGF增高,与血清特异性IgE的增高显著相关,且患多种变应性疾病比患单种更高,提示NGF直接参与了变应性疾病包括变应性鼻炎的发病。本研究进一步证实大鼠鼻粘膜中浸润的淋巴细、肥大细胞表达NGF mRNA,但人鼻粘膜中是否存在NGF,它的改变是否与变应性鼻炎有关,有待进一步研究。
, 百拇医药
(韩国庆北大学医学院耳鼻咽喉科朴浚植、李相欣教授为本研究提供大部分试剂,谨致谢意)
基金项目:湖南省卫生厅重点项目资助课题(No 9403)
作者简介:谢民强,男,42岁,博士,副教授
参考文献
1,Nuovo GT. PCR in situ hybridization: Protocols and applications. 2nd ed, New York:Raven Press, 1994:247~306
2,Staecker H, Cammer M, Rubinstein R et al. A procedure for RT-PCR amplification of mRNA on histological specimens. Biotechniques, 1994;16:76
, 百拇医药
3,Leon A, Buriani A, DelToso R et al. Mast cell synthesize, store, and release nerve growth factor. Proc Natl Acad Sci USA, 1994:91:3739
4,Santambrogio L, Benedetli M, Chao MV et al. Nerve growth factor production by lymphocytes. J Immunol, 1994;153:4488
5,Torcia M, Bracci-Laudiero L, Lucibello M el al. Nerve growth factor is an autocrine survival factor for memory B lymphocytes. Cell, 1996;85:345
, 百拇医药
6,谢民强,朴浚植,李相淑.仓鼠口腔癌变过程中表皮细胞生长因子受体 mRNA的表达.中华口腔医学杂志,1998;33(4):243
7,谢民强.应用原位多聚酶链反应检测喉癌组织中p53基因.湖南医科大学学报,1997;22:459
8,谢民强,肖健云,朴浚植等. 用地高辛标记的染色体特异性DNA探针检测石蜡切片组织细胞中期核染色体异常的敏感方法. 中国耳鼻咽喉颅底外科杂志,1995;1:41
9,Bonini S, Lambiase A, Bonini S et al. Circulating nerve growth factor levels are increased in humans with allergic diseases and asthma. Prac Natl Acad Sci USA,1996;93:10955
收稿日期:1998-03-13, http://www.100md.com