APP基因真核表达载体的构建与鉴定1
作者:常洋 秦川 琦祖和 蔡有余
单位:常 洋 秦 蔡有余(中国医学科学院中国协和医科大学实验动物研究所,北京 100021);川琦祖和 中国医学科学院中国协和医科大学基础医学研究所
关键词:APP;定向克隆;表达载体;SY5Y细胞
中国老年学杂志/990429 摘 要 目的 重组APP基因真核表达载体。方法 采用定向克隆技术、脂质体转染和Northen blot杂交技术。结果 在分别独立的反应中,PDGF启动子、APP cDNA、载体依摩尔比3∶3∶1及1∶1∶1同时连接,重组体利用脂质体介导转染SY5Y神经母细胞瘤细胞,Northern bolt杂交检测到瞬时表达。结论 构建具有神经组织特异性的APP基因真核表达载体。
The construction of the eukaryotic expression
, http://www.100md.com
vector of mutation APP gene and its identification
Chang Yang, Qin Chuan, Qi Zuhe et al
Department of Genetics, Institute of Laboratory Animal
Science, Peking Union Medical College & Chinese Academy
of Medical Science, PUMC&CAMS, Beijing 100021
Contemporary research shows that the mutation overproduction of and accumulation of β-amyloid precuser protein(β APP) is closely related to the developmens of Alzheimer's disease. We constructed the recombinant plasmid containing the human APP cDNA 695, 751V717I driven by PDGF promoter which expressed specifically in nervous system. With two respecting molar ratio of 3∶3∶1 and 1∶1∶1, the promoter, APP cDNA were subcloned into the vector. The recombinant was introduced into SY5Y cell by lipeofectamine, and the expression of the construction was analysed by Northern blot. Now, we are microjecting the transgene into the male pronucleus of the zygotes, aim at providing a resembling animal model of the human mechanism.
, 百拇医药
Key words APP directional cloning expression vector SY5Y cells
早老性痴呆(AD)是进行性神经降解性疾病,是威胁人类健康的神经系统主要疾病之一。AD的主要病理表现是在脑部形成淀粉样斑块。斑块的主要成分是从淀粉样前体蛋白(β-APP)衍生的具有神经毒性的多肽片断Aβ〔1〕。现在的研究认为APP基因的突变和异常表达与AD的发生有关〔2,3〕。然而,动物模型的缺少已成为AD发病机制研究和药物筛选的主要障碍。为克服这一障碍,我们构建了血小板衍生生长因子启动子(PDGF promoter)调控下的重组质粒,并在细胞水平检测了质粒的表达,为我们现在进行的建立AD转基因动物模型工作奠定了基础。
1 材料与方法
1.1 酶及主要生化试剂 限制性内切酶、T4 DNA连接酶等均购自Promega公司、华美生物工程公司和中国医学科学院友谊公司。DNA快速纯化回收试剂盒为天象人生物工程公司产品。α-32P dCTP为亚辉公司产品。
, 百拇医药
1.2 质粒及细胞株 质粒PsisCAT 6a由Tucker Collins博士惠赠。质粒Pcep4及人APP cDNA695,751由Chris Eckman博士惠赠,APP cDNA第717位点缬基酸突变为异亮氨酸(V717I)。SY5Y神经母细胞瘤细胞由宣武医院多肽研究室赠送。
1.3 质粒构建 从质粒PsisCAT 6a回收1.5kb含PDGF启动子的BamHⅠ~HindⅢ片段。9.6kbNheⅠ~BglⅡ载体片段由质粒PCEP4回收。APP cDNA695,751V717I片断的酶切位点是HindⅢ~XbaⅠ(如图1)。使用T4DNA ligase在分别独立的反应中,启动子、APP cDNA、载体依摩尔比3∶3∶1及1∶1∶1同时连接。对照组设启动子∶载体=3∶1,APP cDNA∶载体=3∶1。反应时间:16℃ 8~12 h,22℃ 3 h。连接反应结束后,转化E.coli.HB101感受态细胞,转化混合物铺于含Amp琼脂平板上,37℃培养12~16 h。挑选阳性克隆,利用不同的限制性内切酶进行酶切鉴定。
, 百拇医药
图1 APP cDNA真核表达载体构建
1.4 转染 SY5Y神经母细胞瘤细胞是贴壁细胞,在DMEM(含10%FBS、100 IU/ml青霉素、100 μg/ml链霉素)37℃、5%CO2条件下培养。当细胞达到50%~80%融合时,用脂质体Lipeofectamine(GIBCO BRL)进行转染。质粒DNA与脂质体的比例为1 μg∶5 μl。
1.5 鉴定 转染46~48 h后,Northern bolt杂交检测瞬时表达。用TRIZol Reagent试剂(GIBCO BRL)提取细胞总RNA,每50 ml细胞培养瓶加2.4 ml TRIZol Reagent,吸管吹打数次混匀后,按每1.5 eppendorf管分装1 ml匀浆,余下操作依TRIZol Reagent试剂说明书进行。RNA样品在甲醛变性胶电泳,每泳道加30 μg RNA。转膜后,尼龙膜于Bio-Rad Gene-linker紫外交联,选择Southern damp membrane(C3)程序。探针分别选择PPDAP751、PPDAP695的1.6 kb和1.4 kb的HindⅢ-BamHⅠ片段。用Prime-a-gene-labelling System Kit(Promega U1100)标记探针和β-actin。同位素标记为α-32P dCTP。
, http://www.100md.com
2 结 果
2.1 定向克隆的最终目的是将PCEP4-APP表达质粒的CMV启动子换为具有神经组织特异性的PDGF启动子。由于APP cNDA695,751V717I内有一个BglⅡ酶切位点,所以不能在质粒PCEP4上直接置换。各个连接反应条件均得到转化菌落,经扩增、质粒提取后,进行酶切鉴定。APP695共得到16个阳性克隆,APP751得到3个阳性克隆。但由于数量较少,无法比较最佳反应条件。图2为酶切鉴定结果。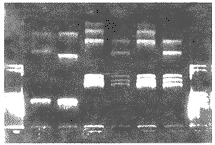
图2 PDAP695,751酶切鉴定结果
PCEP4的1 443位点存在NcoⅠ的酶切位点,距CMV启动子内的NcoⅠ位点约0.7 kb,置换为PDGF启动子后,PDGF启动子内也存在NcoⅠ位点,但距离为1.4 kb。置换前后表达载体其他NcoⅠ位点不变,所以通过NcoⅠ酶切并与原PCEP4-APP比较可以确定质粒已置换为PDGF启动子,并保留其他组件。重组质粒在启动子和APP cDNA5′端连接处,恢复一个HindⅢ酶切位点,同时,BamHⅠ在APP cDNA3′端和载体连接处及APP cDNA内部各有一个酶切位点。双酶切的结果,电泳第一条带0.5 kb,第二条带长度PPDAP751为1.6 kb,PPDAP695为1.4 kb,第三条带为载体9.6 kb片段。
, http://www.100md.com
2.2 Northern blot杂交选择APP cDNA751、695有差别的HindⅢ-BamHⅠ片段作为探针。由于APP751包含蛋白酶抑制子编码区,所以二者长度相差168 bp(见图3)。SY5Y细胞系是来源于人类的神经母细胞瘤细胞,为防止内源APP影响杂交结果判定,选择β-actin作为内对照。Northern blot杂交结果见图4。
图3 回收APP695、751探针电泳图
图4 Northern blot杂交结果
3 讨 论
AD病因研究和药物筛选的主要障碍是缺少一个合适的动物模型。虽然化学方法、免疫方法甚至将多肽直接注入啮齿类动物脑内的努力都已尝试,但结果都不是很理想〔4〕。随着转基因技术的发展,复制AD转基因动物模型已成为一个主要发展方向〔5,6〕。
, 百拇医药
研究表明,直接表达APP基因的Aβ片段或C99~104片段以产生AD表型,可能不是一个适当的策略〔7~10〕。而APP基因组长达170 kb〔11〕,转基因操作难度较大。已在病人脑部发现APP各剪接单体表达比例的异常,推测APP基因的异常表达与AD发病有关。在M17成纤维细胞瘤细胞中发现V717I突变可增加A4(1~42)与A4(1~40)的比例,而前者正是选择沉淀在斑块核心的主要成分,证明这些突变是致病性的〔2〕。由于鼠内源APP与人的同源性高达97.5%,而且鼠生命周期较短,所以必须选择一个强启动子在鼠脑特异表达人APP。PDGF启动子在转基因鼠的神经系统广泛表达,而且主要分布在皮层、海马回、下丘脑、小脑神经元,与AD一致〔12〕。根据以上结果我们选择了PDGF启动子调控APP cDNA695、751V717I构建转基因。常规克隆为两个片段连接,在反应体系存在三个片段的情况下重组体的可能性将远大于两个片段的连接的情况。不同粘性末端将干扰重组体成环。由于APP cDNA695,751V717I内有一个BglⅡ酶切位点,所以不能在质粒PCEP4-APP上直接将CMV启动子置换成PDGF启动子。本实验在摩尔比为3∶3∶1及1∶1∶1的条件下均得到阳性克隆,但数量极少。
, http://www.100md.com
我们正进行显微注射将回收的APP转基因片段注入小鼠受精卵的雄性原核,PCR检测已得到阳性动物,现正进行进一步研究。目的是建立与人类AD发病机制相似并有助于药物筛选的动物模型。
致谢 感谢张连峰、孟雁、刘艳、曾萍、沈洁、马耀文、刘雪丰、尹红星的指导与帮助。
1 本课题受国家科技部资助(特别资助)
作者简介:常 洋,男,29岁,博士生,研究方向:分子遗传
参考文献
1 Jie K, Hans-Georg L, Unterbeek A et al.The precursor of Alzheimer′s disease amyloid A4 protein resemblems a Cell-surface receptor.Nature,1987;325(19):733
, http://www.100md.com
2 Steven AJ, Thomas M, Babara C et al.Relation of neuronal APP-751/APP-695 mRNA ratio and neuritic plaque density in Alzheimer′s disease.Science,1990;248:854
3 Suzuki N, Tobum T, Cai XD et al.An increase percentage of long amyloid β-protein secreted by familial amyloid β protein precursor(β APP717) mutations.Science,1994;264:1336
4 Games D, Khan KM, Sorinao FG.Lack of Alzheimer pathology after β-Amyloid protein injections in rat brain.Neurobiol Aging,1992;13:569
, 百拇医药
5 Adriano A, Sebastian B, Ulrich S et al.Transgenic and knock-out mice:Models of neurological disease.Neurobiology of Aging,1992;13:569
6 Alan RS.Transgenic Animals.Mole Med,1996;334(10):653
7 Wirak DO, Bayrey R, Ramabhaelram TV et al.Deposits of amyloid β protein in the central nervous system of transgenic mice.Science,1991;253:323
8 Wirak DO, Bayrey R, Ramabhaelram TV et al.Age-associated inclusion in normal and transgenic mouse brain.Science,1992;255:1445
, 百拇医药
9 Ali SM, Siledlak SL, Gonzalze PA et al.Artificial strain-specific signs of incipient brain amyloidosis in APP transgenicmice.Neurobiol Aging,1996;17:223
10 Kawabata S, Hinggins GA, Gordon JW et al.Amyloidplaques neurofibrillary tangles and neuronal loss in brains of transgenic mice overexpressing a C-terminal fragment of human amyloid precursor protein.Nature,1991;354:476
11 Yoshikai S, Sasaki H, Dohura K et al.Genomic organization of the human amyloid betaprotein precursor gene.Gene,1990;87:257
12 Masakiyo S, Jochen W, Elaine W et al.PDGF B-chain in neurous of the central nervous system, Posterior Pituitary, and in a Transgenic Model.Cell,1991;64:217
〔1998-12-10收稿 1999-01-08修回〕, 百拇医药
单位:常 洋 秦 蔡有余(中国医学科学院中国协和医科大学实验动物研究所,北京 100021);川琦祖和 中国医学科学院中国协和医科大学基础医学研究所
关键词:APP;定向克隆;表达载体;SY5Y细胞
中国老年学杂志/990429 摘 要 目的 重组APP基因真核表达载体。方法 采用定向克隆技术、脂质体转染和Northen blot杂交技术。结果 在分别独立的反应中,PDGF启动子、APP cDNA、载体依摩尔比3∶3∶1及1∶1∶1同时连接,重组体利用脂质体介导转染SY5Y神经母细胞瘤细胞,Northern bolt杂交检测到瞬时表达。结论 构建具有神经组织特异性的APP基因真核表达载体。
The construction of the eukaryotic expression
, http://www.100md.com
vector of mutation APP gene and its identification
Chang Yang, Qin Chuan, Qi Zuhe et al
Department of Genetics, Institute of Laboratory Animal
Science, Peking Union Medical College & Chinese Academy
of Medical Science, PUMC&CAMS, Beijing 100021
Contemporary research shows that the mutation overproduction of and accumulation of β-amyloid precuser protein(β APP) is closely related to the developmens of Alzheimer's disease. We constructed the recombinant plasmid containing the human APP cDNA 695, 751V717I driven by PDGF promoter which expressed specifically in nervous system. With two respecting molar ratio of 3∶3∶1 and 1∶1∶1, the promoter, APP cDNA were subcloned into the vector. The recombinant was introduced into SY5Y cell by lipeofectamine, and the expression of the construction was analysed by Northern blot. Now, we are microjecting the transgene into the male pronucleus of the zygotes, aim at providing a resembling animal model of the human mechanism.
, 百拇医药
Key words APP directional cloning expression vector SY5Y cells
早老性痴呆(AD)是进行性神经降解性疾病,是威胁人类健康的神经系统主要疾病之一。AD的主要病理表现是在脑部形成淀粉样斑块。斑块的主要成分是从淀粉样前体蛋白(β-APP)衍生的具有神经毒性的多肽片断Aβ〔1〕。现在的研究认为APP基因的突变和异常表达与AD的发生有关〔2,3〕。然而,动物模型的缺少已成为AD发病机制研究和药物筛选的主要障碍。为克服这一障碍,我们构建了血小板衍生生长因子启动子(PDGF promoter)调控下的重组质粒,并在细胞水平检测了质粒的表达,为我们现在进行的建立AD转基因动物模型工作奠定了基础。
1 材料与方法
1.1 酶及主要生化试剂 限制性内切酶、T4 DNA连接酶等均购自Promega公司、华美生物工程公司和中国医学科学院友谊公司。DNA快速纯化回收试剂盒为天象人生物工程公司产品。α-32P dCTP为亚辉公司产品。
, 百拇医药
1.2 质粒及细胞株 质粒PsisCAT 6a由Tucker Collins博士惠赠。质粒Pcep4及人APP cDNA695,751由Chris Eckman博士惠赠,APP cDNA第717位点缬基酸突变为异亮氨酸(V717I)。SY5Y神经母细胞瘤细胞由宣武医院多肽研究室赠送。
1.3 质粒构建 从质粒PsisCAT 6a回收1.5kb含PDGF启动子的BamHⅠ~HindⅢ片段。9.6kbNheⅠ~BglⅡ载体片段由质粒PCEP4回收。APP cDNA695,751V717I片断的酶切位点是HindⅢ~XbaⅠ(如图1)。使用T4DNA ligase在分别独立的反应中,启动子、APP cDNA、载体依摩尔比3∶3∶1及1∶1∶1同时连接。对照组设启动子∶载体=3∶1,APP cDNA∶载体=3∶1。反应时间:16℃ 8~12 h,22℃ 3 h。连接反应结束后,转化E.coli.HB101感受态细胞,转化混合物铺于含Amp琼脂平板上,37℃培养12~16 h。挑选阳性克隆,利用不同的限制性内切酶进行酶切鉴定。

, 百拇医药
图1 APP cDNA真核表达载体构建
1.4 转染 SY5Y神经母细胞瘤细胞是贴壁细胞,在DMEM(含10%FBS、100 IU/ml青霉素、100 μg/ml链霉素)37℃、5%CO2条件下培养。当细胞达到50%~80%融合时,用脂质体Lipeofectamine(GIBCO BRL)进行转染。质粒DNA与脂质体的比例为1 μg∶5 μl。
1.5 鉴定 转染46~48 h后,Northern bolt杂交检测瞬时表达。用TRIZol Reagent试剂(GIBCO BRL)提取细胞总RNA,每50 ml细胞培养瓶加2.4 ml TRIZol Reagent,吸管吹打数次混匀后,按每1.5 eppendorf管分装1 ml匀浆,余下操作依TRIZol Reagent试剂说明书进行。RNA样品在甲醛变性胶电泳,每泳道加30 μg RNA。转膜后,尼龙膜于Bio-Rad Gene-linker紫外交联,选择Southern damp membrane(C3)程序。探针分别选择PPDAP751、PPDAP695的1.6 kb和1.4 kb的HindⅢ-BamHⅠ片段。用Prime-a-gene-labelling System Kit(Promega U1100)标记探针和β-actin。同位素标记为α-32P dCTP。
, http://www.100md.com
2 结 果
2.1 定向克隆的最终目的是将PCEP4-APP表达质粒的CMV启动子换为具有神经组织特异性的PDGF启动子。由于APP cNDA695,751V717I内有一个BglⅡ酶切位点,所以不能在质粒PCEP4上直接置换。各个连接反应条件均得到转化菌落,经扩增、质粒提取后,进行酶切鉴定。APP695共得到16个阳性克隆,APP751得到3个阳性克隆。但由于数量较少,无法比较最佳反应条件。图2为酶切鉴定结果。

图2 PDAP695,751酶切鉴定结果
PCEP4的1 443位点存在NcoⅠ的酶切位点,距CMV启动子内的NcoⅠ位点约0.7 kb,置换为PDGF启动子后,PDGF启动子内也存在NcoⅠ位点,但距离为1.4 kb。置换前后表达载体其他NcoⅠ位点不变,所以通过NcoⅠ酶切并与原PCEP4-APP比较可以确定质粒已置换为PDGF启动子,并保留其他组件。重组质粒在启动子和APP cDNA5′端连接处,恢复一个HindⅢ酶切位点,同时,BamHⅠ在APP cDNA3′端和载体连接处及APP cDNA内部各有一个酶切位点。双酶切的结果,电泳第一条带0.5 kb,第二条带长度PPDAP751为1.6 kb,PPDAP695为1.4 kb,第三条带为载体9.6 kb片段。
, http://www.100md.com
2.2 Northern blot杂交选择APP cDNA751、695有差别的HindⅢ-BamHⅠ片段作为探针。由于APP751包含蛋白酶抑制子编码区,所以二者长度相差168 bp(见图3)。SY5Y细胞系是来源于人类的神经母细胞瘤细胞,为防止内源APP影响杂交结果判定,选择β-actin作为内对照。Northern blot杂交结果见图4。

图3 回收APP695、751探针电泳图

图4 Northern blot杂交结果
3 讨 论
AD病因研究和药物筛选的主要障碍是缺少一个合适的动物模型。虽然化学方法、免疫方法甚至将多肽直接注入啮齿类动物脑内的努力都已尝试,但结果都不是很理想〔4〕。随着转基因技术的发展,复制AD转基因动物模型已成为一个主要发展方向〔5,6〕。
, 百拇医药
研究表明,直接表达APP基因的Aβ片段或C99~104片段以产生AD表型,可能不是一个适当的策略〔7~10〕。而APP基因组长达170 kb〔11〕,转基因操作难度较大。已在病人脑部发现APP各剪接单体表达比例的异常,推测APP基因的异常表达与AD发病有关。在M17成纤维细胞瘤细胞中发现V717I突变可增加A4(1~42)与A4(1~40)的比例,而前者正是选择沉淀在斑块核心的主要成分,证明这些突变是致病性的〔2〕。由于鼠内源APP与人的同源性高达97.5%,而且鼠生命周期较短,所以必须选择一个强启动子在鼠脑特异表达人APP。PDGF启动子在转基因鼠的神经系统广泛表达,而且主要分布在皮层、海马回、下丘脑、小脑神经元,与AD一致〔12〕。根据以上结果我们选择了PDGF启动子调控APP cDNA695、751V717I构建转基因。常规克隆为两个片段连接,在反应体系存在三个片段的情况下重组体的可能性将远大于两个片段的连接的情况。不同粘性末端将干扰重组体成环。由于APP cDNA695,751V717I内有一个BglⅡ酶切位点,所以不能在质粒PCEP4-APP上直接将CMV启动子置换成PDGF启动子。本实验在摩尔比为3∶3∶1及1∶1∶1的条件下均得到阳性克隆,但数量极少。
, http://www.100md.com
我们正进行显微注射将回收的APP转基因片段注入小鼠受精卵的雄性原核,PCR检测已得到阳性动物,现正进行进一步研究。目的是建立与人类AD发病机制相似并有助于药物筛选的动物模型。
致谢 感谢张连峰、孟雁、刘艳、曾萍、沈洁、马耀文、刘雪丰、尹红星的指导与帮助。
1 本课题受国家科技部资助(特别资助)
作者简介:常 洋,男,29岁,博士生,研究方向:分子遗传
参考文献
1 Jie K, Hans-Georg L, Unterbeek A et al.The precursor of Alzheimer′s disease amyloid A4 protein resemblems a Cell-surface receptor.Nature,1987;325(19):733
, http://www.100md.com
2 Steven AJ, Thomas M, Babara C et al.Relation of neuronal APP-751/APP-695 mRNA ratio and neuritic plaque density in Alzheimer′s disease.Science,1990;248:854
3 Suzuki N, Tobum T, Cai XD et al.An increase percentage of long amyloid β-protein secreted by familial amyloid β protein precursor(β APP717) mutations.Science,1994;264:1336
4 Games D, Khan KM, Sorinao FG.Lack of Alzheimer pathology after β-Amyloid protein injections in rat brain.Neurobiol Aging,1992;13:569
, 百拇医药
5 Adriano A, Sebastian B, Ulrich S et al.Transgenic and knock-out mice:Models of neurological disease.Neurobiology of Aging,1992;13:569
6 Alan RS.Transgenic Animals.Mole Med,1996;334(10):653
7 Wirak DO, Bayrey R, Ramabhaelram TV et al.Deposits of amyloid β protein in the central nervous system of transgenic mice.Science,1991;253:323
8 Wirak DO, Bayrey R, Ramabhaelram TV et al.Age-associated inclusion in normal and transgenic mouse brain.Science,1992;255:1445
, 百拇医药
9 Ali SM, Siledlak SL, Gonzalze PA et al.Artificial strain-specific signs of incipient brain amyloidosis in APP transgenicmice.Neurobiol Aging,1996;17:223
10 Kawabata S, Hinggins GA, Gordon JW et al.Amyloidplaques neurofibrillary tangles and neuronal loss in brains of transgenic mice overexpressing a C-terminal fragment of human amyloid precursor protein.Nature,1991;354:476
11 Yoshikai S, Sasaki H, Dohura K et al.Genomic organization of the human amyloid betaprotein precursor gene.Gene,1990;87:257
12 Masakiyo S, Jochen W, Elaine W et al.PDGF B-chain in neurous of the central nervous system, Posterior Pituitary, and in a Transgenic Model.Cell,1991;64:217
〔1998-12-10收稿 1999-01-08修回〕, 百拇医药