甲状腺功能低下对大鼠小脑细胞凋亡的影响
作者:张桂华 刘家慧 马春节 褚丽萍 赵启仁
单位:中国医学科学院 中国协和医科大学 放射医学研究所,天津 300192
关键词:甲状腺激素;小脑;细胞凋亡;脑发育;大鼠
甲状腺功能低下对大鼠小脑细胞凋亡的影响 摘要 目的 观察发育期大鼠小脑细胞程序化死亡(PCD)的发生及甲状腺素(T4)对大鼠小脑PCD的影响。方法 用丙基硫氧嘧啶(PTU)复制甲状腺功能低下的大鼠动物模型,然后用原位末端标记方法检测PCD阳性细胞。结果 (1)PTU组母鼠和各日龄仔鼠血清T4水平明显低于对照组(P<0.01或P<0.05);PTU+T4组仔鼠用T4替代后血清T4水平恢复正常;PTU组T3代偿性升高;(2)正常小脑各层内均有散在的凋亡细胞,以内颗粒层最多;正常小脑生后10天和20天有两个PCD高峰;甲低使小脑各层结构内PCD数量均增加,而且PCD峰分别延迟到生后15天和30天;补充T4后PCD数量及峰值基本恢复正常。结论 T4不但促进发育期脑细胞的增殖、迁移和分化,对脑细胞的PCD也有明显影响。
, 百拇医药
中图分类号 R581.2;Q255 [文献标识码] A [文章编号] 1000-4955(1999)04-0241-04
Hypothyroidism led to increase of apoptotic cells in developing rat cerebellum
ZHANG Gui-hua,LIU Jia-hui,MA Chun-jie,et al
(Institute of Radiation Medicine,CAMS and PUMC,Tianjin 300192,China)
Abstract Objective To study programmed cell death (PCD) of developing rat cerebellum and the effects of thyroid hormone on PCD of rat cerebellum.Methods Replicated the hypothyroid rat model with propylthiouracil (PTU),and then detected the positive cells of PCD in sections by TdT-mediated dUTP nick end labeling.Results (1)Serum T4 levels of dams and their offspring in PTU group are significantly lower than those in control group (P<0.05 or P<0.01);In PTU+T4 group the T4 levels of offspring recover to the normal after giving physiological dose of T4;Serum T3 levels are increased compensatively in PTU group;(2)The labeling staining has shown that the apoptotic cells in every cerebellar layer are scattered,the number of apototic cells in internal granular layer (IGL) is much more than other layers;There are two peaks of PCD during the developing process of normal rat cerebellum on postnatal days 10 and 20 respectively;Hypothyroidism leads to increasement of apoptotic cells in every cerebellar layer and retardation of apoptotic peaks to postnatal days 15 and 30 respectively;After T4 supplementation the number of apoptotic cells and the peaks almost return to normal.Conclusions T4 not only promotes the cell proliferation,migration and differentiation,it does greatly effect PCD of developing cerebellum also.
, 百拇医药
Key words Thyroid hormone;Cerebellum;Apoptosis;Brain development;Rat
甲状腺激素(TH)是影响脑发育的关键激素,但其作用机制及作用的具体环节仍不完全清楚。已知小脑发育过程中存在程序化细胞死亡(PCD)[1],国外虽有TH影响发育期小脑细胞PCD的报导[2,3],但资料不完整,结果也各有差别,国内尚无这方面的研究资料。据此,本实验将发育期大鼠小脑的PCD过程同TH的作用联系起来进行研究,探讨TH对小脑PCD的影响,为解释TH影响脑发育的某些机理提供实验依据,并为深入研究脑细胞PCD的发生机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物:Wistar大鼠,200~220g,购自中国医学科学院实验动物中心。
, http://www.100md.com
1.1.2 试剂:T3、T4放免药盒(中国医学科学院核技术中心);甲状腺素、丙基硫氧嘧啶(PTU,Sigma);原位标记细胞凋亡检测药盒(德国BM公司);其它生化试剂均为分析纯。
1.2 实验过程
1.2.1 实验动物的分组:将妊娠18天的母鼠随机分成三组,即对照组、PTU组和PTU+T4组。
1.2.1.1 对照组:不加任何处理因素。
1.2.1.2 PTU组:自妊娠18天起给母鼠投入PTU,每天每100g体重25mg PTU,用胃管给药,给药时间一直持续到其所生仔鼠全部处死为止。
1.2.1.3 PTU+T4组:给药时间和剂量与实验组相同,不同的是:其仔鼠出生后,腹腔注射甲状腺素(L-thyroxine,T4),给药时间和剂量按文献[4]。
, http://www.100md.com
1.2.2 取材:上述三组母鼠所生仔鼠分为5、10、15、20、30天5个日龄组,将达到所需日龄的仔鼠断头收集血清,为获得足量血清需收集几只小鼠的血作为一个样本。并迅速取出小脑称重,放入4%的中性福尔马林液中固定。
1.2.3 甲状腺激素测定:用T3、T4放免试剂盒测定动物血清T3与T4水平。
1.2.4 小脑细胞程序化死亡的观察:常规方法进行组织制片,用原位末端标记技术[5],即TUNEL方法来标记已发生DNA断裂的细胞,镜下观察并计数凋亡细胞的数目。
1.3 数据的统计学处理:本实验中的实验数据以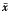 ±s表示,统计处理采用t检验。
±s表示,统计处理采用t检验。
, 百拇医药
2 实验结果
2.1 血清T3、T4水平:见表1和表2。
表1 母鼠和仔鼠血清T4水平(ng/ml)
Days
Control(C)
PTU
PTU+T4
5
13.59±9.10
0.46±0.50**
, http://www.100md.com
24.56±9.95##
10
16.25±10.0
0.80±0.78**
44.07±5.36*##
15
34.51±28.18
1.5±0.97**
56.94±5.65##
20
, http://www.100md.com 30.94±8.69
1.75±0.91*
46.15±3.55#
30
38.06±13.59
1.62±1.46*
23.02±6.58#
Dams
33.23±13.12
0.35±0.29*
, http://www.100md.com -
注:n=3, PTU vs PTU+T4 #P<0.05,##P<0.01;
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01 表2 母鼠和仔鼠血清T3水平(ng/ml)
Days
Control(C)
PTU
PTU+T4
5
0.89±0.16
0.93±0.35
, 百拇医药
0.79±0.50
10
1.24±0.70
1.48±0.74
0.61±0.21*#
15
1.54±0.18
1.69±1.12
0.99±0.08**##
20
0.91±0.19
, http://www.100md.com 2.54±0.80**
0.78±0.07#
30
1.10±0.01
0.84±0.15*
0.58±0.23**
Dams
0.83±0.25
0.11±0.06**
-
注:n=3, PTU vs PTU+T4 #P<0.05,##P<0.01;
, http://www.100md.com
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01
从表1可以看出:PTU组血清T4水平均明显低于对照组(P<0.01或P<0.05),两组差别有高度的显著性意义;PTU+T4组仔鼠T4水平明显增加,说明给予T4已纠正了PTU导致的甲状腺功能低下状态。表2结果显示:T4能纠正PTU所致的血清T3代偿性升高,使仔鼠血清T3水平回落。上述结果说明我们的实验组动物确实处于甲状腺功能低下状态。
2.2 动物小脑重量的变化:从表3可以看出:实验组各日龄仔鼠的脑重均明显低于对照组,补充T4后脑重都有不同程度的改善,但与对照组仍有差距。
表3 大鼠小脑的重量(mg)
, http://www.100md.com
Days
Control(C)
PTU
PTU+T4
5
83.50±12.66
69.13±7.99*
74.00±4.78**
10
150.13±19.81
131.5±5.58*
, 百拇医药
131.56±22.17*
15
215.38±23.00
192.63±23.21**
207.62±42.13
20
272.29±22.31
221.83±13.04**
227.29±14.84**
30
, http://www.100md.com 301.67±19.62
246.00±8.94**
275.83±9.68**#
注:n=8, PTU vs PTU+T4 #P<0.05;
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01
2.3 小脑的组织形态学变化:镜下对照组小脑外颗粒细胞层(EGL)生后20天仅剩一层细胞,而PTU组发育明显延迟,20日龄时EGL仍有2~5层细胞,30日龄时还有1~2层细胞未消失,分子层与白质发育也较差;PTU+T4组组织学发育已与对照组相似。细胞PCD的情况:(1)镜下可见染色阳性的凋亡细胞散在分布,EGL、IGL(内颗粒细胞层)、分子层、白质均有凋亡的细胞,以IGL内凋亡细胞最多;PTU组凋亡细胞的数量明显增多,在EGL、分子层与白质中PCD增加近一倍,在IGL增加4倍;给予T4后PCD明显减少,接近正常鼠水平,见图1。(2)对照组在10天与20天出现两个凋亡小峰,PTU组这两个峰出现延迟,补充T4后峰型恢复至近正常,结果见图2。
, 百拇医药
图1 小脑不同层次内发生PCD的数量
图2 不同时间小脑发生PC的数量
3 讨论
同细胞增殖与分化一样,PCD也是主动的生理过程,是CNS形成与发育不可缺少的环节,CNS在发生发育与分化过程中将有50%细胞发生PCD[6]。以往研究TH对脑发育的影响,只注重脑发育的一个侧面—即细胞的增殖、生长和分化,而TH对脑发育另一侧面—PCD影响的研究很少,尚无系统的资料。因此,我们进行了这方面的研究。之所以选择小脑,因为大鼠小脑主要在生后发育,且小脑小叶只有EGL、分子层、浦氏细胞层、IGL与白质5种层次,结构清晰,易于观察,也便于施加处理因素,是观察激素与药物作用的良好模型,我们正是利用这一特点来研究甲状腺激素对小脑PCD的影响。
, 百拇医药
丙基硫氧嘧啶(PTU)是阻断甲状腺功能的常用药物,它能抑制甲状腺激素的合成[7]。本实验利用PTU已造成了动物明显甲状腺功能低下状态,说明实验的模型是成功的,为进一步验证是T4的作用,实验中设了PTU+T4组。
实验说明T4下降导致小脑发育过程中PCD增加,使细胞凋亡总数平均增高2.35倍,以内颗粒层尤为突出,是正常的4.6倍;分析一下小脑各层凋亡细胞的比例可见PTU组60%以上的凋亡是发生在内颗粒层,对照组仅占40%左右;补充T4后PCD数量减少,恢复近正常水平。同时我们的结果首次证明:大鼠小脑发育过程中要经过两次PCD高峰,分别在生后10天和20天,甲低则使这两个PCD峰延迟到15天和30天。对照组凋亡峰的出现分别与小脑生后发育的细胞增殖和神经网络形成过程在时间上相吻合,这表明PCD可能与这两个过程密切相关;甲低时细胞增殖、迁移、分化等各项指标均延迟,也致使PCD后移。推测T4缺乏时,由于PCD过程受到影响,使不该死亡的细胞在不恰当的时间内发生了死亡,尤其在突触形成时期,神经元过多的、或延迟的死亡导致突触联接的错位及紊乱,阻碍了小脑发育与功能成熟。
, http://www.100md.com
甲低引起PCD增多的机制,可能与浦氏细胞发育受阻、神经营养因子家族成员的合成和表达障碍有关。正常情况下细胞的存活与死亡取决于它们能否与其支配的靶形成恰当稳定的联系并得到足够的神经营养因子[8]。有研究表明,小脑EGL细胞在向内迁移过程中及定位于内颗粒层之后,均需同浦氏细胞的纤维接触和联系,以保证其迁移过程的顺利进行及到达目的地后的进一步分化,当T4缺乏时,一方面首先影响了浦氏细胞的发育,该细胞树突分枝减少,树突生长严重受阻,颗粒细胞无法与之形成有效的接触和联络[7],便在原位、中途或目的地相继死亡;另一方面,当T4缺乏时,神经营养因子家族的某些成员及其受体(比如NGF/trkA、BDNF/trkB、NT-3/trkC、p75LNGFR等)的表达与合成均受到影响[3,7,8],这样在竞争极其有限的神经营养因子的过程中,有一部分不该死亡的细胞又因得不到足够的神经营养因子而死亡。
甲状腺激素除了影响神经营养因子途径外,似乎还可以直接启动Bcl-2凋亡途径。Muller Y.找到了甲状腺激素促进Bcl-2表达的直接证据[9],发现生后甲低大鼠小脑内Bcl-2蛋白明显降低,T4能使Bcl-2明显增加, 认为甲状腺激素通过促进Bcl-2蛋白的合成来阻止新形成的和早期分化的颗粒神经元的凋亡。
, 百拇医药
综上所述,甲状腺激素缺乏使小脑细胞PCD增加可能通过以下途径:(1)T4不足→浦氏细胞树突分枝减少→颗粒细胞失去依附和联络→发生PCD;(2)T4不足→神经营养因子家族及其受体表达与合成受阻→发生PCD;(3)T4不足→Bcl-2蛋白减少→发生PCD。
基金来源:天津市21世纪-青年科学基金(963707911)
作者简介:张桂华,女,1961年生,副研究员,硕士
参考文献
[1] Wood KA,Dipasquale B,Youle RJ.In situ labeling of granule cells for apoptosis-associated DNA fragmentation reveals different mechanisms of cell loss in developing cerebellum[J].Neuron,1993,11:621-632.
, 百拇医药
[2] Rabie A,Favre C,Clavel MC,et al.Sequential effects of thyroxine on the developing cerebellum of rats made hypothyroid by propylthiouracil[J].Brain Res,1979,161:469-479.
[3] Neveu I,Arenas E.Neurotrophins promote survival and development of neurons in the cerebellum of hypothyroid rats in vivo[J].J Cell Biol,1996,133(3):631-646.
[4] 陈祖培,王仁明,朱学良,等.脑发育临界期的实验研究[J].地方病通讯,1986,1(2):87-91.
[5] Billig H,Furuta I,Hsueh AJW.Estrogens inhibit and androgens enhance overian granulosa cell apoptosis[J].Endocrinology,1993,133(5):2204-2212.
, 百拇医药
[6] Naruse I,Keino H.Apoptosis in the developing CNS[J].Prog Neurobiol,1995,47:135-155.
[7] Legrand Ch,Clos J.Biochemical,immunocytochemical and morphological evidence for an interaction between thyroid hormone and nerve growth factor in the developing cerebellum of normal and hypothyroid rats[J].Dev Neurosci,1991,13:382-396.
[8] Raff MC,Barres BA,Burne JF,et al.Programmed cell death and the control of cell survival:Lessons from the nervous system[J].Science,1993,262:695-700.
[9] Muller Y,Rocchi E,Lazaro JB,et al.Thyroid hormone promotes Bcl-2 expression and prevents apoptosis of early differentiation cerebellar granule neurons[J].Int J Dev Neurosci,1995,13(8):871-885.
收稿日期1998-11-28;修订日期1999-03-20, 百拇医药
单位:中国医学科学院 中国协和医科大学 放射医学研究所,天津 300192
关键词:甲状腺激素;小脑;细胞凋亡;脑发育;大鼠
甲状腺功能低下对大鼠小脑细胞凋亡的影响 摘要 目的 观察发育期大鼠小脑细胞程序化死亡(PCD)的发生及甲状腺素(T4)对大鼠小脑PCD的影响。方法 用丙基硫氧嘧啶(PTU)复制甲状腺功能低下的大鼠动物模型,然后用原位末端标记方法检测PCD阳性细胞。结果 (1)PTU组母鼠和各日龄仔鼠血清T4水平明显低于对照组(P<0.01或P<0.05);PTU+T4组仔鼠用T4替代后血清T4水平恢复正常;PTU组T3代偿性升高;(2)正常小脑各层内均有散在的凋亡细胞,以内颗粒层最多;正常小脑生后10天和20天有两个PCD高峰;甲低使小脑各层结构内PCD数量均增加,而且PCD峰分别延迟到生后15天和30天;补充T4后PCD数量及峰值基本恢复正常。结论 T4不但促进发育期脑细胞的增殖、迁移和分化,对脑细胞的PCD也有明显影响。
, 百拇医药
中图分类号 R581.2;Q255 [文献标识码] A [文章编号] 1000-4955(1999)04-0241-04
Hypothyroidism led to increase of apoptotic cells in developing rat cerebellum
ZHANG Gui-hua,LIU Jia-hui,MA Chun-jie,et al
(Institute of Radiation Medicine,CAMS and PUMC,Tianjin 300192,China)
Abstract Objective To study programmed cell death (PCD) of developing rat cerebellum and the effects of thyroid hormone on PCD of rat cerebellum.Methods Replicated the hypothyroid rat model with propylthiouracil (PTU),and then detected the positive cells of PCD in sections by TdT-mediated dUTP nick end labeling.Results (1)Serum T4 levels of dams and their offspring in PTU group are significantly lower than those in control group (P<0.05 or P<0.01);In PTU+T4 group the T4 levels of offspring recover to the normal after giving physiological dose of T4;Serum T3 levels are increased compensatively in PTU group;(2)The labeling staining has shown that the apoptotic cells in every cerebellar layer are scattered,the number of apototic cells in internal granular layer (IGL) is much more than other layers;There are two peaks of PCD during the developing process of normal rat cerebellum on postnatal days 10 and 20 respectively;Hypothyroidism leads to increasement of apoptotic cells in every cerebellar layer and retardation of apoptotic peaks to postnatal days 15 and 30 respectively;After T4 supplementation the number of apoptotic cells and the peaks almost return to normal.Conclusions T4 not only promotes the cell proliferation,migration and differentiation,it does greatly effect PCD of developing cerebellum also.
, 百拇医药
Key words Thyroid hormone;Cerebellum;Apoptosis;Brain development;Rat
甲状腺激素(TH)是影响脑发育的关键激素,但其作用机制及作用的具体环节仍不完全清楚。已知小脑发育过程中存在程序化细胞死亡(PCD)[1],国外虽有TH影响发育期小脑细胞PCD的报导[2,3],但资料不完整,结果也各有差别,国内尚无这方面的研究资料。据此,本实验将发育期大鼠小脑的PCD过程同TH的作用联系起来进行研究,探讨TH对小脑PCD的影响,为解释TH影响脑发育的某些机理提供实验依据,并为深入研究脑细胞PCD的发生机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物:Wistar大鼠,200~220g,购自中国医学科学院实验动物中心。
, http://www.100md.com
1.1.2 试剂:T3、T4放免药盒(中国医学科学院核技术中心);甲状腺素、丙基硫氧嘧啶(PTU,Sigma);原位标记细胞凋亡检测药盒(德国BM公司);其它生化试剂均为分析纯。
1.2 实验过程
1.2.1 实验动物的分组:将妊娠18天的母鼠随机分成三组,即对照组、PTU组和PTU+T4组。
1.2.1.1 对照组:不加任何处理因素。
1.2.1.2 PTU组:自妊娠18天起给母鼠投入PTU,每天每100g体重25mg PTU,用胃管给药,给药时间一直持续到其所生仔鼠全部处死为止。
1.2.1.3 PTU+T4组:给药时间和剂量与实验组相同,不同的是:其仔鼠出生后,腹腔注射甲状腺素(L-thyroxine,T4),给药时间和剂量按文献[4]。
, http://www.100md.com
1.2.2 取材:上述三组母鼠所生仔鼠分为5、10、15、20、30天5个日龄组,将达到所需日龄的仔鼠断头收集血清,为获得足量血清需收集几只小鼠的血作为一个样本。并迅速取出小脑称重,放入4%的中性福尔马林液中固定。
1.2.3 甲状腺激素测定:用T3、T4放免试剂盒测定动物血清T3与T4水平。
1.2.4 小脑细胞程序化死亡的观察:常规方法进行组织制片,用原位末端标记技术[5],即TUNEL方法来标记已发生DNA断裂的细胞,镜下观察并计数凋亡细胞的数目。
1.3 数据的统计学处理:本实验中的实验数据以
, 百拇医药
2 实验结果
2.1 血清T3、T4水平:见表1和表2。
表1 母鼠和仔鼠血清T4水平(ng/ml)
Days
Control(C)
PTU
PTU+T4
5
13.59±9.10
0.46±0.50**
, http://www.100md.com
24.56±9.95##
10
16.25±10.0
0.80±0.78**
44.07±5.36*##
15
34.51±28.18
1.5±0.97**
56.94±5.65##
20
, http://www.100md.com 30.94±8.69
1.75±0.91*
46.15±3.55#
30
38.06±13.59
1.62±1.46*
23.02±6.58#
Dams
33.23±13.12
0.35±0.29*
, http://www.100md.com -
注:n=3, PTU vs PTU+T4 #P<0.05,##P<0.01;
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01 表2 母鼠和仔鼠血清T3水平(ng/ml)
Days
Control(C)
PTU
PTU+T4
5
0.89±0.16
0.93±0.35
, 百拇医药
0.79±0.50
10
1.24±0.70
1.48±0.74
0.61±0.21*#
15
1.54±0.18
1.69±1.12
0.99±0.08**##
20
0.91±0.19
, http://www.100md.com 2.54±0.80**
0.78±0.07#
30
1.10±0.01
0.84±0.15*
0.58±0.23**
Dams
0.83±0.25
0.11±0.06**
-
注:n=3, PTU vs PTU+T4 #P<0.05,##P<0.01;
, http://www.100md.com
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01
从表1可以看出:PTU组血清T4水平均明显低于对照组(P<0.01或P<0.05),两组差别有高度的显著性意义;PTU+T4组仔鼠T4水平明显增加,说明给予T4已纠正了PTU导致的甲状腺功能低下状态。表2结果显示:T4能纠正PTU所致的血清T3代偿性升高,使仔鼠血清T3水平回落。上述结果说明我们的实验组动物确实处于甲状腺功能低下状态。
2.2 动物小脑重量的变化:从表3可以看出:实验组各日龄仔鼠的脑重均明显低于对照组,补充T4后脑重都有不同程度的改善,但与对照组仍有差距。
表3 大鼠小脑的重量(mg)
, http://www.100md.com
Days
Control(C)
PTU
PTU+T4
5
83.50±12.66
69.13±7.99*
74.00±4.78**
10
150.13±19.81
131.5±5.58*
, 百拇医药
131.56±22.17*
15
215.38±23.00
192.63±23.21**
207.62±42.13
20
272.29±22.31
221.83±13.04**
227.29±14.84**
30
, http://www.100md.com 301.67±19.62
246.00±8.94**
275.83±9.68**#
注:n=8, PTU vs PTU+T4 #P<0.05;
C vs PTU or C vs PTU+T4 *P<0.05,**P<0.01
2.3 小脑的组织形态学变化:镜下对照组小脑外颗粒细胞层(EGL)生后20天仅剩一层细胞,而PTU组发育明显延迟,20日龄时EGL仍有2~5层细胞,30日龄时还有1~2层细胞未消失,分子层与白质发育也较差;PTU+T4组组织学发育已与对照组相似。细胞PCD的情况:(1)镜下可见染色阳性的凋亡细胞散在分布,EGL、IGL(内颗粒细胞层)、分子层、白质均有凋亡的细胞,以IGL内凋亡细胞最多;PTU组凋亡细胞的数量明显增多,在EGL、分子层与白质中PCD增加近一倍,在IGL增加4倍;给予T4后PCD明显减少,接近正常鼠水平,见图1。(2)对照组在10天与20天出现两个凋亡小峰,PTU组这两个峰出现延迟,补充T4后峰型恢复至近正常,结果见图2。

, 百拇医药
图1 小脑不同层次内发生PCD的数量

图2 不同时间小脑发生PC的数量
3 讨论
同细胞增殖与分化一样,PCD也是主动的生理过程,是CNS形成与发育不可缺少的环节,CNS在发生发育与分化过程中将有50%细胞发生PCD[6]。以往研究TH对脑发育的影响,只注重脑发育的一个侧面—即细胞的增殖、生长和分化,而TH对脑发育另一侧面—PCD影响的研究很少,尚无系统的资料。因此,我们进行了这方面的研究。之所以选择小脑,因为大鼠小脑主要在生后发育,且小脑小叶只有EGL、分子层、浦氏细胞层、IGL与白质5种层次,结构清晰,易于观察,也便于施加处理因素,是观察激素与药物作用的良好模型,我们正是利用这一特点来研究甲状腺激素对小脑PCD的影响。
, 百拇医药
丙基硫氧嘧啶(PTU)是阻断甲状腺功能的常用药物,它能抑制甲状腺激素的合成[7]。本实验利用PTU已造成了动物明显甲状腺功能低下状态,说明实验的模型是成功的,为进一步验证是T4的作用,实验中设了PTU+T4组。
实验说明T4下降导致小脑发育过程中PCD增加,使细胞凋亡总数平均增高2.35倍,以内颗粒层尤为突出,是正常的4.6倍;分析一下小脑各层凋亡细胞的比例可见PTU组60%以上的凋亡是发生在内颗粒层,对照组仅占40%左右;补充T4后PCD数量减少,恢复近正常水平。同时我们的结果首次证明:大鼠小脑发育过程中要经过两次PCD高峰,分别在生后10天和20天,甲低则使这两个PCD峰延迟到15天和30天。对照组凋亡峰的出现分别与小脑生后发育的细胞增殖和神经网络形成过程在时间上相吻合,这表明PCD可能与这两个过程密切相关;甲低时细胞增殖、迁移、分化等各项指标均延迟,也致使PCD后移。推测T4缺乏时,由于PCD过程受到影响,使不该死亡的细胞在不恰当的时间内发生了死亡,尤其在突触形成时期,神经元过多的、或延迟的死亡导致突触联接的错位及紊乱,阻碍了小脑发育与功能成熟。
, http://www.100md.com
甲低引起PCD增多的机制,可能与浦氏细胞发育受阻、神经营养因子家族成员的合成和表达障碍有关。正常情况下细胞的存活与死亡取决于它们能否与其支配的靶形成恰当稳定的联系并得到足够的神经营养因子[8]。有研究表明,小脑EGL细胞在向内迁移过程中及定位于内颗粒层之后,均需同浦氏细胞的纤维接触和联系,以保证其迁移过程的顺利进行及到达目的地后的进一步分化,当T4缺乏时,一方面首先影响了浦氏细胞的发育,该细胞树突分枝减少,树突生长严重受阻,颗粒细胞无法与之形成有效的接触和联络[7],便在原位、中途或目的地相继死亡;另一方面,当T4缺乏时,神经营养因子家族的某些成员及其受体(比如NGF/trkA、BDNF/trkB、NT-3/trkC、p75LNGFR等)的表达与合成均受到影响[3,7,8],这样在竞争极其有限的神经营养因子的过程中,有一部分不该死亡的细胞又因得不到足够的神经营养因子而死亡。
甲状腺激素除了影响神经营养因子途径外,似乎还可以直接启动Bcl-2凋亡途径。Muller Y.找到了甲状腺激素促进Bcl-2表达的直接证据[9],发现生后甲低大鼠小脑内Bcl-2蛋白明显降低,T4能使Bcl-2明显增加, 认为甲状腺激素通过促进Bcl-2蛋白的合成来阻止新形成的和早期分化的颗粒神经元的凋亡。
, 百拇医药
综上所述,甲状腺激素缺乏使小脑细胞PCD增加可能通过以下途径:(1)T4不足→浦氏细胞树突分枝减少→颗粒细胞失去依附和联络→发生PCD;(2)T4不足→神经营养因子家族及其受体表达与合成受阻→发生PCD;(3)T4不足→Bcl-2蛋白减少→发生PCD。
基金来源:天津市21世纪-青年科学基金(963707911)
作者简介:张桂华,女,1961年生,副研究员,硕士
参考文献
[1] Wood KA,Dipasquale B,Youle RJ.In situ labeling of granule cells for apoptosis-associated DNA fragmentation reveals different mechanisms of cell loss in developing cerebellum[J].Neuron,1993,11:621-632.
, 百拇医药
[2] Rabie A,Favre C,Clavel MC,et al.Sequential effects of thyroxine on the developing cerebellum of rats made hypothyroid by propylthiouracil[J].Brain Res,1979,161:469-479.
[3] Neveu I,Arenas E.Neurotrophins promote survival and development of neurons in the cerebellum of hypothyroid rats in vivo[J].J Cell Biol,1996,133(3):631-646.
[4] 陈祖培,王仁明,朱学良,等.脑发育临界期的实验研究[J].地方病通讯,1986,1(2):87-91.
[5] Billig H,Furuta I,Hsueh AJW.Estrogens inhibit and androgens enhance overian granulosa cell apoptosis[J].Endocrinology,1993,133(5):2204-2212.
, 百拇医药
[6] Naruse I,Keino H.Apoptosis in the developing CNS[J].Prog Neurobiol,1995,47:135-155.
[7] Legrand Ch,Clos J.Biochemical,immunocytochemical and morphological evidence for an interaction between thyroid hormone and nerve growth factor in the developing cerebellum of normal and hypothyroid rats[J].Dev Neurosci,1991,13:382-396.
[8] Raff MC,Barres BA,Burne JF,et al.Programmed cell death and the control of cell survival:Lessons from the nervous system[J].Science,1993,262:695-700.
[9] Muller Y,Rocchi E,Lazaro JB,et al.Thyroid hormone promotes Bcl-2 expression and prevents apoptosis of early differentiation cerebellar granule neurons[J].Int J Dev Neurosci,1995,13(8):871-885.
收稿日期1998-11-28;修订日期1999-03-20, 百拇医药