反义6A8cDNA转染肿瘤细胞生物学行为的研究
作者:刘玉琴 张立新 顾蓓 马凤蓉 赵雪梅 薛克勋 高进 朱立平
单位:100005 北京,中国医学科学院基础医学研究所中国协和医科大学基础医学院
关键词:反义cDNA;转染;肿瘤
中华医学杂志/990422 【摘要】 目的 探讨反义6A8对肿瘤细胞恶性行为的影响。方法 选用来自人鼻咽癌细胞系CNE-2Z的高转移克隆CNE-2L2细胞,分别用pRC/CMV-反义6A8 cNDA表达载体及空质粒转染并检测了反义6A8cDNA转染、空载体转染及未转染细胞自身及与基质的粘附性、运动性和水解酶活性、体外侵袭性及体内生长转移能力。结果 反义6A8cDNA转染CNE-2L2细胞与基质的粘附性下降,其运动性和水解能力及体外侵袭及体内生长及转移能力也均下降。结论 反义6A8cDNA转染可明显降低肿瘤的恶性行为。
The effects of 6A8 cDNA transfection on biological behavior of Tumor cells LIU Yuqin, ZHANG Lixin, GU Pei, et al. Institute of Basic Medical Sciences, Peking Union Medical college, Chinese Academy of Medical Sciences, Beijing 100005
, http://www.100md.com
【Abstract】 Objective To investigate the effects of antisense 6A8 cDNA on the malignant behavior of tumor.Methods Highly metastatic clonal variant CNE-2L2 from nasopharygeal carcinoma cell line(CNE-2Z)was transfected with antisense 6A8 cDNA or mock plasmid. Their adhesion, locomotion, proteolytic ability, in vitro invasion, in vivo growth and metastasis were comparatively studied with the wild CNE-2L2 cells. Results Antisense 6A8 cDNA transfected CNE-2L2 showed less adhesion to FN and LN, weakened locomotive ability and proteolytic ability, retarded in vivo growth and much less metastasis. Conclusion Transfection of antisense 6A8 cDNA obviously decreased the malignant behavior of tumor cells.
, 百拇医药
【Key words】 DNA,Antisense Transfecion Neoplasms
(Natl Med J China, 1999, 79:292-294)
正常细胞变为肿瘤细胞后发生了许多变化。其中包括糖基化作用的改变及细胞表面成分如糖蛋白、蛋白多糖等的改变。这些变化与其恶性行为密切相关。细胞表面糖蛋白中寡糖链(N-寡糖链)受末端糖基转移酶和寡糖修剪酶调节,α-甘露糖苷酶参与N-寡糖链的合成。我们克隆到的人6A8 cDNA(1 358 bp,GenBank登记号U37248)编码的蛋白质,与一个大鼠的ER α-甘露糖苷酶相同性高达84%,相似性达88%[1]。我们用构建的反义6A8cDNA真核表达栽体转染高转移性肿瘤克隆亚系,观察了其生物学行为如运动性、侵袭性及转移性等的变化。
材料和方法
, http://www.100md.com
一、细胞来源
实验所用细胞CNE-2L2是本组由人鼻咽癌细胞CNE-2Z中克隆分离的高转移亚系[2]。常规RPMI-1640培养。
二、方法
1.PRC/CMV-反义6A8 cDNA 表达载体的构建与转染:6A8cDNA 是本所免疫室从人扁桃体细胞 cDNA文库中克隆的[1]。把 6A8 cDNA反向插入质粒 pRC/CMV中,构建 6A8 cDNA反义表达质粒(pRC/CMV-反义 6A8 cDNA) 用于细胞转染,转染采用脂质体法,以空载质粒转染作为对照,G418筛选后,经细胞原位杂交鉴定。细胞分别命名为反6A8-CNE2L2和空-CNE2L2。
2.肿瘤细胞粘附性测定方法[3]:在6孔板中每孔加纤维粘连蛋白(FN)和层粘连蛋白(LN)各20 ng作为靶基质。另在6孔板中传代不同肿瘤细胞,长满单层不留空隙,经无钙镁磷酸盐酸缓冲液(PBS)洗涤后做靶细胞。检测时生长良好的各细胞胰蛋白酶消化制备悬液,PBS洗涤后,在靶细胞或靶基质孔中各加入相应的肿瘤细胞1×105,37℃ 50 ml/L的CO2孵箱中缓慢摇动,使其充分接触粘附,40分钟后吸出上清液,用少量(0.1 ml)无钙镁PBS洗2次,然后计数上清液及洗涤液中的未粘附细胞数,按下列公式计算粘附率: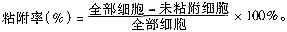 。每次3孔以上平行对照,实验重复数次。
。每次3孔以上平行对照,实验重复数次。
, 百拇医药
3.肿瘤细胞运动水解能力测定[4]:铺一层小鼠血浆在盖玻片上,置6孔板中,然后将新制备的胶体金溶液加至盖玻片上,静置45分钟,培养液洗涤数次待用。待测细胞制备悬液,每个6孔板中加2 000个细胞,常规CO2孵箱培养24小时,取出盖玻片,35 ml/L甲醛固定后,考马斯亮蓝R-250染色,干燥封片后可观察肿瘤细胞运动轨迹(金颗粒清除区)及水解酶释放活性(透明空斑区)。每次2~3片平行,实验进行2次。计数100~400个细胞中水解、运动细胞所占百分比。
4.肿瘤细胞侵袭性的测定[3]:采用Boyden 小室法。滤膜孔径8 μm,上面铺备人工基底膜Matrigel,下面铺FN。Boyden小室下室加100 μl 3T3 成纤维细胞条件培养液,上室加待测细胞1×105,37 ℃,50 ml/L的CO2孵箱中培养6小时,取出滤膜,擦掉膜上面细胞,100 ml/L甲醛固定,HE染色,计数膜背面每高倍视野平均细胞数。
, http://www.100md.com
5.肿瘤细胞体内转移性测定[5]:分别以2.4×106各种肿瘤细胞各接种10只Balb/c裸小鼠(中国医学科学院肿瘤研究所实验动物室购买)。每周游标尺测量皮下肿瘤大小,绘制体内生长曲线。8周时处死全部动物,取瘤组织、双侧肺及同侧腹股沟淋巴结,Bouin液固定,石蜡包埋,切片,HE染色。组织学观察体内肺、淋巴结转移情况,肺转移分级方法参见文献[5]。实验重复1次。
结果
一、反义pRC/CMV-6A8cDNA 转染肿瘤细胞后对其粘附性的影响
粘附性测定结果见表1。斜线上方是各细胞与自身细胞同质粘附的百分率(三孔的平均
数),斜线下方是各细胞与FN、LN基质粘附的百分率(三孔 的平均数)。表1列出了4次实验结果。可以看出反义 6A8-CNE2L2 与空CNE-2L2 及CNE2L2相比,自身粘附性变化不明显,而其与基质的粘附性降低。
, http://www.100md.com
表1 转染前后肿瘤细胞粘附率(%) 次序
标本数
CNE2L2
空CNE2L2
反CNE2L2
1
3
30/49
34/73
35/16
2
3
81/83
, http://www.100md.com
80/83
82/71
3
3
未测
73/86
86/85
4
3
未测
67/83
51/44
二、反义pRC/CMV-6A8cDNA转染肿瘤细胞后对其运动和水解活性的影响
, 百拇医药
肿瘤细胞在铺备胶体金颗粒的玻片上运动时清除了途中的金颗粒,留下无颗粒区域,可代表其运动能力。肿瘤细胞释放水解酶,降解了玻片上的金颗粒下面的蛋白膜,考马斯亮蓝染色后呈透明无色区,可代表其水解能力(图1)。反义6A8-CNE2L2细胞(图2)其运动和水解能力均较空-CNE2L2(图1)低,其运动和水解细胞所占百分比也较低(表2)。可见转染可降低其运动水解能力。

图1,2 空质粒(图1)和反义6A8cDNA(图2)转染肿瘤细胞运动水解能力
测定(考马斯亮蓝染色) ×200
表2 转染前后小鼠肿瘤细胞的水解细胞率
和运动细胞率(%) 组别
, http://www.100md.com
标本数
第1次
第2次
第3次
第4次
反义6A8
-CNE2L2
2
17/12
35/33
18/11
15/9
空-CNE2L2
, http://www.100md.com
2
78/48
75/65
60/30
55/30
CNE-2L2
2
82/54
79/60
未测
未测
注:斜线上为水解细胞所占百分比,下为运动细胞所占百分比;所列数据为2个标本的平均值,表中列了4次实验结果
, 百拇医药
三、反义6A8pRC/CMV 转染肿瘤细胞后对其侵袭性的影响
在Boyden小室中,肿瘤细胞侵袭Matigel,通过膜上的孔可达滤膜背面。细胞数的多少可代表其侵袭能力的强弱。图2可见反义 6A8-CNE2L2(图3)达到背面的细胞数较空-CNE-2L2(图4)少,前者每高倍视野平均细胞数为119±34,后者则达232±8,差异有显著意义,表明反义6A8cDNA转染可降低肿瘤细胞的体外侵袭能力。

图3,4 空质粒 (图3)和反义6A8cDNA(图4)转染肿瘤细胞体外
侵袭测定结果(苏木素染色) ×200
四、反义6A8pRC/CMV转染肿瘤细胞后对其体内转移性的影响
, 百拇医药
反义6A8-CNE2L2、空-CNE2L2和CNE2L2的体内生长曲线见图5。反义6A8-CNE2L2细胞潜伏期延长,生长明显减慢。空-CNE2L2生长速度也有所下降。切片观察结果见表3。反义6A8-CNE2L2细胞的肺转移率明显下降,且仅见1、2个小转移灶。空-CNE2L2细胞也略有下降,后两者的肺转移率则为多发转移灶、大转移灶。证明反义6A8-cDNA转染肿瘤细胞可抑制其在体内的生长,明显降低其转移能力。重复实验结果相似。
图5 肿瘤体内生长曲线
表3 转染前后小鼠肿瘤细胞体内转移实验结果(鼠数) 组别
鼠数
肿瘤分级
肺转移(%)
, 百拇医药
Ⅰ
Ⅱ
Ⅲ
CNE2L2
10
0
1
8
90
空CNE2L2
8
3
2
1
, 百拇医药
6/8
反义CNE2L2
10
3
0
0
30
讨论
肿瘤细胞的侵袭转移始于其与基底膜FN、LN等糖蛋白的粘附,肿瘤细胞表面的4大类粘附分子整合素,免疫球蛋白超家族,钙粘蛋白,选择素超家族都是糖蛋白。在上皮性细胞癌变过程中其细胞表面的糖性成分往往发生显著变化,包括糖基化作用的改变[5]。在肿瘤侵袭部位糖类结构改变的程度是一个预后的指标。如存在于正常腺上皮细胞腔面上的MUC1粘蛋白,在癌变时其表达量分布特点及结构均可发生改变,可作为肿瘤的生物标志及恶性程度的标志[6]。目前认为糖类表达的改变主要是因特异类型糖基化转移酶类的合成缺乏所致。α-甘露糖苷酶是催化糖蛋白分子中糖基代谢的一类重要酶类。Sebtor 等[7]曾报道用swainsonine和 deoxymannozirmycin抑制甘露糖苷酶,人黑色素瘤细胞的侵袭即可被抑制。Ochi等[8]曾观察到甘露糖苷酶抑制剂mannostatin可抑制B16/F10的体外侵袭和体内转移能力。刀豆素A受体就是细胞膜上的甘露糖序列,所以刀豆素A受体的改变也可反映甘露糖苷酶的变化。我们实验室以前的工作曾证明肿瘤细胞经维甲酸处理后,其刀豆素A受体[9]明显降低,而其生长和转移能力则受到影响。葛曰平等[10]研制的能抑制肿瘤生长的单抗识别的膜蛋白与刀豆素A受体密切相关。这也反应了甘露糖序列在肿瘤生物行为中的重要性。我们通过用反义6A8 cDNA转染肿瘤细胞,抑制了肿瘤的恶性行为。反义6A8-pRC/CMV转染高转移肿瘤细胞克隆后,经原位杂交、酶学测定(另发表),证明反义6A8 cDNA干扰α-甘露糖苷酶的表达,抑制了其活性。本文则进一步表明反义6A8 cDNA转染肿瘤细胞后,其与FN、LN的粘附、其运动性受到了部分抑制。其体外侵袭能力明显下降。体内的实验又证明其生长、转移能力明显下降了。证明了反义6A8 cDNA对肿瘤恶性行为的抑制作用。同时也为反义6A8 cDNA作为抗肿瘤侵袭和转移的新靶点提供了实验基础。
, 百拇医药
本课题为国家自然科学基金资助项目(39670295)
参考文献
[1] 张立新,朱立平,石伟,等.一个编码大鼠ERα-甘露糖苷酶同源的人cDNA分子克隆.中华微生物和免疫学杂志,1997,17:34-38.
[2] 郁多男,高进.人鼻咽癌CNE-2Z细胞的不同转移潜能克隆株在严重联合免疫缺陷小鼠体内的检验和比较研究.解剖学报,1994,10:6-11.
[3] 刘玉琴.侵袭和转移性癌细胞相关生物学特性研究方法和应用.见:高进主编.癌的侵袭和转移——基础与临床.北京:北京医科大学中国协和医科大学联合出版社,1996.15-27.
[4] 李存玺,顾蓓,高进.癌细胞粘附、位移水解活性综合测定方法的建立.中华病理学杂志,1996,25:310-311.
, http://www.100md.com
[5] Dabelsten E ,Clausen H, Mandel U. Carbonhydrate changes in squamous cell carcinoma. AMPIS,1992,100 suppl:130-138.
[6] 张立新,李春海.MUC1粘蛋白及其基因在肿瘤诊断和治疗中的应用.见:李春海,郭亚军主编.肿瘤分子生物学研究进展.北京:军事医学出版社,1996.117.
[7] Sebtor RE, Seftor EA, Grimes WJ, et al.Human melanoma cell invasion is inhibited in vitro by swainsonine and deoxymannojirimycin with a concomitant decrease in collagenase Ⅳ expression. Melanoma Res, 1991,1:43-46.
, http://www.100md.com
[8] Ochi Y, Atsumi S, Aoyagi T, et al. Inhibition of tumor cell invasion in the boyden chamber assay by α-mannosidase inhibitor A. Anticancer Res, 1993,l3:1421-1428.
[9] 于晓妉,赵雪梅,高进.维甲酸对肿瘤细胞膜的影响及其与转移能力相关性探讨.中华病理学杂志,1995,17:179-182.
[10] 葛曰平,陈尊器,陈维洁,等.人肝癌细胞GHC-3表面抗原性质的研究.中国免疫学杂志,1995,11:348-352.
(收稿:1998-06-24 修回:1998-09-10), 百拇医药
单位:100005 北京,中国医学科学院基础医学研究所中国协和医科大学基础医学院
关键词:反义cDNA;转染;肿瘤
中华医学杂志/990422 【摘要】 目的 探讨反义6A8对肿瘤细胞恶性行为的影响。方法 选用来自人鼻咽癌细胞系CNE-2Z的高转移克隆CNE-2L2细胞,分别用pRC/CMV-反义6A8 cNDA表达载体及空质粒转染并检测了反义6A8cDNA转染、空载体转染及未转染细胞自身及与基质的粘附性、运动性和水解酶活性、体外侵袭性及体内生长转移能力。结果 反义6A8cDNA转染CNE-2L2细胞与基质的粘附性下降,其运动性和水解能力及体外侵袭及体内生长及转移能力也均下降。结论 反义6A8cDNA转染可明显降低肿瘤的恶性行为。
The effects of 6A8 cDNA transfection on biological behavior of Tumor cells LIU Yuqin, ZHANG Lixin, GU Pei, et al. Institute of Basic Medical Sciences, Peking Union Medical college, Chinese Academy of Medical Sciences, Beijing 100005
, http://www.100md.com
【Abstract】 Objective To investigate the effects of antisense 6A8 cDNA on the malignant behavior of tumor.Methods Highly metastatic clonal variant CNE-2L2 from nasopharygeal carcinoma cell line(CNE-2Z)was transfected with antisense 6A8 cDNA or mock plasmid. Their adhesion, locomotion, proteolytic ability, in vitro invasion, in vivo growth and metastasis were comparatively studied with the wild CNE-2L2 cells. Results Antisense 6A8 cDNA transfected CNE-2L2 showed less adhesion to FN and LN, weakened locomotive ability and proteolytic ability, retarded in vivo growth and much less metastasis. Conclusion Transfection of antisense 6A8 cDNA obviously decreased the malignant behavior of tumor cells.
, 百拇医药
【Key words】 DNA,Antisense Transfecion Neoplasms
(Natl Med J China, 1999, 79:292-294)
正常细胞变为肿瘤细胞后发生了许多变化。其中包括糖基化作用的改变及细胞表面成分如糖蛋白、蛋白多糖等的改变。这些变化与其恶性行为密切相关。细胞表面糖蛋白中寡糖链(N-寡糖链)受末端糖基转移酶和寡糖修剪酶调节,α-甘露糖苷酶参与N-寡糖链的合成。我们克隆到的人6A8 cDNA(1 358 bp,GenBank登记号U37248)编码的蛋白质,与一个大鼠的ER α-甘露糖苷酶相同性高达84%,相似性达88%[1]。我们用构建的反义6A8cDNA真核表达栽体转染高转移性肿瘤克隆亚系,观察了其生物学行为如运动性、侵袭性及转移性等的变化。
材料和方法
, http://www.100md.com
一、细胞来源
实验所用细胞CNE-2L2是本组由人鼻咽癌细胞CNE-2Z中克隆分离的高转移亚系[2]。常规RPMI-1640培养。
二、方法
1.PRC/CMV-反义6A8 cDNA 表达载体的构建与转染:6A8cDNA 是本所免疫室从人扁桃体细胞 cDNA文库中克隆的[1]。把 6A8 cDNA反向插入质粒 pRC/CMV中,构建 6A8 cDNA反义表达质粒(pRC/CMV-反义 6A8 cDNA) 用于细胞转染,转染采用脂质体法,以空载质粒转染作为对照,G418筛选后,经细胞原位杂交鉴定。细胞分别命名为反6A8-CNE2L2和空-CNE2L2。
2.肿瘤细胞粘附性测定方法[3]:在6孔板中每孔加纤维粘连蛋白(FN)和层粘连蛋白(LN)各20 ng作为靶基质。另在6孔板中传代不同肿瘤细胞,长满单层不留空隙,经无钙镁磷酸盐酸缓冲液(PBS)洗涤后做靶细胞。检测时生长良好的各细胞胰蛋白酶消化制备悬液,PBS洗涤后,在靶细胞或靶基质孔中各加入相应的肿瘤细胞1×105,37℃ 50 ml/L的CO2孵箱中缓慢摇动,使其充分接触粘附,40分钟后吸出上清液,用少量(0.1 ml)无钙镁PBS洗2次,然后计数上清液及洗涤液中的未粘附细胞数,按下列公式计算粘附率:
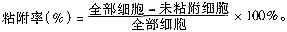 。每次3孔以上平行对照,实验重复数次。
。每次3孔以上平行对照,实验重复数次。, 百拇医药
3.肿瘤细胞运动水解能力测定[4]:铺一层小鼠血浆在盖玻片上,置6孔板中,然后将新制备的胶体金溶液加至盖玻片上,静置45分钟,培养液洗涤数次待用。待测细胞制备悬液,每个6孔板中加2 000个细胞,常规CO2孵箱培养24小时,取出盖玻片,35 ml/L甲醛固定后,考马斯亮蓝R-250染色,干燥封片后可观察肿瘤细胞运动轨迹(金颗粒清除区)及水解酶释放活性(透明空斑区)。每次2~3片平行,实验进行2次。计数100~400个细胞中水解、运动细胞所占百分比。
4.肿瘤细胞侵袭性的测定[3]:采用Boyden 小室法。滤膜孔径8 μm,上面铺备人工基底膜Matrigel,下面铺FN。Boyden小室下室加100 μl 3T3 成纤维细胞条件培养液,上室加待测细胞1×105,37 ℃,50 ml/L的CO2孵箱中培养6小时,取出滤膜,擦掉膜上面细胞,100 ml/L甲醛固定,HE染色,计数膜背面每高倍视野平均细胞数。
, http://www.100md.com
5.肿瘤细胞体内转移性测定[5]:分别以2.4×106各种肿瘤细胞各接种10只Balb/c裸小鼠(中国医学科学院肿瘤研究所实验动物室购买)。每周游标尺测量皮下肿瘤大小,绘制体内生长曲线。8周时处死全部动物,取瘤组织、双侧肺及同侧腹股沟淋巴结,Bouin液固定,石蜡包埋,切片,HE染色。组织学观察体内肺、淋巴结转移情况,肺转移分级方法参见文献[5]。实验重复1次。
结果
一、反义pRC/CMV-6A8cDNA 转染肿瘤细胞后对其粘附性的影响
粘附性测定结果见表1。斜线上方是各细胞与自身细胞同质粘附的百分率(三孔的平均
数),斜线下方是各细胞与FN、LN基质粘附的百分率(三孔 的平均数)。表1列出了4次实验结果。可以看出反义 6A8-CNE2L2 与空CNE-2L2 及CNE2L2相比,自身粘附性变化不明显,而其与基质的粘附性降低。
, http://www.100md.com
表1 转染前后肿瘤细胞粘附率(%) 次序
标本数
CNE2L2
空CNE2L2
反CNE2L2
1
3
30/49
34/73
35/16
2
3
81/83
, http://www.100md.com
80/83
82/71
3
3
未测
73/86
86/85
4
3
未测
67/83
51/44
二、反义pRC/CMV-6A8cDNA转染肿瘤细胞后对其运动和水解活性的影响
, 百拇医药
肿瘤细胞在铺备胶体金颗粒的玻片上运动时清除了途中的金颗粒,留下无颗粒区域,可代表其运动能力。肿瘤细胞释放水解酶,降解了玻片上的金颗粒下面的蛋白膜,考马斯亮蓝染色后呈透明无色区,可代表其水解能力(图1)。反义6A8-CNE2L2细胞(图2)其运动和水解能力均较空-CNE2L2(图1)低,其运动和水解细胞所占百分比也较低(表2)。可见转染可降低其运动水解能力。


图1,2 空质粒(图1)和反义6A8cDNA(图2)转染肿瘤细胞运动水解能力
测定(考马斯亮蓝染色) ×200
表2 转染前后小鼠肿瘤细胞的水解细胞率
和运动细胞率(%) 组别
, http://www.100md.com
标本数
第1次
第2次
第3次
第4次
反义6A8
-CNE2L2
2
17/12
35/33
18/11
15/9
空-CNE2L2
, http://www.100md.com
2
78/48
75/65
60/30
55/30
CNE-2L2
2
82/54
79/60
未测
未测
注:斜线上为水解细胞所占百分比,下为运动细胞所占百分比;所列数据为2个标本的平均值,表中列了4次实验结果
, 百拇医药
三、反义6A8pRC/CMV 转染肿瘤细胞后对其侵袭性的影响
在Boyden小室中,肿瘤细胞侵袭Matigel,通过膜上的孔可达滤膜背面。细胞数的多少可代表其侵袭能力的强弱。图2可见反义 6A8-CNE2L2(图3)达到背面的细胞数较空-CNE-2L2(图4)少,前者每高倍视野平均细胞数为119±34,后者则达232±8,差异有显著意义,表明反义6A8cDNA转染可降低肿瘤细胞的体外侵袭能力。


图3,4 空质粒 (图3)和反义6A8cDNA(图4)转染肿瘤细胞体外
侵袭测定结果(苏木素染色) ×200
四、反义6A8pRC/CMV转染肿瘤细胞后对其体内转移性的影响
, 百拇医药
反义6A8-CNE2L2、空-CNE2L2和CNE2L2的体内生长曲线见图5。反义6A8-CNE2L2细胞潜伏期延长,生长明显减慢。空-CNE2L2生长速度也有所下降。切片观察结果见表3。反义6A8-CNE2L2细胞的肺转移率明显下降,且仅见1、2个小转移灶。空-CNE2L2细胞也略有下降,后两者的肺转移率则为多发转移灶、大转移灶。证明反义6A8-cDNA转染肿瘤细胞可抑制其在体内的生长,明显降低其转移能力。重复实验结果相似。

图5 肿瘤体内生长曲线
表3 转染前后小鼠肿瘤细胞体内转移实验结果(鼠数) 组别
鼠数
肿瘤分级
肺转移(%)
, 百拇医药
Ⅰ
Ⅱ
Ⅲ
CNE2L2
10
0
1
8
90
空CNE2L2
8
3
2
1
, 百拇医药
6/8
反义CNE2L2
10
3
0
0
30
讨论
肿瘤细胞的侵袭转移始于其与基底膜FN、LN等糖蛋白的粘附,肿瘤细胞表面的4大类粘附分子整合素,免疫球蛋白超家族,钙粘蛋白,选择素超家族都是糖蛋白。在上皮性细胞癌变过程中其细胞表面的糖性成分往往发生显著变化,包括糖基化作用的改变[5]。在肿瘤侵袭部位糖类结构改变的程度是一个预后的指标。如存在于正常腺上皮细胞腔面上的MUC1粘蛋白,在癌变时其表达量分布特点及结构均可发生改变,可作为肿瘤的生物标志及恶性程度的标志[6]。目前认为糖类表达的改变主要是因特异类型糖基化转移酶类的合成缺乏所致。α-甘露糖苷酶是催化糖蛋白分子中糖基代谢的一类重要酶类。Sebtor 等[7]曾报道用swainsonine和 deoxymannozirmycin抑制甘露糖苷酶,人黑色素瘤细胞的侵袭即可被抑制。Ochi等[8]曾观察到甘露糖苷酶抑制剂mannostatin可抑制B16/F10的体外侵袭和体内转移能力。刀豆素A受体就是细胞膜上的甘露糖序列,所以刀豆素A受体的改变也可反映甘露糖苷酶的变化。我们实验室以前的工作曾证明肿瘤细胞经维甲酸处理后,其刀豆素A受体[9]明显降低,而其生长和转移能力则受到影响。葛曰平等[10]研制的能抑制肿瘤生长的单抗识别的膜蛋白与刀豆素A受体密切相关。这也反应了甘露糖序列在肿瘤生物行为中的重要性。我们通过用反义6A8 cDNA转染肿瘤细胞,抑制了肿瘤的恶性行为。反义6A8-pRC/CMV转染高转移肿瘤细胞克隆后,经原位杂交、酶学测定(另发表),证明反义6A8 cDNA干扰α-甘露糖苷酶的表达,抑制了其活性。本文则进一步表明反义6A8 cDNA转染肿瘤细胞后,其与FN、LN的粘附、其运动性受到了部分抑制。其体外侵袭能力明显下降。体内的实验又证明其生长、转移能力明显下降了。证明了反义6A8 cDNA对肿瘤恶性行为的抑制作用。同时也为反义6A8 cDNA作为抗肿瘤侵袭和转移的新靶点提供了实验基础。
, 百拇医药
本课题为国家自然科学基金资助项目(39670295)
参考文献
[1] 张立新,朱立平,石伟,等.一个编码大鼠ERα-甘露糖苷酶同源的人cDNA分子克隆.中华微生物和免疫学杂志,1997,17:34-38.
[2] 郁多男,高进.人鼻咽癌CNE-2Z细胞的不同转移潜能克隆株在严重联合免疫缺陷小鼠体内的检验和比较研究.解剖学报,1994,10:6-11.
[3] 刘玉琴.侵袭和转移性癌细胞相关生物学特性研究方法和应用.见:高进主编.癌的侵袭和转移——基础与临床.北京:北京医科大学中国协和医科大学联合出版社,1996.15-27.
[4] 李存玺,顾蓓,高进.癌细胞粘附、位移水解活性综合测定方法的建立.中华病理学杂志,1996,25:310-311.
, http://www.100md.com
[5] Dabelsten E ,Clausen H, Mandel U. Carbonhydrate changes in squamous cell carcinoma. AMPIS,1992,100 suppl:130-138.
[6] 张立新,李春海.MUC1粘蛋白及其基因在肿瘤诊断和治疗中的应用.见:李春海,郭亚军主编.肿瘤分子生物学研究进展.北京:军事医学出版社,1996.117.
[7] Sebtor RE, Seftor EA, Grimes WJ, et al.Human melanoma cell invasion is inhibited in vitro by swainsonine and deoxymannojirimycin with a concomitant decrease in collagenase Ⅳ expression. Melanoma Res, 1991,1:43-46.
, http://www.100md.com
[8] Ochi Y, Atsumi S, Aoyagi T, et al. Inhibition of tumor cell invasion in the boyden chamber assay by α-mannosidase inhibitor A. Anticancer Res, 1993,l3:1421-1428.
[9] 于晓妉,赵雪梅,高进.维甲酸对肿瘤细胞膜的影响及其与转移能力相关性探讨.中华病理学杂志,1995,17:179-182.
[10] 葛曰平,陈尊器,陈维洁,等.人肝癌细胞GHC-3表面抗原性质的研究.中国免疫学杂志,1995,11:348-352.
(收稿:1998-06-24 修回:1998-09-10), 百拇医药