HBVx基因在肝癌细胞中的表达及其对肝癌细胞凋亡的影响
作者:郭双平 王文亮
单位:郭双平 王文亮(第四军医大学病理学教研室,西安 710032)
关键词:乙型肝炎病毒X蛋白;肝肿瘤;细胞凋亡;基因表达
临床与实验病理学杂志990401摘要 目的:研究乙型肝炎病毒X基因在肝癌细胞中的表达及其对肝癌细胞凋亡的影响。方法:用分子生物学的方法构建HBVx基因真核表达载体pCDNA3.1-HBX,用脂质体将真核表达载体pCDNA3.1-HBX转染入肝癌细胞HCC 9204,G418 500 mg.L-1筛选,获得稳定表达HBx蛋白的细胞,阿霉素20 μmol.L-1诱导细胞凋亡。电镜、琼脂糖凝胶电泳和流式细胞仪检测凋亡细胞。结果:20 μmol.L-1阿霉素可诱导肝癌细胞凋亡,稳定表达HBx蛋白的肝癌细胞凋亡率比未进行基因转染的肝癌细胞凋亡率低。结论:HBx蛋白可抑制阿霉素诱导的肝癌细胞调亡。
, 百拇医药
分类号 R735.7; R394.2 文献标识码 A
文章编号 1001-7399(1999)04-0283-04
Expression of HBVx gene in hepatocellular carcinoma cell and the effect on apoptosis
Guo Shuangping, Wang Wenliang
(Dept of Pathol, The Fourth Military Medical University, Xian 710032)
ABSTRACT Purpose To investigate the expression of HBVx gene in hepatocellular carcinoma cells and the effect of HBx protein (HBx Ag) on hepatocellular carcinoma cell apoptosis. Methods Molecular biological methods were used to construct the eukaryotic expression vector of HBVx gene named pCDNA3.1-HBX. HBVx gene was transfected into hepatocellular carcinoma cell line HCC 9204 using lipofectamine. The cells which express HBx protein stably were obtained by the selective medium containing 500 mg.L-1 G418 20 μmol.L-1 adriamycin was used to induce cell apoptosis. Flow cytometer and other methods were used to detect apoptosis. Results Apoptotic cells were confirmed by electron-microscopy, flow cytometer and other methods. The percentage of apoptotic cells which stably express HBx protein was lower than that of cells which do not express HBx protein. Conclusion HBx protein can inhibit apoptosis of hepatocellular carcinoma cell induced by adriamycin.
, 百拇医药
KEY WORDS HBx protein (HBx Ag); liver neoplasms; apoptosis; gene expression
肝细胞肝癌(HCC)是最常见的恶性肿瘤之一,每年至少有250 000例HCC被诊断,其发生与乙型肝炎病毒(HBV)密切相关。HBV携带者发生HCC的比例为200∶1,是人类肿瘤已知的最相关的因素之一,特别是HBVx基因及其产物HBx蛋白(HBx Ag)在HBV慢性感染并发展为HCC的过程中发挥重要作用。细胞凋亡是由特定基因调节的程序性死亡,对维持机体的自身稳定性和防止恶性肿瘤的发生是必要的。研究表明,在原发性肝细胞肝癌中存在广泛的细胞凋亡现象,特别是感染HBV的肝脏,提示HBV可能与肝细胞凋亡相关,并在HBV慢性感染以致发展成HCC的过程中起一定的作用。因此,作者对HBVx基因及其产物在肝癌细胞中的表达及其对肝癌细胞凋亡的影响进行了探讨。
1 材料与方法
, 百拇医药
1.1 HBVx基因真核表达载体pCDNA3.1-HBX的构建 用PCR法从含HBV全病毒的质粒pTTHK扩增HBVx基因。PCR引物和Taq DNA聚合酶购自上海生物工程公司,引物序列如下,分别在上游引物和下游引物5端加限制性内切酶Kpn 1和EcoR 1酶切位点。上游引物:5′TCGGTACCATGGCTGCTAGGCTG3;下游引物:5′GAGAATTCATGATTAGGCAGAGGTG3。
PCR循环条件:94℃ 5 min, 59℃ 1 min, 74℃ 1 min,30次循环后,74℃ 10min。PCR产物用低熔点胶回收,与克隆载体pT7Blue连接,构建成重组体pT7Blue-HBX,进行序列测定。选择测序结果正确的克隆提取质粒,经EcoR 1和Kpn 1双酶后连接于真核表达载体pCDNA3.1,构建HBVx基因真核表达载体pCDNA3.1-HBX。
, 百拇医药
1.2 基因转染及HBVx基因在肝癌细胞HCC 9204中的表达
1.2.1 基因转染 选择状态良好的对数生长早期肝癌细胞HCC 9204,用脂质体分别将2 μg pCDNA3.1,pCDNA3.1-HBX质粒DNA转入肝癌细胞,pCDNA3.1为载体对照,未进行基因转染的细胞为空白对照。转染后72 h将细胞接种于含500 mg.L-1 G418的选择性培养基,37℃,5%CO2,饱和湿度下培养4周,以筛选阳性细胞克隆。
1.2.2 HBVx基因在肝癌细胞HCC 9204细胞中的表达 (1)用原位杂交法检测HBVx mRNA在肝癌细胞HCC 9204中的表达:从真核表达载体pCDNA3.1-HBX上用限制性内切酶EcoR 1和Kpn 1切取HBx片段,低熔点胶回收,13%聚乙二醇8000纯化,地高辛标记的随机引物标记,地高辛随机引物标记试剂盒购自德国宝灵曼公司。转染pCDNA3.1-HBX的第四代肝癌细胞为实验组,未进行基因转染的肝癌细胞为对照组。按常规原位杂交步骤进行。(2)用免疫荧光法检测肝癌细胞中HBx蛋白:以转染pCDNA3.1-HBX的第四代肝癌细胞为实验组,未进行基因转染的肝癌细胞为阴性对照,按常规免疫荧光法进行。兔抗HBx多克隆抗体由王文亮教授提供,羊抗兔IgG-FITC购自华美公司。
, http://www.100md.com
1.3 HBx蛋白对肝癌细胞凋亡的影响
1.3.1 阿霉素诱导肝癌细胞凋亡 参照张晓东的方法〔1〕,将含20 μmol.L-1阿霉素的完全培养液4 ml加入转染pCDNA3.1-HBX的第四代肝癌细胞和未进行基因转染的肝癌细胞,37℃,5%CO2,饱和湿度下培养3 h后,洗细胞数次,用无药液的完全培养液继续培养6 h的细胞进行下列实验。
1.3.2 常规HE染色 步骤略。
1.3.3 琼脂糖凝胶电泳 收集离壁漂浮和贴壁的细胞提取DNA,进行1.8%琼脂糖凝胶电泳,30V,2 h。
1.3.4 透射电镜 3%戊二醛固定细胞,制备透射电镜标本。
, http://www.100md.com 1.3.5 流式细胞仪 70%乙醇固定细胞,4℃过夜,流式细胞仪分析细胞周期。
2 结果
2.1 HBVx基因真核表达载体pCDNA3.1-HBX的构建 重组体pT7Blue-HBX经EcoR 1和Kpn 1双酶切产生480 bp的目的片段,选择一个克隆测序。结果表明,连接于克隆载体的PCR产物为全长的HBVx基因,含起始码和终止码,属于adw 2型。重组体pT7Blue-HBX经EcoR 1和Kpn 1双酶切,回收HBVx片段,用T4DNA连接酶定向克隆于真核表达载体pCDNA3.1,构建成HBVx基因真核表达载体pCDNA3.1-HBX,酶切鉴定正确(图1,2),说明成功构建了HBVx基因真核表达载体。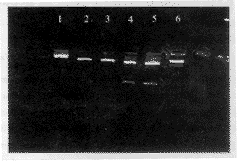
, 百拇医药
图1 克隆载体pCDNA3.1-HBX酶切结果
1:未经酶切质粒pT7Blue-HBX;2,3:BamH 1酶切质粒pT7Blue-HBX;
4,5:EcoR 1和Kpn 1酶切质粒pT7Blue-HBX;6:Mark λDNA/HindⅢ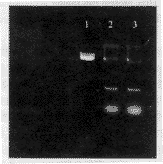
图2 HBVx基因真核表达载体pCDNA3.1-HBX酶切结果
2.2 基因转染及HBVx基因在肝癌细胞HCC 9204的表达
2.2.1 基因转染 将真核表达载体pCDNA3.1-HBX转染入对数生长早期的HCC 9402细胞,500 mg.L-1 G418筛选2周,绝大多数细胞死亡,仅少数细胞存活。存活的细胞继续在37℃,5%CO2,饱和湿度下培养2周,逐渐形成细胞克隆(图3),初步说明基因转染成功。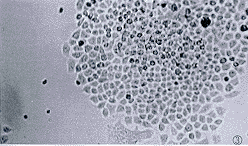
, 百拇医药
图3 转染PCDNA 3.1-HBX的肝癌细胞用G418筛选4周后形成的克隆.×100
2.2.2 HBVx基因在肝癌细胞HCC 9204的表达 (1)原位杂交法检测HBVx mRNA:按常规方法检测转染pCDNA3.1-HBX的第四代肝癌细胞中HBVx mRNA,未转染的肝癌细胞为阴性对照。在实验组细胞,可见蓝紫色颗粒样物位于细胞质中,细胞核中无阳性信号,对照组细胞胞质和胞核中均无阳性信号(图4)。说明HBVx基因被转入肝癌细胞并转录。(2)免疫荧光法检测HBx蛋白在肝癌细胞中的表达:按常规免疫荧光法检测HBx蛋白在转染HBVx基因的第四代肝癌细胞中的表达,未进行基因转染的细胞为阴性对照。荧光显微镜下观察,可见在实验组细胞胞质和胞核有黄绿色荧光(图5)。对照组细胞无黄绿荧光,说明HBVx基因被转入肝癌细胞并稳定表达HBx蛋白。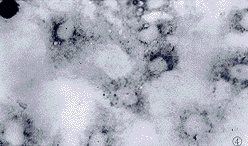
图4 原位杂交法显示肝癌细胞中的 HBx mRNA. ×400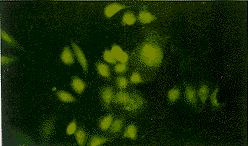
, 百拇医药
图5 免疫荧光法显示肝癌细胞中的 HBx 蛋白. ×400
2.3 HBx蛋白对肝癌细胞凋亡的影响
2.3.1 阿霉素诱导肝癌细胞凋亡 含20 μmol.L-1阿霉素的完全培养4 ml加入转染pCDNA3.1-HBX和未转染基因的HCC 9204细胞,37℃,5%CO2,饱和湿度下培养3 h,不含药液的完全培养液继续培养6 h。倒置显微镜下观察,可见部分细胞离壁漂浮于培养液中,部分细胞尚贴壁,体积缩小,表面呈桑椹样。
2.3.2 常规HE染色 部分细胞体积明显缩小,细胞核缩小,染色变深,细胞表面看见毛刺样突起,为凋亡细胞的形态学表现,而且凋亡细胞多成群分布(图6)。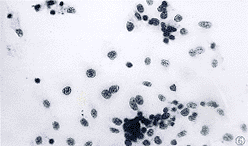
, http://www.100md.com
图6 20 μmol.L-1阿霉素作用3h/6h的肝癌细胞.HE×200
2.3.3 琼脂糖凝胶电泳 收集离壁漂浮和贴壁细胞,提取细胞DNA,1.8%琼脂糖凝胶电泳,可见20 μmol.L-1阿霉素作用3 h、6 h后未出现明显DNA ladder。40 μmol.L-1阿霉素作用3 h、6 h后,细胞DNA电泳为弥散的带型,是坏死细胞的表型(图7)。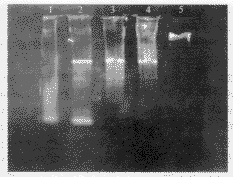
图7 1.8%琼脂糖凝胶电泳显示细胞凋亡DNA梯形条带
2.3.4 透射电镜 结果可见,部分肝癌细胞体积明显缩小,胞核变小,染色质致密,并边集,位于胞核周边,细胞表面微绒毛消失,是凋亡细胞典型的形态学改变。未经阿霉素处理的肝癌细胞则不出现上述改变(图8,9)。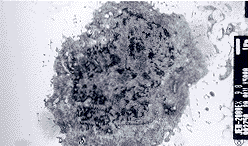
, http://www.100md.com
图8 肝癌细胞透射电镜.×75000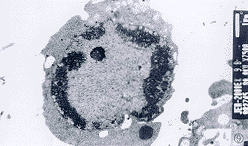
图9 透射电镜显示经阿霉素诱导的凋亡细胞.×75000
2.3.5 流式细胞仪 流式细胞仪分析20 μmol.L-1阿霉素作用3 h、6 h的转染pCDNA3.1-HBX的第四代细胞和未转染的肝癌细胞。结果稳定表达HBx蛋白的肝癌细胞凋亡率比未进行基因转染的肝癌细胞凋亡率低,分别为11.6%和38.4%(P<0.05)。
3 讨论
HBV的感染和肝细胞肝癌的关系密切,与HBV相关的肝细胞肝癌是东南亚、非洲及我国最常见的恶性肿瘤之一。特别是HBVx基因编码的HBx蛋白具有反式激活作用,可激活病毒和细胞基因,在HBV感染并发展为HCC的过程中起重要作用。恶性肿瘤的发生也与细胞凋亡有关,一方面细胞恶性转化具有自主生长能力,另一方面细胞凋亡也异常。病毒和细胞凋亡的关系已引起人们的重视,多种病毒基因可编码蛋白参与细胞凋亡。如SV40T抗原〔2〕、HPV E6〔3〕、EBV EBNA-5〔4〕、腺病毒E1B〔5〕等。HBV作为原发性肝癌已知的最相关的因素,其病毒基因是否编码蛋白参与细胞凋亡仅有少量报道〔6〕,有学者用微注射的方法将HBVx基因注入人成纤维细胞后,细胞凋亡被抑制。HBVx基因及其编码的HBx蛋白是否影响肝癌细胞凋亡?为此我们首先构建了HBVx基因真核表达载体pCDNA3.1-HBX,并用脂质体介导的方法转染入肝癌细胞HCC 9204,G418筛选获得稳定表达HBx蛋白的肝癌细胞。用阿霉素诱导细胞凋亡,流式细胞仪分析细胞周期。结果发现,稳定表达HBx蛋白的肝癌细胞凋亡率比不表达该蛋白的亲本细胞凋亡率低。说明HBx蛋白对肝癌细胞凋亡有抑制作用。
, 百拇医药
本研究结果显示HBx蛋白可抑制肝癌细胞凋亡,对进一步研究HBV在HCC发生中的作用具有重要意义。在HBV慢性感染过程中,病毒基因组常整合入宿主细胞基因组,X基因是最常被整合的基因,绝大多数原发性肝癌及肝癌细胞株都含有部分或全部的HBVx基因〔7〕,整合形式的X基因产生的HBx蛋白在体内〔8〕和体外〔9〕都具有反式激活作用,能够激活多种靶基因。HBx蛋白可反式激活病毒基因,促进病毒的复制和转录〔10〕,使病毒表达基因产物进入S抗原等,刺激机体免疫系统识别和清除被感染的肝细胞;同时,由于整合有HBVx基因的肝癌细胞不断再生,使HBx蛋白阳性的肝癌细胞克隆性增生〔11〕。HBx蛋白阳性的肝癌细胞与HBx蛋白阴性的肝癌细胞比较,发生了很大变化。HBx蛋白可参与细胞内多种信号转导途径,如ras/raf/MAPK/MAPKK和蛋白激酶C途径〔11〕,使信号转导改变。另外HBx蛋白具有生长因子样作用,可直接刺激细胞生长〔12〕。同时,还可使一些负性生长调控因子如p53失活〔13〕,并灭活一种或几种DNA修复途径,使肝细胞再生过程中有DNA损伤的细胞积累。HBx蛋白对细胞凋亡有抑制作用,HBx蛋白阳性的肝癌细胞对凋亡产生抗性。这可能是由于HBx蛋白对某些细胞凋亡调控基因(特别是促凋亡基因)的抑制所致。上述作用综合起来,最终使肝癌细胞发生恶性转化,这可能是HBV相关的HCC发生的重要机制。
, 百拇医药
关于HBx蛋白参与细胞凋亡的确切机制尚不清楚,已有的研究表明,HBx蛋白并不直接与DNA结合,而是在蛋白质水平形成复合体,由复合体调节靶基因的表达〔11〕。总之,本研究仅表明HBx蛋白可抑制肝癌细胞凋亡,但HBx蛋白的作用是广泛而复杂的,需进一步研究。
基金项目:国家自然科学基金资助课题 (No 39470771)
作者简介:郭双平,女,30岁,博士。研究方向:HBV与肝癌细胞凋亡
王文亮,男,65岁,教授,博士生导师。研究方向:肝癌的分子病理学
参考文献
1,张晓东.阿霉素诱导肝癌细胞凋亡及其凋亡相关基因和杀伤因子的研究[博士论文].西安:第四军医大学,1996
, 百拇医药
2,Lane DP. T antigen is bound to a host protein in SV40-transformed cells. Nature, 1979;278:261~263
3,Dyson N. The human papilloma virus-16 E7 oncoprotein is able to bind to the retinoblastoma gene product. Science, 1989;243:934~937
4,Szekely L. EBNA-5, an Epstein-Barr virus-encoded nuclear antigen, binds to the retinoblastoma and p53 proteins. Proc Natl Acad Sci USA, 1993;90:5455~5459
5,Wyllie A. Adenovirus Eld-58 KD tumor antigen and SV 40 large tumor antigen are physically associated with the same 54KD cellular protein in transformed cells. Cell, 1982;28:387~394
, 百拇医药
6,Wang XW, Gibson MK, Vermeulen W et al. Abrogation of p53-induced apoptosis by the hepatitis B virus x gene. Cancer Res, 1995;55:6012~6016
7,Matsubara K, Tokino T. Integration of hepatitis B virus DNA and its implications for hepatocarcinogenesis. Mol Bio Med, 1990;7:243~260
8,Balsano C, Billet O, Bennoun M et al. Hepatits B virus x gene product acts as a transactivator in vivo. J Hepto, 1994;27:103~109
, http://www.100md.com
9,Zahm P, Hofschneider PH, Koshy R. The HBV-ORF encodes a trans-activator: a potential factor in viral hepatocarcinogenesis. Oncogene, 1988;3:169~177
10,Nakatake H, Chisaka O, Yamamoto S et al. Effect of x protein on transactivation of HBV promoters and on viral replication. Virology, 1993;195:305~314
11,Feitelson MA, Duan LX. Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma. Am J Pathol, 1997;150(4):1141~1157
, http://www.100md.com
12,Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci USA, 1995;92:11215~11219
13,Truant R, Antunovic J, Greenblatt J et al. Direct interaction of the hepatits B virus HBx protein with p53 response element-directed transactivation. J Virol, 1995;69:1851~1859
收稿日期:1998-12-18, 百拇医药
单位:郭双平 王文亮(第四军医大学病理学教研室,西安 710032)
关键词:乙型肝炎病毒X蛋白;肝肿瘤;细胞凋亡;基因表达
临床与实验病理学杂志990401摘要 目的:研究乙型肝炎病毒X基因在肝癌细胞中的表达及其对肝癌细胞凋亡的影响。方法:用分子生物学的方法构建HBVx基因真核表达载体pCDNA3.1-HBX,用脂质体将真核表达载体pCDNA3.1-HBX转染入肝癌细胞HCC 9204,G418 500 mg.L-1筛选,获得稳定表达HBx蛋白的细胞,阿霉素20 μmol.L-1诱导细胞凋亡。电镜、琼脂糖凝胶电泳和流式细胞仪检测凋亡细胞。结果:20 μmol.L-1阿霉素可诱导肝癌细胞凋亡,稳定表达HBx蛋白的肝癌细胞凋亡率比未进行基因转染的肝癌细胞凋亡率低。结论:HBx蛋白可抑制阿霉素诱导的肝癌细胞调亡。
, 百拇医药
分类号 R735.7; R394.2 文献标识码 A
文章编号 1001-7399(1999)04-0283-04
Expression of HBVx gene in hepatocellular carcinoma cell and the effect on apoptosis
Guo Shuangping, Wang Wenliang
(Dept of Pathol, The Fourth Military Medical University, Xian 710032)
ABSTRACT Purpose To investigate the expression of HBVx gene in hepatocellular carcinoma cells and the effect of HBx protein (HBx Ag) on hepatocellular carcinoma cell apoptosis. Methods Molecular biological methods were used to construct the eukaryotic expression vector of HBVx gene named pCDNA3.1-HBX. HBVx gene was transfected into hepatocellular carcinoma cell line HCC 9204 using lipofectamine. The cells which express HBx protein stably were obtained by the selective medium containing 500 mg.L-1 G418 20 μmol.L-1 adriamycin was used to induce cell apoptosis. Flow cytometer and other methods were used to detect apoptosis. Results Apoptotic cells were confirmed by electron-microscopy, flow cytometer and other methods. The percentage of apoptotic cells which stably express HBx protein was lower than that of cells which do not express HBx protein. Conclusion HBx protein can inhibit apoptosis of hepatocellular carcinoma cell induced by adriamycin.
, 百拇医药
KEY WORDS HBx protein (HBx Ag); liver neoplasms; apoptosis; gene expression
肝细胞肝癌(HCC)是最常见的恶性肿瘤之一,每年至少有250 000例HCC被诊断,其发生与乙型肝炎病毒(HBV)密切相关。HBV携带者发生HCC的比例为200∶1,是人类肿瘤已知的最相关的因素之一,特别是HBVx基因及其产物HBx蛋白(HBx Ag)在HBV慢性感染并发展为HCC的过程中发挥重要作用。细胞凋亡是由特定基因调节的程序性死亡,对维持机体的自身稳定性和防止恶性肿瘤的发生是必要的。研究表明,在原发性肝细胞肝癌中存在广泛的细胞凋亡现象,特别是感染HBV的肝脏,提示HBV可能与肝细胞凋亡相关,并在HBV慢性感染以致发展成HCC的过程中起一定的作用。因此,作者对HBVx基因及其产物在肝癌细胞中的表达及其对肝癌细胞凋亡的影响进行了探讨。
1 材料与方法
, 百拇医药
1.1 HBVx基因真核表达载体pCDNA3.1-HBX的构建 用PCR法从含HBV全病毒的质粒pTTHK扩增HBVx基因。PCR引物和Taq DNA聚合酶购自上海生物工程公司,引物序列如下,分别在上游引物和下游引物5端加限制性内切酶Kpn 1和EcoR 1酶切位点。上游引物:5′TCGGTACCATGGCTGCTAGGCTG3;下游引物:5′GAGAATTCATGATTAGGCAGAGGTG3。
PCR循环条件:94℃ 5 min, 59℃ 1 min, 74℃ 1 min,30次循环后,74℃ 10min。PCR产物用低熔点胶回收,与克隆载体pT7Blue连接,构建成重组体pT7Blue-HBX,进行序列测定。选择测序结果正确的克隆提取质粒,经EcoR 1和Kpn 1双酶后连接于真核表达载体pCDNA3.1,构建HBVx基因真核表达载体pCDNA3.1-HBX。
, 百拇医药
1.2 基因转染及HBVx基因在肝癌细胞HCC 9204中的表达
1.2.1 基因转染 选择状态良好的对数生长早期肝癌细胞HCC 9204,用脂质体分别将2 μg pCDNA3.1,pCDNA3.1-HBX质粒DNA转入肝癌细胞,pCDNA3.1为载体对照,未进行基因转染的细胞为空白对照。转染后72 h将细胞接种于含500 mg.L-1 G418的选择性培养基,37℃,5%CO2,饱和湿度下培养4周,以筛选阳性细胞克隆。
1.2.2 HBVx基因在肝癌细胞HCC 9204细胞中的表达 (1)用原位杂交法检测HBVx mRNA在肝癌细胞HCC 9204中的表达:从真核表达载体pCDNA3.1-HBX上用限制性内切酶EcoR 1和Kpn 1切取HBx片段,低熔点胶回收,13%聚乙二醇8000纯化,地高辛标记的随机引物标记,地高辛随机引物标记试剂盒购自德国宝灵曼公司。转染pCDNA3.1-HBX的第四代肝癌细胞为实验组,未进行基因转染的肝癌细胞为对照组。按常规原位杂交步骤进行。(2)用免疫荧光法检测肝癌细胞中HBx蛋白:以转染pCDNA3.1-HBX的第四代肝癌细胞为实验组,未进行基因转染的肝癌细胞为阴性对照,按常规免疫荧光法进行。兔抗HBx多克隆抗体由王文亮教授提供,羊抗兔IgG-FITC购自华美公司。
, http://www.100md.com
1.3 HBx蛋白对肝癌细胞凋亡的影响
1.3.1 阿霉素诱导肝癌细胞凋亡 参照张晓东的方法〔1〕,将含20 μmol.L-1阿霉素的完全培养液4 ml加入转染pCDNA3.1-HBX的第四代肝癌细胞和未进行基因转染的肝癌细胞,37℃,5%CO2,饱和湿度下培养3 h后,洗细胞数次,用无药液的完全培养液继续培养6 h的细胞进行下列实验。
1.3.2 常规HE染色 步骤略。
1.3.3 琼脂糖凝胶电泳 收集离壁漂浮和贴壁的细胞提取DNA,进行1.8%琼脂糖凝胶电泳,30V,2 h。
1.3.4 透射电镜 3%戊二醛固定细胞,制备透射电镜标本。
, http://www.100md.com 1.3.5 流式细胞仪 70%乙醇固定细胞,4℃过夜,流式细胞仪分析细胞周期。
2 结果
2.1 HBVx基因真核表达载体pCDNA3.1-HBX的构建 重组体pT7Blue-HBX经EcoR 1和Kpn 1双酶切产生480 bp的目的片段,选择一个克隆测序。结果表明,连接于克隆载体的PCR产物为全长的HBVx基因,含起始码和终止码,属于adw 2型。重组体pT7Blue-HBX经EcoR 1和Kpn 1双酶切,回收HBVx片段,用T4DNA连接酶定向克隆于真核表达载体pCDNA3.1,构建成HBVx基因真核表达载体pCDNA3.1-HBX,酶切鉴定正确(图1,2),说明成功构建了HBVx基因真核表达载体。

, 百拇医药
图1 克隆载体pCDNA3.1-HBX酶切结果
1:未经酶切质粒pT7Blue-HBX;2,3:BamH 1酶切质粒pT7Blue-HBX;
4,5:EcoR 1和Kpn 1酶切质粒pT7Blue-HBX;6:Mark λDNA/HindⅢ

图2 HBVx基因真核表达载体pCDNA3.1-HBX酶切结果
2.2 基因转染及HBVx基因在肝癌细胞HCC 9204的表达
2.2.1 基因转染 将真核表达载体pCDNA3.1-HBX转染入对数生长早期的HCC 9402细胞,500 mg.L-1 G418筛选2周,绝大多数细胞死亡,仅少数细胞存活。存活的细胞继续在37℃,5%CO2,饱和湿度下培养2周,逐渐形成细胞克隆(图3),初步说明基因转染成功。

, 百拇医药
图3 转染PCDNA 3.1-HBX的肝癌细胞用G418筛选4周后形成的克隆.×100
2.2.2 HBVx基因在肝癌细胞HCC 9204的表达 (1)原位杂交法检测HBVx mRNA:按常规方法检测转染pCDNA3.1-HBX的第四代肝癌细胞中HBVx mRNA,未转染的肝癌细胞为阴性对照。在实验组细胞,可见蓝紫色颗粒样物位于细胞质中,细胞核中无阳性信号,对照组细胞胞质和胞核中均无阳性信号(图4)。说明HBVx基因被转入肝癌细胞并转录。(2)免疫荧光法检测HBx蛋白在肝癌细胞中的表达:按常规免疫荧光法检测HBx蛋白在转染HBVx基因的第四代肝癌细胞中的表达,未进行基因转染的细胞为阴性对照。荧光显微镜下观察,可见在实验组细胞胞质和胞核有黄绿色荧光(图5)。对照组细胞无黄绿荧光,说明HBVx基因被转入肝癌细胞并稳定表达HBx蛋白。

图4 原位杂交法显示肝癌细胞中的 HBx mRNA. ×400

, 百拇医药
图5 免疫荧光法显示肝癌细胞中的 HBx 蛋白. ×400
2.3 HBx蛋白对肝癌细胞凋亡的影响
2.3.1 阿霉素诱导肝癌细胞凋亡 含20 μmol.L-1阿霉素的完全培养4 ml加入转染pCDNA3.1-HBX和未转染基因的HCC 9204细胞,37℃,5%CO2,饱和湿度下培养3 h,不含药液的完全培养液继续培养6 h。倒置显微镜下观察,可见部分细胞离壁漂浮于培养液中,部分细胞尚贴壁,体积缩小,表面呈桑椹样。
2.3.2 常规HE染色 部分细胞体积明显缩小,细胞核缩小,染色变深,细胞表面看见毛刺样突起,为凋亡细胞的形态学表现,而且凋亡细胞多成群分布(图6)。

, http://www.100md.com
图6 20 μmol.L-1阿霉素作用3h/6h的肝癌细胞.HE×200
2.3.3 琼脂糖凝胶电泳 收集离壁漂浮和贴壁细胞,提取细胞DNA,1.8%琼脂糖凝胶电泳,可见20 μmol.L-1阿霉素作用3 h、6 h后未出现明显DNA ladder。40 μmol.L-1阿霉素作用3 h、6 h后,细胞DNA电泳为弥散的带型,是坏死细胞的表型(图7)。

图7 1.8%琼脂糖凝胶电泳显示细胞凋亡DNA梯形条带
2.3.4 透射电镜 结果可见,部分肝癌细胞体积明显缩小,胞核变小,染色质致密,并边集,位于胞核周边,细胞表面微绒毛消失,是凋亡细胞典型的形态学改变。未经阿霉素处理的肝癌细胞则不出现上述改变(图8,9)。

, http://www.100md.com
图8 肝癌细胞透射电镜.×75000

图9 透射电镜显示经阿霉素诱导的凋亡细胞.×75000
2.3.5 流式细胞仪 流式细胞仪分析20 μmol.L-1阿霉素作用3 h、6 h的转染pCDNA3.1-HBX的第四代细胞和未转染的肝癌细胞。结果稳定表达HBx蛋白的肝癌细胞凋亡率比未进行基因转染的肝癌细胞凋亡率低,分别为11.6%和38.4%(P<0.05)。
3 讨论
HBV的感染和肝细胞肝癌的关系密切,与HBV相关的肝细胞肝癌是东南亚、非洲及我国最常见的恶性肿瘤之一。特别是HBVx基因编码的HBx蛋白具有反式激活作用,可激活病毒和细胞基因,在HBV感染并发展为HCC的过程中起重要作用。恶性肿瘤的发生也与细胞凋亡有关,一方面细胞恶性转化具有自主生长能力,另一方面细胞凋亡也异常。病毒和细胞凋亡的关系已引起人们的重视,多种病毒基因可编码蛋白参与细胞凋亡。如SV40T抗原〔2〕、HPV E6〔3〕、EBV EBNA-5〔4〕、腺病毒E1B〔5〕等。HBV作为原发性肝癌已知的最相关的因素,其病毒基因是否编码蛋白参与细胞凋亡仅有少量报道〔6〕,有学者用微注射的方法将HBVx基因注入人成纤维细胞后,细胞凋亡被抑制。HBVx基因及其编码的HBx蛋白是否影响肝癌细胞凋亡?为此我们首先构建了HBVx基因真核表达载体pCDNA3.1-HBX,并用脂质体介导的方法转染入肝癌细胞HCC 9204,G418筛选获得稳定表达HBx蛋白的肝癌细胞。用阿霉素诱导细胞凋亡,流式细胞仪分析细胞周期。结果发现,稳定表达HBx蛋白的肝癌细胞凋亡率比不表达该蛋白的亲本细胞凋亡率低。说明HBx蛋白对肝癌细胞凋亡有抑制作用。
, 百拇医药
本研究结果显示HBx蛋白可抑制肝癌细胞凋亡,对进一步研究HBV在HCC发生中的作用具有重要意义。在HBV慢性感染过程中,病毒基因组常整合入宿主细胞基因组,X基因是最常被整合的基因,绝大多数原发性肝癌及肝癌细胞株都含有部分或全部的HBVx基因〔7〕,整合形式的X基因产生的HBx蛋白在体内〔8〕和体外〔9〕都具有反式激活作用,能够激活多种靶基因。HBx蛋白可反式激活病毒基因,促进病毒的复制和转录〔10〕,使病毒表达基因产物进入S抗原等,刺激机体免疫系统识别和清除被感染的肝细胞;同时,由于整合有HBVx基因的肝癌细胞不断再生,使HBx蛋白阳性的肝癌细胞克隆性增生〔11〕。HBx蛋白阳性的肝癌细胞与HBx蛋白阴性的肝癌细胞比较,发生了很大变化。HBx蛋白可参与细胞内多种信号转导途径,如ras/raf/MAPK/MAPKK和蛋白激酶C途径〔11〕,使信号转导改变。另外HBx蛋白具有生长因子样作用,可直接刺激细胞生长〔12〕。同时,还可使一些负性生长调控因子如p53失活〔13〕,并灭活一种或几种DNA修复途径,使肝细胞再生过程中有DNA损伤的细胞积累。HBx蛋白对细胞凋亡有抑制作用,HBx蛋白阳性的肝癌细胞对凋亡产生抗性。这可能是由于HBx蛋白对某些细胞凋亡调控基因(特别是促凋亡基因)的抑制所致。上述作用综合起来,最终使肝癌细胞发生恶性转化,这可能是HBV相关的HCC发生的重要机制。
, 百拇医药
关于HBx蛋白参与细胞凋亡的确切机制尚不清楚,已有的研究表明,HBx蛋白并不直接与DNA结合,而是在蛋白质水平形成复合体,由复合体调节靶基因的表达〔11〕。总之,本研究仅表明HBx蛋白可抑制肝癌细胞凋亡,但HBx蛋白的作用是广泛而复杂的,需进一步研究。
基金项目:国家自然科学基金资助课题 (No 39470771)
作者简介:郭双平,女,30岁,博士。研究方向:HBV与肝癌细胞凋亡
王文亮,男,65岁,教授,博士生导师。研究方向:肝癌的分子病理学
参考文献
1,张晓东.阿霉素诱导肝癌细胞凋亡及其凋亡相关基因和杀伤因子的研究[博士论文].西安:第四军医大学,1996
, 百拇医药
2,Lane DP. T antigen is bound to a host protein in SV40-transformed cells. Nature, 1979;278:261~263
3,Dyson N. The human papilloma virus-16 E7 oncoprotein is able to bind to the retinoblastoma gene product. Science, 1989;243:934~937
4,Szekely L. EBNA-5, an Epstein-Barr virus-encoded nuclear antigen, binds to the retinoblastoma and p53 proteins. Proc Natl Acad Sci USA, 1993;90:5455~5459
5,Wyllie A. Adenovirus Eld-58 KD tumor antigen and SV 40 large tumor antigen are physically associated with the same 54KD cellular protein in transformed cells. Cell, 1982;28:387~394
, 百拇医药
6,Wang XW, Gibson MK, Vermeulen W et al. Abrogation of p53-induced apoptosis by the hepatitis B virus x gene. Cancer Res, 1995;55:6012~6016
7,Matsubara K, Tokino T. Integration of hepatitis B virus DNA and its implications for hepatocarcinogenesis. Mol Bio Med, 1990;7:243~260
8,Balsano C, Billet O, Bennoun M et al. Hepatits B virus x gene product acts as a transactivator in vivo. J Hepto, 1994;27:103~109
, http://www.100md.com
9,Zahm P, Hofschneider PH, Koshy R. The HBV-ORF encodes a trans-activator: a potential factor in viral hepatocarcinogenesis. Oncogene, 1988;3:169~177
10,Nakatake H, Chisaka O, Yamamoto S et al. Effect of x protein on transactivation of HBV promoters and on viral replication. Virology, 1993;195:305~314
11,Feitelson MA, Duan LX. Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma. Am J Pathol, 1997;150(4):1141~1157
, http://www.100md.com
12,Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci USA, 1995;92:11215~11219
13,Truant R, Antunovic J, Greenblatt J et al. Direct interaction of the hepatits B virus HBx protein with p53 response element-directed transactivation. J Virol, 1995;69:1851~1859
收稿日期:1998-12-18, 百拇医药