IL-10基因转染对小鼠炎症介质产生的抑制作用
作者:太光平 汪仕良 王 裴 陈 渝 刘 昕 王桂珍 章 波 黎 鳌
单位:太光平、汪仕良、王 裴、陈 渝、王桂珍、黎 鳌 400038 重庆,第三军医大学附属西南医院烧伤研究所;刘 昕、章 波 第三军医大学分子遗传教研室
关键词:白细胞介素10;基因疗法;白细胞介素6;肿瘤坏死因子α;内毒素血症
中华创伤杂志990410 【摘要】 目的 以内毒素攻击模型观察腹腔转染炎症诱导启动子SAA3指导的HIL10基因在小鼠体内表达的可行性及对炎症介质表达的影响。方法 小鼠分3组,采用腹腔注射法转染脂质体/DNA复合物,48小时后LPS攻击, 测定不同时间HIL10的诱导表达(RT-PCR、ELISA) 及分布(免疫组化),不同时间TNF-α、IL-6表达测定(ELISA法)。结果 RT-PCR证明LPS攻击后基因转染小鼠肝脏HIL10表达迅速增加(12.6~14.9倍),维持1~5天;免疫组化显示肝细胞及kupffer细胞有强阳性反应细胞。HIL10基因转染显著下调肝脏TNF-α(66.21%~44.8%)及IL-6表达(42.25%)(P<0.05),显著降低血清TNF-α(33.6%~53.6%)及IL-6(16%~40%)水平(P<0.05)。 结论 PSAA3 HIL10诱导表达体系腹腔转染可被炎症诱导,迅速启动并在小鼠肝脏表达,白细胞介素10(IL-10)基因转染显著抑制肝脏TNF-α、IL-6表达,显著降低血清炎症介质的水平。
, http://www.100md.com
Inhibition of IL-10 Gene Transfection on TNF-α、IL-6 Production in Endotoxemia Mouse
TAI Guangping, WANG Shiliang, LI Ao, et al.
Burn Research Institute of PLA, Southwestern Hospital, Third Military Medical University, Chongqing 400038
【Abstract】 Objective To investigate the possibility of HIL-10 gene expression and its inhibitory effects of inflammation on TNF-α and IL-6 production in endotoxemia mouse model. Methods Experimental mice were divided into three groups. Each mouse was administered PSAA3 HIL-10 intraperitoneally and then challenged with LPS. HIL-10 expression was detected by RT-PCR, ELISA and immunohistochemistry at indicated time. TNF-α and IL-6 were determined by ELISA method. Results HIL-10 expression was rapidly increased by 12.6-14.9 fold after LPS challenge and maintained 1-5 days. Positive cell of HIL-10 expression was mainly found in Kupffer cell and hepatocyte. HIL-10 gene transfection significantly decreased not only the expression of hepatic TNF-α (66.21%-44.8%) and IL-6 (42.25%) (P<0.05), but also the serum levels of TNF-α (33.6%-53.6%) and IL-6 (16%-40%)(P<0.05). Conclusions The expression of PSAA3 HIL-10 in the liver of transfected mouse can be induced by inflammation and in an inflammation inducible pattern. HIL-10 can markedly inhibit endotoxin-induced hepatic and serum TNF-α, IL-6 expression and production in endotoxemia mouse.
, 百拇医药
【Key Words】 Interleukin-10 Gene therapy Interleukin-6 Tumor necrosis factor-α Endotoxemia
治疗基因表达的组织、时序及水平的严格调控是任何基因治疗进入临床前必需解决的问题,而如何有效地调控转染的外源性细胞因子基因则决定了其基因治疗的价值及应用范围[1]。白细胞介素10(IL-10)又名“细胞因子合成抑制因子(CSIF)”,其广泛抑制多种炎症介质的合成, IL-10 已经应用于脓毒症及SIRS的抗介质治疗、移植排斥反应、哮喘及慢性炎症疾病等综合治疗的临床研究[2],但半衰期过短是其主要问题之一。笔者探索IL-10基因治疗方法及调控治疗基因IL-10表达的全新策略,拟应用急性相蛋白血清淀粉样蛋白A3 (SAA3)启动子调控IL-10表达,使IL-10表达呈炎症诱导及自适应表达特性[3]。在内毒素攻击模型观察pSAA3 HIL-10诱导表达体系在小鼠的炎症诱导表达及IL-10基因转染对TNF-α、IL-6表达的抑制作用。
, 百拇医药
材料与方法
一、材料
1.动物:昆明种小鼠, 18~25 g, 6~8周龄,本校实验动物中心提供。
2.主要试剂:DNA抽提药盒、 DOTap脂质体转染试剂盒、RNA抽提药盒,Titan RT-PCR药盒,人特异性IL-10 ELISA kit ( Boehringmannheim 公司);RNA酶抑制剂、逆转录酶AMV等为Promega公司产品 ; LPS(E.coli O111 B4, Sigma公司);HIL10 引物合成(中科院上海生理所生工公司);TNF-a测定用ELISA 药盒(军事医学科学院邦定公司提供);IL-6 ELISA 药盒(第四军医大学提供)。
3.表达载体:真核表达载体pSAA3HIL-10本室构建[3],全长4.5kb, 含小鼠SAA3的启动子/增强子 (-306~+47)调节序列其下游为HIL-10 cDNA完整的编码区及信号肽。
, 百拇医药
二、方法
1. 动物分组:小鼠随机分3组: PSAA3 HIL-10基因转染组、单纯LPS攻击组(LPS 250 μg/只)及基因转染联合LPS攻击组(LPS 250 μg/只)。
2.pSAA3HIL10基因的体内导入:脂质体/DNA复合物准备:溶液A, 取75 μg pSAA3 HIL10质粒DNA, 用HEPE缓冲液稀释至100 μl, 溶液B, 取100 μl DOTap脂质体,混合A、B溶液,轻轻摇匀,室温静止置10~25分钟。脂质体腹腔转染:常规消毒腹部,取上述混合液200 μl及300 μl等渗盐水,腹腔注射。
3. 基因转染后处理:基因转染组转染后动物恢复正常饮食,基因转染联合LPS攻击组,48小时后腹腔注射250 μg LPS,小鼠LPS攻击后不同时间(6,24,48,72,96,120,144小时)取眼眶血,处死小鼠取肝、脾、肺、肾标本液氮保存。
, 百拇医药
4.HIL10表达测定:用人特异性IL-10 ELISA kit测定;用人特异性IL-10抗体常规做脏器免疫组织化学分析。
5. HIL10 表达RT-PCR分析: 用RNA抽提药盒抽提细胞总RNA,HIL10 引物, P1:5'-CTGAAGACTTTCTTTCAAACA
AA G-3',P2: 3'-CTGCTCCACTGCCTTGCTCTTATT-5' ;RT-PCR扩增反应条件:首先55℃反转录30分钟,94℃变性30秒,55℃复性45秒,68℃延长2分钟,共30~35循环,首轮循环94℃变性2分钟,最后一轮68℃延长10分钟。扩增产物用2%琼脂糖凝胶电泳观察。
6.TNF-а测定:常规ELISA药盒测定。
7.IL-6测定:常规ELISA药盒测定。
, 百拇医药
8.数据处理: 数据以均数±标准差表示。用EXCEL软件和SPSS统计程序包进行方差分析及t检验。
结 果
一、 HIL-10在小鼠体内表达的分析
人特异引物RT-PCR显示,单次剂量LPS活化12小时即可检出肝脏HIL-10mRNA的表达,LPS攻击后24,48,72小时均可持续检出HIL10 mRNA的表达(图1)。
图1 肝脏HIL10 mRNA表达的RT-PCR分析示
12,24,48,72h HIL10 mRNA的扩增条带
LPS攻击48小时,显著诱导肝脏HIL-10表达,而脾、肺仅有少量HIL-10表达,血清HIL-10水平为肝HIL-10的1/18(774.45 pg/ml,表1)。
, http://www.100md.com
表1 LPS攻击诱导转染小鼠脏脏器HIL-10表达HlL-10蛋白(ng/g) 脏器
HlL-10
肝
14.66±4.26
脾
1.90±0.33
肺
2.25±0.64
血清
0.77±0.48
肾
-
, http://www.100md.com
肠
-
二、转染小鼠肝脏HIL-10诱导表达的动力学
单剂量的LPS攻击迅速启动肝脏HIL10表达,第2,3天时HlL10表达增加12.6~14.9倍,达15.24~17.9 ng/g,第5天已降至对照组水平(1.21ng/g,表2)。
表2 转染小鼠肝脏HIL-10诱导表达动态(ng/g,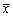 ±s) 时间
±s) 时间
HlL-10
0h
1.21±0.68
, 百拇医药 12h
2.99±1.74
1d
9.27±2.49
2d
15.24±6.12
3d
17.97±4.71
4d
4.80±1.46
5d
1.17±0.09
三、转染小鼠HIL-10基因表达的免疫组织化学分析
, http://www.100md.com
免疫组织化学分析显示:LPS攻击后肝实质细胞及kupffer细胞有强阳性反应细胞(HIL-10),肝窦间的阳性反应细胞有肝窦内皮细胞及浸润的单核细胞,阳性反应肝细胞主要分布在中央静脉周围(图2)。
四、HIL-10基因转染下调小鼠肝脏IL-6的表达
LPS攻击后肝脏匀浆IL-6水平迅速表达,24及48小时增加显著, 基因转染组肝脏匀浆IL-6水平在各时相点均显著低于对照组,平均下调水平为42.25%(P<0.05,表3)。
五、HIL-10基因转染下调小鼠肝脏TNF-α的表达
TNF-α在LPS攻击后上升较早,12小时肝脏匀浆TNF-α水平为1.637 ng/g,24小时迅速下降,HIL-10基因转染动物在LPS攻击后肝脏匀浆TNF-α水平在各时相点低于对照组,较对照组下调66.21%~44.8%(P<0.05,表4)。
, 百拇医药
表3 HIL-10基因转染下调小鼠肝脏IL-6的表达(ng/g,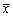 ±s) 组别
±s) 组别
时间(h)
12
24
48
72
对照组
4.01±0.26
7.6±0.61
5.82±1.4
2.91±0.14
, 百拇医药
转染组
2.37±0.16*
4.71±1.5*
3.49±0.75*
0.85±0.12*
与对照组比较,*P<0.05
图2 肝脏HIL-10免疫组织化学分析
表4 HIL-10基因转染下调小鼠肝脏TNF-α的表达(ng/g,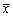 ±s) 组别
±s) 组别
, 百拇医药
时间(h)
12
24
48
对照组
1.64±0.15
1.35±0.08
0.89±0.04
转染组
0.87±0.13
0.75±0.07*
0.30±0.02*
, 百拇医药
与对照组比较,*P<0.05
六、HIL-10基因转染对小鼠血清炎症介质水平的影响
LPS攻击6小时小鼠血清TNF-a迅速升高771.4 pg/ml ,IL-6在24小时达峰值770 pg/ml,基因转染组TNF-α、IL-6较对照分别下降33.6%~53.6%(P<0.05)及16%~40%(P<0.05,表5,6)。
表5 HIL-10基因转染下调小鼠血清TNF-α水平(pg/g,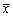 ±s) 组别
±s) 组别
时间(h)
6
12
, 百拇医药
24
对照组
771.4±132.74
638.01±72.19
519.62±31.6
转染组
511.8±112.5
352.0±65.67*
241.3±23.36*
与对照组比较,* P<0.05表6 HIL-10基因转染下调小鼠血清IL-6水平(pg/g,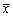 ±s) 组别
±s) 组别
, 百拇医药
时间(h)
12
24
48
对照组
406.58±56.2
770.01±66.3
589.16±13.6
转染组
340.22±64.1*
477.41±14.9*
353.49±75.3*
, 百拇医药
与对照组比较,*P<0.05讨 论
目前普遍采用的基因治疗表达载体,其目的基因受所选择的载体启动子自发激活,表达不受限制,难于解决目的基因表达的时机和表达水平动态控制这一关键问题。 急性相反应蛋白(SAA3)是一类进化上高度保守的蛋白,能对各种炎性刺激响应灵敏。业已阐明,血液SAA3水平的升高与创伤(烧伤)、感染及炎症反应的严重程度成正比,随病程的波动而波动,可表达于肝细胞及肝外单核吞噬细胞系统。SAA3启动子存在IL-1、IL-6等激活应答元件[1]。本研究中选用能对病理信号响应的启动子(SAA3),就可能实现目的基因的表达随疾病的病理生理信号变化而改变,治疗基因(HIL-10)表达受疾病病理过程(炎性水平)的自动控制,将为解决急慢性炎症疾病的基因治疗目的基因(IL-1ra、sTNFR等)表达的时机和表达水平的动态控制这一关键问题,提供一条极好的基因调控策略。
LPS攻击小鼠后,肝脏可产生IL-1、TNF-α、IL-6等初级炎性介质,IL-1、TNF-α、 LPS自身进一步活化肝内皮细胞,强烈地诱导次级炎性分子的表达。本实验LPS攻击小鼠迅速诱导肝脏HIL-10表达高水平,而肺、脾较低。应用的人特异性引物RT-PCR扩增后出现了特异的扩增产物,该特异性引物其Primer 124个碱基中与小鼠同源性误配仅7/20bp,Primer 224碱基中与小鼠同源性误配仅为5/20 bp,表明外源基因HIL-10 mRNA已在肝细胞有效地转录。免疫组织化学分析结果也显示,LPS攻击后肝细胞及kupffer细胞有强阳性反应细胞,肝窦间的阳性反应细胞可能为肝窦内皮细胞及浸润的单核细胞,而且肝细胞阳性反应细胞主要分布在中央静脉周围。HlL-10表达的细胞特异性与SAA3 启动子/增强子决定有关。 Li等报告SAA3 启动子5'端片段中存在决定SAA3组织特异性的序列,SAA3 TATA盒子5'上游一个56bp的序列(-93~-38bp)为SAA3 启动子细胞特异性表达增强子元件,其存在是SAA3在肝细胞表达所必需的,可与肝特异性转录因子C/EBP、HNFs作用,启动下游基因转录[4]。另外,与脂质体体内分布特性一致,腹腔注射的脂质体主要为巨噬细胞系统收集过滤,有报道40%以上的脂质体汇集在肝脏。
, 百拇医药
LPS攻击迅速激发分泌产生炎症介质,激活SAA3启动子应答元件,从而启动下游的外源HIL-10基因转录及表达,本研究HIL-10基因转染组肝脏匀浆、血清IL-6、TNF-α产生减少,提示HIL-10基因转染的确显著下调LPS攻击早期炎症介质的产生,但试验中外源HIL-10主要在局部器官(肝)表达,诱导后血清HIL-10水平增加有限,其如何发挥体内下调体内系统炎症介质IL-6、TNF-α的产生?Chernoff等报告静脉给予rHIL-10,24小时后血清已无可测水平HIL-10,但仍然维持60%~82%抑制TNF-a、IL-1产生的效应, 该作用显然不是残留IL-10的作用。Chernoff发现hIL-10增加单核细胞(55%~125%)中性细胞(40%~160%)数量,显著增加TNF拮抗剂sTNFR 的产生及IL-1ra的表达,从而介导了IL-10的后继抗炎症效应[5]。
本研究证明,用急性期反应蛋白SAA3启动子/增强子元件调控基因治疗中目的基因HIL-10表达的策略是可行的,由于SAA3独特的可诱导、自适应表达等特点,提示SAA3启动子/增强子元件调控的HIL-10基因表达体系可应用于系统性急、慢性炎症反应性疾病的基因治疗[6]。
, http://www.100md.com
*本课题为国家自然科学基金资助项目(No:39600140)
参考文献
1 Brigham KL, Canonico AE, Meyrick BO, et al. Gene therapy for inflammatory diseases. Prog Clin Biol Res, 1994, 388: 361-365.
2 de Vries JE. Immunosuppressive and anti-inflammatory properties of interleukin-10. Ann Med, 1995 , 27: 537-541.
3 太光平,汪仕良.炎症诱导白介素10基因表达体系的构建及临床意义. 第三军医大学学报, 1998,20: 39-42.
, 百拇医药
4 Ray BK, Ray A. Induction of serum amyloid A (SAA) gene by SAA activating sequence binding factor (SAF) in monocyte/macrophage cells: evidence for a functional synergy between SAF and Spl. J Biol Chem, 1997, 272:28948-28953.
5 Wissing KM, Morelon E, Legendre C, et al. A pilot trial of recombinant human interleukin-10 in kidney transplant recipients receiving OKT3 induction therapy. Transplantation , 1997, 64:999-1006.
6 Crawley JB, Williams LM, Mander T, et al. Interleukin-10 stimulation of phosphatidylinositol 3 kinase and P70 S6 kinase is required for the proliferative but not the antiinflammatory effects of the cytokine. J Biol Chem, 1996 , 271: 16357 -16362.
收稿日期:1998-07-04
修稿日期:1999-04-21, 百拇医药
单位:太光平、汪仕良、王 裴、陈 渝、王桂珍、黎 鳌 400038 重庆,第三军医大学附属西南医院烧伤研究所;刘 昕、章 波 第三军医大学分子遗传教研室
关键词:白细胞介素10;基因疗法;白细胞介素6;肿瘤坏死因子α;内毒素血症
中华创伤杂志990410 【摘要】 目的 以内毒素攻击模型观察腹腔转染炎症诱导启动子SAA3指导的HIL10基因在小鼠体内表达的可行性及对炎症介质表达的影响。方法 小鼠分3组,采用腹腔注射法转染脂质体/DNA复合物,48小时后LPS攻击, 测定不同时间HIL10的诱导表达(RT-PCR、ELISA) 及分布(免疫组化),不同时间TNF-α、IL-6表达测定(ELISA法)。结果 RT-PCR证明LPS攻击后基因转染小鼠肝脏HIL10表达迅速增加(12.6~14.9倍),维持1~5天;免疫组化显示肝细胞及kupffer细胞有强阳性反应细胞。HIL10基因转染显著下调肝脏TNF-α(66.21%~44.8%)及IL-6表达(42.25%)(P<0.05),显著降低血清TNF-α(33.6%~53.6%)及IL-6(16%~40%)水平(P<0.05)。 结论 PSAA3 HIL10诱导表达体系腹腔转染可被炎症诱导,迅速启动并在小鼠肝脏表达,白细胞介素10(IL-10)基因转染显著抑制肝脏TNF-α、IL-6表达,显著降低血清炎症介质的水平。
, http://www.100md.com
Inhibition of IL-10 Gene Transfection on TNF-α、IL-6 Production in Endotoxemia Mouse
TAI Guangping, WANG Shiliang, LI Ao, et al.
Burn Research Institute of PLA, Southwestern Hospital, Third Military Medical University, Chongqing 400038
【Abstract】 Objective To investigate the possibility of HIL-10 gene expression and its inhibitory effects of inflammation on TNF-α and IL-6 production in endotoxemia mouse model. Methods Experimental mice were divided into three groups. Each mouse was administered PSAA3 HIL-10 intraperitoneally and then challenged with LPS. HIL-10 expression was detected by RT-PCR, ELISA and immunohistochemistry at indicated time. TNF-α and IL-6 were determined by ELISA method. Results HIL-10 expression was rapidly increased by 12.6-14.9 fold after LPS challenge and maintained 1-5 days. Positive cell of HIL-10 expression was mainly found in Kupffer cell and hepatocyte. HIL-10 gene transfection significantly decreased not only the expression of hepatic TNF-α (66.21%-44.8%) and IL-6 (42.25%) (P<0.05), but also the serum levels of TNF-α (33.6%-53.6%) and IL-6 (16%-40%)(P<0.05). Conclusions The expression of PSAA3 HIL-10 in the liver of transfected mouse can be induced by inflammation and in an inflammation inducible pattern. HIL-10 can markedly inhibit endotoxin-induced hepatic and serum TNF-α, IL-6 expression and production in endotoxemia mouse.
, 百拇医药
【Key Words】 Interleukin-10 Gene therapy Interleukin-6 Tumor necrosis factor-α Endotoxemia
治疗基因表达的组织、时序及水平的严格调控是任何基因治疗进入临床前必需解决的问题,而如何有效地调控转染的外源性细胞因子基因则决定了其基因治疗的价值及应用范围[1]。白细胞介素10(IL-10)又名“细胞因子合成抑制因子(CSIF)”,其广泛抑制多种炎症介质的合成, IL-10 已经应用于脓毒症及SIRS的抗介质治疗、移植排斥反应、哮喘及慢性炎症疾病等综合治疗的临床研究[2],但半衰期过短是其主要问题之一。笔者探索IL-10基因治疗方法及调控治疗基因IL-10表达的全新策略,拟应用急性相蛋白血清淀粉样蛋白A3 (SAA3)启动子调控IL-10表达,使IL-10表达呈炎症诱导及自适应表达特性[3]。在内毒素攻击模型观察pSAA3 HIL-10诱导表达体系在小鼠的炎症诱导表达及IL-10基因转染对TNF-α、IL-6表达的抑制作用。
, 百拇医药
材料与方法
一、材料
1.动物:昆明种小鼠, 18~25 g, 6~8周龄,本校实验动物中心提供。
2.主要试剂:DNA抽提药盒、 DOTap脂质体转染试剂盒、RNA抽提药盒,Titan RT-PCR药盒,人特异性IL-10 ELISA kit ( Boehringmannheim 公司);RNA酶抑制剂、逆转录酶AMV等为Promega公司产品 ; LPS(E.coli O111 B4, Sigma公司);HIL10 引物合成(中科院上海生理所生工公司);TNF-a测定用ELISA 药盒(军事医学科学院邦定公司提供);IL-6 ELISA 药盒(第四军医大学提供)。
3.表达载体:真核表达载体pSAA3HIL-10本室构建[3],全长4.5kb, 含小鼠SAA3的启动子/增强子 (-306~+47)调节序列其下游为HIL-10 cDNA完整的编码区及信号肽。
, 百拇医药
二、方法
1. 动物分组:小鼠随机分3组: PSAA3 HIL-10基因转染组、单纯LPS攻击组(LPS 250 μg/只)及基因转染联合LPS攻击组(LPS 250 μg/只)。
2.pSAA3HIL10基因的体内导入:脂质体/DNA复合物准备:溶液A, 取75 μg pSAA3 HIL10质粒DNA, 用HEPE缓冲液稀释至100 μl, 溶液B, 取100 μl DOTap脂质体,混合A、B溶液,轻轻摇匀,室温静止置10~25分钟。脂质体腹腔转染:常规消毒腹部,取上述混合液200 μl及300 μl等渗盐水,腹腔注射。
3. 基因转染后处理:基因转染组转染后动物恢复正常饮食,基因转染联合LPS攻击组,48小时后腹腔注射250 μg LPS,小鼠LPS攻击后不同时间(6,24,48,72,96,120,144小时)取眼眶血,处死小鼠取肝、脾、肺、肾标本液氮保存。
, 百拇医药
4.HIL10表达测定:用人特异性IL-10 ELISA kit测定;用人特异性IL-10抗体常规做脏器免疫组织化学分析。
5. HIL10 表达RT-PCR分析: 用RNA抽提药盒抽提细胞总RNA,HIL10 引物, P1:5'-CTGAAGACTTTCTTTCAAACA
AA G-3',P2: 3'-CTGCTCCACTGCCTTGCTCTTATT-5' ;RT-PCR扩增反应条件:首先55℃反转录30分钟,94℃变性30秒,55℃复性45秒,68℃延长2分钟,共30~35循环,首轮循环94℃变性2分钟,最后一轮68℃延长10分钟。扩增产物用2%琼脂糖凝胶电泳观察。
6.TNF-а测定:常规ELISA药盒测定。
7.IL-6测定:常规ELISA药盒测定。
, 百拇医药
8.数据处理: 数据以均数±标准差表示。用EXCEL软件和SPSS统计程序包进行方差分析及t检验。
结 果
一、 HIL-10在小鼠体内表达的分析
人特异引物RT-PCR显示,单次剂量LPS活化12小时即可检出肝脏HIL-10mRNA的表达,LPS攻击后24,48,72小时均可持续检出HIL10 mRNA的表达(图1)。

图1 肝脏HIL10 mRNA表达的RT-PCR分析示
12,24,48,72h HIL10 mRNA的扩增条带
LPS攻击48小时,显著诱导肝脏HIL-10表达,而脾、肺仅有少量HIL-10表达,血清HIL-10水平为肝HIL-10的1/18(774.45 pg/ml,表1)。
, http://www.100md.com
表1 LPS攻击诱导转染小鼠脏脏器HIL-10表达HlL-10蛋白(ng/g) 脏器
HlL-10
肝
14.66±4.26
脾
1.90±0.33
肺
2.25±0.64
血清
0.77±0.48
肾
-
, http://www.100md.com
肠
-
二、转染小鼠肝脏HIL-10诱导表达的动力学
单剂量的LPS攻击迅速启动肝脏HIL10表达,第2,3天时HlL10表达增加12.6~14.9倍,达15.24~17.9 ng/g,第5天已降至对照组水平(1.21ng/g,表2)。
表2 转染小鼠肝脏HIL-10诱导表达动态(ng/g,
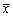 ±s) 时间
±s) 时间HlL-10
0h
1.21±0.68
, 百拇医药 12h
2.99±1.74
1d
9.27±2.49
2d
15.24±6.12
3d
17.97±4.71
4d
4.80±1.46
5d
1.17±0.09
三、转染小鼠HIL-10基因表达的免疫组织化学分析
, http://www.100md.com
免疫组织化学分析显示:LPS攻击后肝实质细胞及kupffer细胞有强阳性反应细胞(HIL-10),肝窦间的阳性反应细胞有肝窦内皮细胞及浸润的单核细胞,阳性反应肝细胞主要分布在中央静脉周围(图2)。
四、HIL-10基因转染下调小鼠肝脏IL-6的表达
LPS攻击后肝脏匀浆IL-6水平迅速表达,24及48小时增加显著, 基因转染组肝脏匀浆IL-6水平在各时相点均显著低于对照组,平均下调水平为42.25%(P<0.05,表3)。
五、HIL-10基因转染下调小鼠肝脏TNF-α的表达
TNF-α在LPS攻击后上升较早,12小时肝脏匀浆TNF-α水平为1.637 ng/g,24小时迅速下降,HIL-10基因转染动物在LPS攻击后肝脏匀浆TNF-α水平在各时相点低于对照组,较对照组下调66.21%~44.8%(P<0.05,表4)。
, 百拇医药
表3 HIL-10基因转染下调小鼠肝脏IL-6的表达(ng/g,
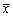 ±s) 组别
±s) 组别时间(h)
12
24
48
72
对照组
4.01±0.26
7.6±0.61
5.82±1.4
2.91±0.14
, 百拇医药
转染组
2.37±0.16*
4.71±1.5*
3.49±0.75*
0.85±0.12*
与对照组比较,*P<0.05

图2 肝脏HIL-10免疫组织化学分析
表4 HIL-10基因转染下调小鼠肝脏TNF-α的表达(ng/g,
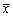 ±s) 组别
±s) 组别, 百拇医药
时间(h)
12
24
48
对照组
1.64±0.15
1.35±0.08
0.89±0.04
转染组
0.87±0.13
0.75±0.07*
0.30±0.02*
, 百拇医药
与对照组比较,*P<0.05
六、HIL-10基因转染对小鼠血清炎症介质水平的影响
LPS攻击6小时小鼠血清TNF-a迅速升高771.4 pg/ml ,IL-6在24小时达峰值770 pg/ml,基因转染组TNF-α、IL-6较对照分别下降33.6%~53.6%(P<0.05)及16%~40%(P<0.05,表5,6)。
表5 HIL-10基因转染下调小鼠血清TNF-α水平(pg/g,
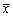 ±s) 组别
±s) 组别时间(h)
6
12
, 百拇医药
24
对照组
771.4±132.74
638.01±72.19
519.62±31.6
转染组
511.8±112.5
352.0±65.67*
241.3±23.36*
与对照组比较,* P<0.05表6 HIL-10基因转染下调小鼠血清IL-6水平(pg/g,
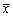 ±s) 组别
±s) 组别, 百拇医药
时间(h)
12
24
48
对照组
406.58±56.2
770.01±66.3
589.16±13.6
转染组
340.22±64.1*
477.41±14.9*
353.49±75.3*
, 百拇医药
与对照组比较,*P<0.05讨 论
目前普遍采用的基因治疗表达载体,其目的基因受所选择的载体启动子自发激活,表达不受限制,难于解决目的基因表达的时机和表达水平动态控制这一关键问题。 急性相反应蛋白(SAA3)是一类进化上高度保守的蛋白,能对各种炎性刺激响应灵敏。业已阐明,血液SAA3水平的升高与创伤(烧伤)、感染及炎症反应的严重程度成正比,随病程的波动而波动,可表达于肝细胞及肝外单核吞噬细胞系统。SAA3启动子存在IL-1、IL-6等激活应答元件[1]。本研究中选用能对病理信号响应的启动子(SAA3),就可能实现目的基因的表达随疾病的病理生理信号变化而改变,治疗基因(HIL-10)表达受疾病病理过程(炎性水平)的自动控制,将为解决急慢性炎症疾病的基因治疗目的基因(IL-1ra、sTNFR等)表达的时机和表达水平的动态控制这一关键问题,提供一条极好的基因调控策略。
LPS攻击小鼠后,肝脏可产生IL-1、TNF-α、IL-6等初级炎性介质,IL-1、TNF-α、 LPS自身进一步活化肝内皮细胞,强烈地诱导次级炎性分子的表达。本实验LPS攻击小鼠迅速诱导肝脏HIL-10表达高水平,而肺、脾较低。应用的人特异性引物RT-PCR扩增后出现了特异的扩增产物,该特异性引物其Primer 124个碱基中与小鼠同源性误配仅7/20bp,Primer 224碱基中与小鼠同源性误配仅为5/20 bp,表明外源基因HIL-10 mRNA已在肝细胞有效地转录。免疫组织化学分析结果也显示,LPS攻击后肝细胞及kupffer细胞有强阳性反应细胞,肝窦间的阳性反应细胞可能为肝窦内皮细胞及浸润的单核细胞,而且肝细胞阳性反应细胞主要分布在中央静脉周围。HlL-10表达的细胞特异性与SAA3 启动子/增强子决定有关。 Li等报告SAA3 启动子5'端片段中存在决定SAA3组织特异性的序列,SAA3 TATA盒子5'上游一个56bp的序列(-93~-38bp)为SAA3 启动子细胞特异性表达增强子元件,其存在是SAA3在肝细胞表达所必需的,可与肝特异性转录因子C/EBP、HNFs作用,启动下游基因转录[4]。另外,与脂质体体内分布特性一致,腹腔注射的脂质体主要为巨噬细胞系统收集过滤,有报道40%以上的脂质体汇集在肝脏。
, 百拇医药
LPS攻击迅速激发分泌产生炎症介质,激活SAA3启动子应答元件,从而启动下游的外源HIL-10基因转录及表达,本研究HIL-10基因转染组肝脏匀浆、血清IL-6、TNF-α产生减少,提示HIL-10基因转染的确显著下调LPS攻击早期炎症介质的产生,但试验中外源HIL-10主要在局部器官(肝)表达,诱导后血清HIL-10水平增加有限,其如何发挥体内下调体内系统炎症介质IL-6、TNF-α的产生?Chernoff等报告静脉给予rHIL-10,24小时后血清已无可测水平HIL-10,但仍然维持60%~82%抑制TNF-a、IL-1产生的效应, 该作用显然不是残留IL-10的作用。Chernoff发现hIL-10增加单核细胞(55%~125%)中性细胞(40%~160%)数量,显著增加TNF拮抗剂sTNFR 的产生及IL-1ra的表达,从而介导了IL-10的后继抗炎症效应[5]。
本研究证明,用急性期反应蛋白SAA3启动子/增强子元件调控基因治疗中目的基因HIL-10表达的策略是可行的,由于SAA3独特的可诱导、自适应表达等特点,提示SAA3启动子/增强子元件调控的HIL-10基因表达体系可应用于系统性急、慢性炎症反应性疾病的基因治疗[6]。
, http://www.100md.com
*本课题为国家自然科学基金资助项目(No:39600140)
参考文献
1 Brigham KL, Canonico AE, Meyrick BO, et al. Gene therapy for inflammatory diseases. Prog Clin Biol Res, 1994, 388: 361-365.
2 de Vries JE. Immunosuppressive and anti-inflammatory properties of interleukin-10. Ann Med, 1995 , 27: 537-541.
3 太光平,汪仕良.炎症诱导白介素10基因表达体系的构建及临床意义. 第三军医大学学报, 1998,20: 39-42.
, 百拇医药
4 Ray BK, Ray A. Induction of serum amyloid A (SAA) gene by SAA activating sequence binding factor (SAF) in monocyte/macrophage cells: evidence for a functional synergy between SAF and Spl. J Biol Chem, 1997, 272:28948-28953.
5 Wissing KM, Morelon E, Legendre C, et al. A pilot trial of recombinant human interleukin-10 in kidney transplant recipients receiving OKT3 induction therapy. Transplantation , 1997, 64:999-1006.
6 Crawley JB, Williams LM, Mander T, et al. Interleukin-10 stimulation of phosphatidylinositol 3 kinase and P70 S6 kinase is required for the proliferative but not the antiinflammatory effects of the cytokine. J Biol Chem, 1996 , 271: 16357 -16362.
收稿日期:1998-07-04
修稿日期:1999-04-21, 百拇医药