大鼠肝癌细胞系H4-ⅡE钙内流的检测方法
作者:陈景龙
单位:福建医科大学寄生虫学教研室(福州 350004)
关键词:H4-ⅡE细胞系;钙内流;荧光显微镜技术;方法
福建医科大学学报990434
目的 利用大鼠肝癌细胞系H4-ⅡE建立一种适用于贴壁生长的细胞检测细胞内游离钙离子([Ca2+]i)浓度的方法。 原理 用荧光染料fluo-3在细胞内能与游离Ca2+结合。在一定波长的光激发下,可发出荧光,根据荧光的强度来检测细胞内游离Ca2+浓度及钙内流的方法。 方法 以H4-ⅡE细胞系为材料,通过Ca2+回加技术、荧光显微镜技术和UMANS计算机软件或Axon计算机成像系统来记录图像和处理数据。 结果 可检测、定量细胞内游离Ca2+的浓度,并可用以研究细胞钙信号的传递和传导机制。 结论 该方法较为简便、易行,相对费用较低,适用于国内实验室。
, 百拇医药
An Approach of Measurement of Calcium Influx
in H4-ⅡE Cell Line
Chen Jinglong
(Department of Parasitology, Fujian Medical University, Fuzhou, 350004)
Objective To provide an approach for measurement of calcium inflow in H4-ⅡE cell line. Mechanism Using a fluorescence dye(fluo-3) to bind cytoplasmic free Ca2+,after binding,the dye can emit fluorescence light when it is excited by 490 nmol/L wavelength light,and the concentration of cytoplasmic free calcium can be detected from the fluorescence intensity. Methods With H4-ⅡE cell line,using the Ca2+-add -back protocol,fluorescence microscopy and UMANS computer software or Axon Imaging Workbench(V.2.1) software,the Ca2+ influx in H4-ⅡE cells was estimated. Results This approach can be used for detection and quantitation of the concentration of Ca2+ and Ca2+ influx in cells by different conditions. Conclusion This approach for measurement of Ca2+ is simple,applicable and less expensive.
, 百拇医药
Key words H4-ⅡE cell line; Ca2+ influx; fluorescence microscopy; approach
离子钙(Ca2+)在细胞中的作用十分重要,肌肉收缩、心脏跳动、大脑思维过程及记忆贮存等等,无不涉及到离子钙[1]。Ca2+作为一个非常重要的细胞内信使,广泛存在于从细菌到高度分化、高度特异性的神经元细胞[2]。在这些细胞中,离子钙在传递信号、调节细胞的各种功能,比如受精、发育、分化等都起到了其他信使无法替代的作用。这些功能和作用的完成,主要是通过细胞质内(cytoplasmic space)游离Ca2+([Ca2+]c)的浓度变化来实现[3]。但是,持续高浓度的[Ca2+]c可以导致细胞死亡。因此,细胞内[Ca2+]c在不同部位、时间、幅度上的精确变化对调节细胞的生理功能甚为关键。所以,如何检测[Ca2+]c,对于研究细胞内信号传递及细胞功能的调节显得非常重要。目前细胞内信号调节、传递、传导的研究,在国际上是一个研究热点和中心,笔者介绍一种比较简单、易行、适合于检测贴壁细胞[Ca2+]c的方法。
, http://www.100md.com
1 材料和方法
1.1 药品、试剂、仪器
毒胡萝卜素(thapsigargin,Tg),离子霉素(ionomycin),均购自Sigma公司。荧光染料fluo-3/AM(fluo-3 acetoxymethylester)购自美国Molecular Probes公司,其余常用化学药品来源同文献[4]。倒置荧光显微镜(Nikon TMD-EF),P1型光度仪(Nikon),UMANS滤光镜转换器和计算机支持软件[4];或滤光镜转轮(Sutter),高密度CCD镜头(ISIS-2/S20,Photonic Science)和Axon成像工作平台(2.1版本)。
1.2 细胞培养
大鼠肝癌细胞系H4-ⅡE(ATCC CRL 1548)培养在37℃ 5%CO2培养箱中。培养基为完全培养基(DMEM)[4]。通常在25 cm2的培养瓶中接种细胞0.5×106个,在75 cm2的培养瓶中接种1.5×106个。大约每2天换一次完全培养基。该细胞贴壁生长,通常1周左右可以完全铺满整个培养瓶。转种时,在25 cm2的培养瓶中,先用0.1%胰蛋白酶1 ml和0.2%EDTA 0.3 ml(溶于0.9%NaCl,0.1%葡萄糖溶液)把细胞从培养瓶壁上洗脱下来(约15 min)。完全培养基5 ml终止洗脱,血细胞计数器计数调整细胞的密度再进行转种。
, http://www.100md.com
1.3 [Ca2+]c测量方法
1.3.1 细胞染色
H4-ⅡE细胞洗脱后,重新用完全培养基悬浮、计数;把细胞种在附有一层胶原蛋白的直径为22 mm的圆玻片上(每片约种0.6×106个细胞)。把含有细胞的圆玻片放在35 mm的培养皿中,放置于37℃ 5% CO2的培养箱培养约1~1.5 h。待大部分细胞贴壁后,加完全培养基1 ml左右,继续培养过夜至细胞铺满玻片表面成为单细胞层。把含有单层细胞的玻片置于DMEM培养基中,该培养基含有2%小牛血清、40 μmol/L fluo-3/AM、0.05%Pluronic F-127酸,并于37℃ 5%CO2 培养箱培养约0.5 h,荧光染色。
1.3.2 细胞清洗
荧光染色后的单层细胞在室温中,用改良Krebs-Henseleit缓冲液[5]进行清洗3次。
, http://www.100md.com
1.3.3 [Ca2+]c的测量
细胞清洗后,把含有单层细胞的玻片置于倒置的荧光显微镜载物台上的温控孵育室内。加入改良Krebs-Henseleit缓冲液300 μl,即可检测。检测时,选取铺满单层细胞的区域(约300~400个细胞)进行测量。显微镜及荧光检测的设置如下:×40倍油镜镜头用以观察和测量,激发光波长设在490 nm,B2A滤光板(filter block)用以分离发射光,中密度滤光片(1.0,2.3或按要求进行调整)以便减低测量时的光泛白现象(photobleaching)。
细胞内游离Ca2+浓度,由以下公式来计算:[Ca2+]c=(F-Fmin)/(Fmax-F)×KD[6]。式中,F代表某一时刻的荧光值,Fmin和Fmax为最小、最大荧光值,分别由在检测缓冲液中加入6 mmol/L EGTA和5 μmol/L的离子霉素得到。KD为Ca2+同荧光染料fluo-3的结合常数(KD=400 nm)[7]。
, 百拇医药
细胞内游离Ca2+的浓度通过加入毒胡萝卜素(Tg)来检测。Tg是细胞内肌浆网或内质网钙镁离子ATP酶的抑制剂。检测时,细胞置于无细胞外Ca2+的Krebs-Henseleit缓冲液中,选好待测细胞区域,测量细胞基础荧光强度,然后加入1 μmol/L Tg,检测荧光强度的变化,待荧光强度回到基础水平之后,往缓冲液中加入过量的CaCl2(1.2 mmol/L),测量荧光强度。之后,用离子霉素和EGTA分别测出细胞的最大、最小荧光强度。最后用公式算出细胞内的[Ca2+]c及Ca2+内流的初始率(initial rate,表示为nmol[Ca2+]c/min)。
2 结 果
2.1 H4-ⅡE在胶原蛋白包被的玻片上贴壁长成完整的单层细胞,呈不规则形状或多角形。用fluo-3/AM进行细胞荧光染色,fluo-3/AM从细胞外进入细胞内,并脱去染料上的乙酰甲基酯(acetoxymethylester),使fluo-3能与细胞内游离的Ca2+结合。fluo-3在490 nm波长的激发下,发出约510 nm波长的荧光。光度仪检测、记录、收集500 nm以上波长的荧光,显示于电脑显示屏上。细胞内可与fluo-3结合的游离Ca2+浓度越高,检测到的荧光越强。经50 μg/ml皂角苷(saponin)或40 μmol/L毛地黄皂苷(digitonin)选择性地破坏细膜质膜而非细胞内膜后,90%fluo-3荧光染料从细胞质中释放出来,表明fluo-3荧光染料绝大部分位于细胞质内,证明该染色方法可用于细胞质内游离Ca2+的检测。
, 百拇医药
2.2 H4-ⅡE细胞未经任何拮抗剂激活时,检测细胞显示一定量的游离Ca2+浓度,这是细胞本身的微量基础细胞钙内流。初始荧光强度与加入EGTA之后所得到的最小荧光强度之差,即代表细胞的基础钙内流。当加入1 μmol/L Tg后,荧光强度逐渐升高,显示细胞质内Ca2+浓度逐渐升高,1.5 min后达到高峰,此时细胞外为无Ca2+环境,Ca2+浓度的升高是内质网的钙池(store)释放Ca2+。2.4 min后,荧光强度回到基础水平,当再往缓冲液中加入过量的Ca2+时,由于细胞外的Ca2+浓度大于细胞质[Ca2+]c,从而启动细胞膜上的Ca2+通道,出现迅速的钙内流, 检测到荧光强度快速升高,大约20~30 s时产生一个荧光峰值(图1)。这种钙浓度的升高,亦即细胞质的钙内流是依赖Tg的(图2),细胞有无Tg存在时,荧光强度相差很大。H4-ⅡE细胞在Tg刺激下,诱导的细胞内Ca2+释放、细胞外Ca2+内流及检测细胞的Ca2+内流率见附表。
, http://www.100md.com
图1 毒胡萝卜素(Tg)刺激的H4-ⅡE细胞钙内流
箭头示各加样的位置、时间.
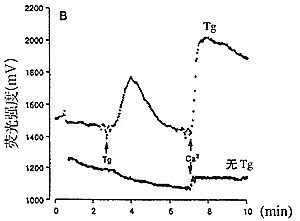
图2 毒胡萝卜素(Tg)诱导的H4-ⅡE细胞钙释放、内流
A.加细胞外钙,Tg诱导的H4-ⅡE钙内流; B.无细胞外钙及相继加入Tg、细胞外钙,Tg诱导的钙释放及内流。 箭头示各加样的时间和位置.
附表 H4-ⅡE细胞毒胡萝卜素(Tg)刺激的钙内流(nm) 条 件
Tg(1 μmol/L)刺激的钙释放
Tg刺激的钙内流
, http://www.100md.com
钙内流初始率
Tg(n=16)
170.85±16.18
333.52±20.54
3.72±0.35
No Tg(n=5)
31.45±5.25
65.87±9.46
0.13±0.05
3 讨 论
H4-ⅡE细胞系来源于Reuber大鼠肝癌,它是一种贴壁生长的细胞系,该细胞系生长周期较短,易于大量繁殖和培养,给实验研究H4-ⅡE细胞的钙信号传递、传导机制带来了诸多方便。利用该细胞系进行细胞内钙内流研究时,要注意以下几个方面:
, 百拇医药
3.1 胶原蛋白包被的圆玻片制备及细胞的接种。胶原蛋白包被的圆玻片是在干净的玻片上包被一层胶原蛋白,给H4-ⅡE细胞提供一个贴附表面,用缓冲液洗细胞时,不至于把细胞从玻片上洗脱下来。在制备胶原蛋白包被的圆玻片时,玻片要干净(可通过置于70%酒精浸泡一段时间),胶原蛋白以1∶9方式溶于0.1%灭菌醋酸溶液中,取约0.6 ml滴于圆玻片置紫外灯下自然晾干。在胶原蛋白包被的圆玻片上接种细胞时,选择生长状态良好的细胞,调整好细胞数再接种,细胞到长满整个圆玻片做检测[Ca2+]c。尚未长成单层细胞或过量生长出现二层细胞均不可用于实验。
3.2 荧光染料的成功染色及定位十分重要。fluo-3/AM是一种脂溶性的荧光染料,该染料加入细胞培养基培养0.5 h,便可通过细胞质膜进入胞内,脱去尾部的酯,由fluo-3/AM变成fluo-3。fluo-3能与游离Ca2+结合,在荧光的激发下发出一定波长的荧光。由于fluo-3要溶解在DMSO溶液中,而高浓度的DMSO不但对细胞产生毒性,也可对细胞内Ca2+浓度产生干扰,因此在染色时培养基中DMSO不要超过1% 。fluo-3/AM高温、见光均易遭破坏,要尽量避光,于-20℃贮存,避免反复冻融。在染色时,fluo-3/AM与同等体积0.05%Pluronic F-127酸混合后再加到培养基中进行染色,有利于fluo-3/AM进入细胞且染色成功。染色后,要注意细胞是否出现染料渗漏,这可通过选择性地破坏细胞质膜来检查fluo-3在细胞中的位置来实现。染色完成后,把多余的fluo-3/AM及培养基用Krebs-Henseleit缓冲液洗干净。
, http://www.100md.com
3.3 用Tg刺激细胞进行细胞钙内流的检测时,开始细胞处于无Ca2+的缓冲液中,细胞的荧光强度维持在低水平。加入Tg后,暂时抑制肌浆内或内质网上的钙镁离子ATP酶,使流入细胞质内的Ca2+不能被泵回到内质网或肌浆网,实验表现出细胞荧光强度不断升高,显示出Ca2+从肌浆或内质网(或可称为钙池)中释放出来”[8]。进入细胞质内的Ca2+亦可通过通道回到钙池,出现荧光强度回到基础水平,而当在缓冲液中加入过量的Ca2+时,细胞外的游离钙可通过细胞膜上的通道大量进入细胞质,从而出现又一个荧光强度的峰值,反映出细胞的钙内流、钙内流量以及钙内流的初始率(当加入细胞外的游离Ca2+时,单位时间内细胞质内游离Ca2+浓度的变化)可反映出钙内流的强度和情况[9]。实验中,离子霉素和EGTA用以校准细胞的荧光强度,离子霉素可在细胞膜上形成孔道,使细胞外的Ca2+直接通过孔道而非钙通道进入细胞质,从而出现细胞最大荧光值,EGTA可同fluo-3竞争Ca2+而形成EGTA-Ca2+鳌合物,使fluo-3失去荧光活性,得到最小的荧光强度。
, 百拇医药
(致谢:此研究由国家留学基金委及澳大利亚Flinders大学共同资助完成,笔者在澳洲做访问学者期间受到医学生化系主任Gregory Barritt教授悉心指导,在此深表谢意,并感谢该系其他同仁给予的一切帮助。)
参考文献
1 Berridge MJ,Bootman MD,Lipp P. Calcium—a life and death signal. Nature, 1998;395:645
2 Clapham DE. Calcium signaling. Cell, 1995;80:259
3 Barritt GJ. Receptor-activated Ca2+ inflow in animal cells: a variety of pathways tailored to meet different intracellular Ca2+ signaling requirements. Biochem J, 1999;337:153
, 百拇医药
4 Fernando KC,Gregory RB,Katsis F,et al. Evidence that a low-molecular-mass GTP-binding protein is required for store-activated Ca2+ inflow in hepatocytes. Biochem J, 1997;328:463
5 Berven LA,Crouch MF,Katsis F,et al. Evidence that the pertussis toxin-sensitive trimeric GTP-binding protein Gi2 is required for agonist-and store-activated Ca2+ inflow in hepatocytes. J Biol Chem, 1995;270:25893
6 Mc Cormack JG,Cobbold PH(Ed). Cellular calcium:A practical approach. New York:Oxford University Press, 1991:1
, 百拇医药
7 Kao JP,Harootunian AT,Tsien RY. Photochemical generated cytosolic calcium pulses and their detection by fluo-3. J Biol Chem, 1989;264:8179
8 Cao Y,Chatton JY. Involvement of calmodulin in the activation of store-operated Ca2+ entry in rat hepatocytes. FEBS Letters, 1998;424:33
9 Gregory RB,Wilcox RA,Berven LA,et al .Evidence for the involvement of a small subregion of the endoplasmic reticulum in the inositol trisphosphate receptor-induced activation of Ca2+ inflow in rat hepatocytes. Biochem J, 1999;341:401
(收稿:1999-07-25 修回:1999-11-11), 百拇医药
单位:福建医科大学寄生虫学教研室(福州 350004)
关键词:H4-ⅡE细胞系;钙内流;荧光显微镜技术;方法
福建医科大学学报990434
目的 利用大鼠肝癌细胞系H4-ⅡE建立一种适用于贴壁生长的细胞检测细胞内游离钙离子([Ca2+]i)浓度的方法。 原理 用荧光染料fluo-3在细胞内能与游离Ca2+结合。在一定波长的光激发下,可发出荧光,根据荧光的强度来检测细胞内游离Ca2+浓度及钙内流的方法。 方法 以H4-ⅡE细胞系为材料,通过Ca2+回加技术、荧光显微镜技术和UMANS计算机软件或Axon计算机成像系统来记录图像和处理数据。 结果 可检测、定量细胞内游离Ca2+的浓度,并可用以研究细胞钙信号的传递和传导机制。 结论 该方法较为简便、易行,相对费用较低,适用于国内实验室。
, 百拇医药
An Approach of Measurement of Calcium Influx
in H4-ⅡE Cell Line
Chen Jinglong
(Department of Parasitology, Fujian Medical University, Fuzhou, 350004)
Objective To provide an approach for measurement of calcium inflow in H4-ⅡE cell line. Mechanism Using a fluorescence dye(fluo-3) to bind cytoplasmic free Ca2+,after binding,the dye can emit fluorescence light when it is excited by 490 nmol/L wavelength light,and the concentration of cytoplasmic free calcium can be detected from the fluorescence intensity. Methods With H4-ⅡE cell line,using the Ca2+-add -back protocol,fluorescence microscopy and UMANS computer software or Axon Imaging Workbench(V.2.1) software,the Ca2+ influx in H4-ⅡE cells was estimated. Results This approach can be used for detection and quantitation of the concentration of Ca2+ and Ca2+ influx in cells by different conditions. Conclusion This approach for measurement of Ca2+ is simple,applicable and less expensive.
, 百拇医药
Key words H4-ⅡE cell line; Ca2+ influx; fluorescence microscopy; approach
离子钙(Ca2+)在细胞中的作用十分重要,肌肉收缩、心脏跳动、大脑思维过程及记忆贮存等等,无不涉及到离子钙[1]。Ca2+作为一个非常重要的细胞内信使,广泛存在于从细菌到高度分化、高度特异性的神经元细胞[2]。在这些细胞中,离子钙在传递信号、调节细胞的各种功能,比如受精、发育、分化等都起到了其他信使无法替代的作用。这些功能和作用的完成,主要是通过细胞质内(cytoplasmic space)游离Ca2+([Ca2+]c)的浓度变化来实现[3]。但是,持续高浓度的[Ca2+]c可以导致细胞死亡。因此,细胞内[Ca2+]c在不同部位、时间、幅度上的精确变化对调节细胞的生理功能甚为关键。所以,如何检测[Ca2+]c,对于研究细胞内信号传递及细胞功能的调节显得非常重要。目前细胞内信号调节、传递、传导的研究,在国际上是一个研究热点和中心,笔者介绍一种比较简单、易行、适合于检测贴壁细胞[Ca2+]c的方法。
, http://www.100md.com
1 材料和方法
1.1 药品、试剂、仪器
毒胡萝卜素(thapsigargin,Tg),离子霉素(ionomycin),均购自Sigma公司。荧光染料fluo-3/AM(fluo-3 acetoxymethylester)购自美国Molecular Probes公司,其余常用化学药品来源同文献[4]。倒置荧光显微镜(Nikon TMD-EF),P1型光度仪(Nikon),UMANS滤光镜转换器和计算机支持软件[4];或滤光镜转轮(Sutter),高密度CCD镜头(ISIS-2/S20,Photonic Science)和Axon成像工作平台(2.1版本)。
1.2 细胞培养
大鼠肝癌细胞系H4-ⅡE(ATCC CRL 1548)培养在37℃ 5%CO2培养箱中。培养基为完全培养基(DMEM)[4]。通常在25 cm2的培养瓶中接种细胞0.5×106个,在75 cm2的培养瓶中接种1.5×106个。大约每2天换一次完全培养基。该细胞贴壁生长,通常1周左右可以完全铺满整个培养瓶。转种时,在25 cm2的培养瓶中,先用0.1%胰蛋白酶1 ml和0.2%EDTA 0.3 ml(溶于0.9%NaCl,0.1%葡萄糖溶液)把细胞从培养瓶壁上洗脱下来(约15 min)。完全培养基5 ml终止洗脱,血细胞计数器计数调整细胞的密度再进行转种。
, http://www.100md.com
1.3 [Ca2+]c测量方法
1.3.1 细胞染色
H4-ⅡE细胞洗脱后,重新用完全培养基悬浮、计数;把细胞种在附有一层胶原蛋白的直径为22 mm的圆玻片上(每片约种0.6×106个细胞)。把含有细胞的圆玻片放在35 mm的培养皿中,放置于37℃ 5% CO2的培养箱培养约1~1.5 h。待大部分细胞贴壁后,加完全培养基1 ml左右,继续培养过夜至细胞铺满玻片表面成为单细胞层。把含有单层细胞的玻片置于DMEM培养基中,该培养基含有2%小牛血清、40 μmol/L fluo-3/AM、0.05%Pluronic F-127酸,并于37℃ 5%CO2 培养箱培养约0.5 h,荧光染色。
1.3.2 细胞清洗
荧光染色后的单层细胞在室温中,用改良Krebs-Henseleit缓冲液[5]进行清洗3次。
, http://www.100md.com
1.3.3 [Ca2+]c的测量
细胞清洗后,把含有单层细胞的玻片置于倒置的荧光显微镜载物台上的温控孵育室内。加入改良Krebs-Henseleit缓冲液300 μl,即可检测。检测时,选取铺满单层细胞的区域(约300~400个细胞)进行测量。显微镜及荧光检测的设置如下:×40倍油镜镜头用以观察和测量,激发光波长设在490 nm,B2A滤光板(filter block)用以分离发射光,中密度滤光片(1.0,2.3或按要求进行调整)以便减低测量时的光泛白现象(photobleaching)。
细胞内游离Ca2+浓度,由以下公式来计算:[Ca2+]c=(F-Fmin)/(Fmax-F)×KD[6]。式中,F代表某一时刻的荧光值,Fmin和Fmax为最小、最大荧光值,分别由在检测缓冲液中加入6 mmol/L EGTA和5 μmol/L的离子霉素得到。KD为Ca2+同荧光染料fluo-3的结合常数(KD=400 nm)[7]。
, 百拇医药
细胞内游离Ca2+的浓度通过加入毒胡萝卜素(Tg)来检测。Tg是细胞内肌浆网或内质网钙镁离子ATP酶的抑制剂。检测时,细胞置于无细胞外Ca2+的Krebs-Henseleit缓冲液中,选好待测细胞区域,测量细胞基础荧光强度,然后加入1 μmol/L Tg,检测荧光强度的变化,待荧光强度回到基础水平之后,往缓冲液中加入过量的CaCl2(1.2 mmol/L),测量荧光强度。之后,用离子霉素和EGTA分别测出细胞的最大、最小荧光强度。最后用公式算出细胞内的[Ca2+]c及Ca2+内流的初始率(initial rate,表示为nmol[Ca2+]c/min)。
2 结 果
2.1 H4-ⅡE在胶原蛋白包被的玻片上贴壁长成完整的单层细胞,呈不规则形状或多角形。用fluo-3/AM进行细胞荧光染色,fluo-3/AM从细胞外进入细胞内,并脱去染料上的乙酰甲基酯(acetoxymethylester),使fluo-3能与细胞内游离的Ca2+结合。fluo-3在490 nm波长的激发下,发出约510 nm波长的荧光。光度仪检测、记录、收集500 nm以上波长的荧光,显示于电脑显示屏上。细胞内可与fluo-3结合的游离Ca2+浓度越高,检测到的荧光越强。经50 μg/ml皂角苷(saponin)或40 μmol/L毛地黄皂苷(digitonin)选择性地破坏细膜质膜而非细胞内膜后,90%fluo-3荧光染料从细胞质中释放出来,表明fluo-3荧光染料绝大部分位于细胞质内,证明该染色方法可用于细胞质内游离Ca2+的检测。
, 百拇医药
2.2 H4-ⅡE细胞未经任何拮抗剂激活时,检测细胞显示一定量的游离Ca2+浓度,这是细胞本身的微量基础细胞钙内流。初始荧光强度与加入EGTA之后所得到的最小荧光强度之差,即代表细胞的基础钙内流。当加入1 μmol/L Tg后,荧光强度逐渐升高,显示细胞质内Ca2+浓度逐渐升高,1.5 min后达到高峰,此时细胞外为无Ca2+环境,Ca2+浓度的升高是内质网的钙池(store)释放Ca2+。2.4 min后,荧光强度回到基础水平,当再往缓冲液中加入过量的Ca2+时,由于细胞外的Ca2+浓度大于细胞质[Ca2+]c,从而启动细胞膜上的Ca2+通道,出现迅速的钙内流, 检测到荧光强度快速升高,大约20~30 s时产生一个荧光峰值(图1)。这种钙浓度的升高,亦即细胞质的钙内流是依赖Tg的(图2),细胞有无Tg存在时,荧光强度相差很大。H4-ⅡE细胞在Tg刺激下,诱导的细胞内Ca2+释放、细胞外Ca2+内流及检测细胞的Ca2+内流率见附表。

, http://www.100md.com
图1 毒胡萝卜素(Tg)刺激的H4-ⅡE细胞钙内流
箭头示各加样的位置、时间.


图2 毒胡萝卜素(Tg)诱导的H4-ⅡE细胞钙释放、内流
A.加细胞外钙,Tg诱导的H4-ⅡE钙内流; B.无细胞外钙及相继加入Tg、细胞外钙,Tg诱导的钙释放及内流。 箭头示各加样的时间和位置.
附表 H4-ⅡE细胞毒胡萝卜素(Tg)刺激的钙内流(nm) 条 件
Tg(1 μmol/L)刺激的钙释放
Tg刺激的钙内流
, http://www.100md.com
钙内流初始率
Tg(n=16)
170.85±16.18
333.52±20.54
3.72±0.35
No Tg(n=5)
31.45±5.25
65.87±9.46
0.13±0.05
3 讨 论
H4-ⅡE细胞系来源于Reuber大鼠肝癌,它是一种贴壁生长的细胞系,该细胞系生长周期较短,易于大量繁殖和培养,给实验研究H4-ⅡE细胞的钙信号传递、传导机制带来了诸多方便。利用该细胞系进行细胞内钙内流研究时,要注意以下几个方面:
, 百拇医药
3.1 胶原蛋白包被的圆玻片制备及细胞的接种。胶原蛋白包被的圆玻片是在干净的玻片上包被一层胶原蛋白,给H4-ⅡE细胞提供一个贴附表面,用缓冲液洗细胞时,不至于把细胞从玻片上洗脱下来。在制备胶原蛋白包被的圆玻片时,玻片要干净(可通过置于70%酒精浸泡一段时间),胶原蛋白以1∶9方式溶于0.1%灭菌醋酸溶液中,取约0.6 ml滴于圆玻片置紫外灯下自然晾干。在胶原蛋白包被的圆玻片上接种细胞时,选择生长状态良好的细胞,调整好细胞数再接种,细胞到长满整个圆玻片做检测[Ca2+]c。尚未长成单层细胞或过量生长出现二层细胞均不可用于实验。
3.2 荧光染料的成功染色及定位十分重要。fluo-3/AM是一种脂溶性的荧光染料,该染料加入细胞培养基培养0.5 h,便可通过细胞质膜进入胞内,脱去尾部的酯,由fluo-3/AM变成fluo-3。fluo-3能与游离Ca2+结合,在荧光的激发下发出一定波长的荧光。由于fluo-3要溶解在DMSO溶液中,而高浓度的DMSO不但对细胞产生毒性,也可对细胞内Ca2+浓度产生干扰,因此在染色时培养基中DMSO不要超过1% 。fluo-3/AM高温、见光均易遭破坏,要尽量避光,于-20℃贮存,避免反复冻融。在染色时,fluo-3/AM与同等体积0.05%Pluronic F-127酸混合后再加到培养基中进行染色,有利于fluo-3/AM进入细胞且染色成功。染色后,要注意细胞是否出现染料渗漏,这可通过选择性地破坏细胞质膜来检查fluo-3在细胞中的位置来实现。染色完成后,把多余的fluo-3/AM及培养基用Krebs-Henseleit缓冲液洗干净。
, http://www.100md.com
3.3 用Tg刺激细胞进行细胞钙内流的检测时,开始细胞处于无Ca2+的缓冲液中,细胞的荧光强度维持在低水平。加入Tg后,暂时抑制肌浆内或内质网上的钙镁离子ATP酶,使流入细胞质内的Ca2+不能被泵回到内质网或肌浆网,实验表现出细胞荧光强度不断升高,显示出Ca2+从肌浆或内质网(或可称为钙池)中释放出来”[8]。进入细胞质内的Ca2+亦可通过通道回到钙池,出现荧光强度回到基础水平,而当在缓冲液中加入过量的Ca2+时,细胞外的游离钙可通过细胞膜上的通道大量进入细胞质,从而出现又一个荧光强度的峰值,反映出细胞的钙内流、钙内流量以及钙内流的初始率(当加入细胞外的游离Ca2+时,单位时间内细胞质内游离Ca2+浓度的变化)可反映出钙内流的强度和情况[9]。实验中,离子霉素和EGTA用以校准细胞的荧光强度,离子霉素可在细胞膜上形成孔道,使细胞外的Ca2+直接通过孔道而非钙通道进入细胞质,从而出现细胞最大荧光值,EGTA可同fluo-3竞争Ca2+而形成EGTA-Ca2+鳌合物,使fluo-3失去荧光活性,得到最小的荧光强度。
, 百拇医药
(致谢:此研究由国家留学基金委及澳大利亚Flinders大学共同资助完成,笔者在澳洲做访问学者期间受到医学生化系主任Gregory Barritt教授悉心指导,在此深表谢意,并感谢该系其他同仁给予的一切帮助。)
参考文献
1 Berridge MJ,Bootman MD,Lipp P. Calcium—a life and death signal. Nature, 1998;395:645
2 Clapham DE. Calcium signaling. Cell, 1995;80:259
3 Barritt GJ. Receptor-activated Ca2+ inflow in animal cells: a variety of pathways tailored to meet different intracellular Ca2+ signaling requirements. Biochem J, 1999;337:153
, 百拇医药
4 Fernando KC,Gregory RB,Katsis F,et al. Evidence that a low-molecular-mass GTP-binding protein is required for store-activated Ca2+ inflow in hepatocytes. Biochem J, 1997;328:463
5 Berven LA,Crouch MF,Katsis F,et al. Evidence that the pertussis toxin-sensitive trimeric GTP-binding protein Gi2 is required for agonist-and store-activated Ca2+ inflow in hepatocytes. J Biol Chem, 1995;270:25893
6 Mc Cormack JG,Cobbold PH(Ed). Cellular calcium:A practical approach. New York:Oxford University Press, 1991:1
, 百拇医药
7 Kao JP,Harootunian AT,Tsien RY. Photochemical generated cytosolic calcium pulses and their detection by fluo-3. J Biol Chem, 1989;264:8179
8 Cao Y,Chatton JY. Involvement of calmodulin in the activation of store-operated Ca2+ entry in rat hepatocytes. FEBS Letters, 1998;424:33
9 Gregory RB,Wilcox RA,Berven LA,et al .Evidence for the involvement of a small subregion of the endoplasmic reticulum in the inositol trisphosphate receptor-induced activation of Ca2+ inflow in rat hepatocytes. Biochem J, 1999;341:401
(收稿:1999-07-25 修回:1999-11-11), 百拇医药