人骨巨细胞瘤多核巨细胞糖皮质激素受体mRNA的表达
作者:黄琳 丘钜世 郑铭豪
单位:510089 广州中山医科大学病理教研室(黄琳、丘钜世);澳大利亚西澳大学骨科(郑铭豪)
关键词:破骨细胞样多核巨细胞;糖皮质激素受体;荧光原位杂交
中国骨质疏松杂志990415
摘要 以骨巨细胞瘤作为体外研究人破骨细胞的模型,采用荧光原位杂交方法和共聚焦显微镜分析检测了糖皮质激素受体mRNA在人骨巨细胞瘤破骨细胞样多核巨细胞中的表达情况。结果表明骨巨细胞瘤中破骨细胞样多核巨细胞胞浆中含有糖皮质激素受体mRNA;此外,反应性成骨骨质表面的骨母细胞也表达大量的糖皮质激素受体mRNA。本研究首次证明了人破骨细胞样骨巨细胞瘤多核巨细胞表达糖皮质激素受体,提示在糖皮质激素诱导的骨质丢失过程中,破骨细胞可能也是其作用的靶细胞。
, 百拇医药 糖皮质激素(Glucocorticoid,GC)诱导的骨质疏松是一种常见的医源性代谢性骨病,其中发病率仅次于绝经后骨质疏松症和老年性骨质疏松症[1]。已证实人成骨细胞和骨细胞具有糖皮质激素受体(Glucocorticoid receptor,GR)[2],GC可通过受体介导直接抑制成骨细胞的功能、诱导成骨细胞和骨细胞凋亡,从而减少骨质形成[3]。然而GC对破骨细胞及骨吸收的作用机制目前尚不明确,因而检测人破骨细胞是否存在GR,对阐明GC对破骨细胞的作用机理十分重要。本研究以骨巨细胞瘤中多核巨细胞作为人破骨细胞的模型,采用荧光原位杂交方法检测了破骨细胞中,GR mRNA的表达情况。
1 材料和方法
1.1 材料
骨巨细胞瘤新鲜冻存(-80℃)标本由中山医科大学病理教研室1996~1998年间收集,共10例。用于制备鼠GR和人降钙素受体(Calcitonin,receptor,CTR)反义RNA探针的质粒分别为pBluesenpt SK(+)和PCR-senpt SK(+),由西澳大学骨科实验室合成。T3、T7 RNA聚合酶及地高辛(DIG)RNA标记试剂盒、Fluorescent antibody enhancer set 购自Boehringer Mannheim公司。抗酒石酸酸性磷酸酯酶(Tartrate resistant acid phosphatase TRAP)检测试剂盒购自Sigma公司。所有RNA原位杂交试剂均用DEPC水配制。
, 百拇医药
1.2 方法
1.2.1 DIG标记反义RNA探针的制备,参见DIG RNA标记试剂盒说明书。载有2.4kb鼠GR cDNA 450bp和CTR cDNA片段的质粒分别用xhoⅠ NotⅠ限制性内切酶制备线性DNA模板,分别用T3和T7 RNA聚合体外转录合成具有DIG标记的反义RNA探针。
1.2.2 组织印片及冰冻切片的制备:将冻存组织置预冷的PBS中解冻,取部分组织轻压印片于硅化处理的载玻片上,其余部分置恒冷箱制备冰冻切片(厚6~8μm)。玻片室温干燥15~20分钟,待细胞组织完全贴附。
1.2.3 破骨细胞的标记染色:TRAP细胞化学染色参见TRAP检测试剂盒说明书,结果用普通光镜观察。
1.2.4 RNA原位杂交:参见Huang[4]等描述的方法。4%多聚甲醛固定玻片3分钟,0.2%Triton/PBS洗5分钟,PK(2μg/ml)37℃消化15~20分钟0.1%甘氨酸/PBS洗2分钟,4%多聚甲醛后固定15分钟,RNase-free DNase(1U/ml)37℃消化处理30分钟以降解DNA,保证原位杂交具有RNA特异性。各步骤间用PBS洗片,无特殊说明均在室温进行。杂交液由45%去离子甲酰胺、10%硫酸葡聚糖、5×SSC及1mg/ml变性鲑鱼精DNA组成。预杂交于37℃,湿盒孵育60分钟。阴性对照玻片在预杂交前用100μg/ml RNase 37℃处理60分钟以除去内源性mRNA。GR及CTR反义RNA探针用杂交液分别稀释至终浓度0.3ng/ml、0.5ng/ml,65℃变性处理10分钟,加至玻片上(30ml/片),37℃湿盒中孵育过夜。
, 百拇医药
杂交过夜的玻片分别用2×SSC、1×SSC和0.1×SSC洗2次,DIG免疫荧光检测参见Fluorescent antibody enhancer set说明书,Ⅰ、Ⅱ、Ⅲ、Ⅳ孵育抗体分别为anti-DIG,anti-mouse-Ig-DIG和anti-DIG-fluorescin,玻片避光干燥后,加抗褪色液(anti-fade)及盖玻片封片。
1.2.5 共聚焦显微镜(Confocal microscope)分析:原位杂交玻片用西澳大学Confocon microscopic系统(MRC-1000,Biorod)观察。选用波长为540nm的氪氨激光激发的检测荧光信号。
2 结果
2.1 破骨细胞的鉴定
破骨细胞的特征为多核,降钙素受体,组织蛋白酶K、碳酸酐酶Ⅱ酒石酸酸性磷酸酶是破骨细胞的标志物。
, 百拇医药
2.1.1 TRAP细胞化学鉴定:骨巨细胞瘤中多核巨细胞皆呈强阳性表达,胞浆红褐色,胞核几乎不着色,部分圆形单核基质细胞呈阳性或弱阳性表达(图1a)。
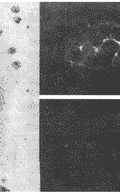

图1 破骨细胞的鉴定
a TRAP细胞化学染色。骨巨细胞瘤中多核巨细胞TRAP反应阳性,阳性产物呈红褐色弥漫分布于整个胞浆,胞核不着色;
b CTR mRNA原位检测,CTR mRNA阳性杂交荧光信号见于骨巨细胞瘤中多核巨细胞中的胞浆,胞核弱阳性;c CTR mRNA原位检测阴性对照
, http://www.100md.com 2.1.2 CTR mRNA原位杂交鉴定:骨巨细胞瘤中多核巨细胞表达CTR mRNA其杂交信号主要见于胞浆。胞核呈阴性。经RNase处理的阴性对照玻片未见阳性表达的细胞(图1b和c)。
2.2 GR mRNA在骨巨细胞瘤中的表达
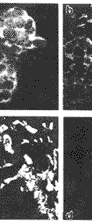
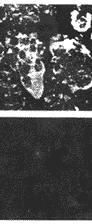
GR mRNA阳性杂交信号见于多核巨细胞的胞浆,核内有效阳性表达(图2a和b)。一例骨巨细胞瘤外周反应性成骨骨质表面的骨母细胞呈强阳性表达GR mRNA(图2c)。经RNase处理的阳性对照玻片未见阳性信号细胞(图2d)。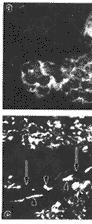

, http://www.100md.com
图2 GR mRNA原位检测
a,b 分别为骨巨细胞瘤组织印片和冰冻切片。GR mRNA阳性杂交荧光信号见于破骨细胞样多核巨细胞的胞浆,胞核弱阳性;c 骨巨细胞瘤组织冰冻切片。反应性成骨(“←”所示)骨质表面的骨母细胞(“ ”所示)强阳性表达GR mRNA;d GR mRNA原位检测阴性对照
”所示)强阳性表达GR mRNA;d GR mRNA原位检测阴性对照
3 讨论
目前比较一致的观点认为,骨巨细胞瘤中多核巨细胞是由反应性增生的巨噬细胞样单核基质细胞融合而成[5,6]。具有CTR和Vitronectin受体,表达丰富的碳酸酐酶Ⅱ(carbonic anhydrase Ⅱ)和TRAP,拥有皱折缘和透明带,体外实验能吸收骨质等。由于人的破骨细胞不易获得,体外培养亦困难,因而骨巨细胞瘤中多核巨细胞就成为体外研究人破骨细胞的细胞来源[9]。本研究证实10例骨巨细胞瘤中多核巨细胞皆呈强阳性表达TRAP和CTR mRNA,表明骨巨细胞瘤中多核巨细胞即为破骨细胞样细胞。
, 百拇医药
本研究首次使用原位检测到骨巨细胞瘤中破骨细胞样多核巨细胞表达GR mRNA,提示人破骨细胞可能也是糖皮质激素作用的靶细胞。已有的研究资料表明,糖皮质激素对破骨细胞生成及活性的影响十分复杂,在人类、小鼠及大鼠间存在明显的种间差异。GC能抑制大鼠的骨吸收作用,造成大鼠体内总骨量(bone mass)的增加[10,11]但却促进人和小鼠的骨质吸收,诱导骨量的迅速丢失[12,13]在体外分离大鼠破骨细胞的培养中,GC诱导破骨细胞的凋亡[14];然而在小鼠骨髓细胞与脾细胞共培养系统中,GC却促进破骨细胞的形成[15],最近Dempster等[14]对大鼠破骨细胞的作用机理表明,GR拮抗剂RU486能特异性阻断GC诱导的破骨细胞的凋亡效应,并用免疫组织化学方法检测到大鼠破骨细胞有GR蛋白表达,提示该效应由破骨细胞上GR所介导。然而如上所述,GC对破骨细胞及骨吸收的影响存在显著的物种差异,大鼠破骨细胞表达GR不能完全反映GC对人破骨细胞的作用机理。因而直接检测到人破骨细胞上GR的存在,为进一步阐明GC促进人骨质吸收的作用机制提供了直接的依据。
, 百拇医药
此外,本研究还检测骨巨细胞瘤外周反应性成骨骨质表面的骨母细胞也表达大量的GR mRNA,与前人报道人成骨细胞具有GR的结果一致[2]。因而GC诱导骨质疏松的发病机制,除了包括目前已公认的直接抑制成骨细胞的活性从而减少骨形成,以及通过抑制小肠钙吸收,增加尿钙排泄和继发性升高甲状旁腺激素(PTH)从而间接增加骨吸收外,还可能直接影响破骨细胞的生成及其功能。有关的研究还在继续。
值得指出的是,人GR存在两种异构体形式[16],分别为GRα和GRβ。近年的研究指出,与传统的GRα相比,GRβ主要位于细胞核内,可能作为GRα的负调节因子,调控靶细胞对GC的反应性[17,18]本实验所制备的GR探针为大鼠24kb GR探针,虽与人GR具有89%同源性,可以检测人GR mRNA的表达,但不能区分人GR的两种形式。人破骨细胞是否同时存在两种形式的GR,以及GR介导的人破骨细胞中GC的作用机制究竟如何,还有待进一步研究。
, http://www.100md.com
作者简介:黄琳,1971年6月出生,1994年中国医科大学医疗系本科毕业,并考入中山医科大学病理学专业硕士,96年直接转为博士生,1998年6月赴澳大利亚西澳大学从事骨病和骨肿瘤的分子生物学研究,有一篇论文已被《美国病理学杂志》接受。
参考文献
1 Lukert B. Glucocorticoid-induced osteoporosis. In: R.Marcus,D Feldman,and J Kelsey,eds.Osteoporosis. 1996, San Diego,CA:Academic Press,801-820.
2 Subramaniam M,Colvard D,Keeting PE,et al.Glucocorticoid regulation of alkaline phosphatase,osteocalcin and proto-oncogenes in normal human osteoblast-like cells. J Cell Biochem, 1992,50:411-424.
, 百拇医药
3 Weinstein RS,Jilka RL,Parfitt AM,et al. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. J Clin Invest,1998,102:274-282.
4 Huang WH,Lau ATT,Daniels LL,et al.Detection of estrogen receptor, a carbonic anhydrase Ⅱ,and tartrate-resistant acid phosphatase mRNA in putative mononuclear osteoclast precursor cells of neonatal rats by fluorescence in situ hybridisation. J Mol Endocrin,1998,20:211-219.
, 百拇医药
5 Athanasou NA,Bliss E,Gatter KC, et al. An immunohistological study of giant cell tumour of bone: evidence for an osteoclast origin of the giant cells. J Pathol, 1985,147:153-158.
6 Golding SR, Roelke MS,Petrison KK,et al.Human giant cell tumours of bone: identification and characterization of cell types. J Clin Invest, 1987,79:483-491.
7 Zheng MH,Fan Y,Wysocki SJ,et al. Detection of mRNA for carbonic anhydrase Ⅱ in human osteoclast-like cells by in situ hybridisation. J Bone Miner Res, 1993,8: 111-116.
, 百拇医药
8 Zheng MH,Fan Y,Wysocki SJ, et al. Gene expression of transforming growth factor b and its type Ⅱ receptor in giant cell tumours of bone: possible involvement in osteoclast-like cell migration. Am J Pathol,1994,145:1095-1104.
9 Grano M,Colucci S,De Bellis M,et al. New model for bone resorption study in vitro:human osteoclast-like cells from giant cell tumors of bone. J Bone Miner Res, 1994,9:1013-1020.
10 Tobias J, Chamber TJ. Glucocorticoids impair bone resorptive ability and viability of osteoclasts disaggregated from neonatal rat long bones. Endocrinology,1989,125:1290-1296.
, 百拇医药
11 Defranco DJ,Lian JB,Glowacki J.Differential effect of glucocorticoid on recruitment and activity of osteoclasts induced by normal and osteocalcin-deficient bone implanted in rats. Endocrinology,1992,131:114-121.
12 Conaway HH,Grigorie D,Lerner UH.Differential effects of glucocorticoids on bone resorption in neonatal mouse calvariae stimulated by peptide and steroid-like hormones. J Endocrinol,1997,155:513-521.
13 Lowe C,Gray DH,Reid IR. Serum blocks the osteolytic effect of cortisol in neonatal mouse calvaria. Calcif Tissue Int,1992,50:189-192.
, 百拇医药
14 Dempster DW,Moonga BS,Stein LS,et al.Glucocorticoids inhibit bone resorption by isolated rat osteoclasts by enhancing apoptosis. J Endocrinology,1997,154:397- 406.
15 Udagawa N,Takahashi N,Akatsu T, et al. The bone marrow-derived stromal cell lines MC3T3-G2/PA6 and ST2 support osteoclast-like cell differentiation in cocultures with mouse spleen cells. Endocrinology,1989,125:1805-1813.
16 Encio IJ,Detera-Wadleigh SD. The genomic structure of the human glucocorticoid receptor. J Biol Chem 1991,266:7182-7188.
, http://www.100md.com
17 Bamberger CM,Bamberger AM,de Castro M,et al. Glucocorticoid receptor β,a potential endogenous inhibitor of glucocorticoid action in humans. J Clin Inves, 1995,95:2435-2441.
18 Oakiey RH,Sar M,Cidlowsk JA. Expression and subcellular distribution of the β-isoform of the human glucocorticoid receptor. Endocrinology,1997,138:5028-5038., http://www.100md.com
单位:510089 广州中山医科大学病理教研室(黄琳、丘钜世);澳大利亚西澳大学骨科(郑铭豪)
关键词:破骨细胞样多核巨细胞;糖皮质激素受体;荧光原位杂交
中国骨质疏松杂志990415
摘要 以骨巨细胞瘤作为体外研究人破骨细胞的模型,采用荧光原位杂交方法和共聚焦显微镜分析检测了糖皮质激素受体mRNA在人骨巨细胞瘤破骨细胞样多核巨细胞中的表达情况。结果表明骨巨细胞瘤中破骨细胞样多核巨细胞胞浆中含有糖皮质激素受体mRNA;此外,反应性成骨骨质表面的骨母细胞也表达大量的糖皮质激素受体mRNA。本研究首次证明了人破骨细胞样骨巨细胞瘤多核巨细胞表达糖皮质激素受体,提示在糖皮质激素诱导的骨质丢失过程中,破骨细胞可能也是其作用的靶细胞。
, 百拇医药 糖皮质激素(Glucocorticoid,GC)诱导的骨质疏松是一种常见的医源性代谢性骨病,其中发病率仅次于绝经后骨质疏松症和老年性骨质疏松症[1]。已证实人成骨细胞和骨细胞具有糖皮质激素受体(Glucocorticoid receptor,GR)[2],GC可通过受体介导直接抑制成骨细胞的功能、诱导成骨细胞和骨细胞凋亡,从而减少骨质形成[3]。然而GC对破骨细胞及骨吸收的作用机制目前尚不明确,因而检测人破骨细胞是否存在GR,对阐明GC对破骨细胞的作用机理十分重要。本研究以骨巨细胞瘤中多核巨细胞作为人破骨细胞的模型,采用荧光原位杂交方法检测了破骨细胞中,GR mRNA的表达情况。
1 材料和方法
1.1 材料
骨巨细胞瘤新鲜冻存(-80℃)标本由中山医科大学病理教研室1996~1998年间收集,共10例。用于制备鼠GR和人降钙素受体(Calcitonin,receptor,CTR)反义RNA探针的质粒分别为pBluesenpt SK(+)和PCR-senpt SK(+),由西澳大学骨科实验室合成。T3、T7 RNA聚合酶及地高辛(DIG)RNA标记试剂盒、Fluorescent antibody enhancer set 购自Boehringer Mannheim公司。抗酒石酸酸性磷酸酯酶(Tartrate resistant acid phosphatase TRAP)检测试剂盒购自Sigma公司。所有RNA原位杂交试剂均用DEPC水配制。
, 百拇医药
1.2 方法
1.2.1 DIG标记反义RNA探针的制备,参见DIG RNA标记试剂盒说明书。载有2.4kb鼠GR cDNA 450bp和CTR cDNA片段的质粒分别用xhoⅠ NotⅠ限制性内切酶制备线性DNA模板,分别用T3和T7 RNA聚合体外转录合成具有DIG标记的反义RNA探针。
1.2.2 组织印片及冰冻切片的制备:将冻存组织置预冷的PBS中解冻,取部分组织轻压印片于硅化处理的载玻片上,其余部分置恒冷箱制备冰冻切片(厚6~8μm)。玻片室温干燥15~20分钟,待细胞组织完全贴附。
1.2.3 破骨细胞的标记染色:TRAP细胞化学染色参见TRAP检测试剂盒说明书,结果用普通光镜观察。
1.2.4 RNA原位杂交:参见Huang[4]等描述的方法。4%多聚甲醛固定玻片3分钟,0.2%Triton/PBS洗5分钟,PK(2μg/ml)37℃消化15~20分钟0.1%甘氨酸/PBS洗2分钟,4%多聚甲醛后固定15分钟,RNase-free DNase(1U/ml)37℃消化处理30分钟以降解DNA,保证原位杂交具有RNA特异性。各步骤间用PBS洗片,无特殊说明均在室温进行。杂交液由45%去离子甲酰胺、10%硫酸葡聚糖、5×SSC及1mg/ml变性鲑鱼精DNA组成。预杂交于37℃,湿盒孵育60分钟。阴性对照玻片在预杂交前用100μg/ml RNase 37℃处理60分钟以除去内源性mRNA。GR及CTR反义RNA探针用杂交液分别稀释至终浓度0.3ng/ml、0.5ng/ml,65℃变性处理10分钟,加至玻片上(30ml/片),37℃湿盒中孵育过夜。
, 百拇医药
杂交过夜的玻片分别用2×SSC、1×SSC和0.1×SSC洗2次,DIG免疫荧光检测参见Fluorescent antibody enhancer set说明书,Ⅰ、Ⅱ、Ⅲ、Ⅳ孵育抗体分别为anti-DIG,anti-mouse-Ig-DIG和anti-DIG-fluorescin,玻片避光干燥后,加抗褪色液(anti-fade)及盖玻片封片。
1.2.5 共聚焦显微镜(Confocal microscope)分析:原位杂交玻片用西澳大学Confocon microscopic系统(MRC-1000,Biorod)观察。选用波长为540nm的氪氨激光激发的检测荧光信号。
2 结果
2.1 破骨细胞的鉴定
破骨细胞的特征为多核,降钙素受体,组织蛋白酶K、碳酸酐酶Ⅱ酒石酸酸性磷酸酶是破骨细胞的标志物。
, 百拇医药
2.1.1 TRAP细胞化学鉴定:骨巨细胞瘤中多核巨细胞皆呈强阳性表达,胞浆红褐色,胞核几乎不着色,部分圆形单核基质细胞呈阳性或弱阳性表达(图1a)。



图1 破骨细胞的鉴定
a TRAP细胞化学染色。骨巨细胞瘤中多核巨细胞TRAP反应阳性,阳性产物呈红褐色弥漫分布于整个胞浆,胞核不着色;
b CTR mRNA原位检测,CTR mRNA阳性杂交荧光信号见于骨巨细胞瘤中多核巨细胞中的胞浆,胞核弱阳性;c CTR mRNA原位检测阴性对照
, http://www.100md.com 2.1.2 CTR mRNA原位杂交鉴定:骨巨细胞瘤中多核巨细胞表达CTR mRNA其杂交信号主要见于胞浆。胞核呈阴性。经RNase处理的阴性对照玻片未见阳性表达的细胞(图1b和c)。
2.2 GR mRNA在骨巨细胞瘤中的表达
GR mRNA阳性杂交信号见于多核巨细胞的胞浆,核内有效阳性表达(图2a和b)。一例骨巨细胞瘤外周反应性成骨骨质表面的骨母细胞呈强阳性表达GR mRNA(图2c)。经RNase处理的阳性对照玻片未见阳性信号细胞(图2d)。




, http://www.100md.com
图2 GR mRNA原位检测
a,b 分别为骨巨细胞瘤组织印片和冰冻切片。GR mRNA阳性杂交荧光信号见于破骨细胞样多核巨细胞的胞浆,胞核弱阳性;c 骨巨细胞瘤组织冰冻切片。反应性成骨(“←”所示)骨质表面的骨母细胞(“
 ”所示)强阳性表达GR mRNA;d GR mRNA原位检测阴性对照
”所示)强阳性表达GR mRNA;d GR mRNA原位检测阴性对照3 讨论
目前比较一致的观点认为,骨巨细胞瘤中多核巨细胞是由反应性增生的巨噬细胞样单核基质细胞融合而成[5,6]。具有CTR和Vitronectin受体,表达丰富的碳酸酐酶Ⅱ(carbonic anhydrase Ⅱ)和TRAP,拥有皱折缘和透明带,体外实验能吸收骨质等。由于人的破骨细胞不易获得,体外培养亦困难,因而骨巨细胞瘤中多核巨细胞就成为体外研究人破骨细胞的细胞来源[9]。本研究证实10例骨巨细胞瘤中多核巨细胞皆呈强阳性表达TRAP和CTR mRNA,表明骨巨细胞瘤中多核巨细胞即为破骨细胞样细胞。
, 百拇医药
本研究首次使用原位检测到骨巨细胞瘤中破骨细胞样多核巨细胞表达GR mRNA,提示人破骨细胞可能也是糖皮质激素作用的靶细胞。已有的研究资料表明,糖皮质激素对破骨细胞生成及活性的影响十分复杂,在人类、小鼠及大鼠间存在明显的种间差异。GC能抑制大鼠的骨吸收作用,造成大鼠体内总骨量(bone mass)的增加[10,11]但却促进人和小鼠的骨质吸收,诱导骨量的迅速丢失[12,13]在体外分离大鼠破骨细胞的培养中,GC诱导破骨细胞的凋亡[14];然而在小鼠骨髓细胞与脾细胞共培养系统中,GC却促进破骨细胞的形成[15],最近Dempster等[14]对大鼠破骨细胞的作用机理表明,GR拮抗剂RU486能特异性阻断GC诱导的破骨细胞的凋亡效应,并用免疫组织化学方法检测到大鼠破骨细胞有GR蛋白表达,提示该效应由破骨细胞上GR所介导。然而如上所述,GC对破骨细胞及骨吸收的影响存在显著的物种差异,大鼠破骨细胞表达GR不能完全反映GC对人破骨细胞的作用机理。因而直接检测到人破骨细胞上GR的存在,为进一步阐明GC促进人骨质吸收的作用机制提供了直接的依据。
, 百拇医药
此外,本研究还检测骨巨细胞瘤外周反应性成骨骨质表面的骨母细胞也表达大量的GR mRNA,与前人报道人成骨细胞具有GR的结果一致[2]。因而GC诱导骨质疏松的发病机制,除了包括目前已公认的直接抑制成骨细胞的活性从而减少骨形成,以及通过抑制小肠钙吸收,增加尿钙排泄和继发性升高甲状旁腺激素(PTH)从而间接增加骨吸收外,还可能直接影响破骨细胞的生成及其功能。有关的研究还在继续。
值得指出的是,人GR存在两种异构体形式[16],分别为GRα和GRβ。近年的研究指出,与传统的GRα相比,GRβ主要位于细胞核内,可能作为GRα的负调节因子,调控靶细胞对GC的反应性[17,18]本实验所制备的GR探针为大鼠24kb GR探针,虽与人GR具有89%同源性,可以检测人GR mRNA的表达,但不能区分人GR的两种形式。人破骨细胞是否同时存在两种形式的GR,以及GR介导的人破骨细胞中GC的作用机制究竟如何,还有待进一步研究。
, http://www.100md.com
作者简介:黄琳,1971年6月出生,1994年中国医科大学医疗系本科毕业,并考入中山医科大学病理学专业硕士,96年直接转为博士生,1998年6月赴澳大利亚西澳大学从事骨病和骨肿瘤的分子生物学研究,有一篇论文已被《美国病理学杂志》接受。
参考文献
1 Lukert B. Glucocorticoid-induced osteoporosis. In: R.Marcus,D Feldman,and J Kelsey,eds.Osteoporosis. 1996, San Diego,CA:Academic Press,801-820.
2 Subramaniam M,Colvard D,Keeting PE,et al.Glucocorticoid regulation of alkaline phosphatase,osteocalcin and proto-oncogenes in normal human osteoblast-like cells. J Cell Biochem, 1992,50:411-424.
, 百拇医药
3 Weinstein RS,Jilka RL,Parfitt AM,et al. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. J Clin Invest,1998,102:274-282.
4 Huang WH,Lau ATT,Daniels LL,et al.Detection of estrogen receptor, a carbonic anhydrase Ⅱ,and tartrate-resistant acid phosphatase mRNA in putative mononuclear osteoclast precursor cells of neonatal rats by fluorescence in situ hybridisation. J Mol Endocrin,1998,20:211-219.
, 百拇医药
5 Athanasou NA,Bliss E,Gatter KC, et al. An immunohistological study of giant cell tumour of bone: evidence for an osteoclast origin of the giant cells. J Pathol, 1985,147:153-158.
6 Golding SR, Roelke MS,Petrison KK,et al.Human giant cell tumours of bone: identification and characterization of cell types. J Clin Invest, 1987,79:483-491.
7 Zheng MH,Fan Y,Wysocki SJ,et al. Detection of mRNA for carbonic anhydrase Ⅱ in human osteoclast-like cells by in situ hybridisation. J Bone Miner Res, 1993,8: 111-116.
, 百拇医药
8 Zheng MH,Fan Y,Wysocki SJ, et al. Gene expression of transforming growth factor b and its type Ⅱ receptor in giant cell tumours of bone: possible involvement in osteoclast-like cell migration. Am J Pathol,1994,145:1095-1104.
9 Grano M,Colucci S,De Bellis M,et al. New model for bone resorption study in vitro:human osteoclast-like cells from giant cell tumors of bone. J Bone Miner Res, 1994,9:1013-1020.
10 Tobias J, Chamber TJ. Glucocorticoids impair bone resorptive ability and viability of osteoclasts disaggregated from neonatal rat long bones. Endocrinology,1989,125:1290-1296.
, 百拇医药
11 Defranco DJ,Lian JB,Glowacki J.Differential effect of glucocorticoid on recruitment and activity of osteoclasts induced by normal and osteocalcin-deficient bone implanted in rats. Endocrinology,1992,131:114-121.
12 Conaway HH,Grigorie D,Lerner UH.Differential effects of glucocorticoids on bone resorption in neonatal mouse calvariae stimulated by peptide and steroid-like hormones. J Endocrinol,1997,155:513-521.
13 Lowe C,Gray DH,Reid IR. Serum blocks the osteolytic effect of cortisol in neonatal mouse calvaria. Calcif Tissue Int,1992,50:189-192.
, 百拇医药
14 Dempster DW,Moonga BS,Stein LS,et al.Glucocorticoids inhibit bone resorption by isolated rat osteoclasts by enhancing apoptosis. J Endocrinology,1997,154:397- 406.
15 Udagawa N,Takahashi N,Akatsu T, et al. The bone marrow-derived stromal cell lines MC3T3-G2/PA6 and ST2 support osteoclast-like cell differentiation in cocultures with mouse spleen cells. Endocrinology,1989,125:1805-1813.
16 Encio IJ,Detera-Wadleigh SD. The genomic structure of the human glucocorticoid receptor. J Biol Chem 1991,266:7182-7188.
, http://www.100md.com
17 Bamberger CM,Bamberger AM,de Castro M,et al. Glucocorticoid receptor β,a potential endogenous inhibitor of glucocorticoid action in humans. J Clin Inves, 1995,95:2435-2441.
18 Oakiey RH,Sar M,Cidlowsk JA. Expression and subcellular distribution of the β-isoform of the human glucocorticoid receptor. Endocrinology,1997,138:5028-5038., http://www.100md.com