加热及感染诱导热休克蛋白70表达及分布改变的观察
作者:叶苓 廖文俊 刘彦仿 杨守京
单位:杨守京 廖文俊 刘彦仿(第四军医大学病理学教研室,西安 710032);叶苓(现在广州中山医科大学博士后流动站)
关键词:热休克蛋白类70;高热;病毒性疾病
临床与实验病理学杂志990415摘要 目的:了解加热和病毒感染状态下细胞中热休克蛋白70(HSP70)的表达及分布情况。方法:分别对体外培养的Vero E6细胞进行加热或病毒感染,然后用免疫组化、免疫印迹杂交和RNA斑点杂交检测。结果:加热和感染均可使培养细胞高表达HSP70,但其分布及定位的改变则有差异。结论:高热和病毒感染可导致HSP70表达增强及分布的改变。
分类号 R511; R441.3 文献标识码 A
文章编号 1001-7399(1999)04-0322-03
, 百拇医药
The investigation of distribution and expression of HSP70 under high temperature or virus infection
Ye Ling, Liao Wenjun, Liu Yanfang et al
(Dept of Pathol, Fourth Military Medical University, Xian 710032)
ABSTRACT Purpose To investigate the expression and distribution of heat shock protein 70 under various stress conditions. Methods Heat treatment, virus infection, immunohistochemistry, Western blot, RNA dot blot. Results The overexpression of HSP70 was detected in the cells under various stresses, but the distribution and localization were varied. Conclusion Different stresses could lead to different expression and distribution of HSP70.
, 百拇医药
KEY WORDS heat-shock protein 70; heat; virus diseases
热休克蛋白(heat shock proteins, HSPs)是广泛存在于生物界从原核到真核细胞中的一类具有高度保守性的蛋白质,当细胞在受到某些不利因素(如高热、感染、缺血、缺氧及化学物质等)刺激时,会迅速短暂地大量合成,并通过与细胞内部分变性的蛋白质结合,协助其复性或将其运送至溶酶体降解而发挥细胞保护功能,因而可以认为应激时HSPs在细胞内的出现标志着细胞自身保护机制的启动。本文观察了高热、病毒感染时体外培养细胞HSP70表达及分布的改变,以了解在不同应激状况下细胞的应激反应及其意义。
1 材料和方法
1.1 材料 汉坦病毒敏感细胞株非洲绿猴肾细胞Vero E6细胞来自中国预防医学科学院病毒所,汉坦病毒A9株乳鼠脑悬液为第四军医大学唐都医院传染科惠赠。鼠抗人HSP70单克隆抗体(美国Santa Cruz公司),生物素化的羊抗鼠IgG和SABC试剂盒(武汉博士德生物制品公司),HSP70寡核苷酸探针(上海生命技术公司合成),[γ-32P]dATP(北京亚辉生物医学工程公司)。
, 百拇医药
1.2 方法
1.2.1 样本处理 将Vero E6细胞接种于预先铺入盖玻片的六孔板中,用5%小牛血清的RPMI1640培养基培养,将细胞分为3组,第一组为加热组,待细胞长成70%融合时,将细胞置于41.5℃孵箱内1 h,然后再置37℃培养;第二组为病毒感染组,倾倒掉大部分培养液,接种汉坦病毒A9株乳鼠脑悬液50 μl/孔,置37℃病毒吸附1 h后加入含5%胎牛血清的RPMI1640培养液。分别于加热和感染后4、8、24、72 h和5天收集被感染细胞铺片。第三组为正常对照组。另将Vero E6细胞接种于培养瓶中,待细胞生长至70%融合时,按上述方法进行加热、感染,在上述相同时间点收集细胞,并提取细胞内蛋白质及RNA,做Western印迹杂交和RNA斑点杂交。
1.2.2 免疫组化染色 参照SABC试剂盒说明书进行。
1.2.3 探针制备、标记及斑点杂交 用DNA合成仪合成HSP70相应的寡核苷酸探针,用[α-32P]dATP 5-末端标记法制备探针。用异硫氰酸胍一步法提取细胞总RNA,将20 μg总RNA点于尼龙膜上,置于真空干燥箱中80℃烤膜2 h,2×SSPE洗膜,42℃预杂交2 h,加入α-32P- HSP70寡核苷酸探针42℃杂交过夜,次日用2×SSPE洗膜数次,放射自显影。
, http://www.100md.com
1.2.4 Western印迹杂交 取等量的各组待测蛋白进行12% SDS-PAGE电泳,用Bio-Rad微型电转移系统将蛋白质转印至硝酸纤维素膜上进行Western印迹杂交分析。
2 结果
2.1 免疫组化染色结果 正常对照组多数细胞为阴性,仅可见到个别细胞浆内较弱的棕黄色阳性信号(图1)。加热组和病毒感染组于感染后4 h即出现HSP70表达增高,在多数细胞胞浆内可见棕黄色颗粒(图2),尤以细胞核周围更明显,加热后8 h组可见HSP70阳性信号出现在细胞核内,充满整个胞核(图3),胞浆中仅见少许阳性颗粒。而感染组则在核仁区出现阳性信号(图4),加热后24 h组HSP70表达接近正常,而病毒感染组仍可见较多细胞胞浆内阳性颗粒,但信号较前减弱,且核仁内阳性信号消失,感染72 h、5天后部分细胞胞浆内仍有阳性信号,但强度减弱,
, 百拇医药
图1 正常组Vero E6细胞免疫组化染色,示HSP70阴性.SABC×200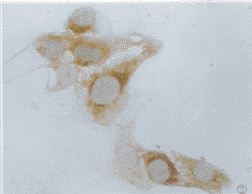
图2 病毒感染后4h组免疫组化染色,示Vero E6细胞胞浆内HSP70高表达.SABC×400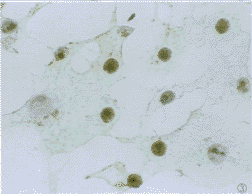
图3 加热8h组免疫组化染色,示Vero E6细胞核HSP70阳性.SABC×400
图4 感染后8h组免疫组化染色,示Vero E6细胞核仁及胞浆HSP70阳性.SABC×400
2.2 Western印迹分析 正常对照组在相对分子质量70 000处可见到一条着色带,但颜色较浅;加热后4 h组70 000处染色带颜色加深,持续至感染后8 h,24 h后接近正常(图5)。病毒感染后4 h组在70 000的染色带颜色加深,提示HSP70表达增强,这种高表达持续至感染后3~4天,以后HSP70表达恢复至正常(图6)。
, 百拇医药
图5 Western印迹分析
A:正常对照组,B:加热后24 h组,C:加热后8 h组,D:加热后4 h组
图6 Western印迹分析
A:正常对照组,B:感染后5天组,C:感染后4天组,D:感染后72 h组,E:感染后24 h组,F:感染后8 h组,G:感染后4 h组
2.3 RNA斑点杂交 用RNA斑点杂交法检测病毒感染后HSP70 mRNA水平,结果发现,病毒感染后4 h HSP 70 mRNA即增高,且持续至感染后第3天,以后HSP70 mRNA水平逐渐恢复至正常水平(图7)。
, 百拇医药
图7 RNA斑点杂交
A:正常对照组,B:感染后4 h组,C:感染后8 h,D:感染后24 h组,E:感染后72 h组,F:感染后5天组
3 讨论
应激反应是广泛存在于包括原核至真核生物界的一种对外界有害刺激的保护性反应,以表达热休克蛋白(HSP)为特征〔1〕,对外来有害刺激的反应随刺激的类型不同而发生改变。同时刺激的强度也影响应激反应的强度。我们发现,加热和感染后数小时内即可检测到HSP70的高表达,加热组于加热后 8h HSP70由正常时的胞浆内转至细胞核内,与此同时胞浆内则仅见少许HSP70阳性颗粒。而病毒感染后8 h可见细胞核的核仁内阳性信号,同时胞浆内也可见阳性颗粒。说明不同的刺激因素对细胞产生的影响也不同。已有报道热应激时细胞内HSP70的分布是经常改变的〔2〕。正常时HSP70位于胞浆,而受热或应激时则迅速聚集在细胞核或核仁附近,温度恢复正常时,HSP70又解聚返回到原来的胞浆位置。因此推测〔3〕,热变性使核仁内正在成熟的核糖体前体不能正确折叠装配而发生变性、聚集,核糖体合成受抑,HSP70首先与核蛋白的疏水基团结合,在其它HSPs的协同下,利用水解ATP的能量,将变性聚集的蛋白质分开,使之复性并重新折叠。在应激后,当核仁形态和功能逐渐恢复时,HSP70离开细胞核及核仁,重回细胞浆中。由此HSP70可以保护核蛋白免于有害因素所致的蛋白质变性〔2,4〕。观察还发现,加热组HSP70的表达于24 h后恢复正常,而病毒感染组HSP70的表达可持续至感染后3天,提示刺激因素的不同可影响HSP70表达的持续时间。
, 百拇医药
基金项目:国家自然科学基金资助课题(No 39770664)
作者简介:叶 苓,女,36岁,博士。研究方向:分子和免疫病理
参考文献
1,Peige V, Polla BS. Heat shock proteins: the hsp70 family. Experientia,1994;50:979~986
2,Hayashi Y, Tohnai J, Kobayashi T et al. Trans-location of hsp-70 and protein synthesis during countinous heating at mild temperatures in Hela cells. Radio Res,1991;125:80~88
3,Pelham HRB. Speculation on the functions of the major heat shock and glucoseregulated proteins. Cell,1986;46:959~961
4,Velazquez J, Linquist S. Hsp70:nuclear concentration during enviromental stress and cytoplasmic storage during recovery. Cell,1984;36:655~662
收稿日期:1999-03-01, 百拇医药
单位:杨守京 廖文俊 刘彦仿(第四军医大学病理学教研室,西安 710032);叶苓(现在广州中山医科大学博士后流动站)
关键词:热休克蛋白类70;高热;病毒性疾病
临床与实验病理学杂志990415摘要 目的:了解加热和病毒感染状态下细胞中热休克蛋白70(HSP70)的表达及分布情况。方法:分别对体外培养的Vero E6细胞进行加热或病毒感染,然后用免疫组化、免疫印迹杂交和RNA斑点杂交检测。结果:加热和感染均可使培养细胞高表达HSP70,但其分布及定位的改变则有差异。结论:高热和病毒感染可导致HSP70表达增强及分布的改变。
分类号 R511; R441.3 文献标识码 A
文章编号 1001-7399(1999)04-0322-03
, 百拇医药
The investigation of distribution and expression of HSP70 under high temperature or virus infection
Ye Ling, Liao Wenjun, Liu Yanfang et al
(Dept of Pathol, Fourth Military Medical University, Xian 710032)
ABSTRACT Purpose To investigate the expression and distribution of heat shock protein 70 under various stress conditions. Methods Heat treatment, virus infection, immunohistochemistry, Western blot, RNA dot blot. Results The overexpression of HSP70 was detected in the cells under various stresses, but the distribution and localization were varied. Conclusion Different stresses could lead to different expression and distribution of HSP70.
, 百拇医药
KEY WORDS heat-shock protein 70; heat; virus diseases
热休克蛋白(heat shock proteins, HSPs)是广泛存在于生物界从原核到真核细胞中的一类具有高度保守性的蛋白质,当细胞在受到某些不利因素(如高热、感染、缺血、缺氧及化学物质等)刺激时,会迅速短暂地大量合成,并通过与细胞内部分变性的蛋白质结合,协助其复性或将其运送至溶酶体降解而发挥细胞保护功能,因而可以认为应激时HSPs在细胞内的出现标志着细胞自身保护机制的启动。本文观察了高热、病毒感染时体外培养细胞HSP70表达及分布的改变,以了解在不同应激状况下细胞的应激反应及其意义。
1 材料和方法
1.1 材料 汉坦病毒敏感细胞株非洲绿猴肾细胞Vero E6细胞来自中国预防医学科学院病毒所,汉坦病毒A9株乳鼠脑悬液为第四军医大学唐都医院传染科惠赠。鼠抗人HSP70单克隆抗体(美国Santa Cruz公司),生物素化的羊抗鼠IgG和SABC试剂盒(武汉博士德生物制品公司),HSP70寡核苷酸探针(上海生命技术公司合成),[γ-32P]dATP(北京亚辉生物医学工程公司)。
, 百拇医药
1.2 方法
1.2.1 样本处理 将Vero E6细胞接种于预先铺入盖玻片的六孔板中,用5%小牛血清的RPMI1640培养基培养,将细胞分为3组,第一组为加热组,待细胞长成70%融合时,将细胞置于41.5℃孵箱内1 h,然后再置37℃培养;第二组为病毒感染组,倾倒掉大部分培养液,接种汉坦病毒A9株乳鼠脑悬液50 μl/孔,置37℃病毒吸附1 h后加入含5%胎牛血清的RPMI1640培养液。分别于加热和感染后4、8、24、72 h和5天收集被感染细胞铺片。第三组为正常对照组。另将Vero E6细胞接种于培养瓶中,待细胞生长至70%融合时,按上述方法进行加热、感染,在上述相同时间点收集细胞,并提取细胞内蛋白质及RNA,做Western印迹杂交和RNA斑点杂交。
1.2.2 免疫组化染色 参照SABC试剂盒说明书进行。
1.2.3 探针制备、标记及斑点杂交 用DNA合成仪合成HSP70相应的寡核苷酸探针,用[α-32P]dATP 5-末端标记法制备探针。用异硫氰酸胍一步法提取细胞总RNA,将20 μg总RNA点于尼龙膜上,置于真空干燥箱中80℃烤膜2 h,2×SSPE洗膜,42℃预杂交2 h,加入α-32P- HSP70寡核苷酸探针42℃杂交过夜,次日用2×SSPE洗膜数次,放射自显影。
, http://www.100md.com
1.2.4 Western印迹杂交 取等量的各组待测蛋白进行12% SDS-PAGE电泳,用Bio-Rad微型电转移系统将蛋白质转印至硝酸纤维素膜上进行Western印迹杂交分析。
2 结果
2.1 免疫组化染色结果 正常对照组多数细胞为阴性,仅可见到个别细胞浆内较弱的棕黄色阳性信号(图1)。加热组和病毒感染组于感染后4 h即出现HSP70表达增高,在多数细胞胞浆内可见棕黄色颗粒(图2),尤以细胞核周围更明显,加热后8 h组可见HSP70阳性信号出现在细胞核内,充满整个胞核(图3),胞浆中仅见少许阳性颗粒。而感染组则在核仁区出现阳性信号(图4),加热后24 h组HSP70表达接近正常,而病毒感染组仍可见较多细胞胞浆内阳性颗粒,但信号较前减弱,且核仁内阳性信号消失,感染72 h、5天后部分细胞胞浆内仍有阳性信号,但强度减弱,

, 百拇医药
图1 正常组Vero E6细胞免疫组化染色,示HSP70阴性.SABC×200

图2 病毒感染后4h组免疫组化染色,示Vero E6细胞胞浆内HSP70高表达.SABC×400

图3 加热8h组免疫组化染色,示Vero E6细胞核HSP70阳性.SABC×400

图4 感染后8h组免疫组化染色,示Vero E6细胞核仁及胞浆HSP70阳性.SABC×400
2.2 Western印迹分析 正常对照组在相对分子质量70 000处可见到一条着色带,但颜色较浅;加热后4 h组70 000处染色带颜色加深,持续至感染后8 h,24 h后接近正常(图5)。病毒感染后4 h组在70 000的染色带颜色加深,提示HSP70表达增强,这种高表达持续至感染后3~4天,以后HSP70表达恢复至正常(图6)。

, 百拇医药
图5 Western印迹分析
A:正常对照组,B:加热后24 h组,C:加热后8 h组,D:加热后4 h组

图6 Western印迹分析
A:正常对照组,B:感染后5天组,C:感染后4天组,D:感染后72 h组,E:感染后24 h组,F:感染后8 h组,G:感染后4 h组
2.3 RNA斑点杂交 用RNA斑点杂交法检测病毒感染后HSP70 mRNA水平,结果发现,病毒感染后4 h HSP 70 mRNA即增高,且持续至感染后第3天,以后HSP70 mRNA水平逐渐恢复至正常水平(图7)。

, 百拇医药
图7 RNA斑点杂交
A:正常对照组,B:感染后4 h组,C:感染后8 h,D:感染后24 h组,E:感染后72 h组,F:感染后5天组
3 讨论
应激反应是广泛存在于包括原核至真核生物界的一种对外界有害刺激的保护性反应,以表达热休克蛋白(HSP)为特征〔1〕,对外来有害刺激的反应随刺激的类型不同而发生改变。同时刺激的强度也影响应激反应的强度。我们发现,加热和感染后数小时内即可检测到HSP70的高表达,加热组于加热后 8h HSP70由正常时的胞浆内转至细胞核内,与此同时胞浆内则仅见少许HSP70阳性颗粒。而病毒感染后8 h可见细胞核的核仁内阳性信号,同时胞浆内也可见阳性颗粒。说明不同的刺激因素对细胞产生的影响也不同。已有报道热应激时细胞内HSP70的分布是经常改变的〔2〕。正常时HSP70位于胞浆,而受热或应激时则迅速聚集在细胞核或核仁附近,温度恢复正常时,HSP70又解聚返回到原来的胞浆位置。因此推测〔3〕,热变性使核仁内正在成熟的核糖体前体不能正确折叠装配而发生变性、聚集,核糖体合成受抑,HSP70首先与核蛋白的疏水基团结合,在其它HSPs的协同下,利用水解ATP的能量,将变性聚集的蛋白质分开,使之复性并重新折叠。在应激后,当核仁形态和功能逐渐恢复时,HSP70离开细胞核及核仁,重回细胞浆中。由此HSP70可以保护核蛋白免于有害因素所致的蛋白质变性〔2,4〕。观察还发现,加热组HSP70的表达于24 h后恢复正常,而病毒感染组HSP70的表达可持续至感染后3天,提示刺激因素的不同可影响HSP70表达的持续时间。
, 百拇医药
基金项目:国家自然科学基金资助课题(No 39770664)
作者简介:叶 苓,女,36岁,博士。研究方向:分子和免疫病理
参考文献
1,Peige V, Polla BS. Heat shock proteins: the hsp70 family. Experientia,1994;50:979~986
2,Hayashi Y, Tohnai J, Kobayashi T et al. Trans-location of hsp-70 and protein synthesis during countinous heating at mild temperatures in Hela cells. Radio Res,1991;125:80~88
3,Pelham HRB. Speculation on the functions of the major heat shock and glucoseregulated proteins. Cell,1986;46:959~961
4,Velazquez J, Linquist S. Hsp70:nuclear concentration during enviromental stress and cytoplasmic storage during recovery. Cell,1984;36:655~662
收稿日期:1999-03-01, 百拇医药