电子射野影像系统
作者:戴建荣 胡逸民
单位:中国医学科学院(中国协和医科大学) 肿瘤医院, 北京 100021
关键词:
中国医学物理学杂志990402 中图分类号:R143 文献标识码:A 文章编号:1005-202X(1999)04-0204-05
1 电子射野影像装置原理
为解决布野和患者摆位的实时验证问题,早在1958年Andrews就设计了第一个电子射野影像装置(Electronic Portal Imaging Device, 简称EPID),用于监测2 MV X线治疗[1],1962年Benner也设计了一个用于监测30 MV X线治疗[2]。尽管当时的图像对比度很差,但这些早期研究为放射治疗的实时验证开辟了道路。其后在荧光剂设计和摄像机技术方面取得的进步大大改进了荧光型EPID的图像质量。自80年代,固体探测器和液体探测器开始用于EPID的设计。EPID系统由射线探测和射线信号的计算机处理两部分组成。不同系统的差别主要表现在前一个部分,后一个部分对所有系统均是相同或相似的。依据射线探测方法的不同可以将EPID系统划分为荧光、固体探测器、液体电离室三大类型。
, http://www.100md.com
1.1 荧光系统
如图1所示,系统由一个覆盖金属板的荧光屏、45°角倾斜的反射镜、透镜和摄像机组成。当光子束入射到金属板,与其发生相互作用而产生电子,电子打到荧光屏上发出荧光。荧光形成的影像经反射镜和透镜组成的光路传到摄像机,经摄像机记录后成为电子图像最后传到负责处理的计算机[3]。这类系统的优点有:①作为探测器的荧光屏可以做得很大,即系统的扫描孔径(FOV)大;②空间分辩率高,这主要取决于荧光屏的厚度;③成像速度快,可达每秒30帧。但由于镜子倾斜占空间,造成系统体积很大,只能安装在没有射束遮挡器的加速器机架上,既便如此,也妨碍患者摆位。Wong用一个光纤图像渐缩器(Fiber-optic Image Reducer)代替反射镜将荧光屏产生的图像传到摄像机,使系统厚度减少到12 cm[4]。改进后的系统可安装到有射束遮挡器的加速器机架上,对患者摆位的干扰也减少了。
, 百拇医药
图1 荧光系统结构
1.2 固体探测器系统
1986年,Lam设计了一个由256个半导体探头构成的线阵,用一块1.1 mm厚的铅板覆盖,相邻探头中心之间的距离均为2 mm。线阵由步进电机驱动,以2 mm步距扫描整个射野区域[5]。由于这个系统一次只能收集射野一个窄条的信息,需要较多的照射剂量才能得到整个射野图像,如长度为20至45 cm的射野需要照射27至60 cGy。系统的另一个局限是半导体探头之间的间距决定了系统的空间分辩率不高。
非晶形硅影像阵列 (an amorphous silicon imaging array)可以克服半导体线阵的缺点,它由光电二极管(Photodiode)和场效应管(Field Effect Transitor,简称FET)组成,紧贴金属/荧光转换板,每一个二极管隅合到一个均效应晶体管。当采集图像信号时,所有的FET线保持负电压以便使整个FET阵列不导电。荧光高效地转换为光电二极管本征层的电子空穴对,随后被收集、贮存在光二极管的电容中。当已为一幅图像采集了足够的信号后,改变某一条FET的电压使位于相应行的所有FET导电。于是存贮在光二极管的信号经FET传到数据线,经外部电子仪器转换为一行数字图像。这条FET线的电压回到初始状态,类似地改变下一条FET的电压便可以得到下一行的图像,逐行进行直至所有行的信号被读出、得到整幅图像。这种探测器有可能提供大面积、高效率、高分辩率的影像系统(图2)[6]。这种系统中的金属/荧光转换板和荧光系统的金属/荧光转换板是完全相同的,而非晶形硅影像阵列的作用是代替荧光系统中的光路和摄像机。
, 百拇医药
图2 非晶硅影像阵列探测器结构
自扫描非晶形硒探测器(a self-scanned a-Se detector) 用非晶形硒做成的光导体直接将X射线转换成代表图像的电荷,后者可以用一个有源矩阵(Active Matrix)读取。如图3所示,非晶形硒层的下表面与有源矩阵接触,而其上表面接高压偏置电极,因而可以在非晶形硒层中形成电场。有源矩阵的每个像素由一个薄膜晶体管(TFT),一个像素电极和一个贮存电容构成。水平布置的门线每次打开一行TFT,使图像电荷从像素电极传输到垂直布置的数据线,再经数据线传到外部电荷放大器,最后由同轴电缆将放大了的并行信号转换成串行输出[7,8]。与非晶形硅影像阵列比较,此方法不需要金属/荧光转换板,因此它是一种更直接的方法。
图3 自扫描非晶形硒探测器结构
, 百拇医药
1.3 液体电离室
芬兰癌症研究所开发的EPID系统采用扫描液体电离室(Scanning Liquid Ionization Chamber, 简称SLIC)作为射线探测器。SLIC是一个256×256的液体电离室矩阵,覆盖着1 mm厚的钢板作为剂量建成材料,电离室高压电极之间填充着1 mm厚异辛烷作为电离介质。通过依次接通每一行电离室的极化电压,256个静电计同时读取这一行内的256个电离室的电离电流。32.5 cm×32.5 cm FOV的扫描时间是5.9 s,更短的时间可通过降低空间分辨率的办法实现[9]。SLIC和相关的读取线路封装在一个52 cm×52 cm×4 cm的盒子中,可以很方便地安装在加速器机架上,既使是配有射线遮挡器的加速器。
1.4 EPID性能参数
EPID重要的性能参数有空间分辩率和对比分辨率,其它的参数还有信噪比、扫描时间、FOV和显示矩阵大小。
, http://www.100md.com
空间分辨率是反映系统分辨临近小物体的能力,与放射源大小、源--患者--探测器三者之间的几何关系以及显示矩阵有关。其它因素如屏厚、探测器和患者的运动也会有影晌。假设源强是宽度为σs的高斯分布,探测器象素大小是σd,放大因子M定义为源到探测器距离与源到等中心距离之比,则等中心位置的线散布函数(Linear Spread Function, 简称LSF)可表示为
当Mopt=1+(σd/σs)2时,σLSF取最小值。
加速器靶点大小一般在0.9~1.6 mm范围,最小的可以到0.5 mm,最大的可以到3 mm。图4给出了当源大小是0.5 mm,1 mm和2 mm时两种典型探测器的线散布函数与放大系数之间的关系,其中显示矩阵是512×480的一组曲线代表Siemens影像系统,像素大小是σd=0.7 mm;显示矩阵是256×256的一组曲线代表Varian SLIC影像系统,像素大小是σd=1.27 mm。前一组曲线比后一组低,说明前一个系统的空间分辨率比后一个高。尽管从图分析,对于前一个系统,M取值应尽可能大;而对于后一个系统,M的合适取值范围是1.4~1.6(不包括源特别大的情况)。但临床实际常用的M值是1.4~1.6,这是考虑到取更大的M会降低射线探测效率和减少FOV。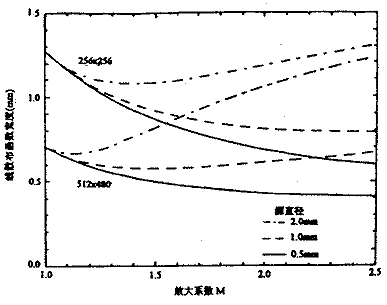
, http://www.100md.com
图4 当源大小是0.5,1 和2 mm时两种典型探测器的线散布函数与放大系数之间的关系
因为受很多因素影响,定义一个图像系统的对比分辨率 (Contrast Resolution)很困难。目前一般采用对比细节分析法(Contrast-detail analysis), 利用一些对比细节体模来评价一个系统的对比分辨率[10-12],其中使用最普遍的是Shalev设计的一个铝制体模,因曾在Las Vegas举行的研讨会上做过介绍而被称为名为"Las Vegas"体模。体模呈方形,表面钻有直径分别为1 mm,2 mm,4 mm,7 mm,10 mm和15 mm,深度分别为0.51 mm,1.0 mm,2.0 mm,3.2 mm和4.8 mm的孔。对比--细节曲线描绘对比值和相应级上最小可见孔影直径之间的关系。图5是6MV X线能量时用"Las Vegas"体模测得的Siemens BEAMVIEW射野影像系统的对比--细节曲线。
, 百拇医药
图5 6MV X线能量时Siemens BEAMVIEW射野影像系统的对比--细节曲线。
2 射野图像登记(Portal Image Registration)
射野图像登记包括两方面的工作。一是登记射野,也就是找出射野边界,并与参考图像中的射野比较,确定射野形状、大小和位置的误差,协助用户找出这些误差产生的原因,如挡块位置不对或忘记加挡块。二是登记患者解剖特征,如解剖标记点、标记线,并与参考图像的解剖特征比较,确定患者摆位误差。参考图像可以是数字重建X光片 (DRR)、模拟定位片或已经验证的第一次治疗时射野图像。由于射野边缘处的图像信噪比很高,射野登记可以用多种边缘追踪算法(Edge Tracking Algorithm)迅速自动地完成[13-15]。相反地,由于代表患者解剖特征的图像区对比度低,并且解剖特征的几何结构复杂,尽管已有许多的登记算法,但尚未有一种算法能准确、自动、迅速地完成登记,并且适合来自各种EPID的射野图像。这许多的登记算法可归纳为交互式算法(Interactive Algorithm) 、以标记为基础的算法(Landmark-based Algorithm) 和交叉关联算法(Cross-correlation Algorithm)三种类型:
, http://www.100md.com
2.1 交互式算法
用户操作鼠标或键盘反复移动、旋转和缩放射野图像,然后借助一些图形工具来观察每一次操作后射野图像和参考图像是否已完全重叠匹配;如用户认为已匹配好,系统可计算出患者位置的平移、旋转和缩放误差[16,17]。一种常用的图形工具是以国际象棋盘形式同时显示射野图像和参考图像,白色格是相应位置的射野图像,黑色格是相应位置的参考图像。另一种常用工具是在参考图像中勾划一些解剖轮廓,这些解剖轮廓可称为模板;模板被显示在射野图像的对应位置,用户便可以观察到模板和解剖轮廓图像的匹配效果。其它类似的工具还有卷帘和开窗显示模式。
2.2 以标记为基础的算法
采用这类算法的软件以计算机自动或用户手动方式定义点对和或线对开始,在射野图像和参考图像中找出一些特征点和(或)线的位置,然后软件自动计算出为最优地匹配这些点对和(或)线对所需要的空间变换[15, 18,19]。这些特征点、线可以是人体解剖特征,也可以是外部植入的微小标记物。标记物要用高密度的生物兼容性材料制作,如金。
, http://www.100md.com
2.3 交叉关联算法
这一类算法要求以手动或自动方式在参考图像中选取一些具有解剖特征的图像区域,这些区域称为参考窗。然后自动在射野图像中为每一个参考窗划出一个包括它的较大图像范围,这个图像范围称为搜索窗。自动在搜素窗内不断调整参考窗位置,计算相应位置的射野图像区和参考窗的相关系数,最终找出相关系数最大的位置并计算出患者摆位误差[20,21]。在这三类算法中,第一类最简单,但自动化程度很低,需要用户主观判断匹配的好坏;第二类算法自动化程度提高了,但一般仍需要手工完成标记点对和(或)线对的定义。第三类算法一般不需要人工干预,既使需要也只是划一些方框来标出参考窗的位置,在三类算法中自动化程度最高,其缺点是计算量很大,费时最多。
3 临床应用
在治疗计划的执行阶段,射野位置和患者摆位都存在误差,甚至出现一些严重的错误。从统计结果看,发生大误差的概率是相当高的,因此位置验证非常必要。利用射野影像系统可以测量误差;当发现误差超过预定的范围时,便可以采取相应的校正措施。在只有胶片的时代,因为拍片、洗片过程费时,进行位置验证的频度很低。Reistein在美国进行的一次调查结果显示,只有40%的医院能坚持每周为患者拍一次射野片[22]。当有了EPID以后,情况就完全不一样了,可以在每个分次治疗时验证患者体位。射野影像系统在位置验证方面的应用目前有治疗前校正射野、离线评价患者摆位、治疗间校正患者摆位、治疗前校正患者摆位这四种形式,将来还可能在治疗过程中实时校正患者摆位。
, 百拇医药
(1)治疗前校正射野
布野时可能发生挡块位置放错或拿错挡块之类的粗差。对于没有配备记录验证系统的加速器,还会发生诸如射野大小、准直器角度和楔形板大小、方向之类的机械运动参数误差。粗差会严重影响患者的治疗效果,甚至造成医疗事故,因此应及时发现及时校正。发现粗差最简单的方法是技术员在每次治疗开始时注意观察射野图像,如发现有错,则立即关机。第二种办法是每次治疗开始时预照数跳获得射野图像,在技术员确认射野正确时照射余下的机器跳数。第三种办法是利用一些EPID系统提供的自动登记射野的功能,当系统发现布野误差超过预设的限值时,自动关机[23]。
(2)离线评价患者摆位
如果将一个疗程中每个分次的射野图像以时间流逝序列(Time-lapse Sequence)的形式显示,就可以动态观察到射野和患者体位的逐日变化情况,因此它是一种回顾整个疗程摆位重复性的快速方法,可做为常规质量保证程序的一部分。对于患同一种肿瘤的患者群体,如果对其整个疗程所有射野图像进行回顾性分析,就可以了解患者群体摆位误差分布情况,为治疗计划设计提供PTV和CTV之间的间隙数据(Margin)[24,25]。
, 百拇医药
(3)治疗间校正患者摆位(Intertreatment Correction)
患者摆位误差无论是平移量、还是旋转量,均由系统误差和随机误差两项构成。系统误差用所有分次的摆位误差的平均值表示,随机误差用所有分次的摆位误差的标准差表示。在设计某个患者的治疗计划时,PTV和CTV之间的间隙是根据患者群体摆位误差分布情况确定的。但实际上由于个体之间的差异,每个患者实际需要的间隙是不一样的,针对这种情况,严蒂提出了自适应放疗的思想(Adaptive Radiation Therapy)[26]。
自疗程开始时起,每次放疗时获取射野图像,用离线方式测量每次的摆位误差。根据最初数次的测量结果预测整个疗程的系统误差和随机误差。在系统误差精度要求为±1 mm、随机误差精度要求为±0.5 mm、置信度大于95%的条件下,所需的测量次数最多不超过9次,具体次数可根据经验公式计算,其中σ是随机误差估计值。
, 百拇医药
如果在测量中发现误差有随时间变化的趋势,则在预测系统误差时要采用加权平均的办法。当预测的平移系统误差大于2 mm或旋转角度系统误差超过20时,调整准直器叶片位置或准直器旋转角度以校正之。如果计划时预留的间隙量不足以包括随机误差表示的患者位置变化,则适当加大射野。在一个包括20位患者的前瞻性临床研究中,有13位患者的射野因为校正系统误差而做了调正,平移系统误差从校正前的平均4 mm降至平均0.5 mm,而调正前后随机误差无显著差别[27]。
(4)治疗前校正患者摆位(Prement Correction)
在每次治疗开始时,预照数跳获得射野定位图像,并在线登记之。如果摆位正确,则继续余下的照射。如果发现患者摆位误差超过预定的限值,则校正患者体位,然后继续照射或重获定位图像。不少临床试验结果证明,治疗前校正可有效减少摆位误差,但治疗时间会延长。例如在De Neve组织的16位肺癌患者前后野照射的试验中,设置横向和纵向的平移误差限值为2 mm,超过限值时通过遥控床做校正。在全部196次照射中有120次误差超过限值,占总射野数的61%。经校正后,纵向误差从(0.1±4.5) mm降至(0.08±1.2) mm,横向误差从(-2.0±5.7) mm降至(-0.9±1.0) mm。每野治疗时间平均延长了2.5分钟,相当于增加了65%[28]。与治疗间校正方法相比,此方法不仅校正了患者摆位的系统误差,还可以校正在整个疗程中表现为随机误差、而在一个分次中表现为系统误差的成份。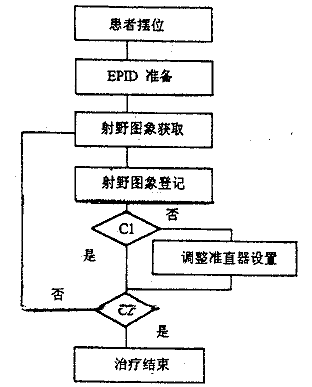
, http://www.100md.com
图6 自动跟踪放疗流程图。C1 是判断条件"摆位误差可以接受吗?"。 C2 是判断条件"所需机器跳数是否已全部照射?"。
(5)治疗中校正患者摆位(Intratreatment Correction)
体位固定装置可以减少患者体位在治疗中的变化。对于头颈部肿瘤,靶区位置和体位可以认为是相对不变的,体位固定了也就保证了靶区位置的固定。对于胸腹部肿瘤,当体位固定后,靶区在体内仍存在一定范围的运动。这些运动主要是呼吸引起的,其它如胃肠蠕动、血液流动也会有影响。为减少因呼吸引起的靶区运动,最简单的办法是当照射时要求患者屏气,但因屏气能坚持的时间一般比照射时间短,在临床使用的效果不理想。Kubo建立一项名为呼吸选通放疗的技术(Respiration Gated Therapy),利用一个呼吸传感器监测患者呼吸[29]。当患者开始吸气时出束照射,一直持续到患者开始呼气时停止照射,直到下一次吸气开始时再恢复照射,如此可以保证在整个治疗过程中只有当靶区位于射野内时出束。目前还没有EPID在这方面应用的报道,究其原因有两个方面。其一是获取一幅射野图像一般需要3~5 s(不包括荧光型EPID),并且图像质量较差;其二是尚未研究成功一种实时准确的射野图像登记算法。不过,我们可以大胆地设想射线束与靶区的关系类似军事领域中的导弹与目标之间的关系,建立如图6所示的自动跟踪放疗技术,利用EPID监测靶区的位置变化,实时调整准直器叶片位置和准直器转角,确保射线束总是对准靶区照射。为实现这样一种放疗技术,必须保证从获取图像至完成登记的时间不超过1 s ,这有赖于 EPID和图像登记算法性能的巨大改进
, 百拇医药
参考文献:
1 J Anderws, R Swain, P Rubin. Continous visual monitoring of 2MEV Rorntgen therapy. Am J Roentgenol,1958,73:74-78.
2 S Benner, B Rosengren, H Wallman. Television monitoring of a 30MV X-ray beam. Phys Med Biol,1962,7:29-33.
3 N Baily, R Horn, T Kampp. Fluroscopic visualization of megavoltage therapeutic x-ray beams. Int J Radiat Oncol Biol,1980,6:935-939.
, 百拇医药 4 J Wong, E Slessinger, R Hermes. On-line radiotherapy imaging with an array of fiber-optic image reducers. Int J Radiat Oncol Biol Phys,1900,18:1477-1484.
5 K Lam, M Partowmah M and W Lam. An on-line electronic portal imaging system for external beam radiotherapy. Br J Radiol,1986,59:1007-1013.
6 L Antonuk, J Boudry, W Huang, et al. Demonstration of megavoltage an diagonostic x-ray imaging with hydrogenated amorphous silicon arrays. Med Phys, 1992, 19:1455-1466.
, 百拇医药
7 W Zhao and JA Rowlands. Digital radiology using active matirx readout of amorphous selenium: Theoretical analysis of detective quantum efficiency. Med Phys,1997, 24:1819-1833.
8 W Zhao and JA Rowlands. X-ray imaging using amorphousslenium: Feasibility of a flat panel self-scanned detector for digital radiology. Med Phys,1995, 22:1595-1604.
9 M van Herk and H Meertens. A matrix ionization chamber imaging device for on-line patient setup verification during radiotherapy. Radio Oncol,1988,11:369-378.
, 百拇医药
10 RM Harrison, and GD Lambert. A method and contrast-detail phantom for the quantitative assessment of radiotherapy portal imaging systems. Brit J Radio ,1994,67:384-388.
11 A Visser, H Huizena, V Althof, et al. Performance of a prototype fluoroscopic radiotherapy imaging system. Int J Radiat Oncol Biol Phys,1990,18:43-50.
12 E Morton, W Swindell, D Lewis, et al. A linear array, scintillation crystal-photodiode detector for megavoltage imaging. Med Phys,1991,18:681-691.
, http://www.100md.com
13 K Eilertsen, A Skretting and TL Tennvassas. Methods for fully automated verification of patient set-up in external beam radiotherapy with polygon shaped fields. Phys Med Biol, 1994,39:933-1012.
14 H Wong and B Fallone. A robust morphological algorithm for automatic radiation field extraction and correlation of portal images. Med Phys, 1994,21:237-244.
15 DS Fritsch, EL Chaney, A Boxwala, et al. Core-based portal image registration for automatic radiotherapy treatment verification. Int J Radiat Oncol Biol Phys 33:1287-1300.
, http://www.100md.com
16 WR Bosch, DA Low, RL Gerber, et al. The electronic viewbox: a software tool for radiation therapy treatment verification. Int J Radiat Oncol Biol Phys, 1995 31:135-142.
17 W De Neve, F Van den Heuvel, M Coghe, et al. Interactive use of on-line portal imaging in pelvic radiation. Int J Radiat Oncol Biol Phys, 1993, 25:517-524.
18 JM Balter, CA Pelizzari and GTY Chen. Correlation of projection radiographs in radiation therapy using open curve segments and points. Med Phys, 1992,19:329-334.
, 百拇医药
19 GX Ding, S Shalev and G Gluchev. A rho-theta technique for treatment verification in radiotherapy and its clinical applications. Med Phys, 1993 ,20:1135-1143.
20 DH Hristov and BG Fallone. A grey-level image alignment algorithm for registration of portal images and digital reconstructed radiographs. Med Phys , 1996,23:75-84.
21 L Dong and AL Boyer. An image correlation procedure for digitally reconstructed radiographs and electronic portal images. Int J Radiat Oncol Biol Phys, 1995, 33:1053-1060.
, 百拇医药
22 L Reistein, H Amols, P Biggs, et al. Radiotherapy portal imaging quality. American Institute of Physics, New York (AAPM Report No 24), 1987.
23 K Leszczynski, S Shalev. Verification of radiotherapy treatments: Computerized analysis of the size and shape of radiation fields.Med Phys,1993,20:687-694.
24 J Hanley, MA Lumley, GS Mageras, et al. Measurement of patient positioning errors in three-dimensional conformal radiotherapy of the prostate. Int J Radiat Oncol Biol Phys,1997,37:435-444.
, 百拇医药
25 MA Hunt, TE Schultheiss, GE Desobry, et al. An evaluation of setup uncertainties for patients treated to pelvic sites. Int J Radiat Oncol Biol Phys,1995,30:227-233.
26 D Yan, F Vicini, J Wong, et al. Adaptive radiation therapy. Phys Med Biol,1997,42:123-132.
27 D Yan, E Ziaja, D Jaffray, et al. The use of adaptive radiation therapy to reduce setup error: a prospective clinical study. Int J Radiat Oncol Biol Phys,1998,41:715-720.
, 百拇医药
28 JVD Steene, VD Heuvel F, A Bel, et al. Electronic portal imaging with on-line correction of setup error in thoracic irradiation: clinical evaluation. Int J Radiat Oncol Biol Phys, 1998,40:967-976.
29 HD Kubo and BC Hill. Respiration gated radiotherapy treatment: a technique study. Phys Med Biol,1996,41:83-91.
收稿日期:1998-12-08, http://www.100md.com
单位:中国医学科学院(中国协和医科大学) 肿瘤医院, 北京 100021
关键词:
中国医学物理学杂志990402 中图分类号:R143 文献标识码:A 文章编号:1005-202X(1999)04-0204-05
1 电子射野影像装置原理
为解决布野和患者摆位的实时验证问题,早在1958年Andrews就设计了第一个电子射野影像装置(Electronic Portal Imaging Device, 简称EPID),用于监测2 MV X线治疗[1],1962年Benner也设计了一个用于监测30 MV X线治疗[2]。尽管当时的图像对比度很差,但这些早期研究为放射治疗的实时验证开辟了道路。其后在荧光剂设计和摄像机技术方面取得的进步大大改进了荧光型EPID的图像质量。自80年代,固体探测器和液体探测器开始用于EPID的设计。EPID系统由射线探测和射线信号的计算机处理两部分组成。不同系统的差别主要表现在前一个部分,后一个部分对所有系统均是相同或相似的。依据射线探测方法的不同可以将EPID系统划分为荧光、固体探测器、液体电离室三大类型。
, http://www.100md.com
1.1 荧光系统
如图1所示,系统由一个覆盖金属板的荧光屏、45°角倾斜的反射镜、透镜和摄像机组成。当光子束入射到金属板,与其发生相互作用而产生电子,电子打到荧光屏上发出荧光。荧光形成的影像经反射镜和透镜组成的光路传到摄像机,经摄像机记录后成为电子图像最后传到负责处理的计算机[3]。这类系统的优点有:①作为探测器的荧光屏可以做得很大,即系统的扫描孔径(FOV)大;②空间分辩率高,这主要取决于荧光屏的厚度;③成像速度快,可达每秒30帧。但由于镜子倾斜占空间,造成系统体积很大,只能安装在没有射束遮挡器的加速器机架上,既便如此,也妨碍患者摆位。Wong用一个光纤图像渐缩器(Fiber-optic Image Reducer)代替反射镜将荧光屏产生的图像传到摄像机,使系统厚度减少到12 cm[4]。改进后的系统可安装到有射束遮挡器的加速器机架上,对患者摆位的干扰也减少了。

, 百拇医药
图1 荧光系统结构
1.2 固体探测器系统
1986年,Lam设计了一个由256个半导体探头构成的线阵,用一块1.1 mm厚的铅板覆盖,相邻探头中心之间的距离均为2 mm。线阵由步进电机驱动,以2 mm步距扫描整个射野区域[5]。由于这个系统一次只能收集射野一个窄条的信息,需要较多的照射剂量才能得到整个射野图像,如长度为20至45 cm的射野需要照射27至60 cGy。系统的另一个局限是半导体探头之间的间距决定了系统的空间分辩率不高。
非晶形硅影像阵列 (an amorphous silicon imaging array)可以克服半导体线阵的缺点,它由光电二极管(Photodiode)和场效应管(Field Effect Transitor,简称FET)组成,紧贴金属/荧光转换板,每一个二极管隅合到一个均效应晶体管。当采集图像信号时,所有的FET线保持负电压以便使整个FET阵列不导电。荧光高效地转换为光电二极管本征层的电子空穴对,随后被收集、贮存在光二极管的电容中。当已为一幅图像采集了足够的信号后,改变某一条FET的电压使位于相应行的所有FET导电。于是存贮在光二极管的信号经FET传到数据线,经外部电子仪器转换为一行数字图像。这条FET线的电压回到初始状态,类似地改变下一条FET的电压便可以得到下一行的图像,逐行进行直至所有行的信号被读出、得到整幅图像。这种探测器有可能提供大面积、高效率、高分辩率的影像系统(图2)[6]。这种系统中的金属/荧光转换板和荧光系统的金属/荧光转换板是完全相同的,而非晶形硅影像阵列的作用是代替荧光系统中的光路和摄像机。

, 百拇医药
图2 非晶硅影像阵列探测器结构
自扫描非晶形硒探测器(a self-scanned a-Se detector) 用非晶形硒做成的光导体直接将X射线转换成代表图像的电荷,后者可以用一个有源矩阵(Active Matrix)读取。如图3所示,非晶形硒层的下表面与有源矩阵接触,而其上表面接高压偏置电极,因而可以在非晶形硒层中形成电场。有源矩阵的每个像素由一个薄膜晶体管(TFT),一个像素电极和一个贮存电容构成。水平布置的门线每次打开一行TFT,使图像电荷从像素电极传输到垂直布置的数据线,再经数据线传到外部电荷放大器,最后由同轴电缆将放大了的并行信号转换成串行输出[7,8]。与非晶形硅影像阵列比较,此方法不需要金属/荧光转换板,因此它是一种更直接的方法。

图3 自扫描非晶形硒探测器结构
, 百拇医药
1.3 液体电离室
芬兰癌症研究所开发的EPID系统采用扫描液体电离室(Scanning Liquid Ionization Chamber, 简称SLIC)作为射线探测器。SLIC是一个256×256的液体电离室矩阵,覆盖着1 mm厚的钢板作为剂量建成材料,电离室高压电极之间填充着1 mm厚异辛烷作为电离介质。通过依次接通每一行电离室的极化电压,256个静电计同时读取这一行内的256个电离室的电离电流。32.5 cm×32.5 cm FOV的扫描时间是5.9 s,更短的时间可通过降低空间分辨率的办法实现[9]。SLIC和相关的读取线路封装在一个52 cm×52 cm×4 cm的盒子中,可以很方便地安装在加速器机架上,既使是配有射线遮挡器的加速器。
1.4 EPID性能参数
EPID重要的性能参数有空间分辩率和对比分辨率,其它的参数还有信噪比、扫描时间、FOV和显示矩阵大小。
, http://www.100md.com
空间分辨率是反映系统分辨临近小物体的能力,与放射源大小、源--患者--探测器三者之间的几何关系以及显示矩阵有关。其它因素如屏厚、探测器和患者的运动也会有影晌。假设源强是宽度为σs的高斯分布,探测器象素大小是σd,放大因子M定义为源到探测器距离与源到等中心距离之比,则等中心位置的线散布函数(Linear Spread Function, 简称LSF)可表示为

当Mopt=1+(σd/σs)2时,σLSF取最小值。
加速器靶点大小一般在0.9~1.6 mm范围,最小的可以到0.5 mm,最大的可以到3 mm。图4给出了当源大小是0.5 mm,1 mm和2 mm时两种典型探测器的线散布函数与放大系数之间的关系,其中显示矩阵是512×480的一组曲线代表Siemens影像系统,像素大小是σd=0.7 mm;显示矩阵是256×256的一组曲线代表Varian SLIC影像系统,像素大小是σd=1.27 mm。前一组曲线比后一组低,说明前一个系统的空间分辨率比后一个高。尽管从图分析,对于前一个系统,M取值应尽可能大;而对于后一个系统,M的合适取值范围是1.4~1.6(不包括源特别大的情况)。但临床实际常用的M值是1.4~1.6,这是考虑到取更大的M会降低射线探测效率和减少FOV。

, http://www.100md.com
图4 当源大小是0.5,1 和2 mm时两种典型探测器的线散布函数与放大系数之间的关系
因为受很多因素影响,定义一个图像系统的对比分辨率 (Contrast Resolution)很困难。目前一般采用对比细节分析法(Contrast-detail analysis), 利用一些对比细节体模来评价一个系统的对比分辨率[10-12],其中使用最普遍的是Shalev设计的一个铝制体模,因曾在Las Vegas举行的研讨会上做过介绍而被称为名为"Las Vegas"体模。体模呈方形,表面钻有直径分别为1 mm,2 mm,4 mm,7 mm,10 mm和15 mm,深度分别为0.51 mm,1.0 mm,2.0 mm,3.2 mm和4.8 mm的孔。对比--细节曲线描绘对比值和相应级上最小可见孔影直径之间的关系。图5是6MV X线能量时用"Las Vegas"体模测得的Siemens BEAMVIEW射野影像系统的对比--细节曲线。

, 百拇医药
图5 6MV X线能量时Siemens BEAMVIEW射野影像系统的对比--细节曲线。
2 射野图像登记(Portal Image Registration)
射野图像登记包括两方面的工作。一是登记射野,也就是找出射野边界,并与参考图像中的射野比较,确定射野形状、大小和位置的误差,协助用户找出这些误差产生的原因,如挡块位置不对或忘记加挡块。二是登记患者解剖特征,如解剖标记点、标记线,并与参考图像的解剖特征比较,确定患者摆位误差。参考图像可以是数字重建X光片 (DRR)、模拟定位片或已经验证的第一次治疗时射野图像。由于射野边缘处的图像信噪比很高,射野登记可以用多种边缘追踪算法(Edge Tracking Algorithm)迅速自动地完成[13-15]。相反地,由于代表患者解剖特征的图像区对比度低,并且解剖特征的几何结构复杂,尽管已有许多的登记算法,但尚未有一种算法能准确、自动、迅速地完成登记,并且适合来自各种EPID的射野图像。这许多的登记算法可归纳为交互式算法(Interactive Algorithm) 、以标记为基础的算法(Landmark-based Algorithm) 和交叉关联算法(Cross-correlation Algorithm)三种类型:
, http://www.100md.com
2.1 交互式算法
用户操作鼠标或键盘反复移动、旋转和缩放射野图像,然后借助一些图形工具来观察每一次操作后射野图像和参考图像是否已完全重叠匹配;如用户认为已匹配好,系统可计算出患者位置的平移、旋转和缩放误差[16,17]。一种常用的图形工具是以国际象棋盘形式同时显示射野图像和参考图像,白色格是相应位置的射野图像,黑色格是相应位置的参考图像。另一种常用工具是在参考图像中勾划一些解剖轮廓,这些解剖轮廓可称为模板;模板被显示在射野图像的对应位置,用户便可以观察到模板和解剖轮廓图像的匹配效果。其它类似的工具还有卷帘和开窗显示模式。
2.2 以标记为基础的算法
采用这类算法的软件以计算机自动或用户手动方式定义点对和或线对开始,在射野图像和参考图像中找出一些特征点和(或)线的位置,然后软件自动计算出为最优地匹配这些点对和(或)线对所需要的空间变换[15, 18,19]。这些特征点、线可以是人体解剖特征,也可以是外部植入的微小标记物。标记物要用高密度的生物兼容性材料制作,如金。
, http://www.100md.com
2.3 交叉关联算法
这一类算法要求以手动或自动方式在参考图像中选取一些具有解剖特征的图像区域,这些区域称为参考窗。然后自动在射野图像中为每一个参考窗划出一个包括它的较大图像范围,这个图像范围称为搜索窗。自动在搜素窗内不断调整参考窗位置,计算相应位置的射野图像区和参考窗的相关系数,最终找出相关系数最大的位置并计算出患者摆位误差[20,21]。在这三类算法中,第一类最简单,但自动化程度很低,需要用户主观判断匹配的好坏;第二类算法自动化程度提高了,但一般仍需要手工完成标记点对和(或)线对的定义。第三类算法一般不需要人工干预,既使需要也只是划一些方框来标出参考窗的位置,在三类算法中自动化程度最高,其缺点是计算量很大,费时最多。
3 临床应用
在治疗计划的执行阶段,射野位置和患者摆位都存在误差,甚至出现一些严重的错误。从统计结果看,发生大误差的概率是相当高的,因此位置验证非常必要。利用射野影像系统可以测量误差;当发现误差超过预定的范围时,便可以采取相应的校正措施。在只有胶片的时代,因为拍片、洗片过程费时,进行位置验证的频度很低。Reistein在美国进行的一次调查结果显示,只有40%的医院能坚持每周为患者拍一次射野片[22]。当有了EPID以后,情况就完全不一样了,可以在每个分次治疗时验证患者体位。射野影像系统在位置验证方面的应用目前有治疗前校正射野、离线评价患者摆位、治疗间校正患者摆位、治疗前校正患者摆位这四种形式,将来还可能在治疗过程中实时校正患者摆位。
, 百拇医药
(1)治疗前校正射野
布野时可能发生挡块位置放错或拿错挡块之类的粗差。对于没有配备记录验证系统的加速器,还会发生诸如射野大小、准直器角度和楔形板大小、方向之类的机械运动参数误差。粗差会严重影响患者的治疗效果,甚至造成医疗事故,因此应及时发现及时校正。发现粗差最简单的方法是技术员在每次治疗开始时注意观察射野图像,如发现有错,则立即关机。第二种办法是每次治疗开始时预照数跳获得射野图像,在技术员确认射野正确时照射余下的机器跳数。第三种办法是利用一些EPID系统提供的自动登记射野的功能,当系统发现布野误差超过预设的限值时,自动关机[23]。
(2)离线评价患者摆位
如果将一个疗程中每个分次的射野图像以时间流逝序列(Time-lapse Sequence)的形式显示,就可以动态观察到射野和患者体位的逐日变化情况,因此它是一种回顾整个疗程摆位重复性的快速方法,可做为常规质量保证程序的一部分。对于患同一种肿瘤的患者群体,如果对其整个疗程所有射野图像进行回顾性分析,就可以了解患者群体摆位误差分布情况,为治疗计划设计提供PTV和CTV之间的间隙数据(Margin)[24,25]。
, 百拇医药
(3)治疗间校正患者摆位(Intertreatment Correction)
患者摆位误差无论是平移量、还是旋转量,均由系统误差和随机误差两项构成。系统误差用所有分次的摆位误差的平均值表示,随机误差用所有分次的摆位误差的标准差表示。在设计某个患者的治疗计划时,PTV和CTV之间的间隙是根据患者群体摆位误差分布情况确定的。但实际上由于个体之间的差异,每个患者实际需要的间隙是不一样的,针对这种情况,严蒂提出了自适应放疗的思想(Adaptive Radiation Therapy)[26]。
自疗程开始时起,每次放疗时获取射野图像,用离线方式测量每次的摆位误差。根据最初数次的测量结果预测整个疗程的系统误差和随机误差。在系统误差精度要求为±1 mm、随机误差精度要求为±0.5 mm、置信度大于95%的条件下,所需的测量次数最多不超过9次,具体次数可根据经验公式计算,其中σ是随机误差估计值。
, 百拇医药
如果在测量中发现误差有随时间变化的趋势,则在预测系统误差时要采用加权平均的办法。当预测的平移系统误差大于2 mm或旋转角度系统误差超过20时,调整准直器叶片位置或准直器旋转角度以校正之。如果计划时预留的间隙量不足以包括随机误差表示的患者位置变化,则适当加大射野。在一个包括20位患者的前瞻性临床研究中,有13位患者的射野因为校正系统误差而做了调正,平移系统误差从校正前的平均4 mm降至平均0.5 mm,而调正前后随机误差无显著差别[27]。
(4)治疗前校正患者摆位(Prement Correction)
在每次治疗开始时,预照数跳获得射野定位图像,并在线登记之。如果摆位正确,则继续余下的照射。如果发现患者摆位误差超过预定的限值,则校正患者体位,然后继续照射或重获定位图像。不少临床试验结果证明,治疗前校正可有效减少摆位误差,但治疗时间会延长。例如在De Neve组织的16位肺癌患者前后野照射的试验中,设置横向和纵向的平移误差限值为2 mm,超过限值时通过遥控床做校正。在全部196次照射中有120次误差超过限值,占总射野数的61%。经校正后,纵向误差从(0.1±4.5) mm降至(0.08±1.2) mm,横向误差从(-2.0±5.7) mm降至(-0.9±1.0) mm。每野治疗时间平均延长了2.5分钟,相当于增加了65%[28]。与治疗间校正方法相比,此方法不仅校正了患者摆位的系统误差,还可以校正在整个疗程中表现为随机误差、而在一个分次中表现为系统误差的成份。

, http://www.100md.com
图6 自动跟踪放疗流程图。C1 是判断条件"摆位误差可以接受吗?"。 C2 是判断条件"所需机器跳数是否已全部照射?"。
(5)治疗中校正患者摆位(Intratreatment Correction)
体位固定装置可以减少患者体位在治疗中的变化。对于头颈部肿瘤,靶区位置和体位可以认为是相对不变的,体位固定了也就保证了靶区位置的固定。对于胸腹部肿瘤,当体位固定后,靶区在体内仍存在一定范围的运动。这些运动主要是呼吸引起的,其它如胃肠蠕动、血液流动也会有影响。为减少因呼吸引起的靶区运动,最简单的办法是当照射时要求患者屏气,但因屏气能坚持的时间一般比照射时间短,在临床使用的效果不理想。Kubo建立一项名为呼吸选通放疗的技术(Respiration Gated Therapy),利用一个呼吸传感器监测患者呼吸[29]。当患者开始吸气时出束照射,一直持续到患者开始呼气时停止照射,直到下一次吸气开始时再恢复照射,如此可以保证在整个治疗过程中只有当靶区位于射野内时出束。目前还没有EPID在这方面应用的报道,究其原因有两个方面。其一是获取一幅射野图像一般需要3~5 s(不包括荧光型EPID),并且图像质量较差;其二是尚未研究成功一种实时准确的射野图像登记算法。不过,我们可以大胆地设想射线束与靶区的关系类似军事领域中的导弹与目标之间的关系,建立如图6所示的自动跟踪放疗技术,利用EPID监测靶区的位置变化,实时调整准直器叶片位置和准直器转角,确保射线束总是对准靶区照射。为实现这样一种放疗技术,必须保证从获取图像至完成登记的时间不超过1 s ,这有赖于 EPID和图像登记算法性能的巨大改进
, 百拇医药
参考文献:
1 J Anderws, R Swain, P Rubin. Continous visual monitoring of 2MEV Rorntgen therapy. Am J Roentgenol,1958,73:74-78.
2 S Benner, B Rosengren, H Wallman. Television monitoring of a 30MV X-ray beam. Phys Med Biol,1962,7:29-33.
3 N Baily, R Horn, T Kampp. Fluroscopic visualization of megavoltage therapeutic x-ray beams. Int J Radiat Oncol Biol,1980,6:935-939.
, 百拇医药 4 J Wong, E Slessinger, R Hermes. On-line radiotherapy imaging with an array of fiber-optic image reducers. Int J Radiat Oncol Biol Phys,1900,18:1477-1484.
5 K Lam, M Partowmah M and W Lam. An on-line electronic portal imaging system for external beam radiotherapy. Br J Radiol,1986,59:1007-1013.
6 L Antonuk, J Boudry, W Huang, et al. Demonstration of megavoltage an diagonostic x-ray imaging with hydrogenated amorphous silicon arrays. Med Phys, 1992, 19:1455-1466.
, 百拇医药
7 W Zhao and JA Rowlands. Digital radiology using active matirx readout of amorphous selenium: Theoretical analysis of detective quantum efficiency. Med Phys,1997, 24:1819-1833.
8 W Zhao and JA Rowlands. X-ray imaging using amorphousslenium: Feasibility of a flat panel self-scanned detector for digital radiology. Med Phys,1995, 22:1595-1604.
9 M van Herk and H Meertens. A matrix ionization chamber imaging device for on-line patient setup verification during radiotherapy. Radio Oncol,1988,11:369-378.
, 百拇医药
10 RM Harrison, and GD Lambert. A method and contrast-detail phantom for the quantitative assessment of radiotherapy portal imaging systems. Brit J Radio ,1994,67:384-388.
11 A Visser, H Huizena, V Althof, et al. Performance of a prototype fluoroscopic radiotherapy imaging system. Int J Radiat Oncol Biol Phys,1990,18:43-50.
12 E Morton, W Swindell, D Lewis, et al. A linear array, scintillation crystal-photodiode detector for megavoltage imaging. Med Phys,1991,18:681-691.
, http://www.100md.com
13 K Eilertsen, A Skretting and TL Tennvassas. Methods for fully automated verification of patient set-up in external beam radiotherapy with polygon shaped fields. Phys Med Biol, 1994,39:933-1012.
14 H Wong and B Fallone. A robust morphological algorithm for automatic radiation field extraction and correlation of portal images. Med Phys, 1994,21:237-244.
15 DS Fritsch, EL Chaney, A Boxwala, et al. Core-based portal image registration for automatic radiotherapy treatment verification. Int J Radiat Oncol Biol Phys 33:1287-1300.
, http://www.100md.com
16 WR Bosch, DA Low, RL Gerber, et al. The electronic viewbox: a software tool for radiation therapy treatment verification. Int J Radiat Oncol Biol Phys, 1995 31:135-142.
17 W De Neve, F Van den Heuvel, M Coghe, et al. Interactive use of on-line portal imaging in pelvic radiation. Int J Radiat Oncol Biol Phys, 1993, 25:517-524.
18 JM Balter, CA Pelizzari and GTY Chen. Correlation of projection radiographs in radiation therapy using open curve segments and points. Med Phys, 1992,19:329-334.
, 百拇医药
19 GX Ding, S Shalev and G Gluchev. A rho-theta technique for treatment verification in radiotherapy and its clinical applications. Med Phys, 1993 ,20:1135-1143.
20 DH Hristov and BG Fallone. A grey-level image alignment algorithm for registration of portal images and digital reconstructed radiographs. Med Phys , 1996,23:75-84.
21 L Dong and AL Boyer. An image correlation procedure for digitally reconstructed radiographs and electronic portal images. Int J Radiat Oncol Biol Phys, 1995, 33:1053-1060.
, 百拇医药
22 L Reistein, H Amols, P Biggs, et al. Radiotherapy portal imaging quality. American Institute of Physics, New York (AAPM Report No 24), 1987.
23 K Leszczynski, S Shalev. Verification of radiotherapy treatments: Computerized analysis of the size and shape of radiation fields.Med Phys,1993,20:687-694.
24 J Hanley, MA Lumley, GS Mageras, et al. Measurement of patient positioning errors in three-dimensional conformal radiotherapy of the prostate. Int J Radiat Oncol Biol Phys,1997,37:435-444.
, 百拇医药
25 MA Hunt, TE Schultheiss, GE Desobry, et al. An evaluation of setup uncertainties for patients treated to pelvic sites. Int J Radiat Oncol Biol Phys,1995,30:227-233.
26 D Yan, F Vicini, J Wong, et al. Adaptive radiation therapy. Phys Med Biol,1997,42:123-132.
27 D Yan, E Ziaja, D Jaffray, et al. The use of adaptive radiation therapy to reduce setup error: a prospective clinical study. Int J Radiat Oncol Biol Phys,1998,41:715-720.
, 百拇医药
28 JVD Steene, VD Heuvel F, A Bel, et al. Electronic portal imaging with on-line correction of setup error in thoracic irradiation: clinical evaluation. Int J Radiat Oncol Biol Phys, 1998,40:967-976.
29 HD Kubo and BC Hill. Respiration gated radiotherapy treatment: a technique study. Phys Med Biol,1996,41:83-91.
收稿日期:1998-12-08, http://www.100md.com