稳恒磁场对体外胚胎中脑神经元细胞分化影响的研究
作者:吴全义 端礼荣 杜玉珍 刘方平
单位:吴全义 刘方平 镇江医学院 物理学教研室;端礼荣 杜玉珍 卫生学毒理室,江苏 镇江 212001
关键词:稳恒磁场;抑制作用;神经细胞微团培养;细胞分化
中国医学物理学杂志990421 摘要: 本文利用大鼠胚胎中脑神经细胞作原代微团培养,培养物经不同强度(分别为5 mT,10 mT,20 mT,30 mT,40 mT,50 mT和60 mT)的稳恒磁场作用,研究其对细胞生长和分化的影响,并利用图像分析细胞形态的变化。结果表明:各种强度的稳恒磁场能明显地抑制中脑神经细胞的分化,集落形成率明显减少,且细胞表面的突起和集落间的神经纤维束减少。
中图分类号:Q64 文献标识码:A
文章编号:1005-202X(1999)04-0258-02
, 百拇医药
Experimental on influence of static magnetic field on culture of rat embryo midbrain cell
WU Quan-yi,et al.
(ZhenJiang Medical College, ZhenJiang JiangShu 212001,China)
Abstract: In virtue of cerebrum cell embyro in wistar rat as original micromass culture, We studied the effect of the static magnetic field (intensity is 5 mT,10 mT,20 mT,30 mT,40 mT,50 mT,60 mT respectively) on the midbrain cells. The result showed that the static magnetic field obviously inhibitory action to the cell differentiation of rat embryo midbrain, and decrease cerebrum fibre bind in nephrocytes, The more the static magnetic field intensity is, The less concentration rate the cell. The result also showed the link between the static magnetic field and dose-effect, It is possible that the static magnetic field resulted in the cell abnormality in ecogenesis.
, 百拇医药
Key words: static magnetic field; inhibitory action;effects of the cell abnormality in exoqenesis micromass culture; cell differentiation.
随着磁生物效应陆续地被发现、应用,人们在生活、工作中受到磁场作用的机会越来越多,磁场对生物和人体的影响日益受到人们的重视。近年来,关于磁场对生物体免疫功能,对氧自由基,过氧化氢酶,超氧化物歧化酶等研究报道很多[1,2],但对胚胎中脑神经细胞生长和分化的影响鲜为报道。为了进一步探讨稳恒磁场对中脑神经细胞生长和发育的影响,本研究采用了Flint对大鼠胚胎中脑神经细胞微团作为短期筛选试验的方法,以便为揭示稳恒磁场对中脑神经细胞的生物效应提供理论依据。
1 材料和方法
1.1 磁场条件
, http://www.100md.com
稳恒磁场由镇江金港磁性元件有限公司提供的(100 mm×100 mm)的铁氧体磁铁,经充磁后,用复写纸把24孔培养板的孔口印于与培养板面等大的白纸上,并将印有孔口的白纸贴于磁极表面,把各孔位加以编号,以便定位。用上海产CT-3特斯拉计测量覆盖有培养板盖板的单极表面各孔区域的磁场强度,精心选取强度为5 mT,10 mT,20 mT,30 mT,40 mT,50 mT和60 mT的圆孔区域各10个。
1.2 实验动物和试剂
采用纯系健康Wistar大白鼠(250 g),由本院动物中心提供,认雌雄2:1合笼过夜,次晨镜检精子,确定交配过的雌鼠在妊娠14天用颈椎脱位处死备用;胰蛋白酶(1:250)为进口分装,胎牛血清,F12 培养基为美国(Sigma公司产品),其它试剂均为市售分析纯。
1.3 胚胎中脑细胞培养物的制备[3,4]
, http://www.100md.com
处死后的孕鼠按常规方法消毒皮肤,在无菌条件下取出全部胚胎,放入无钙镁离子Hanks盐溶液中清洗2次后,取出胚胎,切下中脑组织,剪碎,经37℃F12 培养基清洗3次后,加入37℃1%胰蛋白酶(1:250)溶液适量,于20℃室温下静止消化15 min,弃去胰酶液,加入含15%胎牛血清的F12 培养液洗涤3次。经充分吹散形成细胞悬液,过滤再经离心(1000 r/min,3分钟),弃去上清液,制备成密度为5×106 个细胞/ml的单个细胞悬液,备用。
1.4 微团培养
取密度为5×106/ml的细胞悬液20 μl滴入24孔培养板,然后置二氧化碳培养箱中(5%CO2 ,95%,100%相对湿度)培养4小时贴壁后,每孔加2 ml培养基,然后随机取一培养板作为对照组,该组不加磁场,其余作为试验组,把培养板各孔与磁铁表面所取定的孔区对齐固定,每个不同磁场强度取10个平等样试验。同时置于同一CO2 培养箱内(放时互相分开避免影响)继续培养5天后取出,经10%甲醛固定30 min后,用苏木精染成深紫色,在显微镜下或摄成照片,计数深染的集落数,确定50%分化抑制浓度(ICD)。
, http://www.100md.com
2 结果
2.1 稳恒磁场强度对细胞存活率的影响
由表1可见,经方差分析强度为20 mT以上各试验组与对照组及各试验组间有显著性差异(P<0.01),随着稳恒磁场强度的增高,细胞生长发育受抑制越明显,呈现较明显的强度效应关系。可见表1,图1所示。
表1:稳恒磁场强度对中脑神经细胞存活率的影响 磁场(mT)
例数(n)
集落数(x±s)
集落形成率%
0
10
132±24.0
, 百拇医药
100
5
10
120±7.9
91
10
10
82±4.6
62
20
10
49±3.7
31*
, 百拇医药
30
10
43±3.5
33*
40
10
39±9.4
30*
50
10
29±3.3
22*
60
, http://www.100md.com
10
27±6.1
20*
注:方差分析*的各组与对照组间及各试验组间有统计学差异(P<0.01)
图1 中脑神经细胞集落数磁场强度的效应曲线
2.2 稳恒磁场对细胞集落形成和细胞形态的影响
结果显示,实验用各种强度的稳恒磁场对大鼠中脑神经细胞分化和对照组比较均有明显的抑制作用,在20~60 mT范围内实验组与对照组差别显著(P<0.01),强度越高,集落形成率降低越多。正常空白对照的中脑神经细胞在培养5天后,分化形成明显的细胞集落,并且集落间有丰富的神经纤维呈网络状(图2),经在稳恒磁场作用下培养5天后的细胞集落数减少,细胞间神经纤维减少(图3)。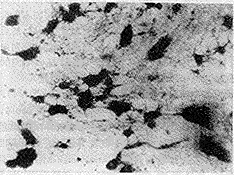
, 百拇医药
图2 空白对照,示集落和神经纤维网络状(×10)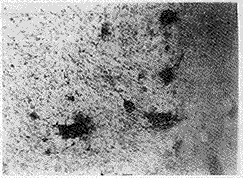
图3 加60 mT磁场强度作用对微团形成的影响(×10)
3 讨论
细胞分化是发育过程中重要的细胞行为,受到外界的物理和化学因素的影响,也会导致细胞发育异常[4]在细胞的形成上不能形成明显的神经细胞集落,细胞集落数明显减少甚至死亡。实验结果显示,用各种不同强度的稳恒磁场作用在胚胎中脑神经细胞,其集落形成率较对照组明显减少,且磁场强度不同,其影响效果也明显不同,磁场作为一种物理因子,它对生物体的作用机制是复杂的,目前关于磁场生物效应的微观机理尚不十分清楚,但我们认为生命现象,神经传导细胞膜的离子选择通透性,与带电物质的迁移运动密切相关的,而磁场对运动过程中的带电物质有洛伦兹力的作用,从而影响带电物质的过程,产生一些生物效应。以及磁场作为应激反应因子作用于细胞,可引起一系列的反应,动物实验研究表明,电磁场暴露引起仔代发育异常,孕妇长期直接或间接地接触电磁场也可对人体胎儿发育造成不良的影响[5]。
, 百拇医药
照片显示经磁场作用的中脑神经细胞,集落数减少,细胞间神经纤维减少,表明它参与调控细胞的生长、分化、增殖。且对中脑神经细胞的分化有抑制作用,其机理可能与磁场作用后改变细胞突触前膜Ca2+ 通道功能,影响对Ca2+ 通道蛋白质的活性,影响乙酰胆碱的释放[6]。影响DNA中氢键变化,影响H+ 离子的隧道效应,影响酶的活性和代谢过程[7],从而抑制神经细胞的分化,本研究结果提示:磁场对胚胎离体中脑细胞的发育有不良影响。对整体动物胚胎神经系统的影响,尚有待于人们进一步的探讨和研究。
参考文献:
1 赵福弟,等.磁场对AMI大鼠血SOD活性及心肌ATP含量变化的影响[J].中国医学物理学杂志,1998,15(1):26.
2 张均一,等.磁场对小鼠自由基代谢的影响[J].中华医疗杂志,1993,16:205.
, 百拇医药
3 Flint OP.An In Vitro tests for teratogens:Desirable end Points,test batteries,and current status of the micromass teratoger test[J].Reproduce Toxicol,1993,7:103.
4 端礼荣,等.醋酸铅的体外发育毒性研究[J].职业医学,1998,25(5):17.
5 Werthemer N,leeper E.possible effectric blankets and heated waterbeds on fetal development[J],Bioelectromagnetics, 1986,7:13-22.
6 丁立新,等.磁场对神经元效应研究进展.[J]中华理疗,1996,2(19)1:49-54.
7 李国栋.生物磁学及其应用[M].北京科学出版社,1983,129-135.
收稿日期:1998-12-30, http://www.100md.com
单位:吴全义 刘方平 镇江医学院 物理学教研室;端礼荣 杜玉珍 卫生学毒理室,江苏 镇江 212001
关键词:稳恒磁场;抑制作用;神经细胞微团培养;细胞分化
中国医学物理学杂志990421 摘要: 本文利用大鼠胚胎中脑神经细胞作原代微团培养,培养物经不同强度(分别为5 mT,10 mT,20 mT,30 mT,40 mT,50 mT和60 mT)的稳恒磁场作用,研究其对细胞生长和分化的影响,并利用图像分析细胞形态的变化。结果表明:各种强度的稳恒磁场能明显地抑制中脑神经细胞的分化,集落形成率明显减少,且细胞表面的突起和集落间的神经纤维束减少。
中图分类号:Q64 文献标识码:A
文章编号:1005-202X(1999)04-0258-02
, 百拇医药
Experimental on influence of static magnetic field on culture of rat embryo midbrain cell
WU Quan-yi,et al.
(ZhenJiang Medical College, ZhenJiang JiangShu 212001,China)
Abstract: In virtue of cerebrum cell embyro in wistar rat as original micromass culture, We studied the effect of the static magnetic field (intensity is 5 mT,10 mT,20 mT,30 mT,40 mT,50 mT,60 mT respectively) on the midbrain cells. The result showed that the static magnetic field obviously inhibitory action to the cell differentiation of rat embryo midbrain, and decrease cerebrum fibre bind in nephrocytes, The more the static magnetic field intensity is, The less concentration rate the cell. The result also showed the link between the static magnetic field and dose-effect, It is possible that the static magnetic field resulted in the cell abnormality in ecogenesis.
, 百拇医药
Key words: static magnetic field; inhibitory action;effects of the cell abnormality in exoqenesis micromass culture; cell differentiation.
随着磁生物效应陆续地被发现、应用,人们在生活、工作中受到磁场作用的机会越来越多,磁场对生物和人体的影响日益受到人们的重视。近年来,关于磁场对生物体免疫功能,对氧自由基,过氧化氢酶,超氧化物歧化酶等研究报道很多[1,2],但对胚胎中脑神经细胞生长和分化的影响鲜为报道。为了进一步探讨稳恒磁场对中脑神经细胞生长和发育的影响,本研究采用了Flint对大鼠胚胎中脑神经细胞微团作为短期筛选试验的方法,以便为揭示稳恒磁场对中脑神经细胞的生物效应提供理论依据。
1 材料和方法
1.1 磁场条件
, http://www.100md.com
稳恒磁场由镇江金港磁性元件有限公司提供的(100 mm×100 mm)的铁氧体磁铁,经充磁后,用复写纸把24孔培养板的孔口印于与培养板面等大的白纸上,并将印有孔口的白纸贴于磁极表面,把各孔位加以编号,以便定位。用上海产CT-3特斯拉计测量覆盖有培养板盖板的单极表面各孔区域的磁场强度,精心选取强度为5 mT,10 mT,20 mT,30 mT,40 mT,50 mT和60 mT的圆孔区域各10个。
1.2 实验动物和试剂
采用纯系健康Wistar大白鼠(250 g),由本院动物中心提供,认雌雄2:1合笼过夜,次晨镜检精子,确定交配过的雌鼠在妊娠14天用颈椎脱位处死备用;胰蛋白酶(1:250)为进口分装,胎牛血清,F12 培养基为美国(Sigma公司产品),其它试剂均为市售分析纯。
1.3 胚胎中脑细胞培养物的制备[3,4]
, http://www.100md.com
处死后的孕鼠按常规方法消毒皮肤,在无菌条件下取出全部胚胎,放入无钙镁离子Hanks盐溶液中清洗2次后,取出胚胎,切下中脑组织,剪碎,经37℃F12 培养基清洗3次后,加入37℃1%胰蛋白酶(1:250)溶液适量,于20℃室温下静止消化15 min,弃去胰酶液,加入含15%胎牛血清的F12 培养液洗涤3次。经充分吹散形成细胞悬液,过滤再经离心(1000 r/min,3分钟),弃去上清液,制备成密度为5×106 个细胞/ml的单个细胞悬液,备用。
1.4 微团培养
取密度为5×106/ml的细胞悬液20 μl滴入24孔培养板,然后置二氧化碳培养箱中(5%CO2 ,95%,100%相对湿度)培养4小时贴壁后,每孔加2 ml培养基,然后随机取一培养板作为对照组,该组不加磁场,其余作为试验组,把培养板各孔与磁铁表面所取定的孔区对齐固定,每个不同磁场强度取10个平等样试验。同时置于同一CO2 培养箱内(放时互相分开避免影响)继续培养5天后取出,经10%甲醛固定30 min后,用苏木精染成深紫色,在显微镜下或摄成照片,计数深染的集落数,确定50%分化抑制浓度(ICD)。
, http://www.100md.com
2 结果
2.1 稳恒磁场强度对细胞存活率的影响
由表1可见,经方差分析强度为20 mT以上各试验组与对照组及各试验组间有显著性差异(P<0.01),随着稳恒磁场强度的增高,细胞生长发育受抑制越明显,呈现较明显的强度效应关系。可见表1,图1所示。
表1:稳恒磁场强度对中脑神经细胞存活率的影响 磁场(mT)
例数(n)
集落数(x±s)
集落形成率%
0
10
132±24.0
, 百拇医药
100
5
10
120±7.9
91
10
10
82±4.6
62
20
10
49±3.7
31*
, 百拇医药
30
10
43±3.5
33*
40
10
39±9.4
30*
50
10
29±3.3
22*
60
, http://www.100md.com
10
27±6.1
20*
注:方差分析*的各组与对照组间及各试验组间有统计学差异(P<0.01)

图1 中脑神经细胞集落数磁场强度的效应曲线
2.2 稳恒磁场对细胞集落形成和细胞形态的影响
结果显示,实验用各种强度的稳恒磁场对大鼠中脑神经细胞分化和对照组比较均有明显的抑制作用,在20~60 mT范围内实验组与对照组差别显著(P<0.01),强度越高,集落形成率降低越多。正常空白对照的中脑神经细胞在培养5天后,分化形成明显的细胞集落,并且集落间有丰富的神经纤维呈网络状(图2),经在稳恒磁场作用下培养5天后的细胞集落数减少,细胞间神经纤维减少(图3)。

, 百拇医药
图2 空白对照,示集落和神经纤维网络状(×10)

图3 加60 mT磁场强度作用对微团形成的影响(×10)
3 讨论
细胞分化是发育过程中重要的细胞行为,受到外界的物理和化学因素的影响,也会导致细胞发育异常[4]在细胞的形成上不能形成明显的神经细胞集落,细胞集落数明显减少甚至死亡。实验结果显示,用各种不同强度的稳恒磁场作用在胚胎中脑神经细胞,其集落形成率较对照组明显减少,且磁场强度不同,其影响效果也明显不同,磁场作为一种物理因子,它对生物体的作用机制是复杂的,目前关于磁场生物效应的微观机理尚不十分清楚,但我们认为生命现象,神经传导细胞膜的离子选择通透性,与带电物质的迁移运动密切相关的,而磁场对运动过程中的带电物质有洛伦兹力的作用,从而影响带电物质的过程,产生一些生物效应。以及磁场作为应激反应因子作用于细胞,可引起一系列的反应,动物实验研究表明,电磁场暴露引起仔代发育异常,孕妇长期直接或间接地接触电磁场也可对人体胎儿发育造成不良的影响[5]。
, 百拇医药
照片显示经磁场作用的中脑神经细胞,集落数减少,细胞间神经纤维减少,表明它参与调控细胞的生长、分化、增殖。且对中脑神经细胞的分化有抑制作用,其机理可能与磁场作用后改变细胞突触前膜Ca2+ 通道功能,影响对Ca2+ 通道蛋白质的活性,影响乙酰胆碱的释放[6]。影响DNA中氢键变化,影响H+ 离子的隧道效应,影响酶的活性和代谢过程[7],从而抑制神经细胞的分化,本研究结果提示:磁场对胚胎离体中脑细胞的发育有不良影响。对整体动物胚胎神经系统的影响,尚有待于人们进一步的探讨和研究。
参考文献:
1 赵福弟,等.磁场对AMI大鼠血SOD活性及心肌ATP含量变化的影响[J].中国医学物理学杂志,1998,15(1):26.
2 张均一,等.磁场对小鼠自由基代谢的影响[J].中华医疗杂志,1993,16:205.
, 百拇医药
3 Flint OP.An In Vitro tests for teratogens:Desirable end Points,test batteries,and current status of the micromass teratoger test[J].Reproduce Toxicol,1993,7:103.
4 端礼荣,等.醋酸铅的体外发育毒性研究[J].职业医学,1998,25(5):17.
5 Werthemer N,leeper E.possible effectric blankets and heated waterbeds on fetal development[J],Bioelectromagnetics, 1986,7:13-22.
6 丁立新,等.磁场对神经元效应研究进展.[J]中华理疗,1996,2(19)1:49-54.
7 李国栋.生物磁学及其应用[M].北京科学出版社,1983,129-135.
收稿日期:1998-12-30, http://www.100md.com