PCR产物快速克隆测序
作者:崔天盆 周新
单位:崔天盆(同济医科大学附属协和医院检验科,武汉430022),周新(湖北医科大学检验系)
关键词:载脂蛋白E;基因克隆;DNA测序;T载体
临床检验杂志990410 摘要 采用自制T载体,快速克隆apo E外显子4基因PCR扩增产物,经双脱氧末端终止法测序证明为ε3等位基因。该方法快速、价廉,在基因诊断中便于推广。
Cloning of PCR products of apolipoprotein E utilizing the T-vectors
CUI Tianpen,ZHOU Xin,(Laboratory Department,Union Hospital,Tongji Medical University,Wuhan 430022)
, http://www.100md.com
Abstract To establish a rapid,simple and practical method for cloning polymerase chain reaction (PCR)products.Apolipoprotein E(apoE)exon 4 was amplified by using PCR.The PCR products was cloned into a plasmid T-vector.The recobinant pUC-apoE is ε3 allele used sequecing.T-vector cloning is considered a rapid,practical and inexpensive technique for cloning PCR products.
Key words apolipoprotein E; T-vector; DNA sequence
随着分子生物学的发展和人类基因组计划的顺利实施,基因诊断已逐渐进入临床实验室,成为临床检验的常规项目。基因诊断常用的有聚合酶链反应(PCR),单链构象多态性分析(SSCP),变性梯度凝胶电泳(DGGE),限制性酶切多态性分析(RFLP),核酸杂交和DNA测序等技术,其中DNA测序是基因诊断的金标准[1]。PCR是一种模拟天然复制过程的体外基因扩增技术,由于操作简便迅速,已成基因诊断中的重要手段,不足的是PCR产物难以克隆,其原因是Taq DNA聚合酶能在扩增 产物的3′端加上一个非配对碱基,且90%以上是dA[2]。分子生物学常在PCR引物5′末端设计酶切位点,双酶切后克隆,而我们在临床实验室做基因诊断实验如SSCP及DGGE中发现异常带,此时来不及设计酶切位点,费用也较高,此时我们构建T载体,它可直接克隆未加任何修饰的PCR产物。下面以载脂蛋白E(apo E)PCR产物为例介绍T载体克隆法。
, 百拇医药
1 材料与方法
1.1 器材
1.1.1 仪器 PE2400型PCR扩增仪,恒温摇床,冷冻恒温循环仪,台式高速冷冻离心机,ABI PRISMTM310基因分析仪。
1.1.2 化学试剂 TE饱和酚,氯仿/异戊醇,无水乙醇,70%乙醇,3 mol/L NaAc(pH 5.0),碱裂解法提取质粒的溶液Ⅰ、Ⅱ、Ⅲ,5×TBE,CaCl2,DNA加样缓冲液(含0.25 g/dl溴酚蓝,0.25 g/dl二甲苯青FF,30%甘油)。均用分析纯试剂配制。基因克隆宿主菌E.coli JM101,其基因型为:supE thiΔ(lac-proAB)F′[traD 36 proAB+lacq lacZ ΔM15],可支持带有琥珀突变的载体生长的宿主菌。JM101为湖北医科大学病毒所伍欣星教授惠赠。
, 百拇医药
1.1.3 细菌培养用品 胰蛋白胨、酵母提取物为Oxiod公司产品,IPTG和X-gal为Promega公司产品。
1.1.4 基因克隆用酶和载体 Klenow、EcoR I、BamH I、pUC18为华美生物工程公司产品,RNase A,Sma I,T4噬菌体DNA连接酶为Promega公司产品。
1.2 方法
1.2.1 模板制备及PCR扩增 采用经典酚抽提法从人静脉血有核细胞中提取基因组DNA,参照Richard等[3]合成一对引物P1、P2用来扩增载脂蛋白E外显子4基因。
P1:5′-AA CAA CTG ACC CCG GTG GCG G-3′
P2:5′-GAT GGC GCT GAG GCC GCG CTC-3′
, 百拇医药
该区基因含apoE 112和158位氨基酸对应的核苷酸序列。扩增方法见文献[3,5],扩增片段长292 bp。
1.2.2 T载体的构建 取质粒pUC18 DNA 1 μg,用Sma Ⅰ酶切消化产生平端。酚抽提,无水乙醇沉淀,用10 μl双蒸水溶解,加入2 μl 10×DNA聚合酶缓冲液,2 μl 10 mmol/L dTTP,灭菌双蒸水6 μl,最后加入Taq DNA聚合酶1 U,72°C 2小时。在反应缺乏其它三种核苷酸时,Taq DNA聚合酶能在每个载体片段的3′末端加上一个dT;经酚抽提和乙醇沉淀后,T载体的构建就完成了。
1.2.3 T载体与apo E PCR产物连接 纯化T载体0.4 μg,PCR产物0.125 μg,混匀用无水乙醇沉淀,待乙醇挥发后,加8 μl水溶解,10×连接缓冲液1 μl,T4噬菌体DNA连接酶1 μl(3 U),混匀,离心,15°C过夜。
, http://www.100md.com
1.2.4 重组质粒转化感受态细胞[4] 取30 μg重组质粒转化JM101感受态细胞。
1.2.5 重组质粒pUC-apo E的筛选与鉴定 重组质粒转化感受态细胞涂布于含amp,X-gal和IPTG的LB平板上,37°C培养过夜后,生成蓝色和白色菌落,其中白色菌落可能含重组质粒pUC-apoE。挑选白色菌落扩大培养后,用碱裂解法提取质粒。
双酶切鉴定 用BamH I和EcoR I对可能重组质粒进行双酶切鉴定。在PCR产物(292 bp)稍后可见阳性片段为重组成功的pUC-apoE上切下的apoE基因。
1.2.6 DNA序列测定 双酶切鉴定阳性重组子,扩大培养后,大量制备质粒,用P1为引物,在PE公司ABI PRISMTM全自动基因分析仪上测序。
1.2.7 apoE PCR产物平末端连接及克隆[4] apoE PCR产物经割胶纯化,乙醇沉淀,干后溶于0.1×TE 10 μl,用大肠杆菌DNA聚合酶Klenow片段将DNA末端切平。载体pUC 18用Sma Ⅰ切平。最后用T4 DNA连接酶将上述PCR产物与载体连接,转化并筛选鉴定重组质粒。
, http://www.100md.com
2 结果
2.1 两种克隆方法克隆效率比较 表1可看出T-A互补克隆法的克隆效率明显高于平末端连接克隆法。T-A互补法实际上是一种粘性末端连接法,且不需Klenow酶。
表1 两种PCR产物处理方法克隆效率的比较
Table 1 Transformfation efficiency for two metheds of PCR products ligation Ligation method
Blunt end ligation
T-vector ligation
Transformation efficiency
, 百拇医药
(recombinant/μg DNA)
8×105
2.2×107
2.2 筛选鉴定 质粒DNA凝胶电泳分析。挑取白色菌落扩大培养后,小量碱裂解法制备质料DNA,1 g/dl琼脂糖凝胶电泳。结果可见阳性重组子稍落后于pUC 18质粒,见图1。单酶切鉴定,pUC 18和pUC-apoE重组质粒分别用BamH Ⅰ酶切,可见线化重组质粒稍落后于线化pUC18质粒,见图1。双酶切鉴定,重组pUC-apoE用BamH Ⅰ和EcoR Ⅰ双酶切后,apoE片段带有pUC18多克隆位点上的21个核苷酸和两个dT,故为315 bp,稍落后于apoE PCR产物(292 bp)见图1。
2.3 DNA序列测定 pUC-apoE用引物P1,在AB1 310 PRIMTM全自动测序仪上,用双脱氧终止法进行测序,结果见图2,该重组子克隆了apoE ε3单倍体,即112位氨基酸对应密码子为TGC,而158位氨基酸对应密码CGC,见序列图中划线碱基。
, http://www.100md.com
Figure 1 Restriction endonuclease analysis on pUC-apoE
图1 pUC-apoE的限制性酶切鉴定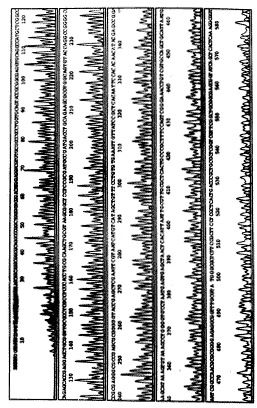
Figure 2 Scheme of DNA sequencing on pUC-apoE
图2 pUC-apoE测序结果
3 讨论
本文以apoE外显子4片段的T载体克隆法为例,该方法同样适合临床检验中其它PCR产物的克隆。对病原体进行基因检测,有时需测序后予以确认,此时可用T载体克隆;用SSCP或DGGE检出可能的原癌基因、抑癌基因或体内其它基因的突变或多态性,同样可用T载体克隆后进行测序。
, http://www.100md.com
PCR产物克隆方法很多,与基因诊断有关的方法主要有粘性末端连接克隆法,平末端连接克隆法,T-A互补克隆法等。粘性末端连接法需事先在两引物5′端设计酶切位点和保护碱基,这样会增加费用,也费时,但粘性末端法克隆效率高,且可定向克隆,在分子生物学中较常用。平末端连接法克隆效率低,筛选也较费时。本研究表明,T-A互补法克隆效率明显高于平端连接法,与经典粘性末端连接法克隆效率相近,T载体制备简单,试剂易得。用自制T载体的T-A互补法克隆简便,快速,省钱。也可从一些生物工程公司购买T载体,如Invitrogen公司的PCRTMⅡ和Promega公司的pGEM-T载体,使用方便、快速。也有些作者介绍PCR产物直接测序的方法,但因PCR产物的非均一性,测序结果不很理想。如T载体克隆法广泛用于临床基因诊断,必将促进其发展。
参考文献
1 马立人,王全立主编.基因诊断研究新进展.北京:新时代出版社,1997
, 百拇医药
2 White BA.PCR Cloning Protocols.New Jersey:Humana Press,1997,61~110
3 Richard P,Thomas G,de Iuluets MP,et al. Common and rare genotypes of human apolipoprotein E determined by specific restriction profiles of polymerase chain reaction-amplififed DNA,Clin Chem,1994,40:24~29
4 金冬雁,黎孟枫译.分子克隆实验指南,第二版.北京:科学出版社,1992
5 周新.动脉粥样硬化与生物化学检验.武汉:湖北科技出版社,1997,54~55
(1998-09-07收稿,1999-01-18修回), 百拇医药
单位:崔天盆(同济医科大学附属协和医院检验科,武汉430022),周新(湖北医科大学检验系)
关键词:载脂蛋白E;基因克隆;DNA测序;T载体
临床检验杂志990410 摘要 采用自制T载体,快速克隆apo E外显子4基因PCR扩增产物,经双脱氧末端终止法测序证明为ε3等位基因。该方法快速、价廉,在基因诊断中便于推广。
Cloning of PCR products of apolipoprotein E utilizing the T-vectors
CUI Tianpen,ZHOU Xin,(Laboratory Department,Union Hospital,Tongji Medical University,Wuhan 430022)
, http://www.100md.com
Abstract To establish a rapid,simple and practical method for cloning polymerase chain reaction (PCR)products.Apolipoprotein E(apoE)exon 4 was amplified by using PCR.The PCR products was cloned into a plasmid T-vector.The recobinant pUC-apoE is ε3 allele used sequecing.T-vector cloning is considered a rapid,practical and inexpensive technique for cloning PCR products.
Key words apolipoprotein E; T-vector; DNA sequence
随着分子生物学的发展和人类基因组计划的顺利实施,基因诊断已逐渐进入临床实验室,成为临床检验的常规项目。基因诊断常用的有聚合酶链反应(PCR),单链构象多态性分析(SSCP),变性梯度凝胶电泳(DGGE),限制性酶切多态性分析(RFLP),核酸杂交和DNA测序等技术,其中DNA测序是基因诊断的金标准[1]。PCR是一种模拟天然复制过程的体外基因扩增技术,由于操作简便迅速,已成基因诊断中的重要手段,不足的是PCR产物难以克隆,其原因是Taq DNA聚合酶能在扩增 产物的3′端加上一个非配对碱基,且90%以上是dA[2]。分子生物学常在PCR引物5′末端设计酶切位点,双酶切后克隆,而我们在临床实验室做基因诊断实验如SSCP及DGGE中发现异常带,此时来不及设计酶切位点,费用也较高,此时我们构建T载体,它可直接克隆未加任何修饰的PCR产物。下面以载脂蛋白E(apo E)PCR产物为例介绍T载体克隆法。
, 百拇医药
1 材料与方法
1.1 器材
1.1.1 仪器 PE2400型PCR扩增仪,恒温摇床,冷冻恒温循环仪,台式高速冷冻离心机,ABI PRISMTM310基因分析仪。
1.1.2 化学试剂 TE饱和酚,氯仿/异戊醇,无水乙醇,70%乙醇,3 mol/L NaAc(pH 5.0),碱裂解法提取质粒的溶液Ⅰ、Ⅱ、Ⅲ,5×TBE,CaCl2,DNA加样缓冲液(含0.25 g/dl溴酚蓝,0.25 g/dl二甲苯青FF,30%甘油)。均用分析纯试剂配制。基因克隆宿主菌E.coli JM101,其基因型为:supE thiΔ(lac-proAB)F′[traD 36 proAB+lacq lacZ ΔM15],可支持带有琥珀突变的载体生长的宿主菌。JM101为湖北医科大学病毒所伍欣星教授惠赠。
, 百拇医药
1.1.3 细菌培养用品 胰蛋白胨、酵母提取物为Oxiod公司产品,IPTG和X-gal为Promega公司产品。
1.1.4 基因克隆用酶和载体 Klenow、EcoR I、BamH I、pUC18为华美生物工程公司产品,RNase A,Sma I,T4噬菌体DNA连接酶为Promega公司产品。
1.2 方法
1.2.1 模板制备及PCR扩增 采用经典酚抽提法从人静脉血有核细胞中提取基因组DNA,参照Richard等[3]合成一对引物P1、P2用来扩增载脂蛋白E外显子4基因。
P1:5′-AA CAA CTG ACC CCG GTG GCG G-3′
P2:5′-GAT GGC GCT GAG GCC GCG CTC-3′
, 百拇医药
该区基因含apoE 112和158位氨基酸对应的核苷酸序列。扩增方法见文献[3,5],扩增片段长292 bp。
1.2.2 T载体的构建 取质粒pUC18 DNA 1 μg,用Sma Ⅰ酶切消化产生平端。酚抽提,无水乙醇沉淀,用10 μl双蒸水溶解,加入2 μl 10×DNA聚合酶缓冲液,2 μl 10 mmol/L dTTP,灭菌双蒸水6 μl,最后加入Taq DNA聚合酶1 U,72°C 2小时。在反应缺乏其它三种核苷酸时,Taq DNA聚合酶能在每个载体片段的3′末端加上一个dT;经酚抽提和乙醇沉淀后,T载体的构建就完成了。
1.2.3 T载体与apo E PCR产物连接 纯化T载体0.4 μg,PCR产物0.125 μg,混匀用无水乙醇沉淀,待乙醇挥发后,加8 μl水溶解,10×连接缓冲液1 μl,T4噬菌体DNA连接酶1 μl(3 U),混匀,离心,15°C过夜。
, http://www.100md.com
1.2.4 重组质粒转化感受态细胞[4] 取30 μg重组质粒转化JM101感受态细胞。
1.2.5 重组质粒pUC-apo E的筛选与鉴定 重组质粒转化感受态细胞涂布于含amp,X-gal和IPTG的LB平板上,37°C培养过夜后,生成蓝色和白色菌落,其中白色菌落可能含重组质粒pUC-apoE。挑选白色菌落扩大培养后,用碱裂解法提取质粒。
双酶切鉴定 用BamH I和EcoR I对可能重组质粒进行双酶切鉴定。在PCR产物(292 bp)稍后可见阳性片段为重组成功的pUC-apoE上切下的apoE基因。
1.2.6 DNA序列测定 双酶切鉴定阳性重组子,扩大培养后,大量制备质粒,用P1为引物,在PE公司ABI PRISMTM全自动基因分析仪上测序。
1.2.7 apoE PCR产物平末端连接及克隆[4] apoE PCR产物经割胶纯化,乙醇沉淀,干后溶于0.1×TE 10 μl,用大肠杆菌DNA聚合酶Klenow片段将DNA末端切平。载体pUC 18用Sma Ⅰ切平。最后用T4 DNA连接酶将上述PCR产物与载体连接,转化并筛选鉴定重组质粒。
, http://www.100md.com
2 结果
2.1 两种克隆方法克隆效率比较 表1可看出T-A互补克隆法的克隆效率明显高于平末端连接克隆法。T-A互补法实际上是一种粘性末端连接法,且不需Klenow酶。
表1 两种PCR产物处理方法克隆效率的比较
Table 1 Transformfation efficiency for two metheds of PCR products ligation Ligation method
Blunt end ligation
T-vector ligation
Transformation efficiency
, 百拇医药
(recombinant/μg DNA)
8×105
2.2×107
2.2 筛选鉴定 质粒DNA凝胶电泳分析。挑取白色菌落扩大培养后,小量碱裂解法制备质料DNA,1 g/dl琼脂糖凝胶电泳。结果可见阳性重组子稍落后于pUC 18质粒,见图1。单酶切鉴定,pUC 18和pUC-apoE重组质粒分别用BamH Ⅰ酶切,可见线化重组质粒稍落后于线化pUC18质粒,见图1。双酶切鉴定,重组pUC-apoE用BamH Ⅰ和EcoR Ⅰ双酶切后,apoE片段带有pUC18多克隆位点上的21个核苷酸和两个dT,故为315 bp,稍落后于apoE PCR产物(292 bp)见图1。
2.3 DNA序列测定 pUC-apoE用引物P1,在AB1 310 PRIMTM全自动测序仪上,用双脱氧终止法进行测序,结果见图2,该重组子克隆了apoE ε3单倍体,即112位氨基酸对应密码子为TGC,而158位氨基酸对应密码CGC,见序列图中划线碱基。

, http://www.100md.com
Figure 1 Restriction endonuclease analysis on pUC-apoE
图1 pUC-apoE的限制性酶切鉴定

Figure 2 Scheme of DNA sequencing on pUC-apoE
图2 pUC-apoE测序结果
3 讨论
本文以apoE外显子4片段的T载体克隆法为例,该方法同样适合临床检验中其它PCR产物的克隆。对病原体进行基因检测,有时需测序后予以确认,此时可用T载体克隆;用SSCP或DGGE检出可能的原癌基因、抑癌基因或体内其它基因的突变或多态性,同样可用T载体克隆后进行测序。
, http://www.100md.com
PCR产物克隆方法很多,与基因诊断有关的方法主要有粘性末端连接克隆法,平末端连接克隆法,T-A互补克隆法等。粘性末端连接法需事先在两引物5′端设计酶切位点和保护碱基,这样会增加费用,也费时,但粘性末端法克隆效率高,且可定向克隆,在分子生物学中较常用。平末端连接法克隆效率低,筛选也较费时。本研究表明,T-A互补法克隆效率明显高于平端连接法,与经典粘性末端连接法克隆效率相近,T载体制备简单,试剂易得。用自制T载体的T-A互补法克隆简便,快速,省钱。也可从一些生物工程公司购买T载体,如Invitrogen公司的PCRTMⅡ和Promega公司的pGEM-T载体,使用方便、快速。也有些作者介绍PCR产物直接测序的方法,但因PCR产物的非均一性,测序结果不很理想。如T载体克隆法广泛用于临床基因诊断,必将促进其发展。
参考文献
1 马立人,王全立主编.基因诊断研究新进展.北京:新时代出版社,1997
, 百拇医药
2 White BA.PCR Cloning Protocols.New Jersey:Humana Press,1997,61~110
3 Richard P,Thomas G,de Iuluets MP,et al. Common and rare genotypes of human apolipoprotein E determined by specific restriction profiles of polymerase chain reaction-amplififed DNA,Clin Chem,1994,40:24~29
4 金冬雁,黎孟枫译.分子克隆实验指南,第二版.北京:科学出版社,1992
5 周新.动脉粥样硬化与生物化学检验.武汉:湖北科技出版社,1997,54~55
(1998-09-07收稿,1999-01-18修回), 百拇医药