大鼠正畸牙移动过程中牙周组织内转化生长因子β1的变化
作者:汪玲丽 朱虹 梁傥
单位:130041 长春,白求恩医科大学口腔医学院
关键词:转化生长因子β1;免疫组织化学;牙移动;较小
New Page 2 【摘要】 目的 了解大鼠正畸牙移动过程中转化生长因子β1(transforming growth factorβ1, TGF-β1)在牙周组织内的变化,探讨TGF-β1在正畸牙移动过程中的作用。方法 对大鼠正畸牙移动不同阶段的牙及牙周组织联合切片,进行免疫组织化学研究。结果 正畸牙移动过程中,牙周膜内TGF-β1表达增加。加力第5~10天,张力区TGF-β1表达增加的幅度明显大于压力区。结论 TGF-β1在正畸牙移动的牙周组织改建中起重要作用,尤其对成骨具有较强的促进作用。
, http://www.100md.com
The changes of transforming growth factor beta 1 in periodontal tissue during orthodontic tooth movement
WANG Lingli, ZHU Hong, LIANG Tang. School of Stomatology, Bethune University of Medical Science,Changchun 130041
【Abstract】 Objective To observe the distribution and change of transforming growth factor beta 1 (TGF-β1) in periodontal tissue and understand the role of TGF-β1 in orthodontic tooth movement. Methods Apply force on right maxillary first molars in rats, and examine the decalcified alveolodental connected tissue in different stage of tooth movement with immunohistochemical staining technique (SP method). Results TGF-β1 exists in normal periodontal tissue. The expression of it in periodontium increases during orthodontic tooth movement. Especially from 5 to 10 days after force application, the expression at tension side is much more than those at pressure side. Conclusion TGF-β1 plays an important role in remodeling of periodontal tissue during orthodontic tooth movement, and can powerfully promote bone formation.
, 百拇医药
【Key words】 Transforming growth factor beta 1 Immunohistochemistry Tooth movement,minor
正畸牙移动过程的实质,是牙及牙周组织的改建过程。其中,尤以骨组织的改建最为重要。大量研究证实,PGE、IL-1、IL-6、TNF-α、EGF等细胞因子均可促进骨吸收,加快牙齿移动[1]。但是,骨改建是骨新生与骨吸收的动态平衡过程。所以,研究对骨改建具有双重调节作用的细胞因子,将对临床实践有更大的指导意义。目前,有关这方面的研究尚未见报道。作为细胞因子的一种, 转化生长因子β1(transforming growth factor β1, TGF-β1)在骨及骨环境的递质中广泛存在,对于参与骨新生与骨吸收的细胞均有重要作用[2]。本项研究利用免疫组织化学方法,观察了大鼠正畸牙移动过程中TGF-β1在牙周组织中的变化,目的在于探讨TGF-β1在正畸牙移动过程中的作用。
, 百拇医药
材料和方法
1.主要试剂:兔抗人TGF-β1多克隆抗体(1∶50),生物素化山羊抗兔IgG(1∶100),过氧化物酶标记的链霉卵白素(1∶100),DAB(均为美国Santa Cruz 公司产品)。
2.主要方法:将180 g重Wistar大鼠63只分为9组。对其右侧上颌第一磨牙施以40 g近中矫治力,作为实验组;左侧上颌第一磨牙未受力,为对照组。分别于第0、1、3、5、7、10、14、21、28天处死动物,取双侧上颌标本,制备石蜡切片,SP免疫组织化学方法染色。阴性对照以PBS代替一抗,阳性对照为正常颌下腺的腺管上皮。
3.显微图像分析:使用CIAM真彩色生物医学图像分析仪,于10倍镜下,在第一磨牙近远中牙周膜各随机选择3个视野。以平均灰度表示染色强度。
结果
, 百拇医药
正畸牙移动过程中,实验组牙周膜内TGF-β1的变化情况见图1与表1;对照组张、压力区染色强度均无明显变化。另外,可见破骨细胞、成骨细胞、张力区新生牙骨质附近的牙周膜及加力第5天的骨髓腔内类骨质染色呈强阳性。
表1 正畸牙移动过程中牙周膜
内TGF-β1的变化(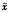 ±s) 加力
±s) 加力
天数
张力区
压力区
P值
0
, 百拇医药 149.25±1.23
149.25±1.27
1
150.92±1.18
152.58±1.21
3
154.15±1.34
158.33±1.29
5
167.13±1.41
156.16±1.47
<0.05
, 百拇医药
7
166.25±1.33
154.79±1.31
<0.05
10
164.33±1.45
153.65±1.39
<0.05
14
157.26±1.23
153.47±1.26
21
, http://www.100md.com
153.87±1.21
151.35±1.19
28
150.92±1.17
150.36±1.14
注:①加力后双侧灰度值均以(实际灰度值+变化量)× 2计算,其结果对统计学分析无影响;②P为采用自身对照t检验的分析结果;③采用方差分析,张力区加力第3、5、7、10、14天与0天,第3天与第5天,第10天与第14天以及压力区加力第3、5、7天与0天,第1天与第3天之间,差异均有显著性(P<0.05)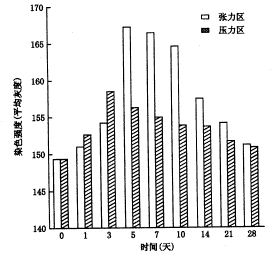
图1 正畸牙移动过程中实验组牙周膜内TGF-β1的变化
, http://www.100md.com
讨论
TGF-β1广泛分布于动物的正常组织和转化细胞中,具有多种生物学功能。研究表明,TGF-β1参与牙周组织形成的调节[3]。大量体外实验结果显示[4],外源性TGF-β在体内可诱导新骨形成,人重组TGF-β可促进牙周膜细胞的DNA合成及碱性磷酸酶活性的增加。但也有研究表明[5],TGF-β可刺激骨吸收,抑制骨形成。可见,TGF-β对牙周软硬组织的功能调节是复杂的。不同的细胞类型、组织来源、生长条件以及有无其他因子的存在等因素,都会对其产生影响。正畸治疗的生理介体是牙周膜,它是具有成骨能力的骨—牙界面,是一种变异的骨膜[6],有明显的骨沉积和骨吸收能力。因此,正畸牙移动过程中牙周膜的变化可直接或间接地反映牙周软硬组织的改建情况。
正畸加力后,尤其在牙齿移动相对较快的时期,牙周膜内TGF-β1的表达明显增多。我们推测,牙周膜内的细胞在正畸力刺激下可产生大量的TGF-β1。尽管牙周膜内TGF-β1的来源尚不清楚,但以往的研究已证实,间充质细胞、成纤维细胞及成骨细胞均可产生TGF-β1[1]。另外,牙周膜内TGF-β1的大幅度增加,可能还与潜活TGF-β1的激活与释放有关。目前认为,潜活TGF-β的激活主要通过以下3种途径:其一,潜活TGF-β在中性pH环境中能稳定存在,pH降低时即可被激活。所以,在骨吸收过程中,骨基质中的潜活复合体可能为破骨细胞所激活和释放[7]。其二,潜活TGF-β可被蛋白酶、纤维蛋白溶解酶、组织蛋白酶D所激活[8]。由于成骨细胞可合成纤维蛋白溶解酶的激活及抑制因子,还可分泌组织蛋白酶D,故其可调节潜活TGF-β的激活[9]。其三,活性TGF-β本身亦可激活TGF-β潜活复合体[2]。
, 百拇医药
综上,我们作出如下分析:正畸牙移动初期,在机械压力刺激下,以压力区为主的破骨过程相对活跃,骨基质内的潜活TGF-β1复合体被激活和释放并出现级联放大效应。即活性TGF-β1刺激牙周膜中未分化间充质细胞形成成骨细胞,后者进一步分泌大量TGF-β1,从而出现以压力区为主的TGF-β1含量大幅度增加。之后,在TGF-β1作用下,压力区成骨作用开始活跃,破骨过程受到抑制;而张力区成骨更加活跃,故出现张力区TGF-β1表达程度大于压力区。TGF-β1对骨代谢中相关细胞的调节是以自分泌和旁分泌形式进行的且存在负反馈调节机制[10]。故当牙周膜中TGF-β1达到一定浓度后,成骨细胞可能通过合成纤维蛋白溶解酶抑制因子,减少TGF-β1潜活复合体的激活。另外,随着新骨的逐渐成熟,TGF-β1逐渐被埋于基质中,这也是导致正畸牙进入缓慢移动期后牙周膜染色逐渐减弱的原因之一。
, http://www.100md.com
张力区牙周膜TGF-β1含量高于压力区,以及成骨细胞和骨髓腔内新生类骨质的TGF-β1染色强阳性,都进一步证实了TGF-β1具有较强的成骨功能。
可见,TGF-β1的释放可触发初期牙周组织的改建,之后,导致骨改建并最终引起牙齿移动。我们推测,牙周膜中TGF-β1的含量变化反映出机械压力所引起的生物学应答的综合反应,即TGF-β1在最终导致正畸牙移动的牙周组织改建中起着重要的作用。
参考文献
[1] Setsuku U, Mogi M, Deguchi T. Increase of transforming growth factor-β1 in gingival crevicular fluid during human orthodontic tooth movement. Archs Oral Biol, 1996; 41:1091-1095.
, 百拇医药
[2] Bonewald LF, Mundy GR. Role of transforming growth factor beta in bone modeling. Clin Orthop Res, 1990,250:261-276.
[3] Wise GE, Lin F, Fan W. Effects of transforming growth factor beta 1 on cultured dental follicle cells from rat mandibular molars. Arch Oral Biol, 1992,37: 471-478.
[4] Lind M. Growth factors: possible new clinical tools. A review. Acta Orthop Scand, 1996,67: 407-417.
[5] Lerner UH. Transforming growth factor-beta stimulates bone resorption in neonatal mouse calvariae by a prostalglandin-unrelated but cell proliferation-dependent pathway. J Bone Miner Res, 1996; 11: 1628-1639.
, 百拇医药
[6] Thomas TG, Robert LV.口腔正畸学——现代原理与技术. 徐芸,梁文勇,曹菊,等译.第1版.天津:天津科技翻译出版公司,1996.191.
[7] Sporn MB, Roberts AB, Wakefield LM, et al. Some recent advances in the chemistry and biology of transforming growth factor beta. J Cell Biol, 1987; 105: 1039-1045.
[8] Lyons RM, Keski-Oja J, Moses HL. Proteolytic activation of latent transforming growth factor-beta from fibroblast-conditioned medium. J Cell Biol, 1988; 106: 1659-1665.
, 百拇医药
[9] Zheng MH, Wood DJ, Papadimitriou JM. What's new in the role of cytokines on osteoblast proliferation and differentiation? Pathol Res Pract, 1992,188: 1104-1121.
[10] Joyce ME, Jingushi S, Bolander ME. Transforming growth factor beta in the regulation of fracture repair. Orthop Clin North Am, 1990; 21: 199-209.
收稿:1998-10-16
修回:1999-04-20, 百拇医药
单位:130041 长春,白求恩医科大学口腔医学院
关键词:转化生长因子β1;免疫组织化学;牙移动;较小
New Page 2 【摘要】 目的 了解大鼠正畸牙移动过程中转化生长因子β1(transforming growth factorβ1, TGF-β1)在牙周组织内的变化,探讨TGF-β1在正畸牙移动过程中的作用。方法 对大鼠正畸牙移动不同阶段的牙及牙周组织联合切片,进行免疫组织化学研究。结果 正畸牙移动过程中,牙周膜内TGF-β1表达增加。加力第5~10天,张力区TGF-β1表达增加的幅度明显大于压力区。结论 TGF-β1在正畸牙移动的牙周组织改建中起重要作用,尤其对成骨具有较强的促进作用。
, http://www.100md.com
The changes of transforming growth factor beta 1 in periodontal tissue during orthodontic tooth movement
WANG Lingli, ZHU Hong, LIANG Tang. School of Stomatology, Bethune University of Medical Science,Changchun 130041
【Abstract】 Objective To observe the distribution and change of transforming growth factor beta 1 (TGF-β1) in periodontal tissue and understand the role of TGF-β1 in orthodontic tooth movement. Methods Apply force on right maxillary first molars in rats, and examine the decalcified alveolodental connected tissue in different stage of tooth movement with immunohistochemical staining technique (SP method). Results TGF-β1 exists in normal periodontal tissue. The expression of it in periodontium increases during orthodontic tooth movement. Especially from 5 to 10 days after force application, the expression at tension side is much more than those at pressure side. Conclusion TGF-β1 plays an important role in remodeling of periodontal tissue during orthodontic tooth movement, and can powerfully promote bone formation.
, 百拇医药
【Key words】 Transforming growth factor beta 1 Immunohistochemistry Tooth movement,minor
正畸牙移动过程的实质,是牙及牙周组织的改建过程。其中,尤以骨组织的改建最为重要。大量研究证实,PGE、IL-1、IL-6、TNF-α、EGF等细胞因子均可促进骨吸收,加快牙齿移动[1]。但是,骨改建是骨新生与骨吸收的动态平衡过程。所以,研究对骨改建具有双重调节作用的细胞因子,将对临床实践有更大的指导意义。目前,有关这方面的研究尚未见报道。作为细胞因子的一种, 转化生长因子β1(transforming growth factor β1, TGF-β1)在骨及骨环境的递质中广泛存在,对于参与骨新生与骨吸收的细胞均有重要作用[2]。本项研究利用免疫组织化学方法,观察了大鼠正畸牙移动过程中TGF-β1在牙周组织中的变化,目的在于探讨TGF-β1在正畸牙移动过程中的作用。
, 百拇医药
材料和方法
1.主要试剂:兔抗人TGF-β1多克隆抗体(1∶50),生物素化山羊抗兔IgG(1∶100),过氧化物酶标记的链霉卵白素(1∶100),DAB(均为美国Santa Cruz 公司产品)。
2.主要方法:将180 g重Wistar大鼠63只分为9组。对其右侧上颌第一磨牙施以40 g近中矫治力,作为实验组;左侧上颌第一磨牙未受力,为对照组。分别于第0、1、3、5、7、10、14、21、28天处死动物,取双侧上颌标本,制备石蜡切片,SP免疫组织化学方法染色。阴性对照以PBS代替一抗,阳性对照为正常颌下腺的腺管上皮。
3.显微图像分析:使用CIAM真彩色生物医学图像分析仪,于10倍镜下,在第一磨牙近远中牙周膜各随机选择3个视野。以平均灰度表示染色强度。
结果
, 百拇医药
正畸牙移动过程中,实验组牙周膜内TGF-β1的变化情况见图1与表1;对照组张、压力区染色强度均无明显变化。另外,可见破骨细胞、成骨细胞、张力区新生牙骨质附近的牙周膜及加力第5天的骨髓腔内类骨质染色呈强阳性。
表1 正畸牙移动过程中牙周膜
内TGF-β1的变化(
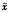 ±s) 加力
±s) 加力天数
张力区
压力区
P值
0
, 百拇医药 149.25±1.23
149.25±1.27
1
150.92±1.18
152.58±1.21
3
154.15±1.34
158.33±1.29
5
167.13±1.41
156.16±1.47
<0.05
, 百拇医药
7
166.25±1.33
154.79±1.31
<0.05
10
164.33±1.45
153.65±1.39
<0.05
14
157.26±1.23
153.47±1.26
21
, http://www.100md.com
153.87±1.21
151.35±1.19
28
150.92±1.17
150.36±1.14
注:①加力后双侧灰度值均以(实际灰度值+变化量)× 2计算,其结果对统计学分析无影响;②P为采用自身对照t检验的分析结果;③采用方差分析,张力区加力第3、5、7、10、14天与0天,第3天与第5天,第10天与第14天以及压力区加力第3、5、7天与0天,第1天与第3天之间,差异均有显著性(P<0.05)

图1 正畸牙移动过程中实验组牙周膜内TGF-β1的变化
, http://www.100md.com
讨论
TGF-β1广泛分布于动物的正常组织和转化细胞中,具有多种生物学功能。研究表明,TGF-β1参与牙周组织形成的调节[3]。大量体外实验结果显示[4],外源性TGF-β在体内可诱导新骨形成,人重组TGF-β可促进牙周膜细胞的DNA合成及碱性磷酸酶活性的增加。但也有研究表明[5],TGF-β可刺激骨吸收,抑制骨形成。可见,TGF-β对牙周软硬组织的功能调节是复杂的。不同的细胞类型、组织来源、生长条件以及有无其他因子的存在等因素,都会对其产生影响。正畸治疗的生理介体是牙周膜,它是具有成骨能力的骨—牙界面,是一种变异的骨膜[6],有明显的骨沉积和骨吸收能力。因此,正畸牙移动过程中牙周膜的变化可直接或间接地反映牙周软硬组织的改建情况。
正畸加力后,尤其在牙齿移动相对较快的时期,牙周膜内TGF-β1的表达明显增多。我们推测,牙周膜内的细胞在正畸力刺激下可产生大量的TGF-β1。尽管牙周膜内TGF-β1的来源尚不清楚,但以往的研究已证实,间充质细胞、成纤维细胞及成骨细胞均可产生TGF-β1[1]。另外,牙周膜内TGF-β1的大幅度增加,可能还与潜活TGF-β1的激活与释放有关。目前认为,潜活TGF-β的激活主要通过以下3种途径:其一,潜活TGF-β在中性pH环境中能稳定存在,pH降低时即可被激活。所以,在骨吸收过程中,骨基质中的潜活复合体可能为破骨细胞所激活和释放[7]。其二,潜活TGF-β可被蛋白酶、纤维蛋白溶解酶、组织蛋白酶D所激活[8]。由于成骨细胞可合成纤维蛋白溶解酶的激活及抑制因子,还可分泌组织蛋白酶D,故其可调节潜活TGF-β的激活[9]。其三,活性TGF-β本身亦可激活TGF-β潜活复合体[2]。
, 百拇医药
综上,我们作出如下分析:正畸牙移动初期,在机械压力刺激下,以压力区为主的破骨过程相对活跃,骨基质内的潜活TGF-β1复合体被激活和释放并出现级联放大效应。即活性TGF-β1刺激牙周膜中未分化间充质细胞形成成骨细胞,后者进一步分泌大量TGF-β1,从而出现以压力区为主的TGF-β1含量大幅度增加。之后,在TGF-β1作用下,压力区成骨作用开始活跃,破骨过程受到抑制;而张力区成骨更加活跃,故出现张力区TGF-β1表达程度大于压力区。TGF-β1对骨代谢中相关细胞的调节是以自分泌和旁分泌形式进行的且存在负反馈调节机制[10]。故当牙周膜中TGF-β1达到一定浓度后,成骨细胞可能通过合成纤维蛋白溶解酶抑制因子,减少TGF-β1潜活复合体的激活。另外,随着新骨的逐渐成熟,TGF-β1逐渐被埋于基质中,这也是导致正畸牙进入缓慢移动期后牙周膜染色逐渐减弱的原因之一。
, http://www.100md.com
张力区牙周膜TGF-β1含量高于压力区,以及成骨细胞和骨髓腔内新生类骨质的TGF-β1染色强阳性,都进一步证实了TGF-β1具有较强的成骨功能。
可见,TGF-β1的释放可触发初期牙周组织的改建,之后,导致骨改建并最终引起牙齿移动。我们推测,牙周膜中TGF-β1的含量变化反映出机械压力所引起的生物学应答的综合反应,即TGF-β1在最终导致正畸牙移动的牙周组织改建中起着重要的作用。
参考文献
[1] Setsuku U, Mogi M, Deguchi T. Increase of transforming growth factor-β1 in gingival crevicular fluid during human orthodontic tooth movement. Archs Oral Biol, 1996; 41:1091-1095.
, 百拇医药
[2] Bonewald LF, Mundy GR. Role of transforming growth factor beta in bone modeling. Clin Orthop Res, 1990,250:261-276.
[3] Wise GE, Lin F, Fan W. Effects of transforming growth factor beta 1 on cultured dental follicle cells from rat mandibular molars. Arch Oral Biol, 1992,37: 471-478.
[4] Lind M. Growth factors: possible new clinical tools. A review. Acta Orthop Scand, 1996,67: 407-417.
[5] Lerner UH. Transforming growth factor-beta stimulates bone resorption in neonatal mouse calvariae by a prostalglandin-unrelated but cell proliferation-dependent pathway. J Bone Miner Res, 1996; 11: 1628-1639.
, 百拇医药
[6] Thomas TG, Robert LV.口腔正畸学——现代原理与技术. 徐芸,梁文勇,曹菊,等译.第1版.天津:天津科技翻译出版公司,1996.191.
[7] Sporn MB, Roberts AB, Wakefield LM, et al. Some recent advances in the chemistry and biology of transforming growth factor beta. J Cell Biol, 1987; 105: 1039-1045.
[8] Lyons RM, Keski-Oja J, Moses HL. Proteolytic activation of latent transforming growth factor-beta from fibroblast-conditioned medium. J Cell Biol, 1988; 106: 1659-1665.
, 百拇医药
[9] Zheng MH, Wood DJ, Papadimitriou JM. What's new in the role of cytokines on osteoblast proliferation and differentiation? Pathol Res Pract, 1992,188: 1104-1121.
[10] Joyce ME, Jingushi S, Bolander ME. Transforming growth factor beta in the regulation of fracture repair. Orthop Clin North Am, 1990; 21: 199-209.
收稿:1998-10-16
修回:1999-04-20, 百拇医药