线粒体DNA定量分析与衰老关系初探1
作者:吴小晶 吴丽娟 李晓东 高 枫
单位:吴小晶 解放军第466医院内科,北京 100089;吴丽娟 李晓东 高 枫 北京医科大学第一医院神经内科
关键词:线粒体DNA;定量分析;衰老
中国老年学杂志990528 摘 要 目的 探讨线粒体DNA(mtDNA)相对含量与衰老的关系。方法 采用定量Southern杂交方法测定mtDNA的相对含量。结果 大鼠大脑组织中老年组mtDNA的相对含量明显高于其他组(P<0.01),而幼年与成年组相比无明显差异(P>0.05)。结论 老年组大鼠大脑组织中mtDNA的含量是增多的,而这种与年龄相关mtDNA含量的变化可能始于成年以后。
Quantitative analysis of mitochondrial DNA associated with aging
, http://www.100md.com
Wu Xiaojing, Wu Lijuan, Li Xiaodong et al
Department of Neurology, the First Teaching Hospital of Beijing Medical University, Beijing 100081
Objective To study the relative content of mitochondrial DNA associated with aging.Methods To determine the relative content of mitochondrial DNA by quantitative Southern blot.Results The amount of mitochondrial DNA of brain in elderly rat group is much higher than the control groups(P<0.01), while there is no significant difference between the infantile and adult groups(P>0.05).Conclusions The increasing of the amount of mitochondrial DNA in brains of elderly rats and this change also occures after becoming full-grown adults.
, 百拇医药
Key words Mitochondrial DNA Quantitative analysis Aging
自1989年Linnane等〔1〕提出线粒体衰老假说以来,人们越来越关注线粒体DNA(mtDNA)与衰老关系的研究。但与增龄相关mtDNA含量变化的研究较少,国内尚未见报道。为此我们测定了不同年龄组大鼠大脑组织中mtDNA的相对含量,现将结果报道如下。
1 材料与方法
1.1 材料 选用Wistar雄性大鼠(本院动物室提供)。将动物分为3组,幼年组(1月龄)、成年组(6~10月龄)和老年组(25~28月龄)。取双侧大脑半球,立即提取DNA。mtDNA全长探针由美国华盛顿大学姜新生博士赠送,克隆有18 SrDNA片段的质粒pBR322/EcoRI由美国哥伦比亚大学神经病学研究室EricA Schon博士赠送。α-32P-dcTP购自北京亚辉生物医学工程公司。随机引物标记试剂盒,美国Promaga公司产品。
, http://www.100md.com
1.2 方 法
1.2.1 DNA的提取 100 mg组织液氮中研碎,加入0.5~1.0 ml DNA提取液,37℃水浴放置1 h,再加入蛋白酶K至终浓度100 μg/ml,37℃消化过夜,再经酚、氯仿抽提,乙醇沉淀纯化,DNA溶于TE溶液,UV 2100型紫外分光光度计测定DNA浓度。
1.2.2 探针制备〔2〕 质粒DNA加入到已制备好的感受态细胞中进行转化,经大规模制备后得到一定量质粒DNA。再经EcoRI酶切、低溶点凝胶回收、纯化得以纯化的探针。
1.2.3 Southern印迹 DNA标本酶切、凝胶电泳分离,凝胶经变性、中和处理后,将尼龙膜置于凝胶上,上面加以滤纸及500 g重物,转膜进行24~36 h。
1.2.4 杂交及放射自显影 尼龙膜于预杂交液中42℃孵育3 h后加入变性探针,42℃杂交18~20 h。洗膜处理后,暗室内压上X线片及增感屏,-70℃曝光1~3 d后冲洗X线片。
, 百拇医药
1.2.5 密度扫描 将做好标记的X线底片,放入电泳激光密度计中,扫描杂交条带,记录数据。
1.2.6 统计分析 资料进行单因素方差分析、卡方检验,利用SPSSPC软件,由计算机进行统计分析。
2 结果
2.1 探针制备 质粒DNA pBR322/EcoRI大规模制备后,取一定量用限制性内切酶EcoRI进行酶切,经0.8%琼脂糖凝胶电泳分离出2个片段,4.3 kb为载体,5.8 kb为18 SrDNA。低溶点凝胶回收5.8 kb片段纯化后,再经检测为单一的5.8 kb条带(图1),即为18 SrDNA探针。
图1 从质粒pBR322/EcoRI中提取的18 SrDNA探针
, http://www.100md.com
以mtDNA全长及18 SrDNA探针同时进行Southern杂交。杂交结果显示,所有的标本均呈现两条清晰的杂交条带,其中16 kb为mtDNA,12 kb为18 SrDNA,无其他异常条带出现(图2)。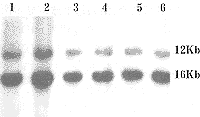

图2 大鼠mtDNA及18 SrDNA双探针
Southern杂交图谱
2.2 mtDNA定量分析结果 统计学分析结果表明:老年大鼠大脑组织中mtDNA的相对含量明显高于成年及幼年鼠(均P<0.01),而成年与幼年鼠相比较无明显差异(P>0.05)(表1,表2)。
表1 不同年龄组大鼠大脑mtDNA定量方差分析 变异来源
, http://www.100md.com
自由度(v)
离均差平
方和(l)
均方(MS)
F
P值
总变异
19
395.48
各组间
2
196.55
98.27
, 百拇医药
8.39
<0.01
误差
17
198.93
11.70
表2 各组两两比较所得结果 比较
处理数(T)
平均差数(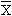 B-
B-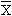 A)
A)
标准误差Q值(Ti,17)
, 百拇医药
P值
老∶成
2
8.92-3.18=5.74
1.14×4.10=4.67
<0.01
老∶幼
3
8.92-3.23=6.69
1.14×4.74=5.40
<0.01
成∶幼
, 百拇医药
2
3.18-2.23=0.95
1.52×2.98=4.52
>0.05
3 讨论
与核DNA不同,哺乳动物细胞内的mtDNA是多拷贝的,其数量变化与细胞的功能状态密切相关。因此,研究衰老过程中mtDNA含量的变化是极有意义的。我们采用定量Southern杂交方法测定不同年龄组mtDNA含量,以mtDNA全长及18 SrDNA探针同时进行杂交,结果每个泳道显示两个杂交带,长度分别为16 kb及12 kb,前者密度代表mtDNA含量,后者是18 SrDNA与核DNA的杂交带。由于18 SrDNA在每个细胞内具有上百个拷贝,含量较恒定,因此,其密度可代表核DNA的含量,二者的比值即为mtDNA的相对含量。最初这种定量分子杂交方法用于分析人类线粒体疾病患者细胞内mtDNA的含量,我们将此方法引入衰老研究中。
, 百拇医药
我们的实验结果表明,大鼠大脑组织中,老年组mtDNA的相对含量高于其他组(P<0.01)。但幼年与成年组之间mtDNA的相对含量无明显差异(P>0.05)。由此推测mtDNA含量在老年期是增多的,其增龄增加的变化可能始于成年以后。有关mtDNA含量增加的机制尚不完全清楚,可能机制为:(1)代谢反馈机制〔3〕,认为与衰老相关线粒体功能的缺陷,一方面通过增加未受损的正常线粒体工作量来进行代偿,另一方面反馈刺激细胞增加线粒体的含量来代偿。(2)快速复制机制〔4〕,不同类型mtDNA的缺失,使其基因组减少,而这种较正常mtDNA短而有缺失的mtDNA,就具有一种复制的优势,结果造成细胞内大量无功能mtDNA的堆积。(3)调节失控机制,野生型mtDNA顺式控制作用因基因突变而被抑制或失活,这样突变型mtDNA的量就超过野生型,导致与细胞能量状态及代谢需要无关的突变型mtDNA的过度增殖〔5〕。
大鼠脑组织中,mtDNA相对含量随增龄而增加,因此,对其做进一步研究,无疑对衰老指标的测定及抗衰老措施的评估十分有意义。
, http://www.100md.com
1 国家自然科学基金资助项目(39370748)
作者简介:吴小晶,女,35岁,主治医师,研究方向:mtDNA与衰老
4 参考文献
1 Nagley P, Mackay IR, Baumer A et al.Mitochondrial DNA mutation associated with aging and degenrative disease.Ann NY Acad Sci,1992;673:92
2 Sambrook J, Fritsch EF, Maniatis J(金东雁,黎孟枫等译).分子克隆实验指南.第2版.北京科学出版社,1995:16
3 Ames BN, Shigenage MK, Hagen TM.Mitochondrial decay in aging.Biochem Biophys Acta,1995;1271:165
4 Cortopassi GA, Arnheim N.Detection of a specific mitochondrial DNA deletion in tissues of older humans.Nucleic Acids Res,1992;18(23):1927
5 Katayama M, Tanaka M, Yamamoto H et al.Deleted mitochondrial DNA in the skeletal muscle of aged individuals.Biochem Int,1991;25(1):47
1998-08-07收稿, 百拇医药
单位:吴小晶 解放军第466医院内科,北京 100089;吴丽娟 李晓东 高 枫 北京医科大学第一医院神经内科
关键词:线粒体DNA;定量分析;衰老
中国老年学杂志990528 摘 要 目的 探讨线粒体DNA(mtDNA)相对含量与衰老的关系。方法 采用定量Southern杂交方法测定mtDNA的相对含量。结果 大鼠大脑组织中老年组mtDNA的相对含量明显高于其他组(P<0.01),而幼年与成年组相比无明显差异(P>0.05)。结论 老年组大鼠大脑组织中mtDNA的含量是增多的,而这种与年龄相关mtDNA含量的变化可能始于成年以后。
Quantitative analysis of mitochondrial DNA associated with aging
, http://www.100md.com
Wu Xiaojing, Wu Lijuan, Li Xiaodong et al
Department of Neurology, the First Teaching Hospital of Beijing Medical University, Beijing 100081
Objective To study the relative content of mitochondrial DNA associated with aging.Methods To determine the relative content of mitochondrial DNA by quantitative Southern blot.Results The amount of mitochondrial DNA of brain in elderly rat group is much higher than the control groups(P<0.01), while there is no significant difference between the infantile and adult groups(P>0.05).Conclusions The increasing of the amount of mitochondrial DNA in brains of elderly rats and this change also occures after becoming full-grown adults.
, 百拇医药
Key words Mitochondrial DNA Quantitative analysis Aging
自1989年Linnane等〔1〕提出线粒体衰老假说以来,人们越来越关注线粒体DNA(mtDNA)与衰老关系的研究。但与增龄相关mtDNA含量变化的研究较少,国内尚未见报道。为此我们测定了不同年龄组大鼠大脑组织中mtDNA的相对含量,现将结果报道如下。
1 材料与方法
1.1 材料 选用Wistar雄性大鼠(本院动物室提供)。将动物分为3组,幼年组(1月龄)、成年组(6~10月龄)和老年组(25~28月龄)。取双侧大脑半球,立即提取DNA。mtDNA全长探针由美国华盛顿大学姜新生博士赠送,克隆有18 SrDNA片段的质粒pBR322/EcoRI由美国哥伦比亚大学神经病学研究室EricA Schon博士赠送。α-32P-dcTP购自北京亚辉生物医学工程公司。随机引物标记试剂盒,美国Promaga公司产品。
, http://www.100md.com
1.2 方 法
1.2.1 DNA的提取 100 mg组织液氮中研碎,加入0.5~1.0 ml DNA提取液,37℃水浴放置1 h,再加入蛋白酶K至终浓度100 μg/ml,37℃消化过夜,再经酚、氯仿抽提,乙醇沉淀纯化,DNA溶于TE溶液,UV 2100型紫外分光光度计测定DNA浓度。
1.2.2 探针制备〔2〕 质粒DNA加入到已制备好的感受态细胞中进行转化,经大规模制备后得到一定量质粒DNA。再经EcoRI酶切、低溶点凝胶回收、纯化得以纯化的探针。
1.2.3 Southern印迹 DNA标本酶切、凝胶电泳分离,凝胶经变性、中和处理后,将尼龙膜置于凝胶上,上面加以滤纸及500 g重物,转膜进行24~36 h。
1.2.4 杂交及放射自显影 尼龙膜于预杂交液中42℃孵育3 h后加入变性探针,42℃杂交18~20 h。洗膜处理后,暗室内压上X线片及增感屏,-70℃曝光1~3 d后冲洗X线片。
, 百拇医药
1.2.5 密度扫描 将做好标记的X线底片,放入电泳激光密度计中,扫描杂交条带,记录数据。
1.2.6 统计分析 资料进行单因素方差分析、卡方检验,利用SPSSPC软件,由计算机进行统计分析。
2 结果
2.1 探针制备 质粒DNA pBR322/EcoRI大规模制备后,取一定量用限制性内切酶EcoRI进行酶切,经0.8%琼脂糖凝胶电泳分离出2个片段,4.3 kb为载体,5.8 kb为18 SrDNA。低溶点凝胶回收5.8 kb片段纯化后,再经检测为单一的5.8 kb条带(图1),即为18 SrDNA探针。

图1 从质粒pBR322/EcoRI中提取的18 SrDNA探针
, http://www.100md.com
以mtDNA全长及18 SrDNA探针同时进行Southern杂交。杂交结果显示,所有的标本均呈现两条清晰的杂交条带,其中16 kb为mtDNA,12 kb为18 SrDNA,无其他异常条带出现(图2)。


图2 大鼠mtDNA及18 SrDNA双探针
Southern杂交图谱
2.2 mtDNA定量分析结果 统计学分析结果表明:老年大鼠大脑组织中mtDNA的相对含量明显高于成年及幼年鼠(均P<0.01),而成年与幼年鼠相比较无明显差异(P>0.05)(表1,表2)。
表1 不同年龄组大鼠大脑mtDNA定量方差分析 变异来源
, http://www.100md.com
自由度(v)
离均差平
方和(l)
均方(MS)
F
P值
总变异
19
395.48
各组间
2
196.55
98.27
, 百拇医药
8.39
<0.01
误差
17
198.93
11.70
表2 各组两两比较所得结果 比较
处理数(T)
平均差数(
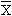 B-
B-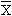 A)
A)标准误差Q值(Ti,17)
, 百拇医药
P值
老∶成
2
8.92-3.18=5.74
1.14×4.10=4.67
<0.01
老∶幼
3
8.92-3.23=6.69
1.14×4.74=5.40
<0.01
成∶幼
, 百拇医药
2
3.18-2.23=0.95
1.52×2.98=4.52
>0.05
3 讨论
与核DNA不同,哺乳动物细胞内的mtDNA是多拷贝的,其数量变化与细胞的功能状态密切相关。因此,研究衰老过程中mtDNA含量的变化是极有意义的。我们采用定量Southern杂交方法测定不同年龄组mtDNA含量,以mtDNA全长及18 SrDNA探针同时进行杂交,结果每个泳道显示两个杂交带,长度分别为16 kb及12 kb,前者密度代表mtDNA含量,后者是18 SrDNA与核DNA的杂交带。由于18 SrDNA在每个细胞内具有上百个拷贝,含量较恒定,因此,其密度可代表核DNA的含量,二者的比值即为mtDNA的相对含量。最初这种定量分子杂交方法用于分析人类线粒体疾病患者细胞内mtDNA的含量,我们将此方法引入衰老研究中。
, 百拇医药
我们的实验结果表明,大鼠大脑组织中,老年组mtDNA的相对含量高于其他组(P<0.01)。但幼年与成年组之间mtDNA的相对含量无明显差异(P>0.05)。由此推测mtDNA含量在老年期是增多的,其增龄增加的变化可能始于成年以后。有关mtDNA含量增加的机制尚不完全清楚,可能机制为:(1)代谢反馈机制〔3〕,认为与衰老相关线粒体功能的缺陷,一方面通过增加未受损的正常线粒体工作量来进行代偿,另一方面反馈刺激细胞增加线粒体的含量来代偿。(2)快速复制机制〔4〕,不同类型mtDNA的缺失,使其基因组减少,而这种较正常mtDNA短而有缺失的mtDNA,就具有一种复制的优势,结果造成细胞内大量无功能mtDNA的堆积。(3)调节失控机制,野生型mtDNA顺式控制作用因基因突变而被抑制或失活,这样突变型mtDNA的量就超过野生型,导致与细胞能量状态及代谢需要无关的突变型mtDNA的过度增殖〔5〕。
大鼠脑组织中,mtDNA相对含量随增龄而增加,因此,对其做进一步研究,无疑对衰老指标的测定及抗衰老措施的评估十分有意义。
, http://www.100md.com
1 国家自然科学基金资助项目(39370748)
作者简介:吴小晶,女,35岁,主治医师,研究方向:mtDNA与衰老
4 参考文献
1 Nagley P, Mackay IR, Baumer A et al.Mitochondrial DNA mutation associated with aging and degenrative disease.Ann NY Acad Sci,1992;673:92
2 Sambrook J, Fritsch EF, Maniatis J(金东雁,黎孟枫等译).分子克隆实验指南.第2版.北京科学出版社,1995:16
3 Ames BN, Shigenage MK, Hagen TM.Mitochondrial decay in aging.Biochem Biophys Acta,1995;1271:165
4 Cortopassi GA, Arnheim N.Detection of a specific mitochondrial DNA deletion in tissues of older humans.Nucleic Acids Res,1992;18(23):1927
5 Katayama M, Tanaka M, Yamamoto H et al.Deleted mitochondrial DNA in the skeletal muscle of aged individuals.Biochem Int,1991;25(1):47
1998-08-07收稿, 百拇医药