关节滑膜内衬细胞凋亡在骨关节病发生机制中的作用
作者:邱续强 周江南
单位:附属湘雅医院运动医学科 长沙 410008
关键词:凋亡;滑膜;内衬细胞*;骨关节病
湖南医科大学学报990512
湖南医科大学学报
BULLETIN OF HUNAN MEDICAL UNIVERSITY
1999年 第24卷 第5期 Vol.24 No.5 1999
, http://www.100md.com 关节滑膜内衬细胞凋亡在骨关节病发生机制中的作用
邱续强 周江南
提要 观察12例骨关节病及10例正常关节的滑膜内衬细胞的细胞凋亡情况,作定量分析且用滑膜组织的DNA凝胶电泳加以证实。结果示,骨关节病滑膜内衬细胞凋亡指数(2.04%)明显高于正常关节组(0.60%);DNA凝胶电泳亦示病理组在200bp处有明显的梯带,对照组则无。提示骨关节病滑膜内衬细胞有高于正常的转换频率,其凋亡作用增强可能在骨关节病的发生发展中有重要意义。
关键词 凋亡; 滑膜; 内衬细胞*; 骨关节病
中国图书分类号 R684
Effects of apoptosis of synovial lining cells on
, 百拇医药
pathogenesis of osteoarthropathy
Qiu Xuqiang Zhou Jiangnan
(Department of Sports Medicine, Xiangya Hospital,Hunan Medical University, Changsha 410008)
The author counted synovial lining cells(SLCs) of apoptosis in the joints of osteoarthropathy(OA, 12 cases) and control(10 cases) patients. The counts of apoptotic SLC were investigated by gel electrophoretic analysis of DNA extracted from synovium. The apoptotic index(AI) of SLCs in OA(2.04%) was obviously higher than that in controls(0.60%); electrophorectogram of DNA revealed a characteristic ladder pattern of DNA fragments at 200bp in the OA group. We conclude that apoptosis can be found in synovial lining layer, and the AI of SLCs in the OA group is much higher than that in the control group, implying the high turn-over rate of SLCs in OA; the increasing apoptosis of SLCs may increase lesion factors retained in joints and cause the injury of articular cartilage.
, 百拇医药
Key words apoptosis; synovial membrane; lining cell*; osteoarthropathy
滑膜是关节滑动体系中的重要组成部分,其生理功能早被许多学者阐明[1]。滑膜的分泌吸收和营养供应是关节软骨维持正常代谢和功能的前提,然而病理状态下的滑膜对关节软骨的影响及其在骨关节病发生发展中的作用研究不多。滑膜病变常被视为继发病变。虽然早在70年代有学者提出了原发性骨关节病的始发部位可能起源于滑膜内衬细胞的假说[2],但几乎所有研究者均着眼于滑膜内衬细胞的增殖、分化及功能表达[3],尚无学者考虑滑膜内衬细胞最后转归,即死亡对骨关节病的影响。细胞凋亡(Apoptosis)是生物界普遍存在而又受体内外多种因素影响的生理现象[4]。研究滑膜内衬细胞凋亡的特点,对探讨骨关节病的发病机理,重新认识滑膜在其发展中应有的作用与地位,并为骨关节病的防治提供新的途径有重要意义。
, 百拇医药
1 资料与方法
1.1 一般资料
所有关节滑膜标本均来源于1993~1994年间我院运动医学科及骨科的住院病人,共22例,分为两组,其中男15例,女7例。所有病人均排除类风湿性关节炎、痛风、自身免疫性疾病和其他内分泌疾病。近3月内无应用激素和非甾体抗炎药物史。实验室检查血尿酸、尿液分析、血常规及血沉均正常。类风湿因子及抗核抗体阴性,抗“O”<500U。均有标准的X线平片资料及术中肉眼所见的关节软骨和滑膜以及其它损伤的情况记录。
1.1.1 骨关节病组 共12例,其中男6例,女6例,年龄21~73(平均41.8)岁。来源于骨关节病行关节置换术和因其他外伤性关节内紊乱的手术病人。标本来源于膝关节8个,髋关节3个,肩关节1个。其中3例伴有其他损伤,1例肩关节脱位,2例半月板损伤。X线显示不同程度的关节间隙变窄,软骨下骨硬化及骨刺形成。术中见关节软骨淡蓝色光泽消失,有絮状物附着,软骨面粗糙,有小区或大片软骨碎裂剥脱,软骨下骨暴露;滑膜略有绒毛结节状,严重者可呈葡萄串状,色较暗,多有充血,表面欠光滑,部分标本滑膜易剥脱撕裂,病变轻者伸展性较好,尚光滑。
, http://www.100md.com
1.1.2 对照组 共10例,其中男9例,女1例,年龄30~40(平均36.5)岁。主要来源于骨肿瘤截肢病人(非关节处肿瘤),或非关节骨折而手术又须进入关节腔者。标本来源于膝关节5个,髋关节3个,踝关节2个。病例均无任何可探测的关节内外紊乱。X线显示正常。手术见关节软骨淡蓝色,表面光滑,无絮状物附着;滑膜光滑、亮泽,伸展性好,无充血,无污物附着,无结节形成。
1.2 方法
1.2.1 组织学切片 参照常规电镜样品制备法,用环氧树酯制2μm的光镜切片,亚甲蓝染色,油镜下观察滑膜内衬凋亡细胞及有丝分裂相。随机连续计数2500个滑膜内衬细胞,若不足者则另随机选择该标本的其他非连续切片累计至2500个细胞。凋亡细胞或凋亡小体的识别参考Kerr及Leoncini[4,5]的方法,并请病理学家鉴定。若一处有多个凋亡小体聚集,仍计为一个凋亡细胞。观察与计数时,注意滑膜内衬细胞的凋亡特点。用AI和MI表示凋亡细胞及有丝分裂相的计数值;即每百个滑膜内衬细胞中凋亡的细胞或有丝分裂相的平均数目。选用成组资料的秩和检验进行统计学处理。
, http://www.100md.com
1.2.2 DNA抽提凝胶电泳 参考Papadimitrion的原理和方法[6]。将冻存-70℃的滑膜组织块剪碎碾成糊状,置于消化缓冲液。消化后行常规DNA抽提,紫外分光光度计测DNA浓度后,取10μg DNA于1.8%琼脂糖凝胶(含0.5μg.ml-1溴乙锭)中电泳(16mA, 8h)。以λDNA/HindⅢ为分子量标准,紫外光下观察电泳带的形成,特点及显现程度,并摄片。
2 结 果
2.1 一般组织学
(1)对照组:滑膜表面光滑,无绒毛,无结节突出,纤维附着物很少。内衬层有1~2层细胞呈长龙样疏松排列,细胞间隔大,内衬下层血管不增生,无充血,单个核细胞浸润较少(图1)。(2)病理组:滑膜表面不光整,有结节样突出,纤维素性物较多、较厚、较广。内衬细胞排列欠规律,有灶性聚集倾向,增生可达5~6层。其内衬下层毛细血管增生呈实心及条索状,血管充血较明显,单个核细胞浸润多呈散在性,围绕血管聚集较少。肥大细胞出现频率较高,尤其是内衬下层(图2)。
, 百拇医药
图1 滑膜内衬细胞呈长龙样排列(↑),并有淋巴细胞(a),肥大细胞(b) ×400
Fig. 1 A long dragon-like SLCs(↑), lymphocytes(a), and mast cells(b) in synovium, stained with methylene blue ×400
图2 骨关节病滑膜内衬下血管增生(a),血管充血(b),滑膜内衬细胞轻度增生(↑),肥大细胞(c) 美蓝染色×200
Fig. 2 Blood vessles proliferation(a), congestion(b), SLCs mild proliferation(↑), and mast cells(c) at the lower-level of synovial lining of OA, stained with methylene blue ×200
, http://www.100md.com
2.2 滑膜内衬细胞凋亡及有丝分裂相观察
两组滑膜内衬层均有凋亡现象。表现为胞体缩小且与周围分离,有一白带环绕胞体,胞质染色较正常滑膜内衬细胞为深,核浓集,深染呈半月状(图3)。凋亡小体表现为含核碎块的膜包小体,可多个聚在一处。滑膜内衬凋亡细胞主要散在于滑膜内衬的表层,有些与内衬层已发生分离,有脱向关节腔内的趋势(图4)。整个切片未见有丝分裂相及滑膜组织的灶性坏死。
图3 滑膜内衬凋亡细胞(↑),美蓝染色 ×1000
Fig. 3 Apoptotic cells in SL(↑), stained with methylene blue×1000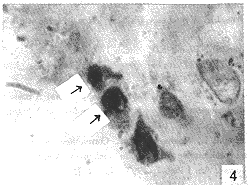
, http://www.100md.com
图4 滑膜内衬细胞凋亡小体已形成(a,b),并有脱离内衬层趋势,美蓝染色 ×1000
Fig. 4 Apoptotic bodies in SL(↑), and haveing the tendency to depart from SL, stained with methylene blue ×1000
2.3 滑膜内衬凋亡细胞计数(A)和凋亡指数(AI)
经统计学处理,骨关节病组AI值M1=2.04%, 对照组M2=0.60%(P<0.01)(附表)。
附表 滑膜内衬凋亡细胞的计数和凋亡指标
标本序号
骨关节病组
, 百拇医药
对照组
A
AI(%)
A
AI(%)
1
55
2.20
14
0.56
2
57
2.28
, 百拇医药 17
0.68
3
45
1.80
14
0.56
4
52
2.08
10
0.40
5
46
, 百拇医药
1.84
15
0.60
6
56
2.20
16
0.64
7
49
1.82
14
0.56
, http://www.100md.com 8
41
1.64
15
0.60
9
50
2.00
16
0.64
10
54
2.16
18
, 百拇医药
0.72
11
45
1.80
12
57
2.28
两组比较P<0.01
2.4 DNA凝胶电泳
病理组有可辨认的DNA梯带出现,于200bp处较明显,其他带则与其成倍数关系。对照组未见此梯带出现(图5)。
, 百拇医药 图5 部分DNA凝胶电泳 病理组:1~6;对照组,7~10
Fig. 5 Apropotion of DNA gel electrophoretic analysis. OA group, 1~6; coutrol group, 7~10
3 讨 论
滑膜内衬细胞层数的增加,血管充血,增生,管壁增厚,单个核细胞浸润等被认为是滑膜非特异性炎症的表现。本组结果显示骨关节病组的慢性炎变较对照组明显,与以往学者的结果类似[3]。
凋亡作为一种生理现象存在于任何组织中,影响组织的转换频率,它还是组织动力学的重要方面,与有丝分裂共同调节组织的增生与退化,并受多种因素影响[4]。凋亡指数是指每百个滑膜内衬细胞中凋亡的细胞平均数目,是研究组织动力学的重要参数[5]。目前尚无骨关节病滑膜凋亡方面的研究。
, 百拇医药
笔者通过半薄切片的观察,发现滑膜内衬层凋亡细胞的形态学特征与Kerr和Leoncini等描述一致[4,5],表现为胞质浓缩,染色加深,与周围分离;胞核浓集呈半月状或小碎片,色深染;核膜变皱,最后形成含有核碎块膜包小体(图3,4)。两组滑膜内衬凋亡细胞计数显示,对照组有一低水平的凋亡指数值(M=0.60%),且其各标本的AI值均接近,说明正常滑膜组织有一低而较恒定的转换频率。而骨关节病组AI值均明显增高(M=2.04%),两组比较差异有显著性(P<0.01)。说明骨关节病滑膜内衬细胞转换频率明显增高与以往学者对骨关节病滑膜生化分析相映衬[3]。引起此增高值的机制目前尚不明了,它在骨关节病的发生发展中的作用还需进一步探讨。但可以推论骨关节病滑膜细胞凋亡作用的增强是多种病理因素共同作用的结果。
凋亡的重要生化特征是在内源性核酸内切酶作用下,有规律的断裂成以200bp为单位的DNA片段,DNA凝胶电泳则出现特征性的凋亡梯带,在200bp处带形最明显,其他带形则为其倍数[7]。本组滑膜组织DNA分析结果显示,病理组DNA电泳带呈梯状,在200bp处较明显,对照组则无(图5)。虽然滑膜组织DNA梯带的出现并不完全是滑膜内衬细胞凋亡的结果,但在组织的初步处理中笔者已尽可能清除滑膜内衬层下面的脂肪和结缔组织,使滑膜内衬细胞在提取的DNA中有一定的份量,故凋亡梯带不仅是整个滑膜组织细胞凋亡的表现,也是两组滑膜内衬细胞凋亡差异有显著性的一个佐证。
, 百拇医药
有报道小肠隐窝和前列腺腺泡的凋亡细胞易脱入肠腔或腺泡腔内[8]。腹膜肿瘤细胞的凋亡小体散在腹腔液也很常见,且常因识别和吞噬障碍发生坏死[9]。本实验也观察到凋亡的滑膜内衬细胞主要处在内衬表层且与周围已发生分离并有脱落的倾向(图4),故推测此种膜状结构的滑膜内衬凋亡细胞有可能脱入关节腔液内,因识别吞噬障碍而发生凋亡性坏死,释放出内容物如溶酶体酶、胶原酶、中性蛋白酶、细胞因子及纤维连接素等而引起关节软骨的损伤[10,11],但尚需实验证实。
本组切片观察未见有丝分裂相,与以往学者的结果类似。但是这种与凋亡频率不相适应的现象说明一方面滑膜内衬细胞局部增殖很弱,另一方面也可证明滑膜内衬细胞主要来源于骨髓单核巨噬细胞系统[12]。凋亡所致的滑膜内衬细胞丢失可能依赖骨髓单核巨噬细胞的迁移和沉积加以补充。
综上所述,骨关节病滑膜内衬细胞凋亡指数远较对照组高(P<0.01),说明骨关节病的滑膜内衬细胞有一高的转换频率。这种高转换在骨关节病的发生发展中可能有重要意义。
, http://www.100md.com
作者单位:附属湘雅医院运动医学科 长沙 410008
参考文献
1 Simkin PA. Physiology of normal and abnormal synovium. Semin Arthritis Rheum, 1991,21(3):179~183
2 Glynn LE. Hypothesis: Primary lesion in osteoarthrosis. Lancet, 1977,12:574~575
3 Myers SL, Brandt KD, Emich JW, et al. Synovial inflammation in patients with early osteoarthritis of the knee. J Rheumatol, 1990,17(12):1662~1669
, http://www.100md.com
4 Kerr JFR, Wyllie AH, Currie AR. Apoptosis: A basic biological phenomenon with wide ranging implication in tissue kinetics. Br J Cancer, 1972,26:239~259
5 Leoncini L, Megha T, et al. Correlations between apoptotic and proliferative induces in malignant Non-hodgkins lymphomas. Am J Pathol, 1993,142(3):755~762
6 Papadimitrion JM, Bruggen IV. Quantiative investigations of apoptosis of murine mononuclear phagocytes during mild hyperthermia. Exp Molecul Pathol, 1983,59:1~12
, 百拇医药
7 Wyllie AH. Apoptosis. Br J Cancer, 1993,67:205~208
8 Kerr JFR. Searle J. Deletion of cells by apoptosis during eastration induced involution in the rat prostate virchows. Arch Abt B Zellpath, 1973,13:87~92
9 Searle J, Lawson TA, Abbot PJ, et al. An electron-microscope study of the mode of cell death induced by cancer-chemotherapeutic agents in populations of proliferating normal and neoplastic cells. J Pathol, 1975,166(3):129~137
, 百拇医药
10 Hendery L. Localization of matrix metalloproteinase(Sromelysin) in osteoarthritic cartilage and synovium. Lab Invest, 1992,66(6):680~689
11 Pelletier JP, Dibattista JA, et al. Cytokines and inflammation in cartilage degeneration. Rheum-Dis Clin North Am, 1993,19(3):545~568
12 Henderson B, Glynn LE, Bitensky L, et al. Evidence for cell division in synoviocytes in acutely inflammed rabbit joints. Ann Rheum Dis, 1981,40:177~181
(本文编辑 陈丽文), 百拇医药
单位:附属湘雅医院运动医学科 长沙 410008
关键词:凋亡;滑膜;内衬细胞*;骨关节病
湖南医科大学学报990512

湖南医科大学学报
BULLETIN OF HUNAN MEDICAL UNIVERSITY
1999年 第24卷 第5期 Vol.24 No.5 1999

, http://www.100md.com 关节滑膜内衬细胞凋亡在骨关节病发生机制中的作用
邱续强 周江南
提要 观察12例骨关节病及10例正常关节的滑膜内衬细胞的细胞凋亡情况,作定量分析且用滑膜组织的DNA凝胶电泳加以证实。结果示,骨关节病滑膜内衬细胞凋亡指数(2.04%)明显高于正常关节组(0.60%);DNA凝胶电泳亦示病理组在200bp处有明显的梯带,对照组则无。提示骨关节病滑膜内衬细胞有高于正常的转换频率,其凋亡作用增强可能在骨关节病的发生发展中有重要意义。
关键词 凋亡; 滑膜; 内衬细胞*; 骨关节病
中国图书分类号 R684
Effects of apoptosis of synovial lining cells on
, 百拇医药
pathogenesis of osteoarthropathy
Qiu Xuqiang Zhou Jiangnan
(Department of Sports Medicine, Xiangya Hospital,Hunan Medical University, Changsha 410008)
The author counted synovial lining cells(SLCs) of apoptosis in the joints of osteoarthropathy(OA, 12 cases) and control(10 cases) patients. The counts of apoptotic SLC were investigated by gel electrophoretic analysis of DNA extracted from synovium. The apoptotic index(AI) of SLCs in OA(2.04%) was obviously higher than that in controls(0.60%); electrophorectogram of DNA revealed a characteristic ladder pattern of DNA fragments at 200bp in the OA group. We conclude that apoptosis can be found in synovial lining layer, and the AI of SLCs in the OA group is much higher than that in the control group, implying the high turn-over rate of SLCs in OA; the increasing apoptosis of SLCs may increase lesion factors retained in joints and cause the injury of articular cartilage.
, 百拇医药
Key words apoptosis; synovial membrane; lining cell*; osteoarthropathy
滑膜是关节滑动体系中的重要组成部分,其生理功能早被许多学者阐明[1]。滑膜的分泌吸收和营养供应是关节软骨维持正常代谢和功能的前提,然而病理状态下的滑膜对关节软骨的影响及其在骨关节病发生发展中的作用研究不多。滑膜病变常被视为继发病变。虽然早在70年代有学者提出了原发性骨关节病的始发部位可能起源于滑膜内衬细胞的假说[2],但几乎所有研究者均着眼于滑膜内衬细胞的增殖、分化及功能表达[3],尚无学者考虑滑膜内衬细胞最后转归,即死亡对骨关节病的影响。细胞凋亡(Apoptosis)是生物界普遍存在而又受体内外多种因素影响的生理现象[4]。研究滑膜内衬细胞凋亡的特点,对探讨骨关节病的发病机理,重新认识滑膜在其发展中应有的作用与地位,并为骨关节病的防治提供新的途径有重要意义。
, 百拇医药
1 资料与方法
1.1 一般资料
所有关节滑膜标本均来源于1993~1994年间我院运动医学科及骨科的住院病人,共22例,分为两组,其中男15例,女7例。所有病人均排除类风湿性关节炎、痛风、自身免疫性疾病和其他内分泌疾病。近3月内无应用激素和非甾体抗炎药物史。实验室检查血尿酸、尿液分析、血常规及血沉均正常。类风湿因子及抗核抗体阴性,抗“O”<500U。均有标准的X线平片资料及术中肉眼所见的关节软骨和滑膜以及其它损伤的情况记录。
1.1.1 骨关节病组 共12例,其中男6例,女6例,年龄21~73(平均41.8)岁。来源于骨关节病行关节置换术和因其他外伤性关节内紊乱的手术病人。标本来源于膝关节8个,髋关节3个,肩关节1个。其中3例伴有其他损伤,1例肩关节脱位,2例半月板损伤。X线显示不同程度的关节间隙变窄,软骨下骨硬化及骨刺形成。术中见关节软骨淡蓝色光泽消失,有絮状物附着,软骨面粗糙,有小区或大片软骨碎裂剥脱,软骨下骨暴露;滑膜略有绒毛结节状,严重者可呈葡萄串状,色较暗,多有充血,表面欠光滑,部分标本滑膜易剥脱撕裂,病变轻者伸展性较好,尚光滑。
, http://www.100md.com
1.1.2 对照组 共10例,其中男9例,女1例,年龄30~40(平均36.5)岁。主要来源于骨肿瘤截肢病人(非关节处肿瘤),或非关节骨折而手术又须进入关节腔者。标本来源于膝关节5个,髋关节3个,踝关节2个。病例均无任何可探测的关节内外紊乱。X线显示正常。手术见关节软骨淡蓝色,表面光滑,无絮状物附着;滑膜光滑、亮泽,伸展性好,无充血,无污物附着,无结节形成。
1.2 方法
1.2.1 组织学切片 参照常规电镜样品制备法,用环氧树酯制2μm的光镜切片,亚甲蓝染色,油镜下观察滑膜内衬凋亡细胞及有丝分裂相。随机连续计数2500个滑膜内衬细胞,若不足者则另随机选择该标本的其他非连续切片累计至2500个细胞。凋亡细胞或凋亡小体的识别参考Kerr及Leoncini[4,5]的方法,并请病理学家鉴定。若一处有多个凋亡小体聚集,仍计为一个凋亡细胞。观察与计数时,注意滑膜内衬细胞的凋亡特点。用AI和MI表示凋亡细胞及有丝分裂相的计数值;即每百个滑膜内衬细胞中凋亡的细胞或有丝分裂相的平均数目。选用成组资料的秩和检验进行统计学处理。
, http://www.100md.com
1.2.2 DNA抽提凝胶电泳 参考Papadimitrion的原理和方法[6]。将冻存-70℃的滑膜组织块剪碎碾成糊状,置于消化缓冲液。消化后行常规DNA抽提,紫外分光光度计测DNA浓度后,取10μg DNA于1.8%琼脂糖凝胶(含0.5μg.ml-1溴乙锭)中电泳(16mA, 8h)。以λDNA/HindⅢ为分子量标准,紫外光下观察电泳带的形成,特点及显现程度,并摄片。
2 结 果
2.1 一般组织学
(1)对照组:滑膜表面光滑,无绒毛,无结节突出,纤维附着物很少。内衬层有1~2层细胞呈长龙样疏松排列,细胞间隔大,内衬下层血管不增生,无充血,单个核细胞浸润较少(图1)。(2)病理组:滑膜表面不光整,有结节样突出,纤维素性物较多、较厚、较广。内衬细胞排列欠规律,有灶性聚集倾向,增生可达5~6层。其内衬下层毛细血管增生呈实心及条索状,血管充血较明显,单个核细胞浸润多呈散在性,围绕血管聚集较少。肥大细胞出现频率较高,尤其是内衬下层(图2)。

, 百拇医药
图1 滑膜内衬细胞呈长龙样排列(↑),并有淋巴细胞(a),肥大细胞(b) ×400
Fig. 1 A long dragon-like SLCs(↑), lymphocytes(a), and mast cells(b) in synovium, stained with methylene blue ×400

图2 骨关节病滑膜内衬下血管增生(a),血管充血(b),滑膜内衬细胞轻度增生(↑),肥大细胞(c) 美蓝染色×200
Fig. 2 Blood vessles proliferation(a), congestion(b), SLCs mild proliferation(↑), and mast cells(c) at the lower-level of synovial lining of OA, stained with methylene blue ×200
, http://www.100md.com
2.2 滑膜内衬细胞凋亡及有丝分裂相观察
两组滑膜内衬层均有凋亡现象。表现为胞体缩小且与周围分离,有一白带环绕胞体,胞质染色较正常滑膜内衬细胞为深,核浓集,深染呈半月状(图3)。凋亡小体表现为含核碎块的膜包小体,可多个聚在一处。滑膜内衬凋亡细胞主要散在于滑膜内衬的表层,有些与内衬层已发生分离,有脱向关节腔内的趋势(图4)。整个切片未见有丝分裂相及滑膜组织的灶性坏死。

图3 滑膜内衬凋亡细胞(↑),美蓝染色 ×1000
Fig. 3 Apoptotic cells in SL(↑), stained with methylene blue×1000

, http://www.100md.com
图4 滑膜内衬细胞凋亡小体已形成(a,b),并有脱离内衬层趋势,美蓝染色 ×1000
Fig. 4 Apoptotic bodies in SL(↑), and haveing the tendency to depart from SL, stained with methylene blue ×1000
2.3 滑膜内衬凋亡细胞计数(A)和凋亡指数(AI)
经统计学处理,骨关节病组AI值M1=2.04%, 对照组M2=0.60%(P<0.01)(附表)。
附表 滑膜内衬凋亡细胞的计数和凋亡指标
标本序号
骨关节病组
, 百拇医药
对照组
A
AI(%)
A
AI(%)
1
55
2.20
14
0.56
2
57
2.28
, 百拇医药 17
0.68
3
45
1.80
14
0.56
4
52
2.08
10
0.40
5
46
, 百拇医药
1.84
15
0.60
6
56
2.20
16
0.64
7
49
1.82
14
0.56
, http://www.100md.com 8
41
1.64
15
0.60
9
50
2.00
16
0.64
10
54
2.16
18
, 百拇医药
0.72
11
45
1.80
12
57
2.28
两组比较P<0.01
2.4 DNA凝胶电泳
病理组有可辨认的DNA梯带出现,于200bp处较明显,其他带则与其成倍数关系。对照组未见此梯带出现(图5)。

, 百拇医药 图5 部分DNA凝胶电泳 病理组:1~6;对照组,7~10
Fig. 5 Apropotion of DNA gel electrophoretic analysis. OA group, 1~6; coutrol group, 7~10
3 讨 论
滑膜内衬细胞层数的增加,血管充血,增生,管壁增厚,单个核细胞浸润等被认为是滑膜非特异性炎症的表现。本组结果显示骨关节病组的慢性炎变较对照组明显,与以往学者的结果类似[3]。
凋亡作为一种生理现象存在于任何组织中,影响组织的转换频率,它还是组织动力学的重要方面,与有丝分裂共同调节组织的增生与退化,并受多种因素影响[4]。凋亡指数是指每百个滑膜内衬细胞中凋亡的细胞平均数目,是研究组织动力学的重要参数[5]。目前尚无骨关节病滑膜凋亡方面的研究。
, 百拇医药
笔者通过半薄切片的观察,发现滑膜内衬层凋亡细胞的形态学特征与Kerr和Leoncini等描述一致[4,5],表现为胞质浓缩,染色加深,与周围分离;胞核浓集呈半月状或小碎片,色深染;核膜变皱,最后形成含有核碎块膜包小体(图3,4)。两组滑膜内衬凋亡细胞计数显示,对照组有一低水平的凋亡指数值(M=0.60%),且其各标本的AI值均接近,说明正常滑膜组织有一低而较恒定的转换频率。而骨关节病组AI值均明显增高(M=2.04%),两组比较差异有显著性(P<0.01)。说明骨关节病滑膜内衬细胞转换频率明显增高与以往学者对骨关节病滑膜生化分析相映衬[3]。引起此增高值的机制目前尚不明了,它在骨关节病的发生发展中的作用还需进一步探讨。但可以推论骨关节病滑膜细胞凋亡作用的增强是多种病理因素共同作用的结果。
凋亡的重要生化特征是在内源性核酸内切酶作用下,有规律的断裂成以200bp为单位的DNA片段,DNA凝胶电泳则出现特征性的凋亡梯带,在200bp处带形最明显,其他带形则为其倍数[7]。本组滑膜组织DNA分析结果显示,病理组DNA电泳带呈梯状,在200bp处较明显,对照组则无(图5)。虽然滑膜组织DNA梯带的出现并不完全是滑膜内衬细胞凋亡的结果,但在组织的初步处理中笔者已尽可能清除滑膜内衬层下面的脂肪和结缔组织,使滑膜内衬细胞在提取的DNA中有一定的份量,故凋亡梯带不仅是整个滑膜组织细胞凋亡的表现,也是两组滑膜内衬细胞凋亡差异有显著性的一个佐证。
, 百拇医药
有报道小肠隐窝和前列腺腺泡的凋亡细胞易脱入肠腔或腺泡腔内[8]。腹膜肿瘤细胞的凋亡小体散在腹腔液也很常见,且常因识别和吞噬障碍发生坏死[9]。本实验也观察到凋亡的滑膜内衬细胞主要处在内衬表层且与周围已发生分离并有脱落的倾向(图4),故推测此种膜状结构的滑膜内衬凋亡细胞有可能脱入关节腔液内,因识别吞噬障碍而发生凋亡性坏死,释放出内容物如溶酶体酶、胶原酶、中性蛋白酶、细胞因子及纤维连接素等而引起关节软骨的损伤[10,11],但尚需实验证实。
本组切片观察未见有丝分裂相,与以往学者的结果类似。但是这种与凋亡频率不相适应的现象说明一方面滑膜内衬细胞局部增殖很弱,另一方面也可证明滑膜内衬细胞主要来源于骨髓单核巨噬细胞系统[12]。凋亡所致的滑膜内衬细胞丢失可能依赖骨髓单核巨噬细胞的迁移和沉积加以补充。
综上所述,骨关节病滑膜内衬细胞凋亡指数远较对照组高(P<0.01),说明骨关节病的滑膜内衬细胞有一高的转换频率。这种高转换在骨关节病的发生发展中可能有重要意义。
, http://www.100md.com
作者单位:附属湘雅医院运动医学科 长沙 410008
参考文献
1 Simkin PA. Physiology of normal and abnormal synovium. Semin Arthritis Rheum, 1991,21(3):179~183
2 Glynn LE. Hypothesis: Primary lesion in osteoarthrosis. Lancet, 1977,12:574~575
3 Myers SL, Brandt KD, Emich JW, et al. Synovial inflammation in patients with early osteoarthritis of the knee. J Rheumatol, 1990,17(12):1662~1669
, http://www.100md.com
4 Kerr JFR, Wyllie AH, Currie AR. Apoptosis: A basic biological phenomenon with wide ranging implication in tissue kinetics. Br J Cancer, 1972,26:239~259
5 Leoncini L, Megha T, et al. Correlations between apoptotic and proliferative induces in malignant Non-hodgkins lymphomas. Am J Pathol, 1993,142(3):755~762
6 Papadimitrion JM, Bruggen IV. Quantiative investigations of apoptosis of murine mononuclear phagocytes during mild hyperthermia. Exp Molecul Pathol, 1983,59:1~12
, 百拇医药
7 Wyllie AH. Apoptosis. Br J Cancer, 1993,67:205~208
8 Kerr JFR. Searle J. Deletion of cells by apoptosis during eastration induced involution in the rat prostate virchows. Arch Abt B Zellpath, 1973,13:87~92
9 Searle J, Lawson TA, Abbot PJ, et al. An electron-microscope study of the mode of cell death induced by cancer-chemotherapeutic agents in populations of proliferating normal and neoplastic cells. J Pathol, 1975,166(3):129~137
, 百拇医药
10 Hendery L. Localization of matrix metalloproteinase(Sromelysin) in osteoarthritic cartilage and synovium. Lab Invest, 1992,66(6):680~689
11 Pelletier JP, Dibattista JA, et al. Cytokines and inflammation in cartilage degeneration. Rheum-Dis Clin North Am, 1993,19(3):545~568
12 Henderson B, Glynn LE, Bitensky L, et al. Evidence for cell division in synoviocytes in acutely inflammed rabbit joints. Ann Rheum Dis, 1981,40:177~181
(本文编辑 陈丽文), 百拇医药