蒙古沙土鼠急性脑缺血时新皮质中单胺类神经递质代谢的变化
作者:欧阳珊 武英 陆雪芬
单位:欧阳珊 武英湖:南医科大学附属湘雅医院(长沙 410008);陆雪芬:广州医学院附属第二医院(广州 510001)
关键词:脑缺血;生物源单胺类;色谱法;高压液相;沙鼠亚科Abstract
湖南医学990502 摘要 目的 分析脑缺血时单胺类神经递质代谢变化的规律并比较其敏感性。方法 结扎成年蒙古沙土鼠左侧颈总动脉建立脑缺血动物模型,以动脉假手术为对照组,采用高效液相色谱法,测定脑缺血6 h新皮层内去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)、3,4-二羟基苯乙酸(DOPAC)、高香草酸(HVA)、5-羟吲哚乙酸(5-HIAA)、色氨酸(Trp)含量。结果 结扎侧单胺递质含量显著降低,其代谢产物含量显著升高;结扎对侧也有类似的变化。结论 单胺递质及其代谢产物水平的变化多数与缺血症状严重程度密切相关。多因素分析发现其中NE水平变化最明显。
, http://www.100md.com
Changes of Monoamine Metabolism in Neocortex of Mongolian Gerbils in Acute Cerebral Ischemia
OU Yangshan,WU Ying,LU Xuefen*
Department of Neurology, Xiangya Hospital,Hunan Medical University,Changsha,410008
(*Department of Neurology,The Second Affiliated Hospital,Guangzhou Medical College,Guangzhou,510001)
Objective To analyze the rule of metabolic changes of monoamines in acute cerebral ischemia and compare its sensitivity.Methods The post-ischemic effects on levels of tryptophan(Trp),monoamines(NE,DA,5-HT) and their metabolites [3,4-dihydroxyphenylacetic acid (DOPAC),homovanillic acid (HVA),5-hydroxyindole acetic acid (5-HIAA)]in neocortex of Mongolian gerbils subjected to left common carotid artery occlusion for 6 hours (i.e.animal models of cerebral ischemia) were estimated by high-performance liquid chromatography.The sham operated gerbils were taken as control group.Results Significantly decreased NE,5-HT levels and increased DOPAC,HVA,5-HIAA levels accompanying with a distinct change of Trp levels were found in the neocortex of the occluded side.Similar results were obtained on the opposite side of occlusion.Conclusion The changes of NE,5-HT,DOPAC,HVA,5-HIAA levels(especially NE)as well as the ratios of (DOPAC+HVA)/DA and 5-HIAA/5-HT were closely correlated with the severity of the ischemia symptoms (stroke index).
, 百拇医药
Key words cerebral ischemia;biogenic monoamines;chromatography,high pressure liquid;gerbillinae
单胺类神经递质在脑缺血时代谢发生紊乱,它在脑缺血发病机制中的作用逐渐受到重视,但所得结果并不一致[1~4]。国内外学者尚未能对几种主要单胺递质及其代谢产物进行较全面的分析,未能比较单胺递质代谢过程中的系列物质在脑缺血时变化的敏感性。本实验研究蒙古沙土鼠新皮层内脑缺血时各单胺递质及其代谢产物的变化情况,以分析脑缺血时这些物质变化的规律并比较其敏感性。
1 材料与方法
1.1 实验对象 人工饲养的蒙古沙土鼠30只,体重40~80 g,平均(59.8±10.1)g,雄14只,雌16只,按随机区组方法,按窝别分为十个区组,然后从每一区组中随机分出一只为对照、二只为实验动物。
, 百拇医药
1.2 脑缺血动物模型的建立 吸入乙醚麻醉后,正中切开沙土鼠颈部腹面皮肤约2 cm,钝性分离皮下组织,游离左颈总动脉并予双重结扎,然后缝合皮肤放回笼中观察。对照组除不予结扎动脉外,其余处理步骤完全相同。术后连续观察6 h,再作乙醚麻醉,从耳后用利剪快速断头处死。对实验动物术后表现,根据Ohnok等修改方法进行观察评分[3]。根据症状轻重分三组:中风指数≥10分、1~9分、0分分别为症状严重组A组、症状较轻组B、无症状组C组,各为4,9,7只。
1.3 脑组织的处理 断头后迅速剥出全脑组织,放入冰生理盐水中洗净,除去表面脑膜及粗大血管,然后置于冰玻璃板上分离出新皮层置试管中,立即插入二氧化碳干冰中冷冻,置-75 ℃超低温冰箱保存。分析前称其湿重,称重后加入30倍脑组织处理液,用超声细胞破碎器在冰浴的条件下,将脑组织制备成匀浆,然后在4 ℃下、15 000 g的相对离心力的条件下离心20 min,吸取上清液并过滤。
1.4 分析仪器与方法 采用Beckman公司的Model 332型梯度洗脱高效液相色谱系统,反相C18Ultrasphere ODS分析柱(250 mm×4.6 mm,d=5μ),BAS公司LC-3A型电化学检测器,一次进样50 μl,即可测出去甲肾上腺素(NE)、5-羟色胺(5-HT)、3,4-二羟基苯乙酸(DOPAC)、5-羟吲哚乙酸(5-HIAA)、色氨酸(Trp)含量(仿Saller及Salama法)[6,7]。
, 百拇医药
2 结果
2.1 各组新皮质内单胺递质及其代谢产物和色氨酸水平比较 见表1。在对照组中,左、右侧新皮层内色氨酸、单胺递质及其代谢产物的含量比较差异无显著性。在结扎侧新皮层内,NE,DOPAC,HVA,5-HIAA含量4组间差异有显著性。症状严重组较其余三组NE,5-HT含量明显下降,DOPAC,HVA,5-HIAA含量明显升高,差异均有高度显著性(P<0.01);症状较轻组NE含量与无症状组相比也有下降,差异亦有显著性;症状严重组DA含量较假手术组明显降低,差异亦显著;Trp含量变化不明显。在结扎对侧新皮层内,HVA,5-HIAA含量4组间差异有高度显著性,且症状严重组较其余三组明显升高(P<0.01),Trp变化不明显。
表1 各组双侧新皮层内色氨酸、单胺递质及代谢产物含量的变化( ±s) 组别
±s) 组别
, http://www.100md.com
n
NE
(ng/g湿重)
DA
(ng/g湿重)
5-HT
(ng/g湿重)
DOPAC
(ng/g湿重)
HVA
(ng/g湿重)
5-HIAA
(ng/g湿重)
, http://www.100md.com
Trp
(μg/g湿重)
A
结扎侧
4
433.21±115.22
747.14±476.65
349.35±54.11
209.17±112.29
2225.30±523.80
228.36±40.19
11.955±2.355
, 百拇医药
对侧
532.10±145.09
1668.32±524.85
571.95±150.70
88.16±31.64
1620.11±1190.86
147.43±62.29
21.650±13.365
B
结扎侧
9
699.40±222.39
, http://www.100md.com
1299.68±747.77
652.11±111.61
78.76±84.32
1224.90±1044.23
96.61±69.90
17.427±14.121
对侧
807.89±264.80
1145.05±552.72
681.32±126.37
49.14±28.49
, 百拇医药
632.46±230.24
77.17±36.67
18.102±13.978
C
结扎侧
7
905.22±213.06
1040.30±397.85
604.44±165.45
58.08±29.46
585.24±247.60
, http://www.100md.com 77.33±44.05
21.592±24.575
对侧
777.77±154.34
1216.55±440.18
662.07±75.99
59.11±56.77
548.75±216.43
49.13±12.93
17.456±5.709
D
, 百拇医药 左侧
10
819.85±124.79
1580.50±427.65
725.51±82.45
60.21±30.21
759.48±185.86
69.59±23.28
13.060±8.185
右侧
735.61±90.54
1275.50±368.23
, 百拇医药
664.71±72.46
50.92±29.73
613.21±310.70
68.68±40.11
18.224±11.653
2.2 脑缺血时单胺递质含量与相应的主要代谢产物含量比值的变化 结果见表2。表2 脑缺血时各组单胺递质代谢产物与单胺递质
之比值的变化( ±s)
±s)
组别
n
, 百拇医药
(DOPAC+HVA)/DA
5-HIAA/5-HT
左
右
左
右
A
4
3.85±1.29
1.02±0.52
0.67±0.19
0.26±0.08
B
, 百拇医药
9
1.09±1.31
0.69±0.31
0.15±0.12
0.11±0.04
C
7
0.65±0.10
0.50±0.10
0.13±0.07
0.08±0.02
D
, 百拇医药
10
0.53±0.22
0.54±0.22
0.10±0.04
0.10±0.05
以中风指数为自变量,比值为因变量,分析它们之间的相关性见表3。结扎侧及结扎对侧组(DOPAC+HVA)/DA,5-HIAA/5-HT相比较差异有高度显著性或显著性,且症状严重组与其余三组之间比较差异也均有高度显著性或显著性。比值与缺血症状严重程度间有高度显著性相关。表3 中风指数(x)与单胺递质及其相应的代谢
产物之比值(y)间的直线相关与回归分析
指标
, 百拇医药 n
直线回归方程
r
P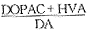
左
20 =0.4455+0.2214x
=0.4455+0.2214x
0.7409
<0.01
右
20 =0.4970+0.0417x
=0.4970+0.0417x
, 百拇医药
0.6232
<0.01
左
20 =0.0681+0.0388x
=0.0681+0.0388x
0.8264
<0.01
右
20 =0.0719+0.0119x
=0.0719+0.0119x
0.7731
, 百拇医药
<0.01
2.3 直线相关与回归分析 在实验动物新皮层内,单胺递质及其代谢产物、色氨酸在脑缺血时含量变化与缺血症状的严重程度(中风指数)之间的直线相关与回归分析见表4。以中风指数为自变量,以实验与对照动物比较所得单胺递质及色氨酸的降低值、单胺递质代谢产物升高值为因变量,进行直线回归与相关性分析。左、右两侧NE,HVA,5-HIAA及左侧5-HT,DOPAC含量的变化与中风指数之间有高度显著性或显著性相关;DA及Trp含量变化与中风指数之间相关性不显著。表4 各物质含量的变化与中风指数之间直线相关与回归分析
指标
左/右
n
直线回归方程
r
, 百拇医药
P
NE
左
20 =60.86+34.58x
=60.86+34.58x
0.6531
<0.01
右
20 =-115.82+22.12x
=-115.82+22.12x
0.4841
<0.05
, http://www.100md.com
DA
左
20 =340.45+17.53x
=340.45+17.53x
0.1262
>0.05
右
20 =114.05-25.17x
=114.05-25.17x
-0.1974
>0.05
5-HT
, http://www.100md.com
左
20 =58.65+19.57x
=58.65+19.57x
0.4824
<0.05
右
20 =-10.67+4.78x
=-10.67+4.78x
0.1872
>0.05
DOPAC
左
, 百拇医药
20 =-14.27+10.99x
=-14.27+10.99x
0.5666
<0.01
右
20 =1.32+1.74x
=1.32+1.74x
0.2114
>0.05
HVA
左
20 =-90.13+113.14x
=-90.13+113.14x
, 百拇医药
0.6079
<0.01
右
20 =-194.33+81.23x
=-194.33+81.23x
0.5378
<0.05
5-HIAA
左
20 =1.17+9.67x
=1.17+9.67x
0.6497
, 百拇医药
<0.01
右
20 =-15.87+6.08x
=-15.87+6.08x
0.4963
<0.01
Trp
左
20 =-11.290+1.234x
=-11.290+1.234x
0.3127
>0.05
, 百拇医药
右
20 =0.041-0.086x
=0.041-0.086x
-0.1535
>0.05
2.4 多因素分析 以缺血症状的严重程度(中风指数)为因变量,以结扎后单胺递质及色氨酸下降值,单胺递质代谢产物之升高值为自变量进行多元逐步回归分析,结果NE变化最显著,结扎侧最明显;代谢产物以结扎侧5-HIAA变化最明显,对侧为HVA变化最显著。
3 讨论
3.1 实验性脑缺血动物模型 结扎蒙古沙土鼠颈总动脉是比较公认的脑缺血动物模型之一[3]。以往各家报道的结果多数以有无运动症状来区分中风与非中风动物,中风率多为40%左右。1984年Ohno K等[3]通过分析局部脑血流量的变化与中风症状的严重性(中风指数)之间的相关性来进行评分。本实验中,实验处理动物缺血症状的发生率与Ohno K等报道的结果非常相似,而且所测得的单胺递质及其主要代谢产物的变化规律,也支持其结论[5]。
, 百拇医药
3.2 单胺类神经递质代谢变化的可能机制及其在脑缺血发生中的作用 结扎蒙古沙土鼠左侧颈总动脉6 h后,结扎侧新皮层内单胺递质的含量下降,而单胺递质的代谢产物的含量则升高,说明脑缺血时单胺递质的代谢过程发生了明显的变化,推测这种变化的机制,可能是由于脑组织的缺血缺氧,细胞的能量代谢过程发生障碍,细胞可利用的高能磷酸键逐渐耗竭,使得单胺递质的合成酶,如酪氨酸羟化酶、色氨酸羟化酶等的活性降低[8],结果导致单胺递质合成减少;同时,因为单胺类递质被重摄取也需通过细胞膜的转运、贮存入突触小泡及突触小泡的再生均是单胺类神经元活动中重要的耗能过程,因此,能量代谢的障碍,也使得突触重摄取的功能降低[9]。加之脑缺血时单胺神经元末梢的受损,单胺递质释放的增多,而已释放入突触间隙又不能被迅速重摄取贮存入突触小泡的大量的单胺递质,则可能被神经元胞浆中及神经元外的单胺氧化酶(MAO)氧化分解,结果表现出单胺递质的含量降低,其代谢产物的水平上升。
除了结扎侧新皮层内单胺递质的代谢发生紊乱,其对侧也有着类似的变化趋势,原因还不清楚。有作者报道结扎一侧沙土鼠颈内动脉后,损害了两侧半球之间神经环路中的联络纤维,使得对侧半球接受结扎的神经冲动减少而出现跨半球的“失神经联系”现象。
, 百拇医药
单胺递质含量(NE及5-HT)的下降,单胺递质代谢产物含量的上升均与缺血症状的严重程度(中风指数)密切相关。通过电子计算机多元逐步回归的分析,也证实了这一点,并且发现NE的含量的下降对脑缺血最为敏感,说明单胺神经递质代谢过程中的系列物质(NE,5-HT,DOPAC,HVA,5-HIAA)均可作为反映脑组织缺血性损害程度的较好生化指标,其中又以结扎侧NE的变化最为敏感。单胺神经递质的代谢紊乱在脑缺血病理生理变化中,可能不只是一个被动过程,它们对脑缺血的发生发展可能有某些主动的作用。但其确切的作用及因果关系,还需进一步研究。
参考文献
1 Zervas NT,Lavyne MH,Negoro M.Neurotransmitters and the normal and ischemic cerebral circulation.New Eng J Med,1975,293(16):812~861
, 百拇医药
2 Wurtman RJ,Zervas NT.Monoamine neurotransmitters and pathophysiology of stroke and central nervous system trauma.J Neurosurg,1974,40(1):34~36
3 Ohno K, Ito U,Inaba Y.Regional cerebral blood flow and stroke index after left carotid artery ligation in the conscious gerbils.Brain Res,1984,297;151~157
4 Gaudet R,Welch KMA,Chabi E,et al.Effect of transicent ischemia on monoamine levels in the cerebral cortex of gerbils.J Neurochem,1978,30:751~757
, http://www.100md.com
5 Cvejic V.Monoamines and related enzymes in cerebral cortex and basal ganglis following transicent ischemia in gerbils.Acta Neuropathologics,1980,51:71~77
6 Saller CF,Salama AI.Rapid automated analysis biogenic amine and their metabolites using reversed-phase high performance liquid chromatography with electrochemical detection.J Chromatogr,1984,309:287~298
7 Warnhoff M.Simultaneous determination of NE,DA,5-HT and their main metabolites in rat brain using high-performance liquid chromatography with electrochemical detection.J Chromatogr,1984,307:271~281
8 Davis JN,Cailson A.The effect of hypoxia on monoamine synthesis,levels and metabolism in rat brain.J Neurochem,1973,21:783~790
9 Mrsvlja BB.Catecholarmine in!brain ischemia effect of alpha-methy-p-tyrosine and pargyline.Brain Res,1976,104:373~837
(19980504 收稿), 百拇医药
单位:欧阳珊 武英湖:南医科大学附属湘雅医院(长沙 410008);陆雪芬:广州医学院附属第二医院(广州 510001)
关键词:脑缺血;生物源单胺类;色谱法;高压液相;沙鼠亚科Abstract
湖南医学990502 摘要 目的 分析脑缺血时单胺类神经递质代谢变化的规律并比较其敏感性。方法 结扎成年蒙古沙土鼠左侧颈总动脉建立脑缺血动物模型,以动脉假手术为对照组,采用高效液相色谱法,测定脑缺血6 h新皮层内去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)、3,4-二羟基苯乙酸(DOPAC)、高香草酸(HVA)、5-羟吲哚乙酸(5-HIAA)、色氨酸(Trp)含量。结果 结扎侧单胺递质含量显著降低,其代谢产物含量显著升高;结扎对侧也有类似的变化。结论 单胺递质及其代谢产物水平的变化多数与缺血症状严重程度密切相关。多因素分析发现其中NE水平变化最明显。
, http://www.100md.com
Changes of Monoamine Metabolism in Neocortex of Mongolian Gerbils in Acute Cerebral Ischemia
OU Yangshan,WU Ying,LU Xuefen*
Department of Neurology, Xiangya Hospital,Hunan Medical University,Changsha,410008
(*Department of Neurology,The Second Affiliated Hospital,Guangzhou Medical College,Guangzhou,510001)
Objective To analyze the rule of metabolic changes of monoamines in acute cerebral ischemia and compare its sensitivity.Methods The post-ischemic effects on levels of tryptophan(Trp),monoamines(NE,DA,5-HT) and their metabolites [3,4-dihydroxyphenylacetic acid (DOPAC),homovanillic acid (HVA),5-hydroxyindole acetic acid (5-HIAA)]in neocortex of Mongolian gerbils subjected to left common carotid artery occlusion for 6 hours (i.e.animal models of cerebral ischemia) were estimated by high-performance liquid chromatography.The sham operated gerbils were taken as control group.Results Significantly decreased NE,5-HT levels and increased DOPAC,HVA,5-HIAA levels accompanying with a distinct change of Trp levels were found in the neocortex of the occluded side.Similar results were obtained on the opposite side of occlusion.Conclusion The changes of NE,5-HT,DOPAC,HVA,5-HIAA levels(especially NE)as well as the ratios of (DOPAC+HVA)/DA and 5-HIAA/5-HT were closely correlated with the severity of the ischemia symptoms (stroke index).
, 百拇医药
Key words cerebral ischemia;biogenic monoamines;chromatography,high pressure liquid;gerbillinae
单胺类神经递质在脑缺血时代谢发生紊乱,它在脑缺血发病机制中的作用逐渐受到重视,但所得结果并不一致[1~4]。国内外学者尚未能对几种主要单胺递质及其代谢产物进行较全面的分析,未能比较单胺递质代谢过程中的系列物质在脑缺血时变化的敏感性。本实验研究蒙古沙土鼠新皮层内脑缺血时各单胺递质及其代谢产物的变化情况,以分析脑缺血时这些物质变化的规律并比较其敏感性。
1 材料与方法
1.1 实验对象 人工饲养的蒙古沙土鼠30只,体重40~80 g,平均(59.8±10.1)g,雄14只,雌16只,按随机区组方法,按窝别分为十个区组,然后从每一区组中随机分出一只为对照、二只为实验动物。
, 百拇医药
1.2 脑缺血动物模型的建立 吸入乙醚麻醉后,正中切开沙土鼠颈部腹面皮肤约2 cm,钝性分离皮下组织,游离左颈总动脉并予双重结扎,然后缝合皮肤放回笼中观察。对照组除不予结扎动脉外,其余处理步骤完全相同。术后连续观察6 h,再作乙醚麻醉,从耳后用利剪快速断头处死。对实验动物术后表现,根据Ohnok等修改方法进行观察评分[3]。根据症状轻重分三组:中风指数≥10分、1~9分、0分分别为症状严重组A组、症状较轻组B、无症状组C组,各为4,9,7只。
1.3 脑组织的处理 断头后迅速剥出全脑组织,放入冰生理盐水中洗净,除去表面脑膜及粗大血管,然后置于冰玻璃板上分离出新皮层置试管中,立即插入二氧化碳干冰中冷冻,置-75 ℃超低温冰箱保存。分析前称其湿重,称重后加入30倍脑组织处理液,用超声细胞破碎器在冰浴的条件下,将脑组织制备成匀浆,然后在4 ℃下、15 000 g的相对离心力的条件下离心20 min,吸取上清液并过滤。
1.4 分析仪器与方法 采用Beckman公司的Model 332型梯度洗脱高效液相色谱系统,反相C18Ultrasphere ODS分析柱(250 mm×4.6 mm,d=5μ),BAS公司LC-3A型电化学检测器,一次进样50 μl,即可测出去甲肾上腺素(NE)、5-羟色胺(5-HT)、3,4-二羟基苯乙酸(DOPAC)、5-羟吲哚乙酸(5-HIAA)、色氨酸(Trp)含量(仿Saller及Salama法)[6,7]。
, 百拇医药
2 结果
2.1 各组新皮质内单胺递质及其代谢产物和色氨酸水平比较 见表1。在对照组中,左、右侧新皮层内色氨酸、单胺递质及其代谢产物的含量比较差异无显著性。在结扎侧新皮层内,NE,DOPAC,HVA,5-HIAA含量4组间差异有显著性。症状严重组较其余三组NE,5-HT含量明显下降,DOPAC,HVA,5-HIAA含量明显升高,差异均有高度显著性(P<0.01);症状较轻组NE含量与无症状组相比也有下降,差异亦有显著性;症状严重组DA含量较假手术组明显降低,差异亦显著;Trp含量变化不明显。在结扎对侧新皮层内,HVA,5-HIAA含量4组间差异有高度显著性,且症状严重组较其余三组明显升高(P<0.01),Trp变化不明显。
表1 各组双侧新皮层内色氨酸、单胺递质及代谢产物含量的变化(
 ±s) 组别
±s) 组别, http://www.100md.com
n
NE
(ng/g湿重)
DA
(ng/g湿重)
5-HT
(ng/g湿重)
DOPAC
(ng/g湿重)
HVA
(ng/g湿重)
5-HIAA
(ng/g湿重)
, http://www.100md.com
Trp
(μg/g湿重)
A
结扎侧
4
433.21±115.22
747.14±476.65
349.35±54.11
209.17±112.29
2225.30±523.80
228.36±40.19
11.955±2.355
, 百拇医药
对侧
532.10±145.09
1668.32±524.85
571.95±150.70
88.16±31.64
1620.11±1190.86
147.43±62.29
21.650±13.365
B
结扎侧
9
699.40±222.39
, http://www.100md.com
1299.68±747.77
652.11±111.61
78.76±84.32
1224.90±1044.23
96.61±69.90
17.427±14.121
对侧
807.89±264.80
1145.05±552.72
681.32±126.37
49.14±28.49
, 百拇医药
632.46±230.24
77.17±36.67
18.102±13.978
C
结扎侧
7
905.22±213.06
1040.30±397.85
604.44±165.45
58.08±29.46
585.24±247.60
, http://www.100md.com 77.33±44.05
21.592±24.575
对侧
777.77±154.34
1216.55±440.18
662.07±75.99
59.11±56.77
548.75±216.43
49.13±12.93
17.456±5.709
D
, 百拇医药 左侧
10
819.85±124.79
1580.50±427.65
725.51±82.45
60.21±30.21
759.48±185.86
69.59±23.28
13.060±8.185
右侧
735.61±90.54
1275.50±368.23
, 百拇医药
664.71±72.46
50.92±29.73
613.21±310.70
68.68±40.11
18.224±11.653
2.2 脑缺血时单胺递质含量与相应的主要代谢产物含量比值的变化 结果见表2。表2 脑缺血时各组单胺递质代谢产物与单胺递质
之比值的变化(
 ±s)
±s)组别
n
, 百拇医药
(DOPAC+HVA)/DA
5-HIAA/5-HT
左
右
左
右
A
4
3.85±1.29
1.02±0.52
0.67±0.19
0.26±0.08
B
, 百拇医药
9
1.09±1.31
0.69±0.31
0.15±0.12
0.11±0.04
C
7
0.65±0.10
0.50±0.10
0.13±0.07
0.08±0.02
D
, 百拇医药
10
0.53±0.22
0.54±0.22
0.10±0.04
0.10±0.05
以中风指数为自变量,比值为因变量,分析它们之间的相关性见表3。结扎侧及结扎对侧组(DOPAC+HVA)/DA,5-HIAA/5-HT相比较差异有高度显著性或显著性,且症状严重组与其余三组之间比较差异也均有高度显著性或显著性。比值与缺血症状严重程度间有高度显著性相关。表3 中风指数(x)与单胺递质及其相应的代谢
产物之比值(y)间的直线相关与回归分析
指标
, 百拇医药 n
直线回归方程
r
P
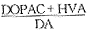
左
20
 =0.4455+0.2214x
=0.4455+0.2214x0.7409
<0.01
右
20
 =0.4970+0.0417x
=0.4970+0.0417x, 百拇医药
0.6232
<0.01

左
20
 =0.0681+0.0388x
=0.0681+0.0388x0.8264
<0.01
右
20
 =0.0719+0.0119x
=0.0719+0.0119x0.7731
, 百拇医药
<0.01
2.3 直线相关与回归分析 在实验动物新皮层内,单胺递质及其代谢产物、色氨酸在脑缺血时含量变化与缺血症状的严重程度(中风指数)之间的直线相关与回归分析见表4。以中风指数为自变量,以实验与对照动物比较所得单胺递质及色氨酸的降低值、单胺递质代谢产物升高值为因变量,进行直线回归与相关性分析。左、右两侧NE,HVA,5-HIAA及左侧5-HT,DOPAC含量的变化与中风指数之间有高度显著性或显著性相关;DA及Trp含量变化与中风指数之间相关性不显著。表4 各物质含量的变化与中风指数之间直线相关与回归分析
指标
左/右
n
直线回归方程
r
, 百拇医药
P
NE
左
20
 =60.86+34.58x
=60.86+34.58x0.6531
<0.01
右
20
 =-115.82+22.12x
=-115.82+22.12x0.4841
<0.05
, http://www.100md.com
DA
左
20
 =340.45+17.53x
=340.45+17.53x0.1262
>0.05
右
20
 =114.05-25.17x
=114.05-25.17x-0.1974
>0.05
5-HT
, http://www.100md.com
左
20
 =58.65+19.57x
=58.65+19.57x0.4824
<0.05
右
20
 =-10.67+4.78x
=-10.67+4.78x0.1872
>0.05
DOPAC
左
, 百拇医药
20
 =-14.27+10.99x
=-14.27+10.99x0.5666
<0.01
右
20
 =1.32+1.74x
=1.32+1.74x0.2114
>0.05
HVA
左
20
 =-90.13+113.14x
=-90.13+113.14x, 百拇医药
0.6079
<0.01
右
20
 =-194.33+81.23x
=-194.33+81.23x0.5378
<0.05
5-HIAA
左
20
 =1.17+9.67x
=1.17+9.67x0.6497
, 百拇医药
<0.01
右
20
 =-15.87+6.08x
=-15.87+6.08x0.4963
<0.01
Trp
左
20
 =-11.290+1.234x
=-11.290+1.234x0.3127
>0.05
, 百拇医药
右
20
 =0.041-0.086x
=0.041-0.086x-0.1535
>0.05
2.4 多因素分析 以缺血症状的严重程度(中风指数)为因变量,以结扎后单胺递质及色氨酸下降值,单胺递质代谢产物之升高值为自变量进行多元逐步回归分析,结果NE变化最显著,结扎侧最明显;代谢产物以结扎侧5-HIAA变化最明显,对侧为HVA变化最显著。
3 讨论
3.1 实验性脑缺血动物模型 结扎蒙古沙土鼠颈总动脉是比较公认的脑缺血动物模型之一[3]。以往各家报道的结果多数以有无运动症状来区分中风与非中风动物,中风率多为40%左右。1984年Ohno K等[3]通过分析局部脑血流量的变化与中风症状的严重性(中风指数)之间的相关性来进行评分。本实验中,实验处理动物缺血症状的发生率与Ohno K等报道的结果非常相似,而且所测得的单胺递质及其主要代谢产物的变化规律,也支持其结论[5]。
, 百拇医药
3.2 单胺类神经递质代谢变化的可能机制及其在脑缺血发生中的作用 结扎蒙古沙土鼠左侧颈总动脉6 h后,结扎侧新皮层内单胺递质的含量下降,而单胺递质的代谢产物的含量则升高,说明脑缺血时单胺递质的代谢过程发生了明显的变化,推测这种变化的机制,可能是由于脑组织的缺血缺氧,细胞的能量代谢过程发生障碍,细胞可利用的高能磷酸键逐渐耗竭,使得单胺递质的合成酶,如酪氨酸羟化酶、色氨酸羟化酶等的活性降低[8],结果导致单胺递质合成减少;同时,因为单胺类递质被重摄取也需通过细胞膜的转运、贮存入突触小泡及突触小泡的再生均是单胺类神经元活动中重要的耗能过程,因此,能量代谢的障碍,也使得突触重摄取的功能降低[9]。加之脑缺血时单胺神经元末梢的受损,单胺递质释放的增多,而已释放入突触间隙又不能被迅速重摄取贮存入突触小泡的大量的单胺递质,则可能被神经元胞浆中及神经元外的单胺氧化酶(MAO)氧化分解,结果表现出单胺递质的含量降低,其代谢产物的水平上升。
除了结扎侧新皮层内单胺递质的代谢发生紊乱,其对侧也有着类似的变化趋势,原因还不清楚。有作者报道结扎一侧沙土鼠颈内动脉后,损害了两侧半球之间神经环路中的联络纤维,使得对侧半球接受结扎的神经冲动减少而出现跨半球的“失神经联系”现象。
, 百拇医药
单胺递质含量(NE及5-HT)的下降,单胺递质代谢产物含量的上升均与缺血症状的严重程度(中风指数)密切相关。通过电子计算机多元逐步回归的分析,也证实了这一点,并且发现NE的含量的下降对脑缺血最为敏感,说明单胺神经递质代谢过程中的系列物质(NE,5-HT,DOPAC,HVA,5-HIAA)均可作为反映脑组织缺血性损害程度的较好生化指标,其中又以结扎侧NE的变化最为敏感。单胺神经递质的代谢紊乱在脑缺血病理生理变化中,可能不只是一个被动过程,它们对脑缺血的发生发展可能有某些主动的作用。但其确切的作用及因果关系,还需进一步研究。
参考文献
1 Zervas NT,Lavyne MH,Negoro M.Neurotransmitters and the normal and ischemic cerebral circulation.New Eng J Med,1975,293(16):812~861
, 百拇医药
2 Wurtman RJ,Zervas NT.Monoamine neurotransmitters and pathophysiology of stroke and central nervous system trauma.J Neurosurg,1974,40(1):34~36
3 Ohno K, Ito U,Inaba Y.Regional cerebral blood flow and stroke index after left carotid artery ligation in the conscious gerbils.Brain Res,1984,297;151~157
4 Gaudet R,Welch KMA,Chabi E,et al.Effect of transicent ischemia on monoamine levels in the cerebral cortex of gerbils.J Neurochem,1978,30:751~757
, http://www.100md.com
5 Cvejic V.Monoamines and related enzymes in cerebral cortex and basal ganglis following transicent ischemia in gerbils.Acta Neuropathologics,1980,51:71~77
6 Saller CF,Salama AI.Rapid automated analysis biogenic amine and their metabolites using reversed-phase high performance liquid chromatography with electrochemical detection.J Chromatogr,1984,309:287~298
7 Warnhoff M.Simultaneous determination of NE,DA,5-HT and their main metabolites in rat brain using high-performance liquid chromatography with electrochemical detection.J Chromatogr,1984,307:271~281
8 Davis JN,Cailson A.The effect of hypoxia on monoamine synthesis,levels and metabolism in rat brain.J Neurochem,1973,21:783~790
9 Mrsvlja BB.Catecholarmine in!brain ischemia effect of alpha-methy-p-tyrosine and pargyline.Brain Res,1976,104:373~837
(19980504 收稿), 百拇医药