头低位(-20°)限制活动7d对兔庆大霉素药代动力学的影响
作者:郭志峰 高建义 王宝珍 石宏志 王静 钱锦康
单位:航天医学工程研究所,北京 100094
关键词:失重模拟;药代动力学;庆大霉素;兔
航天医学与医学工程990505摘要:目的 探讨模拟失重条件下以血流量改变为生理基础的药代动力学变化。方法 选择庆大霉素作为模型药物,采用头低位(-20°)兔限制活动为模拟失重动物模型,观察模拟失重对兔庆大霉素药代动力学参数的影响。7只家兔在头低位7 d前后,分别静脉滴注了3 mg/kg的庆大霉素,用TDxFLx测定了给药后4 h内的血药浓度。结果 庆大霉素的分布变慢,这表现在α值由头低位前的(0.1838±0.1076)min-1降至头低位后的(0.0591±0.0334)min-1,t1/2α由(5.30±3.55)min延长为(15.04±7.49)min,K12由(0.1025±0.0721)min-1降至(0.0181±0.0161)min-1,都有显著性差异;V(C)、V(D)也有升高的趋势。庆大霉素清除率在模拟失重后也有所增加,CL(S)从(2.2±0.5)ml.min-1.kg-1升至(2.7±0.3)ml.min-1.kg-1。 结论 模拟失重可改变药代动力学过程。
, 百拇医药
中图分类号:R852.22;R859 文献标识码:A 文章编号:1002-0837(1999)05-0333-05
Effects of 7 d Head-Down Tilt(-20°) Immobilization on Pharmacokinetics of Gentamicin in Rabbits
GUO Zhi-feng,GAO Jian-yi,WANG Bao-zhen,SHI Hong-zhi,WANG Jing,QIAN Jin-kang
Abstract:Objective To observe pharmacokinetic changes under simulated weightlessness in relevant to body flood flow changes. Method Gentamicin was selected as probe drug in the present study, and rabbits exposed to Head-Down Tilt( HDT,-20°) immobilization were selected as simulated weightlessness animal model. Seven rabbits were treated inf. with 3 mg/kg of gentamicin sulfate pre-HDT and 7 d after HDT. Gentamicin blood samples within 4 h after administration were analyzed by TDxFLx. Result The distribution of gentamicin postponed significantly: a significant decrease in α from (0.1838±0.1076)min-1 before HDT to (0.0591±0.0334)min-1 after HDT; a significant increase in t1/2 α from (5.30±3.55)min to (15.04±7.49)min;a significant decrease in k12 from (0.1025±0.0721)min-1 to (0.0181±0.0161)min-1,a increase trend in V(C) and V(D). After HDT, CL(S) of gentamicin increased from (2.2±0.5)ml.min-1.kg-1 to (2.7±0.3)ml.min-1.kg-1. Conclusion Simulated weightlessness might induce pharmacokinetic changes.
, 百拇医药
Key words:weightlessness simulation;pharmacokinetics;gentamicin;rabbits
Address reprint requests to:GUO Zhi-feng.Institute of Space Medico-Engineering,Beijing 100094,China
在航天中,航天员用药越来越普遍。据报道[1],航天乘员中80%以上曾经服用过药物,有的甚至是多次服用。失重环境对药物在人体内的处置过程有什么影响尚不清楚。失重环境下,由于血液重新分布,肝、肾等药物清除器官血流可能不同于地面情况,为确保航天员用药的有效性及安全性,有必要研究失重条件下的药代动力学变化。针对血流量改变进行药代动力学研究是探讨失重药代动力学的着眼点,目前,这方面国外有少量研究[2,3],国内尚未开展。本实验选取庆大霉素(Gentamicin,GM)作为研究药物,采用荧光偏振免疫方法(FPIA)测定庆大霉素血药浓度,以头低位(-20°)限制活动7 d的家兔[2]为动物模型,观察了庆大霉素药代动力学的变化,以了解模拟失重对药代动力学过程的影响,为今后失重条件下人体的药代动力学研究奠定基础。
, 百拇医药
方 法
仪器、试剂及试药 全自动荧光偏振免疫分析仪(TDxFLx);庆大霉素试剂盒:批号:9512-60;庆大霉素样本标准液,编号A-F,批号:9512-01;庆大霉素质控品:由低、中、高浓度3瓶含药血清组成,批号:9512-10;以上仪器及试剂均为美国雅培公司产品。硫酸庆大霉素注射液:大同市利群制药厂产品,批号:950415。
动物实验 本实验采用自身对照的实验分组方法。取新西兰白兔7只,雄性,体重2.2~3 kg,适应性饲养3 d后,用生理盐水将硫酸庆大霉素稀释为0.32 mg/ml,通过兔耳缘静脉恒速滴注庆大霉素3.0 mg/kg,给药速度为0.375 mg/min,需时约20 min。在静脉滴注给药结束后5、10、15、30、60、90、120、180、240、300 min于另一侧耳缘静脉取血1.0 ml。动物休息7 d,然后,以兔头低位(-20°)限制活动模型来模拟失重,7 d后,再以同样的方式给药、取血。所取样品在室温下放置,凝血后分离血清,如不能在24 h内分析,置血清于-20℃冰箱内保存。
, 百拇医药
血药浓度的测定 采用FPIA方法测定庆大霉素的血药浓度。根据操作手册作TDxFLx仪器的温度、光路和吸量检查[3],通过后作庆大霉素的标准曲线,存于仪器内。取庆大霉素质控品,依法测得3种不同浓度质控品的回收量,见表1,表明测试值在合格浓度范围之内,TDXFLx可供使用。最低检测浓度为0.27 μg/ml。
表1 庆大霉素质控血清测试值(μg/ml)
Table 1 Serum concentration of gentamicin controls(μg/ml) 浓度
(concentration)
标示量
(given values)
测试值
, http://www.100md.com
(test results)
合格浓度范围
(qualified concentration range)
H
8.00
7.92
7.20~8.80
M
4.00
4.01
3.60~4.40
L
, http://www.100md.com
1.00
1.01
0.85~1.15
药代动力学分析 药代动力学数据用“实用药代动力学程序”即3P87软件来处理。用非线性最小二乘法进行曲线拟合,对于模型的契合程度,采用F检验值,R2值及AIC,结合最大误差进行筛选,以选择房室模型,绘出药时曲线,并求出药代动力学参数。
统计处理 应用“统计设计与分析系统”软件,SDAS 2.0版,对所获药代动力学参数逐项进行“配对t检验”。个别参数呈非正态分布,则采用Wilcoxon's Test。结 果
庆大霉素血药浓度 模拟失重前、后两组庆大霉素血药浓度见表2。
表2 7只家兔模拟失重前、后庆大霉素血药浓度(μg/ml, ±s)
±s)
, http://www.100md.com
Table 2 Mean and median serum concentration of seven rabbits before and after HDT(μg/ml, ±s) 时间
±s) 时间
(time)(min)
模拟失重前
(pre-HDT)
模拟失重后
(after HDT)
5
13.89±2.20
14.23±2.14
, 百拇医药
10
11.81±1.39
12.18±1.36
15
10.41±1.32
10.87±1.17
30
8.79±2.38
7.95±0.97
60
6.04±1.52
5.16±0.86
, 百拇医药
90
4.19±1.11
3.24±0.56
120
3.05±1.11
2.25±0.39
180
1.66±0.53
1.15±0.20
240
1.04±0.35
0.78±0.15
, http://www.100md.com
静滴停药后庆大霉素血药浓度-时间曲线 将模拟失重前、后两组庆大霉素药-时数据对用3P87软件经计算机处理,所得药-时曲线见图1,对于模型的契合程度,经F检验值,R2值及AIC,结合最大误差进行比较,二室模型和单室模型F检验值比较具有显著性差异P<0.01,并且二室模型的R2值较大,AIC值较小,因而开放型二室模型的契合程度优于开放型一室模型,其中一只家兔选择了一室模型。为了能够兼顾分布相及消除相,权重选择1/C。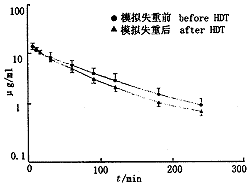
图1 模拟失重前后庆大霉素药时曲线
Fig.1 Mean±SD serum gentamicin concentration-time curves of
rabbits before and after HDT
, http://www.100md.com
药代动力学参数 按开放型二室模型求出的模拟失重前、后两组庆大霉素药代动力学参数及其相差显著性结果见表3。由表可见,模拟失重后兔药代动力学的变化主要表现在α、K12显著下降,t1/2α明显升高,V(C)、V(D)有升高趋势,CL(S)由(2.2±0.2)ml.kg-1.min-1升至(2.7±0.3)ml.kg-1.min-1(P=0.079)。
表3 模拟失重后庆大霉素药代动力学参数的变化(n=6, ±s)
±s)
Table 3 Changes of pharmacokinetic values in rabbits
, 百拇医药
after HDT(n=6, ±s) 参数
±s) 参数
(parameters)
单位
(units)
模拟失重前
(before HDT)
模拟失重后
(after HDT)
A
μg.ml-1
, 百拇医药
16.67±6.53
14.05±8.00
α
min-1
0.1838±0.1076
0.0591±0.0334*
B
μg.ml-1
57.35±17.23
42.76±10.60
β
, 百拇医药
min-1
0.0108±0.0012
0.0107±0.0022
V(C)
l.kg-1
0.0603±0.0441
0.1387±0.0339
V(D)
l.kg-1
0.2033±0.0641
, 百拇医药
0.2617±0.0665
t1/2α
min
5.30±3.55
15.04±7.49*
t1/2β
min
64.62±7.04
68.48±13.84
k21
min-1
, http://www.100md.com
0.0385±0.0094
0.0315±0.0172
k10
min-1
0.0535±0.0370
0.0202±0.0045
k12
min-1
0.1025±0.0721
0.0181±0.0161*
, http://www.100md.com
AUC
μg.ml-1.min
1450.81 ±369.90
1124.72 ±146.76
CL(S)
l.kg-1.min-1
0.0022±0.0005
0.0027±0.0003
注:*P<0.05,与模拟失重前比较 Note:*P<0.05,as compared with pre-HDT
, 百拇医药
讨 论
研究药物的选择 航天药代动力学是航天药理学中的重要组成部分,它着重探讨失重对药物在体内吸收、分布、代谢和排泄的影响。为探讨这种影响,应当针对失重条件下的有代表性的生理生化变化,选取药物加以研究。所选药物应具有如下特点:其体内处置过程中的某一环节受失重所致生理生化变化(如血液重分布引起的全身血流变化)的影响很大,最好这一环节能特征性地反映失重所致生理生化变化;从药代动力学的角度来说,其体内处置过程尽可能地单纯,能足以表征这一环节特点。GM体内处置过程比较单纯,血浆蛋白结合率很低,基本上分布于细胞外液中,在体内不代谢,主要以原形通过肾小球滤过而排泄,肾小管内无排泄和重吸收[4]。选择GM作为研究药物便于研究失重或模拟失重条件下药代动力学变化。但是选择GM会带来一个问题:GM有效血药浓度范围窄,可引起肾的毒性反应[4],影响结果。因而必须选择适当的给药剂量和方式,避免肾毒性。本实验采用静脉滴注的给药方式,参照他人的给药剂量2.0~5.0 mg/kg[5~8],确定为3 mg/kg,并测定了给药前后的兔BUN、Cr值,结果发现其值并未改变,因此可以认为,本实验排除了给药本身对实验结果的影响。
, 百拇医药
模拟失重对兔GM药代动力学的影响 实验结果表明,兔在头低位限制活动后,GM一些有关分布的药代动力学参数发生了明显变化:α由(0.1838±0.1076)min-1降至(0.0591±0.0334)min-1,t1/2 α由(5.30±3.55)min延长为(15.04±7.49)min,这说明模拟失重引起GM分布变慢。通常,药物组织分布的影响因素关键是药物膜通透性及血流量,据此,分布速率划分为膜限速类及血流限速二类[9]。人和动物实验[10,11]已证明:庆大霉素由于水溶性强,极性很高,基本上分布于细胞外液中;易于通过毛细血管壁,庆大霉素能迅速分布到组织间液中,其分布相时间较短,持续数分钟。因而其分布应是血流限速过程。模拟失重对GM分布的影响也主要与血流限速过程有关。
分析GM分布减慢的原因可能与以下因素相关:
(1)模拟失重条件下,各器官血流量发生再分配。实验表明:头低位限制活动时肌肉血流量下降[2],这会导致GM分布的减慢。因为在GM房室模型中,肌肉处于周边室的位置,是药物的组织储库,肌肉血流量的减少会造成GM从中央室向周边室转运变慢,分布减慢。中央室向周边室的转运速率常数K12由(0.1025±0.0721)min-1降至(0.0181±0.0161)min-1证明了这一点。
, 百拇医药
(2)中央室表观分布容积V(C)和表观分布容积V(D)有增加的趋势,GM分布减慢与此有关。因GM分布容积相当于细胞外液容积,说明GM在血液灌注多的器官(中央室),如心、肝、肾、肺的分布容积扩大了,其中值得注意的是肺脏。失重或模拟失重条件下,体液头胸向转移,一方面,通过神经、体液的调节机制,引起体液的减少,主要是血浆(循环血量)和细胞内液的减少;另一方面,这些额外的体液可能滤过到了组织间隙,增加组织间液特别是肺组织间液。Gabel[12]等发现,模拟失重时狗肺重量的增加,主要是因为肺组织间液增加。因而由于血浆容量的减少,组织间液的积聚,在庆大霉素由血浆向组织间液分布时,速度减缓。另外,心输出量的变化也会影响GM分布。关于失重或模拟失重下的心输出量的变化,降低、不变、增加的报道都有。在兔头低位限制活动模拟失重后,心脏功能下降[13],心输出量变化不得而知。分布变慢是否与之相关,由于缺乏相关指标测定,无法判断。
GM的总体清除率CL(S)在模拟失重后有所增加,从(2.2±0.5)ml.min-1.kg-1升至(2.7±0.3)ml.min-1.kg-1,P=0.079。如前所述:GM几乎全部通过肾脏清除,因而CL(S)基本上反映的是肾清除率。因为GM不在肾小管内排泌和重吸收,因此,清除率增加主要反映肾小球滤过率增加。
, http://www.100md.com
分析其原因,模拟失重后肾小球滤过率增加与肾血流量增加有关。因为机体主要通过调节肾血流量来调节肾小球滤过。在模拟失重时,体液头向分布,将影响肾血流量。兔头低位(-20°)15 d内[2],肾皮质血流量持续增加。在鼠尾悬吊(-25°)30 d期间,Tuker[14]观察了肾血浆流量、肾小球滤过率、细胞外液和血浆容积的变化,发现在头低位1~2 wk时前3个参数都平行地升高了,其后恢复到了卧床前水平,而血浆容积持续下降。机制是:肾血浆流量增加而导致的肾小球滤过率增加,是对细胞外液增加的一种反应。本实验观察到兔模拟失重期间V(C)、V(D)增加,CL(S)平行地增加了,可用Tuker的观点加以解释。由于表观分布容积和肾脏清除率都有所增加,因而,消除半衰期t1/2β改变不明显。
总之,兔模拟失重时GM药代动力学的变化,主要是由于体液头向分布引起的。当然,由于缺乏相关的平行实验研究,比如:心输出量,全身血流量,细胞外液等指标的测定,因而对以上过程应进一步探讨。
, http://www.100md.com
参考文献
[1]Pool SL,Davis JR,Cintron NM et al. Medication use and therapeutic effectiveness on the first 33 space shuttle missions[C].In:Yajima K,ed.Proceedings of the third nihon university international symoposium on aerospace science, Nihon university Tokyo Japan,1991:131~136
[2]Kates RE,Harapat SR,Keefe DLD et al.Influence of prolonged recumbency on drug disposition[J].Clin Pharmacol Ther,1980,28(5):624~628
, http://www.100md.com
[3]Saivin S,Traon PL,Cornac A et al.Impact of a four-day head-down tilt(-6°) on lidocaine pharmakinetics used as probe to evaluate hepatic blood flow[J].J Clin Pharmacol,1995,35:697~704
[4]向求鲁,沈羡云,孟京瑞.模拟失重时兔脏器血流量反应特性研究[J].空间科学学报,1989,9(2):148~154
[5]TDx操作手册[M].美国雅培公司编
[6]戴自英.实用抗菌药物学[M].上海:上海科学技术出版社,1992:184
[7]Curl JL,Curl JS.Pharmacokinetics of gentamicin in laboratory rabbits[J]. American Journal of Vetevinary research,1988,49(12):2065~2067
, http://www.100md.com
[8]Ogden L,Wilson RC,Clark CH et al. Pharmacokinetics of gentamicin in rabbits[J]. J Vet Pharmacol Therap,1995,18(2):156~159
[9]丁龙其,张荣珍.微生物法测定家兔中庆大霉素药代动力学的实验[J].现代应用药学,1994,11(2):24~25
[10]Frame PT,Phair JP,Watanaknnakorn C. Pharmacologic factors associated with gentamicin nephrotoxicity in rabbits[J]. J lnfect Dis,1977,135(6),952~956
[11]宋振玉. 药物代谢研究-意义、方法、应用[M].北京:人民卫生出版社,1990:69
, http://www.100md.com
[12]Rodriguez V,Stewart D,Bodey GP.Gentamicin sulfate distribution in body fluids[J]. Clin Pharmacol Ther,1970,11:275~281
[13]Carbon C,Contrepois A,Lamotte-Barillon S.Comparasion distribution of gentamicin, tobramycin, sisomicin, netilmicin, and amikacin in interstitial fluid[J]. Antimicrob Agents Chemother,1978,13:368~372
[14]Gabel JC,Re Drake.Pulmonary capillery pressure in inact dog lungs[J]. Am J Physiol,1978,4:H569~573
[15]沈羡云,孟京瑞,王玉清等.头低位-20°限制活动期间兔生理指标的变化[J].航天医学与医学工程,1994,7(3):186~191
[16]Tucker BJ,Medonca MM. Effects of 30 day simulated microgravity and recovery on fluid homeostasis and renal function in the rat[J]. Journal of Gravitational Physiology,1995,2(1):33~34
收稿日期:1998-11-03, http://www.100md.com
单位:航天医学工程研究所,北京 100094
关键词:失重模拟;药代动力学;庆大霉素;兔
航天医学与医学工程990505摘要:目的 探讨模拟失重条件下以血流量改变为生理基础的药代动力学变化。方法 选择庆大霉素作为模型药物,采用头低位(-20°)兔限制活动为模拟失重动物模型,观察模拟失重对兔庆大霉素药代动力学参数的影响。7只家兔在头低位7 d前后,分别静脉滴注了3 mg/kg的庆大霉素,用TDxFLx测定了给药后4 h内的血药浓度。结果 庆大霉素的分布变慢,这表现在α值由头低位前的(0.1838±0.1076)min-1降至头低位后的(0.0591±0.0334)min-1,t1/2α由(5.30±3.55)min延长为(15.04±7.49)min,K12由(0.1025±0.0721)min-1降至(0.0181±0.0161)min-1,都有显著性差异;V(C)、V(D)也有升高的趋势。庆大霉素清除率在模拟失重后也有所增加,CL(S)从(2.2±0.5)ml.min-1.kg-1升至(2.7±0.3)ml.min-1.kg-1。 结论 模拟失重可改变药代动力学过程。
, 百拇医药
中图分类号:R852.22;R859 文献标识码:A 文章编号:1002-0837(1999)05-0333-05
Effects of 7 d Head-Down Tilt(-20°) Immobilization on Pharmacokinetics of Gentamicin in Rabbits
GUO Zhi-feng,GAO Jian-yi,WANG Bao-zhen,SHI Hong-zhi,WANG Jing,QIAN Jin-kang
Abstract:Objective To observe pharmacokinetic changes under simulated weightlessness in relevant to body flood flow changes. Method Gentamicin was selected as probe drug in the present study, and rabbits exposed to Head-Down Tilt( HDT,-20°) immobilization were selected as simulated weightlessness animal model. Seven rabbits were treated inf. with 3 mg/kg of gentamicin sulfate pre-HDT and 7 d after HDT. Gentamicin blood samples within 4 h after administration were analyzed by TDxFLx. Result The distribution of gentamicin postponed significantly: a significant decrease in α from (0.1838±0.1076)min-1 before HDT to (0.0591±0.0334)min-1 after HDT; a significant increase in t1/2 α from (5.30±3.55)min to (15.04±7.49)min;a significant decrease in k12 from (0.1025±0.0721)min-1 to (0.0181±0.0161)min-1,a increase trend in V(C) and V(D). After HDT, CL(S) of gentamicin increased from (2.2±0.5)ml.min-1.kg-1 to (2.7±0.3)ml.min-1.kg-1. Conclusion Simulated weightlessness might induce pharmacokinetic changes.
, 百拇医药
Key words:weightlessness simulation;pharmacokinetics;gentamicin;rabbits
Address reprint requests to:GUO Zhi-feng.Institute of Space Medico-Engineering,Beijing 100094,China
在航天中,航天员用药越来越普遍。据报道[1],航天乘员中80%以上曾经服用过药物,有的甚至是多次服用。失重环境对药物在人体内的处置过程有什么影响尚不清楚。失重环境下,由于血液重新分布,肝、肾等药物清除器官血流可能不同于地面情况,为确保航天员用药的有效性及安全性,有必要研究失重条件下的药代动力学变化。针对血流量改变进行药代动力学研究是探讨失重药代动力学的着眼点,目前,这方面国外有少量研究[2,3],国内尚未开展。本实验选取庆大霉素(Gentamicin,GM)作为研究药物,采用荧光偏振免疫方法(FPIA)测定庆大霉素血药浓度,以头低位(-20°)限制活动7 d的家兔[2]为动物模型,观察了庆大霉素药代动力学的变化,以了解模拟失重对药代动力学过程的影响,为今后失重条件下人体的药代动力学研究奠定基础。
, 百拇医药
方 法
仪器、试剂及试药 全自动荧光偏振免疫分析仪(TDxFLx);庆大霉素试剂盒:批号:9512-60;庆大霉素样本标准液,编号A-F,批号:9512-01;庆大霉素质控品:由低、中、高浓度3瓶含药血清组成,批号:9512-10;以上仪器及试剂均为美国雅培公司产品。硫酸庆大霉素注射液:大同市利群制药厂产品,批号:950415。
动物实验 本实验采用自身对照的实验分组方法。取新西兰白兔7只,雄性,体重2.2~3 kg,适应性饲养3 d后,用生理盐水将硫酸庆大霉素稀释为0.32 mg/ml,通过兔耳缘静脉恒速滴注庆大霉素3.0 mg/kg,给药速度为0.375 mg/min,需时约20 min。在静脉滴注给药结束后5、10、15、30、60、90、120、180、240、300 min于另一侧耳缘静脉取血1.0 ml。动物休息7 d,然后,以兔头低位(-20°)限制活动模型来模拟失重,7 d后,再以同样的方式给药、取血。所取样品在室温下放置,凝血后分离血清,如不能在24 h内分析,置血清于-20℃冰箱内保存。
, 百拇医药
血药浓度的测定 采用FPIA方法测定庆大霉素的血药浓度。根据操作手册作TDxFLx仪器的温度、光路和吸量检查[3],通过后作庆大霉素的标准曲线,存于仪器内。取庆大霉素质控品,依法测得3种不同浓度质控品的回收量,见表1,表明测试值在合格浓度范围之内,TDXFLx可供使用。最低检测浓度为0.27 μg/ml。
表1 庆大霉素质控血清测试值(μg/ml)
Table 1 Serum concentration of gentamicin controls(μg/ml) 浓度
(concentration)
标示量
(given values)
测试值
, http://www.100md.com
(test results)
合格浓度范围
(qualified concentration range)
H
8.00
7.92
7.20~8.80
M
4.00
4.01
3.60~4.40
L
, http://www.100md.com
1.00
1.01
0.85~1.15
药代动力学分析 药代动力学数据用“实用药代动力学程序”即3P87软件来处理。用非线性最小二乘法进行曲线拟合,对于模型的契合程度,采用F检验值,R2值及AIC,结合最大误差进行筛选,以选择房室模型,绘出药时曲线,并求出药代动力学参数。
统计处理 应用“统计设计与分析系统”软件,SDAS 2.0版,对所获药代动力学参数逐项进行“配对t检验”。个别参数呈非正态分布,则采用Wilcoxon's Test。结 果
庆大霉素血药浓度 模拟失重前、后两组庆大霉素血药浓度见表2。
表2 7只家兔模拟失重前、后庆大霉素血药浓度(μg/ml,
 ±s)
±s), http://www.100md.com
Table 2 Mean and median serum concentration of seven rabbits before and after HDT(μg/ml,
 ±s) 时间
±s) 时间(time)(min)
模拟失重前
(pre-HDT)
模拟失重后
(after HDT)
5
13.89±2.20
14.23±2.14
, 百拇医药
10
11.81±1.39
12.18±1.36
15
10.41±1.32
10.87±1.17
30
8.79±2.38
7.95±0.97
60
6.04±1.52
5.16±0.86
, 百拇医药
90
4.19±1.11
3.24±0.56
120
3.05±1.11
2.25±0.39
180
1.66±0.53
1.15±0.20
240
1.04±0.35
0.78±0.15
, http://www.100md.com
静滴停药后庆大霉素血药浓度-时间曲线 将模拟失重前、后两组庆大霉素药-时数据对用3P87软件经计算机处理,所得药-时曲线见图1,对于模型的契合程度,经F检验值,R2值及AIC,结合最大误差进行比较,二室模型和单室模型F检验值比较具有显著性差异P<0.01,并且二室模型的R2值较大,AIC值较小,因而开放型二室模型的契合程度优于开放型一室模型,其中一只家兔选择了一室模型。为了能够兼顾分布相及消除相,权重选择1/C。

图1 模拟失重前后庆大霉素药时曲线
Fig.1 Mean±SD serum gentamicin concentration-time curves of
rabbits before and after HDT
, http://www.100md.com
药代动力学参数 按开放型二室模型求出的模拟失重前、后两组庆大霉素药代动力学参数及其相差显著性结果见表3。由表可见,模拟失重后兔药代动力学的变化主要表现在α、K12显著下降,t1/2α明显升高,V(C)、V(D)有升高趋势,CL(S)由(2.2±0.2)ml.kg-1.min-1升至(2.7±0.3)ml.kg-1.min-1(P=0.079)。
表3 模拟失重后庆大霉素药代动力学参数的变化(n=6,
 ±s)
±s)Table 3 Changes of pharmacokinetic values in rabbits
, 百拇医药
after HDT(n=6,
 ±s) 参数
±s) 参数(parameters)
单位
(units)
模拟失重前
(before HDT)
模拟失重后
(after HDT)
A
μg.ml-1
, 百拇医药
16.67±6.53
14.05±8.00
α
min-1
0.1838±0.1076
0.0591±0.0334*
B
μg.ml-1
57.35±17.23
42.76±10.60
β
, 百拇医药
min-1
0.0108±0.0012
0.0107±0.0022
V(C)
l.kg-1
0.0603±0.0441
0.1387±0.0339
V(D)
l.kg-1
0.2033±0.0641
, 百拇医药
0.2617±0.0665
t1/2α
min
5.30±3.55
15.04±7.49*
t1/2β
min
64.62±7.04
68.48±13.84
k21
min-1
, http://www.100md.com
0.0385±0.0094
0.0315±0.0172
k10
min-1
0.0535±0.0370
0.0202±0.0045
k12
min-1
0.1025±0.0721
0.0181±0.0161*
, http://www.100md.com
AUC
μg.ml-1.min
1450.81 ±369.90
1124.72 ±146.76
CL(S)
l.kg-1.min-1
0.0022±0.0005
0.0027±0.0003
注:*P<0.05,与模拟失重前比较 Note:*P<0.05,as compared with pre-HDT
, 百拇医药
讨 论
研究药物的选择 航天药代动力学是航天药理学中的重要组成部分,它着重探讨失重对药物在体内吸收、分布、代谢和排泄的影响。为探讨这种影响,应当针对失重条件下的有代表性的生理生化变化,选取药物加以研究。所选药物应具有如下特点:其体内处置过程中的某一环节受失重所致生理生化变化(如血液重分布引起的全身血流变化)的影响很大,最好这一环节能特征性地反映失重所致生理生化变化;从药代动力学的角度来说,其体内处置过程尽可能地单纯,能足以表征这一环节特点。GM体内处置过程比较单纯,血浆蛋白结合率很低,基本上分布于细胞外液中,在体内不代谢,主要以原形通过肾小球滤过而排泄,肾小管内无排泄和重吸收[4]。选择GM作为研究药物便于研究失重或模拟失重条件下药代动力学变化。但是选择GM会带来一个问题:GM有效血药浓度范围窄,可引起肾的毒性反应[4],影响结果。因而必须选择适当的给药剂量和方式,避免肾毒性。本实验采用静脉滴注的给药方式,参照他人的给药剂量2.0~5.0 mg/kg[5~8],确定为3 mg/kg,并测定了给药前后的兔BUN、Cr值,结果发现其值并未改变,因此可以认为,本实验排除了给药本身对实验结果的影响。
, 百拇医药
模拟失重对兔GM药代动力学的影响 实验结果表明,兔在头低位限制活动后,GM一些有关分布的药代动力学参数发生了明显变化:α由(0.1838±0.1076)min-1降至(0.0591±0.0334)min-1,t1/2 α由(5.30±3.55)min延长为(15.04±7.49)min,这说明模拟失重引起GM分布变慢。通常,药物组织分布的影响因素关键是药物膜通透性及血流量,据此,分布速率划分为膜限速类及血流限速二类[9]。人和动物实验[10,11]已证明:庆大霉素由于水溶性强,极性很高,基本上分布于细胞外液中;易于通过毛细血管壁,庆大霉素能迅速分布到组织间液中,其分布相时间较短,持续数分钟。因而其分布应是血流限速过程。模拟失重对GM分布的影响也主要与血流限速过程有关。
分析GM分布减慢的原因可能与以下因素相关:
(1)模拟失重条件下,各器官血流量发生再分配。实验表明:头低位限制活动时肌肉血流量下降[2],这会导致GM分布的减慢。因为在GM房室模型中,肌肉处于周边室的位置,是药物的组织储库,肌肉血流量的减少会造成GM从中央室向周边室转运变慢,分布减慢。中央室向周边室的转运速率常数K12由(0.1025±0.0721)min-1降至(0.0181±0.0161)min-1证明了这一点。
, 百拇医药
(2)中央室表观分布容积V(C)和表观分布容积V(D)有增加的趋势,GM分布减慢与此有关。因GM分布容积相当于细胞外液容积,说明GM在血液灌注多的器官(中央室),如心、肝、肾、肺的分布容积扩大了,其中值得注意的是肺脏。失重或模拟失重条件下,体液头胸向转移,一方面,通过神经、体液的调节机制,引起体液的减少,主要是血浆(循环血量)和细胞内液的减少;另一方面,这些额外的体液可能滤过到了组织间隙,增加组织间液特别是肺组织间液。Gabel[12]等发现,模拟失重时狗肺重量的增加,主要是因为肺组织间液增加。因而由于血浆容量的减少,组织间液的积聚,在庆大霉素由血浆向组织间液分布时,速度减缓。另外,心输出量的变化也会影响GM分布。关于失重或模拟失重下的心输出量的变化,降低、不变、增加的报道都有。在兔头低位限制活动模拟失重后,心脏功能下降[13],心输出量变化不得而知。分布变慢是否与之相关,由于缺乏相关指标测定,无法判断。
GM的总体清除率CL(S)在模拟失重后有所增加,从(2.2±0.5)ml.min-1.kg-1升至(2.7±0.3)ml.min-1.kg-1,P=0.079。如前所述:GM几乎全部通过肾脏清除,因而CL(S)基本上反映的是肾清除率。因为GM不在肾小管内排泌和重吸收,因此,清除率增加主要反映肾小球滤过率增加。
, http://www.100md.com
分析其原因,模拟失重后肾小球滤过率增加与肾血流量增加有关。因为机体主要通过调节肾血流量来调节肾小球滤过。在模拟失重时,体液头向分布,将影响肾血流量。兔头低位(-20°)15 d内[2],肾皮质血流量持续增加。在鼠尾悬吊(-25°)30 d期间,Tuker[14]观察了肾血浆流量、肾小球滤过率、细胞外液和血浆容积的变化,发现在头低位1~2 wk时前3个参数都平行地升高了,其后恢复到了卧床前水平,而血浆容积持续下降。机制是:肾血浆流量增加而导致的肾小球滤过率增加,是对细胞外液增加的一种反应。本实验观察到兔模拟失重期间V(C)、V(D)增加,CL(S)平行地增加了,可用Tuker的观点加以解释。由于表观分布容积和肾脏清除率都有所增加,因而,消除半衰期t1/2β改变不明显。
总之,兔模拟失重时GM药代动力学的变化,主要是由于体液头向分布引起的。当然,由于缺乏相关的平行实验研究,比如:心输出量,全身血流量,细胞外液等指标的测定,因而对以上过程应进一步探讨。
, http://www.100md.com
参考文献
[1]Pool SL,Davis JR,Cintron NM et al. Medication use and therapeutic effectiveness on the first 33 space shuttle missions[C].In:Yajima K,ed.Proceedings of the third nihon university international symoposium on aerospace science, Nihon university Tokyo Japan,1991:131~136
[2]Kates RE,Harapat SR,Keefe DLD et al.Influence of prolonged recumbency on drug disposition[J].Clin Pharmacol Ther,1980,28(5):624~628
, http://www.100md.com
[3]Saivin S,Traon PL,Cornac A et al.Impact of a four-day head-down tilt(-6°) on lidocaine pharmakinetics used as probe to evaluate hepatic blood flow[J].J Clin Pharmacol,1995,35:697~704
[4]向求鲁,沈羡云,孟京瑞.模拟失重时兔脏器血流量反应特性研究[J].空间科学学报,1989,9(2):148~154
[5]TDx操作手册[M].美国雅培公司编
[6]戴自英.实用抗菌药物学[M].上海:上海科学技术出版社,1992:184
[7]Curl JL,Curl JS.Pharmacokinetics of gentamicin in laboratory rabbits[J]. American Journal of Vetevinary research,1988,49(12):2065~2067
, http://www.100md.com
[8]Ogden L,Wilson RC,Clark CH et al. Pharmacokinetics of gentamicin in rabbits[J]. J Vet Pharmacol Therap,1995,18(2):156~159
[9]丁龙其,张荣珍.微生物法测定家兔中庆大霉素药代动力学的实验[J].现代应用药学,1994,11(2):24~25
[10]Frame PT,Phair JP,Watanaknnakorn C. Pharmacologic factors associated with gentamicin nephrotoxicity in rabbits[J]. J lnfect Dis,1977,135(6),952~956
[11]宋振玉. 药物代谢研究-意义、方法、应用[M].北京:人民卫生出版社,1990:69
, http://www.100md.com
[12]Rodriguez V,Stewart D,Bodey GP.Gentamicin sulfate distribution in body fluids[J]. Clin Pharmacol Ther,1970,11:275~281
[13]Carbon C,Contrepois A,Lamotte-Barillon S.Comparasion distribution of gentamicin, tobramycin, sisomicin, netilmicin, and amikacin in interstitial fluid[J]. Antimicrob Agents Chemother,1978,13:368~372
[14]Gabel JC,Re Drake.Pulmonary capillery pressure in inact dog lungs[J]. Am J Physiol,1978,4:H569~573
[15]沈羡云,孟京瑞,王玉清等.头低位-20°限制活动期间兔生理指标的变化[J].航天医学与医学工程,1994,7(3):186~191
[16]Tucker BJ,Medonca MM. Effects of 30 day simulated microgravity and recovery on fluid homeostasis and renal function in the rat[J]. Journal of Gravitational Physiology,1995,2(1):33~34
收稿日期:1998-11-03, http://www.100md.com