涎腺多形性腺瘤p53基因突变的SSCP及核酸序列分析研究
作者:王洁 董福生 雍平 李荷香 任贵云
单位:050017石家庄,河北医科大学口腔医学院
关键词:腺瘤;多形性;基因;p53;突变;序列分析;DNA
New Page 1 【摘要】 目的 检测涎腺多形性腺瘤中p53基因第6外显子突变的密码及突变类型。方法 采用聚合酶链式反应-单股构型多态分析(polymerase chain reaction-single-strand conformational polymorphism,PCR-SSCP)技术及DNA核酸序列测定方法对涎腺多形性腺瘤进行研究。结果 在11例PCR-SSCP阳性的肿瘤中,第6外显子异常者6例。对其中4例肿瘤进行核酸序列测定,发现SSCP阳性的肿瘤第6外显子碱基序列发生突变。突变部位在204~216号位点上,突变类型有碱基替换(G→T,T→G)和移码突变,包括碱基缺失(T、A、G缺失)以及碱基插入(T插入)。结论 涎腺多形性腺瘤发生中p53基因第6外显子突变方式多样,涉及多个密码子;PCR-SSCP技术是筛选基因突变的简便方法。
, http://www.100md.com
p53 gene mutation determined by single-strand conformational polymorphism and DNA sequencing analysis in pleomorphic adenoma of salivary gland
WANG Jie, DONG Fusheng, YONG Ping, et al.
School of Stomatology, Hebei Medical University, Shijiazhuang 050017
【Abstract】 Objective To detect p53 exon 6 mutation pattern in pleomorphic adenoma of salivary galnd. Methods Single-strand conformational polymorphism (SSCP) and DNA sequecing were used.Results SSCP analysis showed that 6 of 11 cases with SSCP positive were exon 6 abnormal. Comparison of the SSCP results with DNA sequecing, 4 cases with p53 exon 6 mutations were SSCP positive. Mutation pattern included base substitution (point mutation,G→T,T→G) and frame-shift mutation (base insertion and base loss). Conclusion Poly-codon and poly-pattern mutations appeared in p53 exon 6. PCR-SSCP was a convenient method to detecte gene mutation.
, 百拇医药
【Key words】 Adenoma,pleomorphic Genes, p53 Mutation Sequence analysis,DNA
p53基因突变是人类上皮性肿瘤中最常见的基因改变。以往的研究发现,涎腺多形性腺瘤中p53基因蛋白存在过度表达[1]。为检测p53基因在涎腺多形性腺瘤发生中突变的密码及类型,采用DNA核酸序列测定技术对多形性腺瘤进行分析研究。
材料与方法
1.标本:手术切除的新鲜涎腺多形性腺瘤组织14例,正常腮腺组织2例。所有新鲜标本均经-196℃液氮速冻15分钟,置-70℃冰柜存放。
2.DNA提取:用酚氯仿法提取100mg新鲜冷冻组织的DNA。
3.聚合酶链式反应-单股构型多态分析(polymerase chain reaction-single-strand conformational polymorphism,PCR-SSCP):①引物设计:p53基因第6外显子的引物扩增了含有易突变位点的p53基因DNA片段。引物序列为:P1=5′-GTCTGGCCCCTC-CTCAGCATC-3′;P2=5′-CTCAGGCGGCTCATAGGGC-AC-3′。②PCR扩增:按常规方法进行PCR。1.5%琼脂糖凝胶电泳鉴定扩增产物。③SSCP技术:取5μlPCR产物,加入5μlSSCP上样液(95%去离子甲酰胺,20mmol/LEDTA,0.05%溴酚蓝,0.05%二甲苯蓝),混匀。98℃变性8分钟,急冷,上样立即进行非变性聚丙烯酰胺凝胶电泳(50V,30mA)8~10小时。
, http://www.100md.com
4.银染:凝胶置固定液(30%乙醇,10%乙酸)中固定4~12小时,30%乙醇洗2次,各30分钟;三蒸水漂洗3次;0.1%硝酸银染液染色30分钟;DDW洗涤;显色液(2.5%碳酸钠,0.02%甲醛)显色10分钟,至条带清晰;终止液(1%乙酸)终止3分钟;少许DDW漂洗5分钟,封干保存。
5.DNA核酸序列测定:①PCR产物纯化:将2-3管PCR产物合并,1.5%琼脂糖电泳,割胶收集产物,称重量。采用QIAGEN割胶纯化试剂盒(德国产品,QIAquick Gel Extraction Kit)纯化PCR产物。②核酸序列测定:采用上游引物进行核酸序列测定(美国PE公司377型,复旦大学遗传所提供)。
结果
1.在14例涎腺多形性腺瘤中,经PCR-SSCP分析发现,有11例出现SSCP异常电泳带,其中第6外显子阳性者6例(图1)。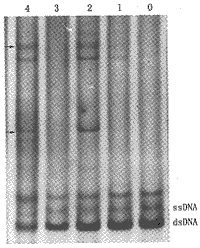
, 百拇医药
0:阴性对照(正常腮腺组织DNA);1~4:涎腺多形性腺瘤DNA;ssDNA:单链DNA;dsDNA:残存双链DNA;→:异常电泳带
图1 银染PCR-SSCP检测p53基因第6外显子突变结果
2.进行核酸序列测定的5例肿瘤中,SSCP阳性的4例肿瘤均出现碱基改变,SSCP阴性的1例肿瘤未发现碱基改变(表1)。碱基改变的位点分布在第6外显子第204号至第216号密码子之间。碱基突变的类型有碱基替换(点突变)和移码突变,包括碱基缺失和碱基插入。其中第204号密码子突变频率较高,突变类型有点突变(G→T),碱基缺失(G缺失)和碱基插入(T插入)。第205、207、208、209和216号密码子分别出现碱基缺失(T缺失、A缺失和G缺失)。第212号密码子出现点突变(T→G)。
表1 4例涎腺多形性腺瘤p53基因突变
, 百拇医药 的SSCP及DNA核酸序列分析结果
病例
外显子
SSCP
位点
碱基突变类型
1
6
(+)
204
TGG→TTTG(G→T,另插入T)
205
AGT→AG(T缺失)
, http://www.100md.com
2
6
(+)
204
TGG→TTTG(G→T,另插入T)
205
AGT→AG(T缺失)
207
TGG→GG(T缺失)
209
ACA→AC(A缺失)
212
, http://www.100md.com CTT→CTG(T→G)
216
GTG→GG(T缺失)
3
6
(+)
204
TGG→TTTG(G→T,另插入T)
4
6
(+)
204
TGG→TG(G缺失)
, http://www.100md.com
注:SSCP:单股构型多态分析
讨论
p53基因的突变方式主要有点突变、等位基因缺失和基因重组等。在大多数上皮源性的肿瘤中,p53基因点突变是最常见的一种突变方式[2,3]。本研究发现,SSCP阳性的肿瘤核酸序列有碱基突变,包括点突变、碱基缺失和碱基插入。说明SSCP技术在筛选基因突变上简便可行,但要确定基因突变的密码子和突变类型还依赖于核酸序列测定。
Li等[4]对胰腺腺癌的p53基因进行DNA核酸序列测定发现,第6外显子突变形式均为碱基缺失,在第204~208号密码子中出现了13个碱基缺失,第211号密码子出现2个碱基缺失。本研究对涎腺多形性腺瘤的DNA核酸序列测定发现,该肿瘤在第204,205,207至209和216号密码子上分别出现了T、G、A碱基缺失。涎腺多形性腺瘤碱基缺失的密码子与胰腺腺癌有相近之处,但由于具体位点缺失碱基不同,可能会导致肿瘤发生上的差异。
, http://www.100md.com
不同部位鳞状细胞癌的p53基因第6外显子的突变形式主要有点突变和碱基插入,点突变主要发生在第213号密码子A→G[5-7]。在Riethdorf等[8]和Matsuda等[9]的报道中,头颈部和口腔鳞状细胞癌中p53基因第6外显子的突变方式主要是点突变,分别在第6外显子的第193、202、204和206号位点上,替换的碱基为T→G,C→T和T→A。在涎腺多形性腺瘤中,p53基因第6外显子的突变形式还有碱基插入和碱基替换(点突变)。突变主要发生在第204(G→T)和212(T→G)号位点上,其中发生频率较高的第204号密码子的点突变(G→T)与口腔鳞状细胞癌点突变的位点和替换的碱基完全一致。
Xu等[7]报道,头颈部鳞状细胞癌中p53基因第6外显子序列中出现了1~4个碱基插入。在对涎腺多形性腺瘤的研究中发现,p53基因第6外显子的第204号密码子有1个碱基插入(T插入)。这与头颈部鳞状细胞癌的突变方式又有相同之处。
, http://www.100md.com
本研究发现,一种肿瘤p53基因第6外显子可以出现两个或多个密码子的突变。这种双位点或多位点的突变在肾细胞癌中有所报道[2],在涎腺多形性腺瘤中还未见报道。多形性腺瘤中p53基因第6外显子中出现的碱基替换和碱基插入会造成DNA序列中某一个密码子的改变,从而产生突变型的蛋白,突变型p53蛋白具有致癌作用[10]。因此,从基因突变的角度去认识涎腺多形性腺瘤,可以看到它的发生及其潜在的恶性生物学特征均不是偶然的。认识和确定涎腺多形性腺瘤发生中密码子突变的位点和类型,不仅可以揭示肿瘤发生的内在因素,而且还可为肿瘤的基因诊断和治疗提供可靠的理论依据。
志谢 核酸序列测定承蒙复旦大学遗传所谢毅老师和唐榕老师的大力协助
卫生部优秀青年科技人才专项科研基金资助课题(96Q-061)
参考文献
, 百拇医药 1 王洁, 董福生, 王小玲 等.ras p21与p53 基因蛋白在涎腺多形性腺瘤中表达的定量研究. 中华口腔医学杂志 ,1997,32: 11-13.
2 Oda H, Nakatsuru Y, Ishikawa T. Mutations of the p53 gene and p53 protein overexpression are associated with sarcomatiod transformation in renal cell carcinomas. Cancer Res, 1995,55: 658-662.
3 Dobashi Y, Sugimura H, Sakamoto A, et al. Stepwiseparticipation of p53 gene mutation during dedifferentitation of human thyroid carcinomas. Diagn Mol Pathol,1994, 3: 9-14.
, 百拇医药
4 Li Y, Bhuiyan M, Vaitkevicius VK, et al. Molecular analysis of the p53 gene in pancreatic adenocarcinoma. Diagn Mol Pathol, 1998, 7: 4-9.
5 Sarkar FH, Sakr WA, Li YW, et al. Tumor suppressor p53 gene mutation in squamous cell carcinoma of the larynx. Diagn Mol Pathol,1996, 5: 201-205.
6 Pilotti S, D′Amato L, Torre GD, et al. Papillomavirus, p53 alteration , and primary carcinoma of the vulva. Diagn Mol Pathol,1995, 4: 239-248.
, http://www.100md.com
7 Xu L, Chen YT, Huvos AG, et al. Overexpression of p53 protein in squamous cell carcinomas of head and neck without apparent gene mutations. Diagn Mol Pathol, 1994, 3: 83-92.
8 Riethdorf S, Friedrich RE, Ostwald Ch, et al. p53 gene mutations and HPV infection in primary head and neck squamous cell carcinomas do not correlate with overall survival: a long-term follow-up study. J Oral Pathol Med, 1997, 26: 315-321.
9 Matsuda H, Konishi N, Hiasa Y, et al. Alterations of p16/CDKN2,p53 and ras genes in oral squamous cell carcinomasand premalignant lesions. J Oral Pathol Med, 1996, 25: 232-238.
10 Hsu IC, Metcalf RA, Sun T, et al. Mutational hotspotin the p53 gene in human hepatocellular carcinomas. Nature,1991,350: 427-428.
(收稿:1998-11-19 修回:1999-03-04), 百拇医药
单位:050017石家庄,河北医科大学口腔医学院
关键词:腺瘤;多形性;基因;p53;突变;序列分析;DNA
New Page 1 【摘要】 目的 检测涎腺多形性腺瘤中p53基因第6外显子突变的密码及突变类型。方法 采用聚合酶链式反应-单股构型多态分析(polymerase chain reaction-single-strand conformational polymorphism,PCR-SSCP)技术及DNA核酸序列测定方法对涎腺多形性腺瘤进行研究。结果 在11例PCR-SSCP阳性的肿瘤中,第6外显子异常者6例。对其中4例肿瘤进行核酸序列测定,发现SSCP阳性的肿瘤第6外显子碱基序列发生突变。突变部位在204~216号位点上,突变类型有碱基替换(G→T,T→G)和移码突变,包括碱基缺失(T、A、G缺失)以及碱基插入(T插入)。结论 涎腺多形性腺瘤发生中p53基因第6外显子突变方式多样,涉及多个密码子;PCR-SSCP技术是筛选基因突变的简便方法。
, http://www.100md.com
p53 gene mutation determined by single-strand conformational polymorphism and DNA sequencing analysis in pleomorphic adenoma of salivary gland
WANG Jie, DONG Fusheng, YONG Ping, et al.
School of Stomatology, Hebei Medical University, Shijiazhuang 050017
【Abstract】 Objective To detect p53 exon 6 mutation pattern in pleomorphic adenoma of salivary galnd. Methods Single-strand conformational polymorphism (SSCP) and DNA sequecing were used.Results SSCP analysis showed that 6 of 11 cases with SSCP positive were exon 6 abnormal. Comparison of the SSCP results with DNA sequecing, 4 cases with p53 exon 6 mutations were SSCP positive. Mutation pattern included base substitution (point mutation,G→T,T→G) and frame-shift mutation (base insertion and base loss). Conclusion Poly-codon and poly-pattern mutations appeared in p53 exon 6. PCR-SSCP was a convenient method to detecte gene mutation.
, 百拇医药
【Key words】 Adenoma,pleomorphic Genes, p53 Mutation Sequence analysis,DNA
p53基因突变是人类上皮性肿瘤中最常见的基因改变。以往的研究发现,涎腺多形性腺瘤中p53基因蛋白存在过度表达[1]。为检测p53基因在涎腺多形性腺瘤发生中突变的密码及类型,采用DNA核酸序列测定技术对多形性腺瘤进行分析研究。
材料与方法
1.标本:手术切除的新鲜涎腺多形性腺瘤组织14例,正常腮腺组织2例。所有新鲜标本均经-196℃液氮速冻15分钟,置-70℃冰柜存放。
2.DNA提取:用酚氯仿法提取100mg新鲜冷冻组织的DNA。
3.聚合酶链式反应-单股构型多态分析(polymerase chain reaction-single-strand conformational polymorphism,PCR-SSCP):①引物设计:p53基因第6外显子的引物扩增了含有易突变位点的p53基因DNA片段。引物序列为:P1=5′-GTCTGGCCCCTC-CTCAGCATC-3′;P2=5′-CTCAGGCGGCTCATAGGGC-AC-3′。②PCR扩增:按常规方法进行PCR。1.5%琼脂糖凝胶电泳鉴定扩增产物。③SSCP技术:取5μlPCR产物,加入5μlSSCP上样液(95%去离子甲酰胺,20mmol/LEDTA,0.05%溴酚蓝,0.05%二甲苯蓝),混匀。98℃变性8分钟,急冷,上样立即进行非变性聚丙烯酰胺凝胶电泳(50V,30mA)8~10小时。
, http://www.100md.com
4.银染:凝胶置固定液(30%乙醇,10%乙酸)中固定4~12小时,30%乙醇洗2次,各30分钟;三蒸水漂洗3次;0.1%硝酸银染液染色30分钟;DDW洗涤;显色液(2.5%碳酸钠,0.02%甲醛)显色10分钟,至条带清晰;终止液(1%乙酸)终止3分钟;少许DDW漂洗5分钟,封干保存。
5.DNA核酸序列测定:①PCR产物纯化:将2-3管PCR产物合并,1.5%琼脂糖电泳,割胶收集产物,称重量。采用QIAGEN割胶纯化试剂盒(德国产品,QIAquick Gel Extraction Kit)纯化PCR产物。②核酸序列测定:采用上游引物进行核酸序列测定(美国PE公司377型,复旦大学遗传所提供)。
结果
1.在14例涎腺多形性腺瘤中,经PCR-SSCP分析发现,有11例出现SSCP异常电泳带,其中第6外显子阳性者6例(图1)。

, 百拇医药
0:阴性对照(正常腮腺组织DNA);1~4:涎腺多形性腺瘤DNA;ssDNA:单链DNA;dsDNA:残存双链DNA;→:异常电泳带
图1 银染PCR-SSCP检测p53基因第6外显子突变结果
2.进行核酸序列测定的5例肿瘤中,SSCP阳性的4例肿瘤均出现碱基改变,SSCP阴性的1例肿瘤未发现碱基改变(表1)。碱基改变的位点分布在第6外显子第204号至第216号密码子之间。碱基突变的类型有碱基替换(点突变)和移码突变,包括碱基缺失和碱基插入。其中第204号密码子突变频率较高,突变类型有点突变(G→T),碱基缺失(G缺失)和碱基插入(T插入)。第205、207、208、209和216号密码子分别出现碱基缺失(T缺失、A缺失和G缺失)。第212号密码子出现点突变(T→G)。
表1 4例涎腺多形性腺瘤p53基因突变
, 百拇医药 的SSCP及DNA核酸序列分析结果
病例
外显子
SSCP
位点
碱基突变类型
1
6
(+)
204
TGG→TTTG(G→T,另插入T)
205
AGT→AG(T缺失)
, http://www.100md.com
2
6
(+)
204
TGG→TTTG(G→T,另插入T)
205
AGT→AG(T缺失)
207
TGG→GG(T缺失)
209
ACA→AC(A缺失)
212
, http://www.100md.com CTT→CTG(T→G)
216
GTG→GG(T缺失)
3
6
(+)
204
TGG→TTTG(G→T,另插入T)
4
6
(+)
204
TGG→TG(G缺失)
, http://www.100md.com
注:SSCP:单股构型多态分析
讨论
p53基因的突变方式主要有点突变、等位基因缺失和基因重组等。在大多数上皮源性的肿瘤中,p53基因点突变是最常见的一种突变方式[2,3]。本研究发现,SSCP阳性的肿瘤核酸序列有碱基突变,包括点突变、碱基缺失和碱基插入。说明SSCP技术在筛选基因突变上简便可行,但要确定基因突变的密码子和突变类型还依赖于核酸序列测定。
Li等[4]对胰腺腺癌的p53基因进行DNA核酸序列测定发现,第6外显子突变形式均为碱基缺失,在第204~208号密码子中出现了13个碱基缺失,第211号密码子出现2个碱基缺失。本研究对涎腺多形性腺瘤的DNA核酸序列测定发现,该肿瘤在第204,205,207至209和216号密码子上分别出现了T、G、A碱基缺失。涎腺多形性腺瘤碱基缺失的密码子与胰腺腺癌有相近之处,但由于具体位点缺失碱基不同,可能会导致肿瘤发生上的差异。
, http://www.100md.com
不同部位鳞状细胞癌的p53基因第6外显子的突变形式主要有点突变和碱基插入,点突变主要发生在第213号密码子A→G[5-7]。在Riethdorf等[8]和Matsuda等[9]的报道中,头颈部和口腔鳞状细胞癌中p53基因第6外显子的突变方式主要是点突变,分别在第6外显子的第193、202、204和206号位点上,替换的碱基为T→G,C→T和T→A。在涎腺多形性腺瘤中,p53基因第6外显子的突变形式还有碱基插入和碱基替换(点突变)。突变主要发生在第204(G→T)和212(T→G)号位点上,其中发生频率较高的第204号密码子的点突变(G→T)与口腔鳞状细胞癌点突变的位点和替换的碱基完全一致。
Xu等[7]报道,头颈部鳞状细胞癌中p53基因第6外显子序列中出现了1~4个碱基插入。在对涎腺多形性腺瘤的研究中发现,p53基因第6外显子的第204号密码子有1个碱基插入(T插入)。这与头颈部鳞状细胞癌的突变方式又有相同之处。
, http://www.100md.com
本研究发现,一种肿瘤p53基因第6外显子可以出现两个或多个密码子的突变。这种双位点或多位点的突变在肾细胞癌中有所报道[2],在涎腺多形性腺瘤中还未见报道。多形性腺瘤中p53基因第6外显子中出现的碱基替换和碱基插入会造成DNA序列中某一个密码子的改变,从而产生突变型的蛋白,突变型p53蛋白具有致癌作用[10]。因此,从基因突变的角度去认识涎腺多形性腺瘤,可以看到它的发生及其潜在的恶性生物学特征均不是偶然的。认识和确定涎腺多形性腺瘤发生中密码子突变的位点和类型,不仅可以揭示肿瘤发生的内在因素,而且还可为肿瘤的基因诊断和治疗提供可靠的理论依据。
志谢 核酸序列测定承蒙复旦大学遗传所谢毅老师和唐榕老师的大力协助
卫生部优秀青年科技人才专项科研基金资助课题(96Q-061)
参考文献
, 百拇医药 1 王洁, 董福生, 王小玲 等.ras p21与p53 基因蛋白在涎腺多形性腺瘤中表达的定量研究. 中华口腔医学杂志 ,1997,32: 11-13.
2 Oda H, Nakatsuru Y, Ishikawa T. Mutations of the p53 gene and p53 protein overexpression are associated with sarcomatiod transformation in renal cell carcinomas. Cancer Res, 1995,55: 658-662.
3 Dobashi Y, Sugimura H, Sakamoto A, et al. Stepwiseparticipation of p53 gene mutation during dedifferentitation of human thyroid carcinomas. Diagn Mol Pathol,1994, 3: 9-14.
, 百拇医药
4 Li Y, Bhuiyan M, Vaitkevicius VK, et al. Molecular analysis of the p53 gene in pancreatic adenocarcinoma. Diagn Mol Pathol, 1998, 7: 4-9.
5 Sarkar FH, Sakr WA, Li YW, et al. Tumor suppressor p53 gene mutation in squamous cell carcinoma of the larynx. Diagn Mol Pathol,1996, 5: 201-205.
6 Pilotti S, D′Amato L, Torre GD, et al. Papillomavirus, p53 alteration , and primary carcinoma of the vulva. Diagn Mol Pathol,1995, 4: 239-248.
, http://www.100md.com
7 Xu L, Chen YT, Huvos AG, et al. Overexpression of p53 protein in squamous cell carcinomas of head and neck without apparent gene mutations. Diagn Mol Pathol, 1994, 3: 83-92.
8 Riethdorf S, Friedrich RE, Ostwald Ch, et al. p53 gene mutations and HPV infection in primary head and neck squamous cell carcinomas do not correlate with overall survival: a long-term follow-up study. J Oral Pathol Med, 1997, 26: 315-321.
9 Matsuda H, Konishi N, Hiasa Y, et al. Alterations of p16/CDKN2,p53 and ras genes in oral squamous cell carcinomasand premalignant lesions. J Oral Pathol Med, 1996, 25: 232-238.
10 Hsu IC, Metcalf RA, Sun T, et al. Mutational hotspotin the p53 gene in human hepatocellular carcinomas. Nature,1991,350: 427-428.
(收稿:1998-11-19 修回:1999-03-04), 百拇医药