大黄酸治疗STZ诱导糖尿病大鼠的远期实验研究
作者:戴春笋 刘志红 陈惠萍 杨俊伟 郭啸华 周 虹 黎磊石
单位:南京军区南京总医院 解放军肾脏病研究所(南 京,210002)
关键词:大黄酸;糖尿病肾病;大鼠
肾脏病与透析肾移值杂志990502
摘 要 目的:观察长期应用大黄酸对糖尿病大鼠远期病变的疗效。 方法:采用小剂量STZ腹腔内多次注射法建立糖尿病大鼠动物模型。动物分为糖尿病对照组,糖尿病大黄酸治疗组,和正常对照组。其中糖尿病治疗组分别给不同剂量的大黄酸(25,100mg/kg.d-1)。定期观察一般情况,血糖及血生化指标,同时测定24h尿蛋白排出量。连续治疗12个月宰杀大鼠,称取右肾重量,并留光镜标本观察肾组织病理学改变。 结果:(1)糖尿病模型建立12月后,糖尿病大鼠体重明显低于正常对照大鼠;血压及心室重量与正常对照大鼠无明显差别;血肌酐,总胆固醇及甘油三酯水平较正常对照大鼠升高。糖尿病模型建立4周时出现少量尿蛋白,12月时尿蛋白水平明显高于正常对照大鼠(65.2±36.4vs8.9±4.9mg/24h,P<0.01),肾脏重量也较正常对照大鼠增加(0.9404±0.0999gvs0.8177±0.0304g,P<0.05)。光镜下可见糖尿病大鼠肾小球,丝球体及系膜区面积均较正常对照大鼠增加,但未见明显的肾小球硬化。(2)治疗期间大鼠血糖水平较糖尿病未治组大鼠略低。治疗12月后,大黄酸组大鼠血肌酐,总胆固醇及甘油三酯水平较糖尿病对照组降低,大黄酸100mg组疗效较强。大鼠体重,平均动脉压及心室重量与糖尿病未治组大鼠相比无显著差别。(3)大黄酸治疗12月后,糖尿病大鼠尿蛋白排泄量较糖尿病对照组大鼠减少,其中高剂量组降低较为明显。治疗组大鼠肾脏重量,肾小球面积及系膜区面积也较糖尿病对照大鼠减小。12月时,糖尿病大鼠肾小球TGFβ1及GLUT1mRNA表达升高,大黄酸治疗后降低明显。 结论:(1)STZ诱导糖尿病大鼠12月时可出现较明显的肾脏病变,表现为尿蛋白排出量增加,肾脏肥大,肾小球面积及丝球体面积加大,系膜区增宽;(2)大黄酸可以降低糖尿病大鼠尿蛋白排出量,减轻肾脏肥大,缩小肾小球面积及系膜区面积,降低肾小球TGFβ1及GLUT1mRNA的高表达,并可改善糖尿病大鼠的血脂代谢异常,有轻度降血糖作用;(3)大黄酸治疗糖尿病肾病的机制可能与其纠正机体及细胞代谢异常,降低TGF-β1产生有关,其对肾小球血流动力学是否有影响,尚待进一步研究。
, 百拇医药
EFFECTS OF RHEIN IN INHIBITING T HE PROGR ESSION OF DIABETIC NEPHROPATHY IN STZ-IN DUCED DIABETIC RATS
Dai Chunsun, Liu Zhihong, Chen Huip ing, Yang Junwei, Zhou Hong, Li Leishi
Research Institute of Nephrology, Jinlin g Hospital,Nanjing University School of Medicine,Nanjing 210002
OBJECTIVE To investigate rhe in’s long-term effects on the progression of diabetic nephropathy and the metabo lism disturbance in STZ-induced diabetic rats.
, 百拇医药
METHODOLOGY Diabetes was ind uced with multi-injection of low-dose STZ in Wistar rats. Wistar rats were di vided into three groups, the untreated diabetic control group, rhein treated dia betic group and the normal control group.Ordinary parameters, urine protein exc re tion and histopathology were investigated for 12months after the induction of di abetes.
RESULTS At the 12th month af ter induction of diabetes, body weight of diabetic rats was significantly lower than normal control group,blood pressure and cardiac ventricular weight were sim ilar to those in normal control group,serum creatini ne,cholesterol,and triglyceride were significantly higher in diabetic group.R ats in diabetic group were found to have mild increase in urine protein excretion at the 4th week after induction of diabetes.At the 12th month,there were significant increases in urine protein excretion (65.2±36.4 vs 8.9±4.9mg/24hrs,P<0.01),kidney weight (0.9404±0.0999 vs 0.8177±0.0304g,P<0.05),glomerular and mesangial area in diabetic rats as comp ared to those of normal controls.Comparing to the untreated diabetic rats,the serum glucose concentration was lower in rhein treated diabetic rats during the 12 months after induction of diabetes.Bo dy weight,blood pressure and cardiacven tricular weight were not significantly different among these groups.As compared to those in untreated diabetic rats,urine protein excretion ,kidney weight,glomerular and mesangial area were decre a sed significantly in rhein treated diabe tic rats at the 12th month after indu ction of diabetes. The mRNA content of T GF β1 and GLUT1 were also decreased in rhein treated diabetic rats.
, 百拇医药
CONCLUSION Rhein can decreas e the urine protein excretion,kidney weight, glomerular area and mesangial ECM deposition in STZ-induced diabetic rats .The mechanism for rhein’s inhibition may be related to its amelioration of the cellular metabolism.
Key words diabetes nephropat hyrhein rats
大黄酸(Rhein,4,5 dihydroxyanthraquinone-2-carboxylic acid)是从大黄蒽醌衍生物中分 离出的一种单体组份[1]。体外实验发现,大黄酸可以抑制高糖培养条件下肾小球系膜细胞细胞外基质合成的增加,对转化生长因子β1(transforming growth factor β1,TGFβ1)所致系膜细胞I型葡萄糖转运蛋白(glucose transport 1,GLUT1)的高表达以及系膜细胞糖摄入的增加也有明显的抑制作用[2]。作者以往的研究结果证实,大黄酸可以抑制STZ诱导糖尿病大鼠初期的肾脏肥大[3],但长期应用大黄酸对糖尿病大 鼠肾脏病变以及机体代谢水平有何影响,目前并不明确。
, http://www.100md.com
本研究采用小剂量链脲佐菌素(streptozotocin,STZ)腹腔内多次注射法建立糖尿病鼠模型 。模型建立后经口给予大黄酸治疗一年。观察一年期间大黄酸对糖尿病大鼠肾脏病变及代谢紊乱的影响,并在此基础上对大黄酸治疗糖尿病肾病的可能机制进行了初步的探讨。
1 材料和方法
1.1 药物 大黄酸均从正品掌叶大黄(甘肃省西宁市药材公司)中提取,由本院中心仪器科提供,经HPLC检验药品纯度在90%以上。
1.2 实验动物及糖尿病模型建立 采用清洁级三月龄雌性Wistar大鼠40只,购自上海动物实验中心。大鼠体重在180~200g之间。实验期间,动物室温控制在25~28℃,湿度70%,12h交替照明。大鼠自由饮水、进食,保持垫料干燥。饲料中蛋白含量为20%,胆固醇含量为3.5%。以小剂量STZ(Sigma公司)腹腔内多次注射法建立糖尿病动物模型,STZ溶于pH4.0枸橼酸缓冲液中,每次药量在10min内用完。以20mg/(kg.d)连续腹腔内给药三次后,减量至10mg/(kg.d)一次,48h后经大鼠眶后静脉丛采血测血糖,以血糖水平高于13.9mmol/L且尿糖阳性作为糖尿病动物模型建立标准。实验期间监测尿酮,个别血糖水平过高者采用适量胰岛素对症处理。
, 百拇医药
1.3 实验分组 糖尿病模型建立后,将动物随机分为两组,即A组(糖尿病对照组,n=10),B组(糖尿病治疗组,分别设大黄酸100mg/(kg.d)及25mg(kg.d)两个剂量组,每组n=10)并设C组(正常对照组,n=10)。大黄酸以间隔一月交替灌胃与经饲料给药的方式进行。将大黄酸溶于75%酒精后用生理盐水稀释10倍,制成药物浓度为0.5g/L大黄酸灌胃,或根据大鼠每天的进食量,制成含有不同剂量大黄酸的大鼠饲料,每天喂食。对照组给予等量的生理盐水或饲料。
1.4 标本留取
1.4.1 普通标本 实验开始后,每月称体重,测定进食量,尿量和血糖一次。血标本以玻璃毛细管(直径1.0mm)经大鼠框后静脉丛采取,6h内离心分离血清,于-20℃冰箱保存待测,尿标本采用金属代谢笼(购自苏州动物实验仪器厂)收集,收集时预先将大鼠放入洗净的代谢笼内,二天后开始收集24h尿标本,记录尿量后取5ml,5000r/min离心5min,去除沉渣并于-20℃冰箱保存待测。
, 百拇医药
1.4.2 肾组织病理标本及肾小球分离 实验12月时,大鼠经氯胺酮麻醉后,取腹正中切口暴露双肾及腹主动脉,经腹主动脉插管,用冷PBS将双肾充分灌洗后,取左肾经肾门冠状面取组织,石蜡切片,厚4μm,行HE,PAS及PAM染色。并取肾组织于-20℃冰箱保存留做冰冻切片。同时取右肾,去除肾包膜及肾门结缔组织并用生理盐水清洗干净后用电子天平称取右肾重量,并参照文献[4]取右肾及部分左肾分离肾小球。在显微镜下观察,纯度在95%以上。
1.5 实验室指标检测
1.5.1 一般指标 血糖每月检测一次;血生化指标用HITACH-7150自动生化分析仪检测;尿蛋白定量采用考马斯亮兰G-250法;尿肌酐采用碱性苦味酸法;外周血糖化血红蛋白(HbAlC)采用试剂盒(Bio-Rad,USA)。
1.5.2 大鼠平均动脉压及心室重量测定 实验12月时每组随机取4只大鼠,用氯氨酮50mg/100g与硫喷妥钠5mg/100g联合腹腔注射麻醉后,经右侧股动脉插管,静置15~20min,用二道生理记录仪(上海生理实验仪器厂)记录平均动脉压(MAP);实验12月宰杀大鼠取大鼠心脏,用生理盐水充分洗净心腔内积血,去除心包膜及双侧心房后用电子天平称取心室重量。
, 百拇医药
1.5.3 肾组织病理定量分析 取PAS染色切片,用彩色CDD摄像机,VC32真彩色图像处理板,用C语言编制实现了对肾组织中肾小球进行定量的彩色图像处理系统。高倍镜下(20倍),每份标本测10个正切的肾小球,分别测定肾小球,肾小球血管袢,系膜区及丝球体面积。
1.5.4 大鼠肾小球TGF-β1及GLUT1 mRNA定量 取肾小球,采用硫氰酸胍一步法提取RNA,参照文献[5],采用RT-PCR法对肾小球中TGF-β1及GLUT1 mRNA进行定量,大鼠TGF-β1引物序列为:正引物:5’-CGAGGT GAC CTG GGC ACC ATC CAT GAC,负引物:5’-CTG CTC CAC CTT GGG CTT GCG ACC CAC(280bp)。β-Actin引物序列为:正引物:5’-AAC CCT AAG GCC ACC CGT GAA AAG-3',负引物:5’-TGG ACT GTC TGA TGG AGT ACT-3’(240bp)。PCR反应条件为:①94℃3min;②94℃变性1min、60℃退火1min、72℃延伸2min,共35个循环;③72℃再延伸10min。GLUT1 mRNA采用增强PCR法进行检测[6,7],GLUT1引物序列为:正引物:5’-CAT GTG CTT CCA ATA TGT GG-3’,负引物:5’-GTC AGT TTG GAA GAG GTC TC-3’(312bp)。β-Actin引物序列为:正引物:5’-CTA CAA TGA GCT GCG TGT GG-3’(cDNA192-211),负引物:5’-TAG CTC TTC TCC AGG GAG GA-3’(450bp)。PCR反应分两步:第一步为:①94℃3 min;②94℃变性1min,55℃退火2min,72℃延伸2min,共20个循环;第一步反应结束后,在反应体系中再加入Mg2+,10×buffer,dNTP,GLUT1primer1及primer2,β-Actinprimer1及primer2,β-Actin,Taq酶,反应条件为94℃1 min,55℃变性1min,72℃退火1min共25个循环,最后72℃延伸10 min。PCR扩增产物在2%琼脂糖凝胶上进行电泳。用四新图象分析仪及其软件对电泳条带亮度及其面积相对百分比进行分析。
, 百拇医药
1.6 统计学处理 计量资料均以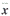 ±s表示,多组间比较采用方差分析,F检验;两组间均值比较采用t检验。P<0.05为差异显著,P<0.01为差异极显著。
±s表示,多组间比较采用方差分析,F检验;两组间均值比较采用t检验。P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 一般情况
实验结束时正常对照大鼠体重平均增加40.5±2.5%(279.3±13.2gvs198.6±7.2g,P<0.01)。糖尿病大鼠模型建立后三个月内大鼠体重有降低趋势,其后体重有轻度增加,但12月时体重仍明显低于正常对照大鼠(216.5±20.8gvs279.3±13.2,P<0.01)。两组大黄酸治疗组大鼠的体重变化与糖尿病对照大鼠相似,12月时三组糖尿病大鼠的体重无明显差别(216.5±20.8gvs222.5±21.0gvs224.4±15.7g,P>0.05)。观察期间糖尿病大鼠进食量较正常大鼠明显增加,而大黄酸治疗后大鼠每天的进食量与糖尿病对照组大鼠相比并无明显差别。实验结束时,三组糖尿病大鼠的血压及心室重量相近,较正常对照也并无明显升高(见表1)。
, http://www.100md.com
表1 糖尿病模型建成12月时大鼠一 般情况的变化
体重
(g)
进食
(g/24h)
血糖
(mmol/L)
糖化血红蛋白
(%)
平均动脉压
(κPa)
心室重量
, http://www.100md.com (×10-1g)
糖尿病对照
216.5±20.8▲
20.5±2.4△
24.2±6.7▲
6.1±0.3▲
16.1±1.48
6.9 98±0.614
大黄酸100mg
222.5±21.0
19.7±2.6
, 百拇医药
20.0±4.1
5.2±0.4*
16.8±0.87
6.729±0.540
大黄酸25mg
224.4±15.7
21.0±4.0
25.4±8.3
5.9±0.7
16.5±0.84
7.012±0.620
正常对照
, http://www.100md.com
279.3±13.2
17.0±2.1
3.0±1.0
3.7±0.5
16 .5±0.33
6.929±0.419
与糖尿病对照组相比*P<0.05;与正常对照组相比△P<0.05; ▲P<0.01
糖尿病模型建立后三组糖尿病大鼠血糖水平相近,明显高于正常对照大鼠(21.7±1.5,22.6±1.3,22.4±1.1mmol/Lvs 3.0±0.4mmol/L,P<0.05)。模型建成后6个月以内,糖尿病大鼠血糖水平呈缓慢增长的趋势,6月时最高,其后至实验结束时血糖水平略有回落,但其水平一直保持在13.9mmol/L以上。大黄酸治疗后大鼠血糖水平较糖尿病对照组大鼠略低,其中大黄酸100mg组6个月时血糖水平降低差异明显(图1)。12月时糖尿病大鼠的糖化血红蛋白(HbA1C)水平明显高于正常对照大鼠,大黄酸治疗后大鼠HbA1C水平低于糖尿病对照大鼠,其中100mg剂量组差异显著(表1)。
, http://www.100md.com
糖尿病模型建成12月时大鼠血清总蛋白及白蛋白水平明显低于正常对照大鼠,血尿素氮,肌酐,血清总胆固醇及甘油三酯水平较正常对照大鼠明显升高。大黄酸治疗12月后大鼠血清肌酐,总胆固醇及甘油三酯水平均低于糖尿病对照组大鼠,血清总蛋白及白蛋白水平高于糖尿病对照组大鼠。大黄酸100mg治疗组大鼠血清总胆固醇,甘油三酯,及血清肌酐水平改善较25mg治疗组大鼠明显(见表2)。
图1 糖尿病模型建成12月内各组大鼠血糖水平变化
表2 糖尿病模型建成12月时各组大 鼠血生化指标变化
大黄酸组
糖尿病对照组
(n=7)
, http://www.100md.com
正常对照组
(n=10)
100mg/kg(n=8)
25mg/kg(n=9)
TP
64.5±5.1
67.6±5.5
61.8±3.2△
65.4±2.4
ALB
30.1±1.7*
31.1±3.2*
, http://www.100md.com
28.4±1.1△
32.4±2.2
BUN
6.8±1.3
7.1±1.3
7.3±0.9△
6.2±0.2
SCr
64.0±3.0*
70.8±5.3
69.0±3.6△
, 百拇医药
63.8±3.1
Ch
2.39±0.24*
2.42±0.23
2.62±0.22△
2.12±0.24
TG
1.18±0.55*
1.53±0.41
1.66±0.30△
1.04±0.22
, http://www.100md.com
与糖尿病对照组相比*P<0.05;与正常对照组相比△P<0.01 TP:血清总蛋白;ALB:白蛋白;Ch:胆固醇;TG:甘油三酯。
2.2 尿蛋白排泄量的变化 正常对照大鼠实验开始时每天尿液中排出少量蛋白,一年后尿蛋白水平有轻度增加(8.9±4.9vs1.9±0.8mg/24h,P<0.05)。糖尿病模型建成4周时大鼠尿蛋白排泄量即明显增加(11.4±4.7vs1.9±0.8mg/24h,P<0.05),其后尿蛋白排泄量逐渐增多,12月时尿蛋白排泄量达65.2±36.4mg/24h,远远高于正常对照大鼠。大黄酸治疗组大鼠一个月时,尿蛋白水平与糖尿病对照大 鼠无明显差别,3个月时尿蛋白排泄量即低于糖尿病对照大鼠(11.7±4.1,15.2±5.6vs20.3±6.1mg/24h),其中大黄酸100 mg组疗效明显。12月后大黄酸治疗组大鼠尿蛋白水平有所增加,但仍低于糖尿病对照大鼠(30.7±14.0,48.8±23.3vs 65.2±36.4 mg/24h,P <0.05)(图2)。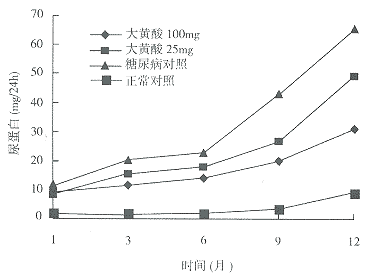
, 百拇医药
图2 糖尿病模型建成12月内各组大鼠24小时尿蛋白排泄量的变化
2.3 肾肌酐清除率(Ccr)的变化 12月时糖尿病对照大鼠Ccr明显高于正常对照(1.84±0.43 vs 0.79±0.13ml/mim.100g,P<0.05),大黄酸100mg治疗组Ccr明显低于糖尿病对照(大黄酸25mg治疗组对Ccr无明显影响)(图3)。
图3 糖尿病模型建成12月时各组大鼠的肌酐清除率
2.4 肾组织病理学改变及定量分析 糖尿病模型建成12月时大鼠右肾重量及右肾/体重比均明显高于正常对照大鼠,其右肾的代偿肥大率为48.5±13.2%,大黄酸100mg及25mg两种剂量治疗后大鼠右肾肥大均减轻,右肾代偿肥大率分别为28.0±8.4%及38.9±11.6%,大黄酸高剂量组疗效显著。
, http://www.100md.com
12月后,正常对照大鼠肾小球及小管间质未见明显的病理改变。糖尿病大鼠肾组织光镜检查可见肾小球面积明显增大,系膜区增宽,但未见明显的肾小球硬化及小管萎缩与间质纤维化(图4)。病理定量分析结果表明,糖尿病大鼠肾小球,丝球体及系膜区面积均较正常对照大鼠明显增加,大黄酸治疗后仍大于正常对照大鼠,但明显低于糖尿病未治疗组大鼠,其中高剂量大黄酸治疗组病变改善最为显著(表3)。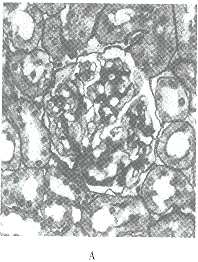


图4 大黄酸治疗12月后各组大鼠肾组织病理改变(PAS,× 400)
正常对照组大鼠(A),糖尿病对照组大鼠(B),大黄酸10 0mg治疗组大鼠(C)。
, 百拇医药
表3 各组大鼠肾小球病理定量分析
肾小球面积(μm2)
丝 球体面积(μm2)
系膜区面积(μm2)
系膜区/丝球体(%)
大黄酸100
11128±958.6*
7309±631.5△
1357±241.4△
18.4±3.1△
, http://www.100md.com
大黄酸25
11175±674.3*
7644±671.6△
1742±545.6△
22.7±6.6△
糖尿病对照
12753±1536.8▲
9002±639.2▲
3315±719.4▲
31.9±7.8▲
, 百拇医药
正常对照
9642±396.5
5460±318.7
866±6 4.2
15.2±2.1
与糖尿病对照组相比*P<0.05,△P<0.01;与正常对照组相比▲ P<0.012.5 肾小球TGF-β1及GLUT1 mRNA的表达 糖尿病模型建立12月后,大鼠肾皮质肾小球中TGF-β1及GLUT1 mRNA表达较正常对照大鼠明显升高(TGF-β1:19.2±9.5%vs9.5±4.3%,P<0.05;GLUT1:48.9±18.0% vs 22.4±2.6%,P<0.05),大黄酸100 mg组TGF-β1及GLUT1 mRNA表达量明显降低(TGF-β1:9.1±6.8%vs19.2±9.5%,P<0.05;GLUT1:28.5±6.2%vs48.9±18.0%, P<0.05)。
, 百拇医药
3 讨 论
本研究采用STZ小剂量多次腹腔内注射法建立糖尿病大鼠动物模型,大鼠表现为血糖及糖化血红蛋白水平明显升高,出现多饮多尿,体重不增或增加较少。模型建立一个月时大鼠即出现尿蛋白排泄量增加,其后尿蛋白水平逐渐上升。实验期间糖尿病大鼠血清肌酐,尿素氮水平有轻度升高,甘油三酯及血总胆固醇水平明显升高。一年后糖尿病大鼠肾脏重量及肌酐清除率较正常对照大鼠明显增加。肾组织病理检查提示肾小球面积,丝球体面积及系膜区面积明显高于正常对照大鼠。12月后,糖尿病大鼠肾小球TGF-β及GLUT1mRNA水平明显高于正常大鼠。本研究建立的糖尿病大鼠模型肾脏病变与临床IDDM及文献报道大鼠糖尿病肾病的表现较为吻合[8,9],可以作为观察治疗糖尿病肾病药物疗效的动物实验模型。
以往的研究表明,大黄可以减轻单侧肾切除大鼠对侧肾脏的代偿性肥大,降低肾组织氧耗,并可延缓慢性肾功能不全的进展[10]。糖尿病肾病早期的病理生理改变与单侧肾切除大鼠相似,也可以表现为肾脏肥大,肾组织氧耗量增加,以及肾小球高滤过等病理生理改变[11]。因此解放军肾脏病研究所近年来对大黄在治疗糖尿病肾病中的作用进行了一系列的实验研究和观察。研究发现,大黄醇提取物可以抑制实验性糖尿病大鼠模型早期的肾脏肥大及肾小球内多肽生长因子的表达,减轻糖尿病大鼠的尿蛋白排泄[12~14]。体外实验证实,大黄素可以减少系膜细胞细胞外基质的表达与产生[15]。临床观察也表明中药大黄可以减轻糖尿病患者的尿白蛋白排出量,降低空腹血糖,延缓患者肾功能的减退[16]。以往的研究结果初步认定大黄蒽醌衍生物是大黄治疗糖尿病肾病的主要有效成份。大黄酸是从大黄蒽醌衍生物中分离出的一种主要的单体组份。大黄酸可以抑制TGF-β1介导的小鼠肾小球系膜细胞GLUT1表达及细胞糖摄入的增加,抑制高糖刺激系膜细胞的肥大及细胞外基质合成的增加[2]。大黄酸在抑制单侧肾切除及STZ诱导糖尿病大鼠初期的肾脏肥大中也有明确的疗效,其作用效果强于大黄素[3]。本文研究结果证实,大黄酸治疗一年期间,治疗组大鼠尿蛋白排泄量明显降低,大鼠的肾功能有所改善;大黄酸治疗一年后,大鼠肾脏肥大减轻,肾小球,丝球体及系膜区面积明显缩小。此外本研究还发现实验剂量的大黄酸对大鼠血糖及糖化血红蛋白水平,血清甘油三酯及总胆固醇水平均有一定程度的影响。大黄酸治疗期间,大鼠进食量与糖尿病未治疗组相比无明显差别,也未出现体重减轻及腹泻等现象,表明本研究中所选大黄酸的剂量可以改善糖尿病大鼠的肾脏病变,同时对实验大鼠也是较为安全的。
, 百拇医药
造成糖尿病肾病发生与发展的因素较为复杂。主要分为遗传因素以及非遗传因素。目前均从纠正非遗传性因素着手来开展针对糖尿病肾病的治疗。非遗传因素主要包括三个方面,即代谢,血流动力学以及相关的生长因子的变化[17]。下面就这三个方面,对大黄酸治疗糖尿病肾病的可能机制进行讨论。
3.1 对代谢的影响 糖尿病状态下,饮食蛋白质摄入量的多少与糖尿病肾脏病变的发生与发展密切相关[18,19],降低饮食中蛋白质的摄入量可以延缓糖尿病肾病的进展[20]。本研究中糖尿病大鼠每天进食量明显高于正常对照,大黄酸治疗后,大鼠每天的进食量并未减少,因此排除了进食蛋白质量的多少对肾脏病变可能产生的影响。糖尿病时血糖水平的高低是糖尿病肾病产生的最重要原因。高血糖可以使细胞糖摄入增加,导致细胞内多元醇通路及PKC的激活,增加糖基化终末产物的生成[21]。以往一些研究结果表明,大黄对糖尿病大鼠以及早期糖尿病患者的血糖水平有降低作用[12,22]。本研究发现,糖尿病大鼠模型建成后,使用大黄酸治疗3个月时血糖水平即较未治疗组有所降低,6个月时高剂量大黄酸治疗组的血糖降低幅度达最大。因此对血糖的影响很可能是大黄酸产生疗效的很重要的一个方面。近年来,对于细胞摄糖机制的研究结果表明,细胞摄糖能力除了取决于微环境中的糖浓度外,细胞表面葡萄糖转运蛋白的多少及功能的强弱也是影响细胞糖摄入的重要因素。这也就解释了为什么有些血糖控制良好的患者最后仍然会发生糖尿病肾病[23,24]。在体外实验中我们已经发现大黄酸可以抑制TGF-β1诱导的肾小球系膜细胞GLUT1mRNA的表达以及细胞糖摄入量的增加[2]。本研究中,大黄酸治疗一年后大鼠肾小球中GLUT1的mRNA水平较糖尿病对照明显降低。因此在体内,大黄酸很可能通过对血糖以及细胞表面糖转运蛋白的影响来减少肾固有细胞的糖摄入量,进而阻止或降低后续途径的激活,并最终延缓糖尿病肾病的进展。大黄酸降低血糖水平的确切机制目前并不清楚,有文献报道,抑制骨骼肌细胞表面GLUT1的功能可以使机体对胰岛素的敏感性增加,大黄酸是否通过此途径来达到其降血糖的作用,抑或还存在其他的降血糖的机制尚待研究。此外,脂代谢紊乱对糖尿病肾病的发展也起到了一定的促进作用[25],糖尿病大鼠经大黄酸治疗后血脂代谢紊乱得到了一定程度的纠正,并且以往在应用大黄治疗慢性肾功能不全患者中,也发现大黄可以改善患者的脂代谢紊乱[26]。因此大黄酸降低糖尿病时血脂水平对延缓糖尿病肾病的进展也有一定的积极作用。
, http://www.100md.com
3.2 对血流动力学的影响 可能造成糖尿病肾脏损害的血流动力学因素主要有体循环血压,肾小球灌注压以及一些血管活性细胞因子(如Ang-II,ET-1等)的产生等[17]。大黄酸对糖尿病状态下机体及肾组织微环境的血流动力学是否有影响,目前尚无直接的证据,本研究中大黄酸对大鼠平均动脉压并无影响,大黄酸治疗组大鼠一年时肾脏肌酐清除率明显降低,但要明确大黄酸在肾血流动力学中的作用,尚需要进一步的研究。
3.3 对相关生长因子的影响 生长因子在糖尿病肾病发病中的作用已得到充分的证实。IGF-1,PDGF,TGFβ1及HGF的mRNA和蛋白质水平在糖尿病动物模型中均有变化,其中TGFβ1的表达与功能在糖尿病肾病的发生与发展中具重要作用。TGFβ1可以促使肾脏细胞肥大,细胞外基质(ECM)沉积,并最终造成肾小球硬化及间质纤维化[27]。本研究中大黄酸治疗组大鼠12月时肾小球中TGFβ1mRNA表达量明显降低。但大黄酸对体内TGFβ1mRNA表达的影响是直接作用的结果还是因纠正机体及细胞代谢紊乱而产生的间接效果尚不明确。
, http://www.100md.com
综合本文以及以往的研究结果,我们认为纠正糖尿病状态下机体以及细胞代谢的紊乱可能是大黄酸延缓糖尿病肾病进展的主要机制。大黄以及其单体大黄酸因其较为特殊的作用方式很可能为糖尿病肾病的治疗开辟一个崭新的领域。这里必须强调的是,由于糖尿病肾病致病机制非常复杂,单用大黄酸也仅仅对糖尿病肾病的发展有一定程度的延缓作用,并不能完全阻断糖尿病肾病的发展。近来有研究表明,联合应用钙离子通道阻断剂及ACEI可以使糖尿病肾病的治疗效果大大提高[28]。结合大黄酸与其他药物不同的作用方式,大黄酸与ACEI两药联用或与ACEI及钙离子通道阻断剂三药联用可能会对延缓糖尿病肾病的进展产生更加显著的疗效。
作者简介:戴春笋 南京大学医学院博士研究生
参考文献
1 陈琼华.大黄的实验研究和临床应用.新医药学杂志,1974,8:226
, 百拇医药
2 章 精,刘志红,李颖健等.大黄酸对系膜细胞糖摄入的影响及其机制.肾脏病与透析肾移植杂志,1999,8(4):307
3 戴春笋,刘志红,杨俊伟等.大黄蒽醌衍生物及其单体大黄酸,大黄素抑制STZ诱导糖尿病大鼠初期肾脏肥大的疗效观察.(待发表)
4 Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction.Analytical Biochemistry,1987,162:156
5 Shankland SJ,Scholey JW,Ly H et al.Expression of transforming growth-β1 during diabetic renal hypertrophy.Kidney Int ,1994,46:430
, http://www.100md.com
6 Ruano G,Fenton W,Kidd KK.Biphasic amplification of very dilute DNA samples via“booster”PCR.Nucleic Acids Research,1989,17(13):5407
7 Ruano G,Kidd KK,Stephens C.Haplotype of multiple polymorphisms resolved by en zymatic amplification of single DNA molecules.Proc Natl Acad Sic USA,1990,87:6296
8 Fujihara CK,Padilha RM,Zatz R.Glomerular abnomalities in long-term experiment al diabetes:Role of hemodynamic and nonhemodynamic factors and effects of antih pertensive therapy.Diabetes,1992,41:286
, 百拇医药
9 Remuzzi A,Perico N,Amuchastegui CS,et al.Short and long-term effect of a ngio tensin II receptor blockade in rats with experimental diabetes.J Am Soc Nephrol,1993,4:40
10 Leishi Li.End stage renal disease in China.Kidney Int,1996,49:287
11 Bryan GT,Hostetter TH.The renal hemodynamic basis of diabetic nephropathy.Se min Nephrol,1997,17(2):93
12 杨俊伟,黎磊石,张 真.大黄治疗糖尿病肾病的实验研究.中华内分泌代谢杂志,1993,9(4):49
, http://www.100md.com
13 杨俊伟,黎磊石,刘志红等.大黄抑制糖尿病大鼠肾脏肥大的作用与肾小球多肽生长因子表达的关系.中华内分泌代谢杂志,1995,11(4):173
14 杨俊伟,黎磊石.大黄对实验性糖尿病大鼠肾脏肥大及高滤过作用的影响.中国中西医结合杂志,1993,13(5):286
15 姚 健,黎磊石,周 虹.大黄素对培养人肾小球系膜细胞纤维连接蛋白产生的抑制作用.肾脏病与透析肾移植杂志,1994,3:349
16 赵洪军,韩学忠,徐 梅等.大黄治疗早期糖尿病肾病32例.中国中西医结合杂志,1996,16(17):429
17 Cooper ME.Pathogenesis,Prevention,and treatment of diabetic nephropathy.Lanc et,1998,352:213
, 百拇医药
18 Klahr S,Levey AS,Beck GJ et al.For the modfication of diet in renal dise ase study group:The effects of dietary protein restriction on the progression of chronic renal disease.N Engl J Med,1994,330:877
19 Zeller K,Whittaker Ae,Sullival L et al.Effects of restricting dietary pr otein on the progression of renal failure in patients with insulin-dependent di abetes mellitus.N Engl J Med,1991,324:78
20 Pearini MT,Levey AS,Lau J et al.The effect of dietary protein restriction on the progression of diabetic and nondiabetic renal diseases-a meta-analysis.Ann Intern Med,1996,124:627
, 百拇医药
21 Cooper ME,Gilbert RE,Epstein M.Pathophysiology of diabetic nephropathy.Metab olism,1998,47(12,suppl 1):3
22 葛祖恺,孙子林,黄继臣.大黄制剂,巯甲丙脯酸治疗糖尿病氮质血症期的效果观察.铁道医学,1994,23(5):282
23 Ayo S,Radnik R,Garoni J et al.High glucose causes an increase in extrace llular matrix proteins in cultured mesangial cells.Am J Pathol,1990,136:1339
24 Baldwin SA.Mammalian passive glucose transporters:members of aubiquitous family of active and passive transport proteins.Biochem Biophys Acta,1993,1154:17
, 百拇医药
25 Rodby RA.Type II diabetic nephropathy:Its clinical course and therapeuticim plications.Smein Nephrol,1997,17(2):132
26 张景红,黎磊石,万柏珍等.大黄对慢性肾衰患者脂质代谢的影响.金陵医院学报,1991,4(4):317
27 Wolf G,Ziyadeh N.Molecular mechanisms of diabetic renal hypertrophy.Kidney I nt,1999,56:393
28 Bakis G.Combination therapy for hypertension and renal disease in diabetes as compared to non-diabetes.In:Mogensen CE,ed.The Kidney and Hypertension in Diabetes Mellitus,3rd edn.Norwell,Massachusetts:Kluwer Academic Publishers,1997.561-68
(1999-09-10收稿), 百拇医药
单位:南京军区南京总医院 解放军肾脏病研究所(南 京,210002)
关键词:大黄酸;糖尿病肾病;大鼠
肾脏病与透析肾移值杂志990502
摘 要 目的:观察长期应用大黄酸对糖尿病大鼠远期病变的疗效。 方法:采用小剂量STZ腹腔内多次注射法建立糖尿病大鼠动物模型。动物分为糖尿病对照组,糖尿病大黄酸治疗组,和正常对照组。其中糖尿病治疗组分别给不同剂量的大黄酸(25,100mg/kg.d-1)。定期观察一般情况,血糖及血生化指标,同时测定24h尿蛋白排出量。连续治疗12个月宰杀大鼠,称取右肾重量,并留光镜标本观察肾组织病理学改变。 结果:(1)糖尿病模型建立12月后,糖尿病大鼠体重明显低于正常对照大鼠;血压及心室重量与正常对照大鼠无明显差别;血肌酐,总胆固醇及甘油三酯水平较正常对照大鼠升高。糖尿病模型建立4周时出现少量尿蛋白,12月时尿蛋白水平明显高于正常对照大鼠(65.2±36.4vs8.9±4.9mg/24h,P<0.01),肾脏重量也较正常对照大鼠增加(0.9404±0.0999gvs0.8177±0.0304g,P<0.05)。光镜下可见糖尿病大鼠肾小球,丝球体及系膜区面积均较正常对照大鼠增加,但未见明显的肾小球硬化。(2)治疗期间大鼠血糖水平较糖尿病未治组大鼠略低。治疗12月后,大黄酸组大鼠血肌酐,总胆固醇及甘油三酯水平较糖尿病对照组降低,大黄酸100mg组疗效较强。大鼠体重,平均动脉压及心室重量与糖尿病未治组大鼠相比无显著差别。(3)大黄酸治疗12月后,糖尿病大鼠尿蛋白排泄量较糖尿病对照组大鼠减少,其中高剂量组降低较为明显。治疗组大鼠肾脏重量,肾小球面积及系膜区面积也较糖尿病对照大鼠减小。12月时,糖尿病大鼠肾小球TGFβ1及GLUT1mRNA表达升高,大黄酸治疗后降低明显。 结论:(1)STZ诱导糖尿病大鼠12月时可出现较明显的肾脏病变,表现为尿蛋白排出量增加,肾脏肥大,肾小球面积及丝球体面积加大,系膜区增宽;(2)大黄酸可以降低糖尿病大鼠尿蛋白排出量,减轻肾脏肥大,缩小肾小球面积及系膜区面积,降低肾小球TGFβ1及GLUT1mRNA的高表达,并可改善糖尿病大鼠的血脂代谢异常,有轻度降血糖作用;(3)大黄酸治疗糖尿病肾病的机制可能与其纠正机体及细胞代谢异常,降低TGF-β1产生有关,其对肾小球血流动力学是否有影响,尚待进一步研究。
, 百拇医药
EFFECTS OF RHEIN IN INHIBITING T HE PROGR ESSION OF DIABETIC NEPHROPATHY IN STZ-IN DUCED DIABETIC RATS
Dai Chunsun, Liu Zhihong, Chen Huip ing, Yang Junwei, Zhou Hong, Li Leishi
Research Institute of Nephrology, Jinlin g Hospital,Nanjing University School of Medicine,Nanjing 210002
OBJECTIVE To investigate rhe in’s long-term effects on the progression of diabetic nephropathy and the metabo lism disturbance in STZ-induced diabetic rats.
, 百拇医药
METHODOLOGY Diabetes was ind uced with multi-injection of low-dose STZ in Wistar rats. Wistar rats were di vided into three groups, the untreated diabetic control group, rhein treated dia betic group and the normal control group.Ordinary parameters, urine protein exc re tion and histopathology were investigated for 12months after the induction of di abetes.
RESULTS At the 12th month af ter induction of diabetes, body weight of diabetic rats was significantly lower than normal control group,blood pressure and cardiac ventricular weight were sim ilar to those in normal control group,serum creatini ne,cholesterol,and triglyceride were significantly higher in diabetic group.R ats in diabetic group were found to have mild increase in urine protein excretion at the 4th week after induction of diabetes.At the 12th month,there were significant increases in urine protein excretion (65.2±36.4 vs 8.9±4.9mg/24hrs,P<0.01),kidney weight (0.9404±0.0999 vs 0.8177±0.0304g,P<0.05),glomerular and mesangial area in diabetic rats as comp ared to those of normal controls.Comparing to the untreated diabetic rats,the serum glucose concentration was lower in rhein treated diabetic rats during the 12 months after induction of diabetes.Bo dy weight,blood pressure and cardiacven tricular weight were not significantly different among these groups.As compared to those in untreated diabetic rats,urine protein excretion ,kidney weight,glomerular and mesangial area were decre a sed significantly in rhein treated diabe tic rats at the 12th month after indu ction of diabetes. The mRNA content of T GF β1 and GLUT1 were also decreased in rhein treated diabetic rats.
, 百拇医药
CONCLUSION Rhein can decreas e the urine protein excretion,kidney weight, glomerular area and mesangial ECM deposition in STZ-induced diabetic rats .The mechanism for rhein’s inhibition may be related to its amelioration of the cellular metabolism.
Key words diabetes nephropat hyrhein rats
大黄酸(Rhein,4,5 dihydroxyanthraquinone-2-carboxylic acid)是从大黄蒽醌衍生物中分 离出的一种单体组份[1]。体外实验发现,大黄酸可以抑制高糖培养条件下肾小球系膜细胞细胞外基质合成的增加,对转化生长因子β1(transforming growth factor β1,TGFβ1)所致系膜细胞I型葡萄糖转运蛋白(glucose transport 1,GLUT1)的高表达以及系膜细胞糖摄入的增加也有明显的抑制作用[2]。作者以往的研究结果证实,大黄酸可以抑制STZ诱导糖尿病大鼠初期的肾脏肥大[3],但长期应用大黄酸对糖尿病大 鼠肾脏病变以及机体代谢水平有何影响,目前并不明确。
, http://www.100md.com
本研究采用小剂量链脲佐菌素(streptozotocin,STZ)腹腔内多次注射法建立糖尿病鼠模型 。模型建立后经口给予大黄酸治疗一年。观察一年期间大黄酸对糖尿病大鼠肾脏病变及代谢紊乱的影响,并在此基础上对大黄酸治疗糖尿病肾病的可能机制进行了初步的探讨。
1 材料和方法
1.1 药物 大黄酸均从正品掌叶大黄(甘肃省西宁市药材公司)中提取,由本院中心仪器科提供,经HPLC检验药品纯度在90%以上。
1.2 实验动物及糖尿病模型建立 采用清洁级三月龄雌性Wistar大鼠40只,购自上海动物实验中心。大鼠体重在180~200g之间。实验期间,动物室温控制在25~28℃,湿度70%,12h交替照明。大鼠自由饮水、进食,保持垫料干燥。饲料中蛋白含量为20%,胆固醇含量为3.5%。以小剂量STZ(Sigma公司)腹腔内多次注射法建立糖尿病动物模型,STZ溶于pH4.0枸橼酸缓冲液中,每次药量在10min内用完。以20mg/(kg.d)连续腹腔内给药三次后,减量至10mg/(kg.d)一次,48h后经大鼠眶后静脉丛采血测血糖,以血糖水平高于13.9mmol/L且尿糖阳性作为糖尿病动物模型建立标准。实验期间监测尿酮,个别血糖水平过高者采用适量胰岛素对症处理。
, 百拇医药
1.3 实验分组 糖尿病模型建立后,将动物随机分为两组,即A组(糖尿病对照组,n=10),B组(糖尿病治疗组,分别设大黄酸100mg/(kg.d)及25mg(kg.d)两个剂量组,每组n=10)并设C组(正常对照组,n=10)。大黄酸以间隔一月交替灌胃与经饲料给药的方式进行。将大黄酸溶于75%酒精后用生理盐水稀释10倍,制成药物浓度为0.5g/L大黄酸灌胃,或根据大鼠每天的进食量,制成含有不同剂量大黄酸的大鼠饲料,每天喂食。对照组给予等量的生理盐水或饲料。
1.4 标本留取
1.4.1 普通标本 实验开始后,每月称体重,测定进食量,尿量和血糖一次。血标本以玻璃毛细管(直径1.0mm)经大鼠框后静脉丛采取,6h内离心分离血清,于-20℃冰箱保存待测,尿标本采用金属代谢笼(购自苏州动物实验仪器厂)收集,收集时预先将大鼠放入洗净的代谢笼内,二天后开始收集24h尿标本,记录尿量后取5ml,5000r/min离心5min,去除沉渣并于-20℃冰箱保存待测。
, 百拇医药
1.4.2 肾组织病理标本及肾小球分离 实验12月时,大鼠经氯胺酮麻醉后,取腹正中切口暴露双肾及腹主动脉,经腹主动脉插管,用冷PBS将双肾充分灌洗后,取左肾经肾门冠状面取组织,石蜡切片,厚4μm,行HE,PAS及PAM染色。并取肾组织于-20℃冰箱保存留做冰冻切片。同时取右肾,去除肾包膜及肾门结缔组织并用生理盐水清洗干净后用电子天平称取右肾重量,并参照文献[4]取右肾及部分左肾分离肾小球。在显微镜下观察,纯度在95%以上。
1.5 实验室指标检测
1.5.1 一般指标 血糖每月检测一次;血生化指标用HITACH-7150自动生化分析仪检测;尿蛋白定量采用考马斯亮兰G-250法;尿肌酐采用碱性苦味酸法;外周血糖化血红蛋白(HbAlC)采用试剂盒(Bio-Rad,USA)。
1.5.2 大鼠平均动脉压及心室重量测定 实验12月时每组随机取4只大鼠,用氯氨酮50mg/100g与硫喷妥钠5mg/100g联合腹腔注射麻醉后,经右侧股动脉插管,静置15~20min,用二道生理记录仪(上海生理实验仪器厂)记录平均动脉压(MAP);实验12月宰杀大鼠取大鼠心脏,用生理盐水充分洗净心腔内积血,去除心包膜及双侧心房后用电子天平称取心室重量。
, 百拇医药
1.5.3 肾组织病理定量分析 取PAS染色切片,用彩色CDD摄像机,VC32真彩色图像处理板,用C语言编制实现了对肾组织中肾小球进行定量的彩色图像处理系统。高倍镜下(20倍),每份标本测10个正切的肾小球,分别测定肾小球,肾小球血管袢,系膜区及丝球体面积。
1.5.4 大鼠肾小球TGF-β1及GLUT1 mRNA定量 取肾小球,采用硫氰酸胍一步法提取RNA,参照文献[5],采用RT-PCR法对肾小球中TGF-β1及GLUT1 mRNA进行定量,大鼠TGF-β1引物序列为:正引物:5’-CGAGGT GAC CTG GGC ACC ATC CAT GAC,负引物:5’-CTG CTC CAC CTT GGG CTT GCG ACC CAC(280bp)。β-Actin引物序列为:正引物:5’-AAC CCT AAG GCC ACC CGT GAA AAG-3',负引物:5’-TGG ACT GTC TGA TGG AGT ACT-3’(240bp)。PCR反应条件为:①94℃3min;②94℃变性1min、60℃退火1min、72℃延伸2min,共35个循环;③72℃再延伸10min。GLUT1 mRNA采用增强PCR法进行检测[6,7],GLUT1引物序列为:正引物:5’-CAT GTG CTT CCA ATA TGT GG-3’,负引物:5’-GTC AGT TTG GAA GAG GTC TC-3’(312bp)。β-Actin引物序列为:正引物:5’-CTA CAA TGA GCT GCG TGT GG-3’(cDNA192-211),负引物:5’-TAG CTC TTC TCC AGG GAG GA-3’(450bp)。PCR反应分两步:第一步为:①94℃3 min;②94℃变性1min,55℃退火2min,72℃延伸2min,共20个循环;第一步反应结束后,在反应体系中再加入Mg2+,10×buffer,dNTP,GLUT1primer1及primer2,β-Actinprimer1及primer2,β-Actin,Taq酶,反应条件为94℃1 min,55℃变性1min,72℃退火1min共25个循环,最后72℃延伸10 min。PCR扩增产物在2%琼脂糖凝胶上进行电泳。用四新图象分析仪及其软件对电泳条带亮度及其面积相对百分比进行分析。
, 百拇医药
1.6 统计学处理 计量资料均以
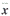 ±s表示,多组间比较采用方差分析,F检验;两组间均值比较采用t检验。P<0.05为差异显著,P<0.01为差异极显著。
±s表示,多组间比较采用方差分析,F检验;两组间均值比较采用t检验。P<0.05为差异显著,P<0.01为差异极显著。2 结 果
2.1 一般情况
实验结束时正常对照大鼠体重平均增加40.5±2.5%(279.3±13.2gvs198.6±7.2g,P<0.01)。糖尿病大鼠模型建立后三个月内大鼠体重有降低趋势,其后体重有轻度增加,但12月时体重仍明显低于正常对照大鼠(216.5±20.8gvs279.3±13.2,P<0.01)。两组大黄酸治疗组大鼠的体重变化与糖尿病对照大鼠相似,12月时三组糖尿病大鼠的体重无明显差别(216.5±20.8gvs222.5±21.0gvs224.4±15.7g,P>0.05)。观察期间糖尿病大鼠进食量较正常大鼠明显增加,而大黄酸治疗后大鼠每天的进食量与糖尿病对照组大鼠相比并无明显差别。实验结束时,三组糖尿病大鼠的血压及心室重量相近,较正常对照也并无明显升高(见表1)。
, http://www.100md.com
表1 糖尿病模型建成12月时大鼠一 般情况的变化
体重
(g)
进食
(g/24h)
血糖
(mmol/L)
糖化血红蛋白
(%)
平均动脉压
(κPa)
心室重量
, http://www.100md.com (×10-1g)
糖尿病对照
216.5±20.8▲
20.5±2.4△
24.2±6.7▲
6.1±0.3▲
16.1±1.48
6.9 98±0.614
大黄酸100mg
222.5±21.0
19.7±2.6
, 百拇医药
20.0±4.1
5.2±0.4*
16.8±0.87
6.729±0.540
大黄酸25mg
224.4±15.7
21.0±4.0
25.4±8.3
5.9±0.7
16.5±0.84
7.012±0.620
正常对照
, http://www.100md.com
279.3±13.2
17.0±2.1
3.0±1.0
3.7±0.5
16 .5±0.33
6.929±0.419
与糖尿病对照组相比*P<0.05;与正常对照组相比△P<0.05; ▲P<0.01
糖尿病模型建立后三组糖尿病大鼠血糖水平相近,明显高于正常对照大鼠(21.7±1.5,22.6±1.3,22.4±1.1mmol/Lvs 3.0±0.4mmol/L,P<0.05)。模型建成后6个月以内,糖尿病大鼠血糖水平呈缓慢增长的趋势,6月时最高,其后至实验结束时血糖水平略有回落,但其水平一直保持在13.9mmol/L以上。大黄酸治疗后大鼠血糖水平较糖尿病对照组大鼠略低,其中大黄酸100mg组6个月时血糖水平降低差异明显(图1)。12月时糖尿病大鼠的糖化血红蛋白(HbA1C)水平明显高于正常对照大鼠,大黄酸治疗后大鼠HbA1C水平低于糖尿病对照大鼠,其中100mg剂量组差异显著(表1)。
, http://www.100md.com
糖尿病模型建成12月时大鼠血清总蛋白及白蛋白水平明显低于正常对照大鼠,血尿素氮,肌酐,血清总胆固醇及甘油三酯水平较正常对照大鼠明显升高。大黄酸治疗12月后大鼠血清肌酐,总胆固醇及甘油三酯水平均低于糖尿病对照组大鼠,血清总蛋白及白蛋白水平高于糖尿病对照组大鼠。大黄酸100mg治疗组大鼠血清总胆固醇,甘油三酯,及血清肌酐水平改善较25mg治疗组大鼠明显(见表2)。

图1 糖尿病模型建成12月内各组大鼠血糖水平变化
表2 糖尿病模型建成12月时各组大 鼠血生化指标变化
大黄酸组
糖尿病对照组
(n=7)
, http://www.100md.com
正常对照组
(n=10)
100mg/kg(n=8)
25mg/kg(n=9)
TP
64.5±5.1
67.6±5.5
61.8±3.2△
65.4±2.4
ALB
30.1±1.7*
31.1±3.2*
, http://www.100md.com
28.4±1.1△
32.4±2.2
BUN
6.8±1.3
7.1±1.3
7.3±0.9△
6.2±0.2
SCr
64.0±3.0*
70.8±5.3
69.0±3.6△
, 百拇医药
63.8±3.1
Ch
2.39±0.24*
2.42±0.23
2.62±0.22△
2.12±0.24
TG
1.18±0.55*
1.53±0.41
1.66±0.30△
1.04±0.22
, http://www.100md.com
与糖尿病对照组相比*P<0.05;与正常对照组相比△P<0.01 TP:血清总蛋白;ALB:白蛋白;Ch:胆固醇;TG:甘油三酯。
2.2 尿蛋白排泄量的变化 正常对照大鼠实验开始时每天尿液中排出少量蛋白,一年后尿蛋白水平有轻度增加(8.9±4.9vs1.9±0.8mg/24h,P<0.05)。糖尿病模型建成4周时大鼠尿蛋白排泄量即明显增加(11.4±4.7vs1.9±0.8mg/24h,P<0.05),其后尿蛋白排泄量逐渐增多,12月时尿蛋白排泄量达65.2±36.4mg/24h,远远高于正常对照大鼠。大黄酸治疗组大鼠一个月时,尿蛋白水平与糖尿病对照大 鼠无明显差别,3个月时尿蛋白排泄量即低于糖尿病对照大鼠(11.7±4.1,15.2±5.6vs20.3±6.1mg/24h),其中大黄酸100 mg组疗效明显。12月后大黄酸治疗组大鼠尿蛋白水平有所增加,但仍低于糖尿病对照大鼠(30.7±14.0,48.8±23.3vs 65.2±36.4 mg/24h,P <0.05)(图2)。

, 百拇医药
图2 糖尿病模型建成12月内各组大鼠24小时尿蛋白排泄量的变化
2.3 肾肌酐清除率(Ccr)的变化 12月时糖尿病对照大鼠Ccr明显高于正常对照(1.84±0.43 vs 0.79±0.13ml/mim.100g,P<0.05),大黄酸100mg治疗组Ccr明显低于糖尿病对照(大黄酸25mg治疗组对Ccr无明显影响)(图3)。

图3 糖尿病模型建成12月时各组大鼠的肌酐清除率
2.4 肾组织病理学改变及定量分析 糖尿病模型建成12月时大鼠右肾重量及右肾/体重比均明显高于正常对照大鼠,其右肾的代偿肥大率为48.5±13.2%,大黄酸100mg及25mg两种剂量治疗后大鼠右肾肥大均减轻,右肾代偿肥大率分别为28.0±8.4%及38.9±11.6%,大黄酸高剂量组疗效显著。
, http://www.100md.com
12月后,正常对照大鼠肾小球及小管间质未见明显的病理改变。糖尿病大鼠肾组织光镜检查可见肾小球面积明显增大,系膜区增宽,但未见明显的肾小球硬化及小管萎缩与间质纤维化(图4)。病理定量分析结果表明,糖尿病大鼠肾小球,丝球体及系膜区面积均较正常对照大鼠明显增加,大黄酸治疗后仍大于正常对照大鼠,但明显低于糖尿病未治疗组大鼠,其中高剂量大黄酸治疗组病变改善最为显著(表3)。



图4 大黄酸治疗12月后各组大鼠肾组织病理改变(PAS,× 400)
正常对照组大鼠(A),糖尿病对照组大鼠(B),大黄酸10 0mg治疗组大鼠(C)。
, 百拇医药
表3 各组大鼠肾小球病理定量分析
肾小球面积(μm2)
丝 球体面积(μm2)
系膜区面积(μm2)
系膜区/丝球体(%)
大黄酸100
11128±958.6*
7309±631.5△
1357±241.4△
18.4±3.1△
, http://www.100md.com
大黄酸25
11175±674.3*
7644±671.6△
1742±545.6△
22.7±6.6△
糖尿病对照
12753±1536.8▲
9002±639.2▲
3315±719.4▲
31.9±7.8▲
, 百拇医药
正常对照
9642±396.5
5460±318.7
866±6 4.2
15.2±2.1
与糖尿病对照组相比*P<0.05,△P<0.01;与正常对照组相比▲ P<0.012.5 肾小球TGF-β1及GLUT1 mRNA的表达 糖尿病模型建立12月后,大鼠肾皮质肾小球中TGF-β1及GLUT1 mRNA表达较正常对照大鼠明显升高(TGF-β1:19.2±9.5%vs9.5±4.3%,P<0.05;GLUT1:48.9±18.0% vs 22.4±2.6%,P<0.05),大黄酸100 mg组TGF-β1及GLUT1 mRNA表达量明显降低(TGF-β1:9.1±6.8%vs19.2±9.5%,P<0.05;GLUT1:28.5±6.2%vs48.9±18.0%, P<0.05)。
, 百拇医药
3 讨 论
本研究采用STZ小剂量多次腹腔内注射法建立糖尿病大鼠动物模型,大鼠表现为血糖及糖化血红蛋白水平明显升高,出现多饮多尿,体重不增或增加较少。模型建立一个月时大鼠即出现尿蛋白排泄量增加,其后尿蛋白水平逐渐上升。实验期间糖尿病大鼠血清肌酐,尿素氮水平有轻度升高,甘油三酯及血总胆固醇水平明显升高。一年后糖尿病大鼠肾脏重量及肌酐清除率较正常对照大鼠明显增加。肾组织病理检查提示肾小球面积,丝球体面积及系膜区面积明显高于正常对照大鼠。12月后,糖尿病大鼠肾小球TGF-β及GLUT1mRNA水平明显高于正常大鼠。本研究建立的糖尿病大鼠模型肾脏病变与临床IDDM及文献报道大鼠糖尿病肾病的表现较为吻合[8,9],可以作为观察治疗糖尿病肾病药物疗效的动物实验模型。
以往的研究表明,大黄可以减轻单侧肾切除大鼠对侧肾脏的代偿性肥大,降低肾组织氧耗,并可延缓慢性肾功能不全的进展[10]。糖尿病肾病早期的病理生理改变与单侧肾切除大鼠相似,也可以表现为肾脏肥大,肾组织氧耗量增加,以及肾小球高滤过等病理生理改变[11]。因此解放军肾脏病研究所近年来对大黄在治疗糖尿病肾病中的作用进行了一系列的实验研究和观察。研究发现,大黄醇提取物可以抑制实验性糖尿病大鼠模型早期的肾脏肥大及肾小球内多肽生长因子的表达,减轻糖尿病大鼠的尿蛋白排泄[12~14]。体外实验证实,大黄素可以减少系膜细胞细胞外基质的表达与产生[15]。临床观察也表明中药大黄可以减轻糖尿病患者的尿白蛋白排出量,降低空腹血糖,延缓患者肾功能的减退[16]。以往的研究结果初步认定大黄蒽醌衍生物是大黄治疗糖尿病肾病的主要有效成份。大黄酸是从大黄蒽醌衍生物中分离出的一种主要的单体组份。大黄酸可以抑制TGF-β1介导的小鼠肾小球系膜细胞GLUT1表达及细胞糖摄入的增加,抑制高糖刺激系膜细胞的肥大及细胞外基质合成的增加[2]。大黄酸在抑制单侧肾切除及STZ诱导糖尿病大鼠初期的肾脏肥大中也有明确的疗效,其作用效果强于大黄素[3]。本文研究结果证实,大黄酸治疗一年期间,治疗组大鼠尿蛋白排泄量明显降低,大鼠的肾功能有所改善;大黄酸治疗一年后,大鼠肾脏肥大减轻,肾小球,丝球体及系膜区面积明显缩小。此外本研究还发现实验剂量的大黄酸对大鼠血糖及糖化血红蛋白水平,血清甘油三酯及总胆固醇水平均有一定程度的影响。大黄酸治疗期间,大鼠进食量与糖尿病未治疗组相比无明显差别,也未出现体重减轻及腹泻等现象,表明本研究中所选大黄酸的剂量可以改善糖尿病大鼠的肾脏病变,同时对实验大鼠也是较为安全的。
, 百拇医药
造成糖尿病肾病发生与发展的因素较为复杂。主要分为遗传因素以及非遗传因素。目前均从纠正非遗传性因素着手来开展针对糖尿病肾病的治疗。非遗传因素主要包括三个方面,即代谢,血流动力学以及相关的生长因子的变化[17]。下面就这三个方面,对大黄酸治疗糖尿病肾病的可能机制进行讨论。
3.1 对代谢的影响 糖尿病状态下,饮食蛋白质摄入量的多少与糖尿病肾脏病变的发生与发展密切相关[18,19],降低饮食中蛋白质的摄入量可以延缓糖尿病肾病的进展[20]。本研究中糖尿病大鼠每天进食量明显高于正常对照,大黄酸治疗后,大鼠每天的进食量并未减少,因此排除了进食蛋白质量的多少对肾脏病变可能产生的影响。糖尿病时血糖水平的高低是糖尿病肾病产生的最重要原因。高血糖可以使细胞糖摄入增加,导致细胞内多元醇通路及PKC的激活,增加糖基化终末产物的生成[21]。以往一些研究结果表明,大黄对糖尿病大鼠以及早期糖尿病患者的血糖水平有降低作用[12,22]。本研究发现,糖尿病大鼠模型建成后,使用大黄酸治疗3个月时血糖水平即较未治疗组有所降低,6个月时高剂量大黄酸治疗组的血糖降低幅度达最大。因此对血糖的影响很可能是大黄酸产生疗效的很重要的一个方面。近年来,对于细胞摄糖机制的研究结果表明,细胞摄糖能力除了取决于微环境中的糖浓度外,细胞表面葡萄糖转运蛋白的多少及功能的强弱也是影响细胞糖摄入的重要因素。这也就解释了为什么有些血糖控制良好的患者最后仍然会发生糖尿病肾病[23,24]。在体外实验中我们已经发现大黄酸可以抑制TGF-β1诱导的肾小球系膜细胞GLUT1mRNA的表达以及细胞糖摄入量的增加[2]。本研究中,大黄酸治疗一年后大鼠肾小球中GLUT1的mRNA水平较糖尿病对照明显降低。因此在体内,大黄酸很可能通过对血糖以及细胞表面糖转运蛋白的影响来减少肾固有细胞的糖摄入量,进而阻止或降低后续途径的激活,并最终延缓糖尿病肾病的进展。大黄酸降低血糖水平的确切机制目前并不清楚,有文献报道,抑制骨骼肌细胞表面GLUT1的功能可以使机体对胰岛素的敏感性增加,大黄酸是否通过此途径来达到其降血糖的作用,抑或还存在其他的降血糖的机制尚待研究。此外,脂代谢紊乱对糖尿病肾病的发展也起到了一定的促进作用[25],糖尿病大鼠经大黄酸治疗后血脂代谢紊乱得到了一定程度的纠正,并且以往在应用大黄治疗慢性肾功能不全患者中,也发现大黄可以改善患者的脂代谢紊乱[26]。因此大黄酸降低糖尿病时血脂水平对延缓糖尿病肾病的进展也有一定的积极作用。
, http://www.100md.com
3.2 对血流动力学的影响 可能造成糖尿病肾脏损害的血流动力学因素主要有体循环血压,肾小球灌注压以及一些血管活性细胞因子(如Ang-II,ET-1等)的产生等[17]。大黄酸对糖尿病状态下机体及肾组织微环境的血流动力学是否有影响,目前尚无直接的证据,本研究中大黄酸对大鼠平均动脉压并无影响,大黄酸治疗组大鼠一年时肾脏肌酐清除率明显降低,但要明确大黄酸在肾血流动力学中的作用,尚需要进一步的研究。
3.3 对相关生长因子的影响 生长因子在糖尿病肾病发病中的作用已得到充分的证实。IGF-1,PDGF,TGFβ1及HGF的mRNA和蛋白质水平在糖尿病动物模型中均有变化,其中TGFβ1的表达与功能在糖尿病肾病的发生与发展中具重要作用。TGFβ1可以促使肾脏细胞肥大,细胞外基质(ECM)沉积,并最终造成肾小球硬化及间质纤维化[27]。本研究中大黄酸治疗组大鼠12月时肾小球中TGFβ1mRNA表达量明显降低。但大黄酸对体内TGFβ1mRNA表达的影响是直接作用的结果还是因纠正机体及细胞代谢紊乱而产生的间接效果尚不明确。
, http://www.100md.com
综合本文以及以往的研究结果,我们认为纠正糖尿病状态下机体以及细胞代谢的紊乱可能是大黄酸延缓糖尿病肾病进展的主要机制。大黄以及其单体大黄酸因其较为特殊的作用方式很可能为糖尿病肾病的治疗开辟一个崭新的领域。这里必须强调的是,由于糖尿病肾病致病机制非常复杂,单用大黄酸也仅仅对糖尿病肾病的发展有一定程度的延缓作用,并不能完全阻断糖尿病肾病的发展。近来有研究表明,联合应用钙离子通道阻断剂及ACEI可以使糖尿病肾病的治疗效果大大提高[28]。结合大黄酸与其他药物不同的作用方式,大黄酸与ACEI两药联用或与ACEI及钙离子通道阻断剂三药联用可能会对延缓糖尿病肾病的进展产生更加显著的疗效。
作者简介:戴春笋 南京大学医学院博士研究生
参考文献
1 陈琼华.大黄的实验研究和临床应用.新医药学杂志,1974,8:226
, 百拇医药
2 章 精,刘志红,李颖健等.大黄酸对系膜细胞糖摄入的影响及其机制.肾脏病与透析肾移植杂志,1999,8(4):307
3 戴春笋,刘志红,杨俊伟等.大黄蒽醌衍生物及其单体大黄酸,大黄素抑制STZ诱导糖尿病大鼠初期肾脏肥大的疗效观察.(待发表)
4 Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction.Analytical Biochemistry,1987,162:156
5 Shankland SJ,Scholey JW,Ly H et al.Expression of transforming growth-β1 during diabetic renal hypertrophy.Kidney Int ,1994,46:430
, http://www.100md.com
6 Ruano G,Fenton W,Kidd KK.Biphasic amplification of very dilute DNA samples via“booster”PCR.Nucleic Acids Research,1989,17(13):5407
7 Ruano G,Kidd KK,Stephens C.Haplotype of multiple polymorphisms resolved by en zymatic amplification of single DNA molecules.Proc Natl Acad Sic USA,1990,87:6296
8 Fujihara CK,Padilha RM,Zatz R.Glomerular abnomalities in long-term experiment al diabetes:Role of hemodynamic and nonhemodynamic factors and effects of antih pertensive therapy.Diabetes,1992,41:286
, 百拇医药
9 Remuzzi A,Perico N,Amuchastegui CS,et al.Short and long-term effect of a ngio tensin II receptor blockade in rats with experimental diabetes.J Am Soc Nephrol,1993,4:40
10 Leishi Li.End stage renal disease in China.Kidney Int,1996,49:287
11 Bryan GT,Hostetter TH.The renal hemodynamic basis of diabetic nephropathy.Se min Nephrol,1997,17(2):93
12 杨俊伟,黎磊石,张 真.大黄治疗糖尿病肾病的实验研究.中华内分泌代谢杂志,1993,9(4):49
, http://www.100md.com
13 杨俊伟,黎磊石,刘志红等.大黄抑制糖尿病大鼠肾脏肥大的作用与肾小球多肽生长因子表达的关系.中华内分泌代谢杂志,1995,11(4):173
14 杨俊伟,黎磊石.大黄对实验性糖尿病大鼠肾脏肥大及高滤过作用的影响.中国中西医结合杂志,1993,13(5):286
15 姚 健,黎磊石,周 虹.大黄素对培养人肾小球系膜细胞纤维连接蛋白产生的抑制作用.肾脏病与透析肾移植杂志,1994,3:349
16 赵洪军,韩学忠,徐 梅等.大黄治疗早期糖尿病肾病32例.中国中西医结合杂志,1996,16(17):429
17 Cooper ME.Pathogenesis,Prevention,and treatment of diabetic nephropathy.Lanc et,1998,352:213
, 百拇医药
18 Klahr S,Levey AS,Beck GJ et al.For the modfication of diet in renal dise ase study group:The effects of dietary protein restriction on the progression of chronic renal disease.N Engl J Med,1994,330:877
19 Zeller K,Whittaker Ae,Sullival L et al.Effects of restricting dietary pr otein on the progression of renal failure in patients with insulin-dependent di abetes mellitus.N Engl J Med,1991,324:78
20 Pearini MT,Levey AS,Lau J et al.The effect of dietary protein restriction on the progression of diabetic and nondiabetic renal diseases-a meta-analysis.Ann Intern Med,1996,124:627
, 百拇医药
21 Cooper ME,Gilbert RE,Epstein M.Pathophysiology of diabetic nephropathy.Metab olism,1998,47(12,suppl 1):3
22 葛祖恺,孙子林,黄继臣.大黄制剂,巯甲丙脯酸治疗糖尿病氮质血症期的效果观察.铁道医学,1994,23(5):282
23 Ayo S,Radnik R,Garoni J et al.High glucose causes an increase in extrace llular matrix proteins in cultured mesangial cells.Am J Pathol,1990,136:1339
24 Baldwin SA.Mammalian passive glucose transporters:members of aubiquitous family of active and passive transport proteins.Biochem Biophys Acta,1993,1154:17
, 百拇医药
25 Rodby RA.Type II diabetic nephropathy:Its clinical course and therapeuticim plications.Smein Nephrol,1997,17(2):132
26 张景红,黎磊石,万柏珍等.大黄对慢性肾衰患者脂质代谢的影响.金陵医院学报,1991,4(4):317
27 Wolf G,Ziyadeh N.Molecular mechanisms of diabetic renal hypertrophy.Kidney I nt,1999,56:393
28 Bakis G.Combination therapy for hypertension and renal disease in diabetes as compared to non-diabetes.In:Mogensen CE,ed.The Kidney and Hypertension in Diabetes Mellitus,3rd edn.Norwell,Massachusetts:Kluwer Academic Publishers,1997.561-68
(1999-09-10收稿), 百拇医药