携带tPA基因转移的真核表达载体的构建研究
作者:赵永波 李 钰 张贵寅 关振中
单位:赵永波 关振中 哈尔滨医科大学 第二临床医学院,黑龙江 哈尔滨 150086;李 钰 张贵寅 哈尔滨医科大学 医学遗传学研究室,黑龙江 哈尔滨 150086
关键词:真核表达载体;组织型纤溶酶原激活剂;基因转移
中国地方病学杂志990601 [摘要] 目的 构建一种无形成病毒及激活原癌基因之虞的真核表达载体pcDNA3.1(+)tPA,以探讨其对纤溶活性的影响。方法 用分子克隆方法,将人tPA cDNA与真核表达载体pcDNA3.1(+)重组,并对重组质粒进行DNA测序。结果 重组质粒pcDNA3.1(+)tPA经K pnI和XbaI酶切后,出现了5.4kb与2.0kb两个片段;经PstI酶切后出现了78bp,414bp,622bp,2.0Kb及4.2Kb五个片段;经EcoRI酶切后,出现了472bp及6.9Kb两个片段;测序结果证明为人全长tPA cDNA。结论 该新型表达质粒的构建为探讨基因防治脑梗塞等血栓性疾病提供了新工具,新思路。
, http://www.100md.com
[中图分类号] R394 [文献标识码] A [文章编号]1000-4955(1999)06-0401-03
Construction of pcDNA3.1(+) tPA experession vector
ZHAO Yong-bo,LI Yu,ZHANG Gui-yin,GUAN Zhen-zhong
(Department of Neurology,The Second Affiliated Hospital,Harbin Medical University,Harbin 150086,China)
[Abstract] Objective To construct a new kind of recombinant vector containing human tissue-type plasminogen activator(t-PA) cDNA for studing the feasibility of enhancing fibrinolytic activity by transplantation of genetic engineering cells.Methods We recombinated human tPA cDNA with expression vector pcDNA3.1(+) by using the method of molecular cloning,sequenced the plasmid DNA,and cut the plasmid by using enzymes.Results The plasmid pcDNA3.1(+)tPA was divided into 5.4Kb and 2.0Kb segments respectively by using Kpn I and Xba I,into 78bp,414bp,822bp,2.0Kb,and 4.2Kb segments respectively by using Pst I,into 472bp and 6.9Kb segments respectively by using EcoR I.Sequenoling result showed that it is the whole human tPA cDNA.Conclusions The new kind of recombinant expression vector could serve as new tools and methods for prevention of thrombogenic diseases.
, 百拇医药
[Key words] tPA;gene transfer;Recombinant expression vector
动脉粥样硬化性血栓性脑梗塞的发病率,病死率及致残率很高,严重危胁人类生命和健康,给国家,社会及家庭带来沉重的精神及经济负担。组织型纤溶酶原激活剂(tPA)具有高效,特异的溶栓作用,是目前治疗急性脑梗塞最有效的药物之一[1]。但由于其半衰期过短(6~8分钟),价格昂贵,限制了t-PA在临床上的广泛使用[2],若将t-PA基因转录单位导入体内,持续表达具有溶栓活性的t-PA供机体不断利用,提高血浆的纤溶活性,使血栓不易形成,可望达到防治急性脑梗塞等血栓性疾病的目的。本文用分子克隆方法,成功地构建了pcDNA3.1(+)tPA真核表达重组体。该型表达质粒的构建为探讨基因防治血栓性疾病奠定基础。
1 材料与方法
1.1 材料 pATA18tPA由荷 兰Berg教授惠赠(含人全长cDNA,全长约2.0Kb);pcDNA3.1(+)购自Invitrogen公司;Pst I,EcoR I,BamH I,Xba I,Kpn I及T4 DNA Ligase购自GIBCOBRL公司;JM109(939931)购自Promega公司;Lambda DNA/EcoR I+Hind Ⅲ Marker购自Promega公司;500bp Molecular Ruler DNA Size Standard购自BIO RAD公司。
, http://www.100md.com
1.2 方法 质粒的转化,提取,限制性酶切均按常规进行[3],酶切后进行0.8%琼脂糖凝胶电泳鉴定。
重组体构建过程:将全长pATA18tPA用Kpn I和Xba I双酶切,回收t-PA片段(2.0Kb);pcDNA3.1(+)用Kpn I和Xba I双酶切成线性载体;t-PA cDNA与线性pcDNA3.1(+)载体在T4 DNA Ligase作用下连接构成重组质粒pcDNA3.1(+)tPA。构建过程见图1。
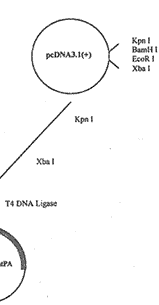
Fig 1.Construction map of pcDNA3.1(+) tPA recombinant
2 结果
, 百拇医药
pcDNA3.1(+)tPA的各种亚克隆质粒酶切图谱见图2。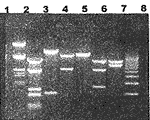
Fig 2.Enzymatic map of pcDNA3.1(+)tPA recombinant and subcloning plasmid
1.λDNA/EcoR I+Hind Ⅲ 2.pcDNA3.1(+)tPA/Pst I
3.pcDNA3.1(+)tPA/EcoR I
4.pcDNA3.1(+)tPA/Kpn I+Xba I
5.pcDNA3.1(+)/BamH I 6.pATA18tPA/Kpn I+Xba I
, http://www.100md.com 7.pATA18tPA/Xba I 8.DNA size standard
鉴定:重组质粒pcDNA3.1(+)tPA用Pst I,EcoR I,Kpn I和Xba I酶切鉴定;pATA18tPA用Xba I,Kpn I和Xba I酶切;pcDNA3.1(+)用BamH I酶切,并对重组质粒进行DNA测序分析,测序引物序列为上游:TAA TAC GAC ACA CTA TAG GG;下游:pcDNA3.1 reverse primer:TAG AAC GCA CAG TCG AGG。
pATA18tPA经Kpn I和Xba I酶切后,产生2.0Kb的t-PA片段。重组质粒pcDNA3.1(+)tPA经Kpn I和Xba I酶切后,出现5.4Kb与2.0Kb两个片段;经Pst I酶切后出现了78bp,414bp,622bp,2.0Kb及4.2Kb五个片段;经EcoR I酶切后,出现了472bp及6.9Kb两个片段 ;测序结果证明为全长tPA cDNA;表明tPA已正确组装在pcDNA3.1(+)载体上。
, http://www.100md.com
3 讨论
目前,将tPA cDNA导入血管内皮细胞内的主要手段是借助逆转录病毒载体。所用的逆转录病毒载体去掉了编码病毒结构蛋白的反式作用序列,代之以tPA cDNA;其顺式作用序列,包括两端的长末端序列,包装信号位号等仍然保留,这种含有tPA cDNA的重组病毒只能形成含有病毒外壳的完整病毒颗粒,必须借助病毒包装细胞提供病毒结构蛋白,才能形成具有感染能力的完整病毒,用其感染血管内皮细胞,使t-PA cDNA转录单位进入细胞与染色体DNA整合[4]。据文献报道,含t-PA cDNA的重组病毒中均有内部启动子,故这种载体又称含内部启动子的病毒载体(VIP)[11]。1989年Dichek等构建了一个VIP类的BzNSt载体,因此,载体转染GPE-8L细胞,收集上清液,感染PA-317病毒包装细胞,再次收集含有完整病毒颗粒的上清液,感染绵羊血管内皮细胞,G418筛选阳性细胞克隆,继续培养后,Southern分析证实,BzNSt组血管内皮细胞中含有t-PA cDNA序列,并已整合到基因组DNA中[5],用酶联免疫吸附法测定t-PA的表达水平,结果显示股静脉内皮细胞为370±8(ng/106cell/24h),颈静脉为1230±6;颈动脉为660±240;而不含t-PA cDNA的对照组血管内皮均低于5;BzNSt组t-PA活性已比对照组高出30倍[4,5],如此高水平的t-PA浓度远远超出激活血液中纤溶酶原和纤维蛋白所需的剂量[6]。
, 百拇医药
基因工程改造体细胞后再回输体内已在基因治疗多项方案中得到应用,其不足之处是周期长,操作复杂,成本高,此外,移植用重组逆转录病毒感染的细胞,虽然在临床应用过程中未发现毒副反应,但仍有顾虑[7]。因为这些重组逆转录病毒具有转座作用的长末端重复序列(LTR),能与靶细胞基因组随机整合,有可能激活原癌基因而导致细胞恶变[8],也不能排除这 些移植细胞在体内再次形成野生型逆转录病毒的可能性,引起宿主的病毒感染[9]。
本研究用分子克隆方法,成功地构建了pcDNA3.1(+)tPA真核表达重组体,无形成病毒之虞,另外,真核表达载体在移植细胞内大多以附加体的形式存生,与细胞基因组的整合频率有限[10],因此,激活原癌基因的可能性几乎可以排除。
总之,用分子克隆方法,构建pcDNA3.1(+)tPA真核表达重组体是一种新尝试,为研究基因防治脑梗塞等血栓性疾病提供可行性。
, 百拇医药
基金来源 国家自然科学基金资助课题(No.39770271)及哈尔滨市学科后备带头人基金资助课题(No.9770218012)
参考文献
[1] Alberts MJ.tPA in actute ischemic stroke:United States experience and issues for the futute[J].Neurology,1998,51(3 Suppl 3):S53.
[2] Fagan SC,Morgenstern LB,Petitta A et al.Cost-effectiveness of tissue plasminogen activator for acute ischemic stroke[J].Neurology.1998,50-883.
[3] Sambrook J,Fritsch EF,Maniatis T,et al.Molecular Cloning[M].2nd edition.Cold Spring Harbor Laboratory Press,1989.
, 百拇医药
[4] Dichek DA,Neville RF,Zwiebel JA,et al.Seeding of introvascular stents with genetically engineered endothelial cells[J].Circulation.1989,80:1347.
[5] Dichek DA,Nussbaum O,Degen SJF,et al.Enhancement of the fibrinolytic activity of sheep endothelial cells by retroviral-mediated gene transfer[J].Blood.1991;77:553.
[6] Nabel EG,Plautz G,Boyce FM,et al.Recombinant Gene Expression in vivo within endothelial cells of the arterial wall[J].Science.1989,244:1342.
, 百拇医药
[7] Grassman M,Raper SE,Kozarsky K,et al.Successful ex vivo gene therapy directed to liver in a patient with familial hypercholesterolaemia[J].Nature Genetics.1994,6:335.
[8] Robinson HL.Retroviruses and cancer.Reviews of Infectious Diseases.1982,4:1015.
[9] Dubensky TW,Campbell BA,and Villarreal LP.Direct transfection of viral and plasmid DNA into the liver or spleen of mice[J].Proc Natl Acad Sci USA,1984,81:7529.
[10] Acsadi G,Jiao S,Jani A,et al.Direct gene transfer and experssion into rat heart in vivo[J].New Biologist,1991,3:71.
[11] Miller AD,Ong ES,Rosenfeld MG,et al.Infections and selectable retrovirus containing and inducible rat growth hor mone minigene[J].Science,1984,225:993.
收稿日期1999-04-01, 百拇医药
单位:赵永波 关振中 哈尔滨医科大学 第二临床医学院,黑龙江 哈尔滨 150086;李 钰 张贵寅 哈尔滨医科大学 医学遗传学研究室,黑龙江 哈尔滨 150086
关键词:真核表达载体;组织型纤溶酶原激活剂;基因转移
中国地方病学杂志990601 [摘要] 目的 构建一种无形成病毒及激活原癌基因之虞的真核表达载体pcDNA3.1(+)tPA,以探讨其对纤溶活性的影响。方法 用分子克隆方法,将人tPA cDNA与真核表达载体pcDNA3.1(+)重组,并对重组质粒进行DNA测序。结果 重组质粒pcDNA3.1(+)tPA经K pnI和XbaI酶切后,出现了5.4kb与2.0kb两个片段;经PstI酶切后出现了78bp,414bp,622bp,2.0Kb及4.2Kb五个片段;经EcoRI酶切后,出现了472bp及6.9Kb两个片段;测序结果证明为人全长tPA cDNA。结论 该新型表达质粒的构建为探讨基因防治脑梗塞等血栓性疾病提供了新工具,新思路。
, http://www.100md.com
[中图分类号] R394 [文献标识码] A [文章编号]1000-4955(1999)06-0401-03
Construction of pcDNA3.1(+) tPA experession vector
ZHAO Yong-bo,LI Yu,ZHANG Gui-yin,GUAN Zhen-zhong
(Department of Neurology,The Second Affiliated Hospital,Harbin Medical University,Harbin 150086,China)
[Abstract] Objective To construct a new kind of recombinant vector containing human tissue-type plasminogen activator(t-PA) cDNA for studing the feasibility of enhancing fibrinolytic activity by transplantation of genetic engineering cells.Methods We recombinated human tPA cDNA with expression vector pcDNA3.1(+) by using the method of molecular cloning,sequenced the plasmid DNA,and cut the plasmid by using enzymes.Results The plasmid pcDNA3.1(+)tPA was divided into 5.4Kb and 2.0Kb segments respectively by using Kpn I and Xba I,into 78bp,414bp,822bp,2.0Kb,and 4.2Kb segments respectively by using Pst I,into 472bp and 6.9Kb segments respectively by using EcoR I.Sequenoling result showed that it is the whole human tPA cDNA.Conclusions The new kind of recombinant expression vector could serve as new tools and methods for prevention of thrombogenic diseases.
, 百拇医药
[Key words] tPA;gene transfer;Recombinant expression vector
动脉粥样硬化性血栓性脑梗塞的发病率,病死率及致残率很高,严重危胁人类生命和健康,给国家,社会及家庭带来沉重的精神及经济负担。组织型纤溶酶原激活剂(tPA)具有高效,特异的溶栓作用,是目前治疗急性脑梗塞最有效的药物之一[1]。但由于其半衰期过短(6~8分钟),价格昂贵,限制了t-PA在临床上的广泛使用[2],若将t-PA基因转录单位导入体内,持续表达具有溶栓活性的t-PA供机体不断利用,提高血浆的纤溶活性,使血栓不易形成,可望达到防治急性脑梗塞等血栓性疾病的目的。本文用分子克隆方法,成功地构建了pcDNA3.1(+)tPA真核表达重组体。该型表达质粒的构建为探讨基因防治血栓性疾病奠定基础。
1 材料与方法
1.1 材料 pATA18tPA由荷 兰Berg教授惠赠(含人全长cDNA,全长约2.0Kb);pcDNA3.1(+)购自Invitrogen公司;Pst I,EcoR I,BamH I,Xba I,Kpn I及T4 DNA Ligase购自GIBCOBRL公司;JM109(939931)购自Promega公司;Lambda DNA/EcoR I+Hind Ⅲ Marker购自Promega公司;500bp Molecular Ruler DNA Size Standard购自BIO RAD公司。
, http://www.100md.com
1.2 方法 质粒的转化,提取,限制性酶切均按常规进行[3],酶切后进行0.8%琼脂糖凝胶电泳鉴定。
重组体构建过程:将全长pATA18tPA用Kpn I和Xba I双酶切,回收t-PA片段(2.0Kb);pcDNA3.1(+)用Kpn I和Xba I双酶切成线性载体;t-PA cDNA与线性pcDNA3.1(+)载体在T4 DNA Ligase作用下连接构成重组质粒pcDNA3.1(+)tPA。构建过程见图1。


Fig 1.Construction map of pcDNA3.1(+) tPA recombinant
2 结果
, 百拇医药
pcDNA3.1(+)tPA的各种亚克隆质粒酶切图谱见图2。

Fig 2.Enzymatic map of pcDNA3.1(+)tPA recombinant and subcloning plasmid
1.λDNA/EcoR I+Hind Ⅲ 2.pcDNA3.1(+)tPA/Pst I
3.pcDNA3.1(+)tPA/EcoR I
4.pcDNA3.1(+)tPA/Kpn I+Xba I
5.pcDNA3.1(+)/BamH I 6.pATA18tPA/Kpn I+Xba I
, http://www.100md.com 7.pATA18tPA/Xba I 8.DNA size standard
鉴定:重组质粒pcDNA3.1(+)tPA用Pst I,EcoR I,Kpn I和Xba I酶切鉴定;pATA18tPA用Xba I,Kpn I和Xba I酶切;pcDNA3.1(+)用BamH I酶切,并对重组质粒进行DNA测序分析,测序引物序列为上游:TAA TAC GAC ACA CTA TAG GG;下游:pcDNA3.1 reverse primer:TAG AAC GCA CAG TCG AGG。
pATA18tPA经Kpn I和Xba I酶切后,产生2.0Kb的t-PA片段。重组质粒pcDNA3.1(+)tPA经Kpn I和Xba I酶切后,出现5.4Kb与2.0Kb两个片段;经Pst I酶切后出现了78bp,414bp,622bp,2.0Kb及4.2Kb五个片段;经EcoR I酶切后,出现了472bp及6.9Kb两个片段 ;测序结果证明为全长tPA cDNA;表明tPA已正确组装在pcDNA3.1(+)载体上。
, http://www.100md.com
3 讨论
目前,将tPA cDNA导入血管内皮细胞内的主要手段是借助逆转录病毒载体。所用的逆转录病毒载体去掉了编码病毒结构蛋白的反式作用序列,代之以tPA cDNA;其顺式作用序列,包括两端的长末端序列,包装信号位号等仍然保留,这种含有tPA cDNA的重组病毒只能形成含有病毒外壳的完整病毒颗粒,必须借助病毒包装细胞提供病毒结构蛋白,才能形成具有感染能力的完整病毒,用其感染血管内皮细胞,使t-PA cDNA转录单位进入细胞与染色体DNA整合[4]。据文献报道,含t-PA cDNA的重组病毒中均有内部启动子,故这种载体又称含内部启动子的病毒载体(VIP)[11]。1989年Dichek等构建了一个VIP类的BzNSt载体,因此,载体转染GPE-8L细胞,收集上清液,感染PA-317病毒包装细胞,再次收集含有完整病毒颗粒的上清液,感染绵羊血管内皮细胞,G418筛选阳性细胞克隆,继续培养后,Southern分析证实,BzNSt组血管内皮细胞中含有t-PA cDNA序列,并已整合到基因组DNA中[5],用酶联免疫吸附法测定t-PA的表达水平,结果显示股静脉内皮细胞为370±8(ng/106cell/24h),颈静脉为1230±6;颈动脉为660±240;而不含t-PA cDNA的对照组血管内皮均低于5;BzNSt组t-PA活性已比对照组高出30倍[4,5],如此高水平的t-PA浓度远远超出激活血液中纤溶酶原和纤维蛋白所需的剂量[6]。
, 百拇医药
基因工程改造体细胞后再回输体内已在基因治疗多项方案中得到应用,其不足之处是周期长,操作复杂,成本高,此外,移植用重组逆转录病毒感染的细胞,虽然在临床应用过程中未发现毒副反应,但仍有顾虑[7]。因为这些重组逆转录病毒具有转座作用的长末端重复序列(LTR),能与靶细胞基因组随机整合,有可能激活原癌基因而导致细胞恶变[8],也不能排除这 些移植细胞在体内再次形成野生型逆转录病毒的可能性,引起宿主的病毒感染[9]。
本研究用分子克隆方法,成功地构建了pcDNA3.1(+)tPA真核表达重组体,无形成病毒之虞,另外,真核表达载体在移植细胞内大多以附加体的形式存生,与细胞基因组的整合频率有限[10],因此,激活原癌基因的可能性几乎可以排除。
总之,用分子克隆方法,构建pcDNA3.1(+)tPA真核表达重组体是一种新尝试,为研究基因防治脑梗塞等血栓性疾病提供可行性。
, 百拇医药
基金来源 国家自然科学基金资助课题(No.39770271)及哈尔滨市学科后备带头人基金资助课题(No.9770218012)
参考文献
[1] Alberts MJ.tPA in actute ischemic stroke:United States experience and issues for the futute[J].Neurology,1998,51(3 Suppl 3):S53.
[2] Fagan SC,Morgenstern LB,Petitta A et al.Cost-effectiveness of tissue plasminogen activator for acute ischemic stroke[J].Neurology.1998,50-883.
[3] Sambrook J,Fritsch EF,Maniatis T,et al.Molecular Cloning[M].2nd edition.Cold Spring Harbor Laboratory Press,1989.
, 百拇医药
[4] Dichek DA,Neville RF,Zwiebel JA,et al.Seeding of introvascular stents with genetically engineered endothelial cells[J].Circulation.1989,80:1347.
[5] Dichek DA,Nussbaum O,Degen SJF,et al.Enhancement of the fibrinolytic activity of sheep endothelial cells by retroviral-mediated gene transfer[J].Blood.1991;77:553.
[6] Nabel EG,Plautz G,Boyce FM,et al.Recombinant Gene Expression in vivo within endothelial cells of the arterial wall[J].Science.1989,244:1342.
, 百拇医药
[7] Grassman M,Raper SE,Kozarsky K,et al.Successful ex vivo gene therapy directed to liver in a patient with familial hypercholesterolaemia[J].Nature Genetics.1994,6:335.
[8] Robinson HL.Retroviruses and cancer.Reviews of Infectious Diseases.1982,4:1015.
[9] Dubensky TW,Campbell BA,and Villarreal LP.Direct transfection of viral and plasmid DNA into the liver or spleen of mice[J].Proc Natl Acad Sci USA,1984,81:7529.
[10] Acsadi G,Jiao S,Jani A,et al.Direct gene transfer and experssion into rat heart in vivo[J].New Biologist,1991,3:71.
[11] Miller AD,Ong ES,Rosenfeld MG,et al.Infections and selectable retrovirus containing and inducible rat growth hor mone minigene[J].Science,1984,225:993.
收稿日期1999-04-01, 百拇医药