联合检测血、胸水、支气管冲洗液CEA对癌性胸水的诊断价值
作者:吕立文
单位:(广西壮族自治区人民医院 南宁 530021)
关键词:胸腔积液;癌胚抗原;诊断
广西医科大学学报990643
摘要 目的:评价联合测定血、胸水、支气管冲洗液中癌胚抗原(CEA)浓度对癌性胸水的诊断价值。方法:对29例恶性胸液及28例良性胸液患者同时测定血、胸水、支气管冲洗液中CEA浓度。结果:①恶性胸液组血清、胸水、支气管冲洗液CEA均显著高于良性胸液组(P<0.05);②当联合支气管冲洗液CEA>20 μg/L,胸水CEA>15 μg/L和血清CEA>15 μg/L中至少有两项时,对癌性胸水诊断的敏感性达68.97%,特异性达96.43%,达3项指标时的敏感性为41.38%,特异性为100%。结论:联合测定血、胸水、支气管冲洗液中CEA浓度对癌性胸水有诊断价值。
, 百拇医药
中国图书资料分类法分类号 R561.3
癌胚抗原(CEA)是临床上常用的肿瘤标志物,近年来临床上常用血清、胸水中CEA测定鉴别胸水性质。我们对良、恶性胸腔积液的病人进行了血清、胸水、支气管冲洗液中CEA测定,探讨联合检测在良恶性胸水鉴别诊断中的价值。
1 材料与方法
1.1 研究对象:恶性胸液组:29例中,男20例,女9例,平均年龄55.2岁。经胸水、痰细胞学检查,纤支镜检,淋巴结活检,术后标本病检等确诊。其中肺腺癌19例,肺鳞癌5例,肺鳞腺癌2例,恶性胸膜间皮瘤3例。良性胸液组:28例中,男15例,女13例,平均年龄41.7岁,经临床表现、胸片、PPD试验,纤支镜检、细菌培养及抗痨治疗效果作出诊断。其中结核性胸膜炎22例,型肺结核并化脓性支气管感染2例,肺炎3例,黄甲综合征1例。
1.2 测定方法:3种标本均为同一天送检。胸水标本为常规胸腔穿刺液。选用Olympus BFIT-20纤维支气管镜,局部麻醉后经口或鼻插入。纤支镜下能见到支气管内病变者,将镜端置于病变所在段的支气管开口处;若开口完全堵塞,则置于最邻近段的支气管开口处;若镜下未见到病变,则置于肺内病变相应部位的亚肺段支气管内;若两肺弥漫性病变则置于右中叶开口处。注入生理盐水10~40 ml,以6.6~13.3 kPa负压立即吸出,回收量为6~30 ml收集于试管中备检。
, 百拇医药
CEA检测采用中国原子能科学院提供的放射免疫测定盒,按药盒规定操作。
1.3 统计学处理:实验结果经两组均数t检验,χ2检验,并检验筛选指标敏感性、特异性等。
2 结 果
2.1良恶性胸液血清、胸水及支气管冲洗液中CEA测定结果见表1~3。
表1 血清、胸水、支气管冲洗液中CEA测定结果(ρB/μg.L-1) 组别
n
血清
胸水
支气管冲洗液
, http://www.100md.com
实测范围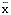 ±s
±s
实测范围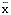 ±s
±s
实测范围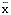 ±s
±s
良性组
28
<5~13.6
9.15±3.1427
<5~16.0
9.25±3.8918
, http://www.100md.com
<5~29.9
10.64±7.1810
恶性组
29
5.6~80
28.91±27.9917
<5~80
43.49±31.2084
<5~80
44.71±26.5633
P
<0.05
, 百拇医药
<0.05
<0.05
表2 良恶性组出现阳性率的比较 组别
血CEA>15μg/L
(%)
胸水CEA>15μg/L
(%)
支气管冲洗液CEA>20μg/L
(%)
良性组
0
17.86
, http://www.100md.com
17.86
恶性组
51.72
62.07
79.31
P
<0.005
<0.005
<0.005
2.2 指标判定:按《诊断学》(第3版)及药盒参考正常值,血CEA的正常范围为0~15 μg/L。参考李留树胸水阳性标准[1],本文定良性胸水CEA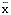 ±2 s(9.25±3.89)为良性胸水的范围,以≥15 μg/L为阳性。
±2 s(9.25±3.89)为良性胸水的范围,以≥15 μg/L为阳性。
, http://www.100md.com
目前支气管冲洗液CEA无正常值,更无诊断肺癌的标准,按张国芳等[2]以>20 μg/L为阳性界限,肺癌的阳性率为79.16%(19/24),肺结核的假阳性率为12.0%(3/25)二者有显著差异(P<0.01),由于本文良性胸液组支气管冲洗液CEA的浓度与血清CEA的平均值接近,因此本实验把>20 μg/L定为支气管冲洗液CEA的阳性界限。根据以上标准,两组阳性结果的百分率见表2,用于癌性胸液诊断时,验证各指标的可信性见表3。
表3 实验室指标的可用性分析 项目
3项指标(+)
(%)
2项指标(+)
(%)
1项指标(+)
, http://www.100md.com
(%)
P
敏感性
41.38
68.97
82.76
<0.01
特异性
100
96.43
67.86
<0.005
3 讨 论
, 百拇医药
Johnson报道恶性胸水标本的细胞病理学诊断75.7%为癌性胸水,主要来源于肺,占81.7%,而肺癌又占其中的66.7%[3],可见肺癌导致胸腔积液的比例很高,癌胚抗原(CEA)是一种分子量为20万单位的糖蛋白,现已广泛用于肿瘤的诊断,肿瘤细胞合成CEA后,首先释放到肺癌细胞所处的微环境——局部支气管肺泡中[4],然后再入血,在肝脏分解,所以支气管冲洗液中CEA比血清中出现早、浓度高,当癌肿侵犯胸膜时,分泌的CEA释放至胸水中,因不受肝脏直接破坏,且为大分子蛋白,因而在局部产生较高的浓度,因此测定胸水、支气管冲洗液、血清CEA值有助于胸水的鉴别诊断。本实验中恶性胸水组血清、胸水、支气管冲洗液中CEA值均显著高于良性胸水组(P<0.05),恶性组上述3项指标的阳性率均高于良性组,差异极显著(P<0.005),证实上述观点。表2提示恶性组中支气管冲洗液CEA阳性率依次大于胸水CEA和血清CEA的阳性率,但其间差异无统计学意义(P>0.20),可能由于出现胸水时病程已至晚期,血、胸水及支气管中CEA均已升高。
, http://www.100md.com
在28例良性胸液中有5例支气管冲洗液假阳性,其中3例为肺炎,另2例为Ⅲ型肺结核并化脓性支气管感染,可能是炎性分泌物中大量粒细胞坏死,释放出易与CEA发生交叉反应的非特异性交叉反应抗原所致[5]。
已经证实伴随不同癌细胞类型分化程度的不同,血清CEA水平也有差异。胸水CEA,支气管冲洗液CEA与肺癌类型的关系从理论上讲也应与细胞类型有关,本实验中支气管冲洗液CEA恶性组有6例假阴性,分别为恶性胸膜间皮瘤3例、肺腺癌1例、低分化鳞癌2例,其原因可能与无肺内原发灶或肿瘤细胞分化程度低有关,胸水CEA的阳性率也表现出这一趋势,分化程度越低(如大、小细胞癌),产生CEA的能力越差,反之亦然[6]。
癌性胸水的诊断目前还有一定困难,特别是在胸水中癌细胞检出率不高(40%~60%),而组织学标本又难以获得的前提下[7]。CEA是国际上公认的肿瘤标志物,但单一检测漏诊率及误诊率都较高,从表3看出,分别以3项指标阳性,任意2项指标阳性和至少1项指标阳性为标准诊断癌性胸水,其敏感性与特异性均有显著差异(P<0.01;P<0.05),其中以任意2项指标阳性为最优选择,对癌性胸水诊断敏感性达68.97%,特异性为96.43%,而联合3项指标和至少1项指标阳性则有敏感性低和特异性差之不足,但若需减少误诊率,则联合检测3项指标阳性为较佳选择。
, 百拇医药
参 考 文 献
1 李留树,何长清,张效公.癌胚抗原测定在良恶性胸水鉴别诊断中的价值.癌症,1986,1(5):53
2 张国芳,乜华凤,孟极敏.肿癌和肺结核病人血清及支气管冲洗液中CEA,β2-MG和Fer的测定.癌症,1994,13(5):462
3 Johnston WW.Jhe Malignant Pleural Effusion.Cancer,1985,56(4):905
4 冉丕鑫,潘显光,李清泉.支气管肺泡冲洗液中4项指标检测诊断肺癌的意义.临床内科杂志,1993,10(3):41
5 Tamurn S,Nishigaki T,Mo riwaki Y,et al.Tumormakers in pleural effusion diagnosis.Cancer,1988,61:298
6 刘燕喃.胸水CEA测定用于鉴别肺部良恶性疾患的临床价值.空军总医院学报,1988,4(4):242
7 吴静华.癌性与结核性胸腔积液的鉴别诊断探讨.中国肿瘤临床,1989,16(4):201
收稿日期1999-04-12, 百拇医药
单位:(广西壮族自治区人民医院 南宁 530021)
关键词:胸腔积液;癌胚抗原;诊断
广西医科大学学报990643
摘要 目的:评价联合测定血、胸水、支气管冲洗液中癌胚抗原(CEA)浓度对癌性胸水的诊断价值。方法:对29例恶性胸液及28例良性胸液患者同时测定血、胸水、支气管冲洗液中CEA浓度。结果:①恶性胸液组血清、胸水、支气管冲洗液CEA均显著高于良性胸液组(P<0.05);②当联合支气管冲洗液CEA>20 μg/L,胸水CEA>15 μg/L和血清CEA>15 μg/L中至少有两项时,对癌性胸水诊断的敏感性达68.97%,特异性达96.43%,达3项指标时的敏感性为41.38%,特异性为100%。结论:联合测定血、胸水、支气管冲洗液中CEA浓度对癌性胸水有诊断价值。
, 百拇医药
中国图书资料分类法分类号 R561.3
癌胚抗原(CEA)是临床上常用的肿瘤标志物,近年来临床上常用血清、胸水中CEA测定鉴别胸水性质。我们对良、恶性胸腔积液的病人进行了血清、胸水、支气管冲洗液中CEA测定,探讨联合检测在良恶性胸水鉴别诊断中的价值。
1 材料与方法
1.1 研究对象:恶性胸液组:29例中,男20例,女9例,平均年龄55.2岁。经胸水、痰细胞学检查,纤支镜检,淋巴结活检,术后标本病检等确诊。其中肺腺癌19例,肺鳞癌5例,肺鳞腺癌2例,恶性胸膜间皮瘤3例。良性胸液组:28例中,男15例,女13例,平均年龄41.7岁,经临床表现、胸片、PPD试验,纤支镜检、细菌培养及抗痨治疗效果作出诊断。其中结核性胸膜炎22例,型肺结核并化脓性支气管感染2例,肺炎3例,黄甲综合征1例。
1.2 测定方法:3种标本均为同一天送检。胸水标本为常规胸腔穿刺液。选用Olympus BFIT-20纤维支气管镜,局部麻醉后经口或鼻插入。纤支镜下能见到支气管内病变者,将镜端置于病变所在段的支气管开口处;若开口完全堵塞,则置于最邻近段的支气管开口处;若镜下未见到病变,则置于肺内病变相应部位的亚肺段支气管内;若两肺弥漫性病变则置于右中叶开口处。注入生理盐水10~40 ml,以6.6~13.3 kPa负压立即吸出,回收量为6~30 ml收集于试管中备检。
, 百拇医药
CEA检测采用中国原子能科学院提供的放射免疫测定盒,按药盒规定操作。
1.3 统计学处理:实验结果经两组均数t检验,χ2检验,并检验筛选指标敏感性、特异性等。
2 结 果
2.1良恶性胸液血清、胸水及支气管冲洗液中CEA测定结果见表1~3。
表1 血清、胸水、支气管冲洗液中CEA测定结果(ρB/μg.L-1) 组别
n
血清
胸水
支气管冲洗液
, http://www.100md.com
实测范围
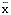 ±s
±s实测范围
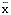 ±s
±s实测范围
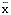 ±s
±s良性组
28
<5~13.6
9.15±3.1427
<5~16.0
9.25±3.8918
, http://www.100md.com
<5~29.9
10.64±7.1810
恶性组
29
5.6~80
28.91±27.9917
<5~80
43.49±31.2084
<5~80
44.71±26.5633
P
<0.05
, 百拇医药
<0.05
<0.05
表2 良恶性组出现阳性率的比较 组别
血CEA>15μg/L
(%)
胸水CEA>15μg/L
(%)
支气管冲洗液CEA>20μg/L
(%)
良性组
0
17.86
, http://www.100md.com
17.86
恶性组
51.72
62.07
79.31
P
<0.005
<0.005
<0.005
2.2 指标判定:按《诊断学》(第3版)及药盒参考正常值,血CEA的正常范围为0~15 μg/L。参考李留树胸水阳性标准[1],本文定良性胸水CEA
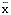 ±2 s(9.25±3.89)为良性胸水的范围,以≥15 μg/L为阳性。
±2 s(9.25±3.89)为良性胸水的范围,以≥15 μg/L为阳性。, http://www.100md.com
目前支气管冲洗液CEA无正常值,更无诊断肺癌的标准,按张国芳等[2]以>20 μg/L为阳性界限,肺癌的阳性率为79.16%(19/24),肺结核的假阳性率为12.0%(3/25)二者有显著差异(P<0.01),由于本文良性胸液组支气管冲洗液CEA的浓度与血清CEA的平均值接近,因此本实验把>20 μg/L定为支气管冲洗液CEA的阳性界限。根据以上标准,两组阳性结果的百分率见表2,用于癌性胸液诊断时,验证各指标的可信性见表3。
表3 实验室指标的可用性分析 项目
3项指标(+)
(%)
2项指标(+)
(%)
1项指标(+)
, http://www.100md.com
(%)
P
敏感性
41.38
68.97
82.76
<0.01
特异性
100
96.43
67.86
<0.005
3 讨 论
, 百拇医药
Johnson报道恶性胸水标本的细胞病理学诊断75.7%为癌性胸水,主要来源于肺,占81.7%,而肺癌又占其中的66.7%[3],可见肺癌导致胸腔积液的比例很高,癌胚抗原(CEA)是一种分子量为20万单位的糖蛋白,现已广泛用于肿瘤的诊断,肿瘤细胞合成CEA后,首先释放到肺癌细胞所处的微环境——局部支气管肺泡中[4],然后再入血,在肝脏分解,所以支气管冲洗液中CEA比血清中出现早、浓度高,当癌肿侵犯胸膜时,分泌的CEA释放至胸水中,因不受肝脏直接破坏,且为大分子蛋白,因而在局部产生较高的浓度,因此测定胸水、支气管冲洗液、血清CEA值有助于胸水的鉴别诊断。本实验中恶性胸水组血清、胸水、支气管冲洗液中CEA值均显著高于良性胸水组(P<0.05),恶性组上述3项指标的阳性率均高于良性组,差异极显著(P<0.005),证实上述观点。表2提示恶性组中支气管冲洗液CEA阳性率依次大于胸水CEA和血清CEA的阳性率,但其间差异无统计学意义(P>0.20),可能由于出现胸水时病程已至晚期,血、胸水及支气管中CEA均已升高。
, http://www.100md.com
在28例良性胸液中有5例支气管冲洗液假阳性,其中3例为肺炎,另2例为Ⅲ型肺结核并化脓性支气管感染,可能是炎性分泌物中大量粒细胞坏死,释放出易与CEA发生交叉反应的非特异性交叉反应抗原所致[5]。
已经证实伴随不同癌细胞类型分化程度的不同,血清CEA水平也有差异。胸水CEA,支气管冲洗液CEA与肺癌类型的关系从理论上讲也应与细胞类型有关,本实验中支气管冲洗液CEA恶性组有6例假阴性,分别为恶性胸膜间皮瘤3例、肺腺癌1例、低分化鳞癌2例,其原因可能与无肺内原发灶或肿瘤细胞分化程度低有关,胸水CEA的阳性率也表现出这一趋势,分化程度越低(如大、小细胞癌),产生CEA的能力越差,反之亦然[6]。
癌性胸水的诊断目前还有一定困难,特别是在胸水中癌细胞检出率不高(40%~60%),而组织学标本又难以获得的前提下[7]。CEA是国际上公认的肿瘤标志物,但单一检测漏诊率及误诊率都较高,从表3看出,分别以3项指标阳性,任意2项指标阳性和至少1项指标阳性为标准诊断癌性胸水,其敏感性与特异性均有显著差异(P<0.01;P<0.05),其中以任意2项指标阳性为最优选择,对癌性胸水诊断敏感性达68.97%,特异性为96.43%,而联合3项指标和至少1项指标阳性则有敏感性低和特异性差之不足,但若需减少误诊率,则联合检测3项指标阳性为较佳选择。
, 百拇医药
参 考 文 献
1 李留树,何长清,张效公.癌胚抗原测定在良恶性胸水鉴别诊断中的价值.癌症,1986,1(5):53
2 张国芳,乜华凤,孟极敏.肿癌和肺结核病人血清及支气管冲洗液中CEA,β2-MG和Fer的测定.癌症,1994,13(5):462
3 Johnston WW.Jhe Malignant Pleural Effusion.Cancer,1985,56(4):905
4 冉丕鑫,潘显光,李清泉.支气管肺泡冲洗液中4项指标检测诊断肺癌的意义.临床内科杂志,1993,10(3):41
5 Tamurn S,Nishigaki T,Mo riwaki Y,et al.Tumormakers in pleural effusion diagnosis.Cancer,1988,61:298
6 刘燕喃.胸水CEA测定用于鉴别肺部良恶性疾患的临床价值.空军总医院学报,1988,4(4):242
7 吴静华.癌性与结核性胸腔积液的鉴别诊断探讨.中国肿瘤临床,1989,16(4):201
收稿日期1999-04-12, 百拇医药