乙型肝炎病毒x蛋白对细胞周期的影响
作者:陶小红 任红 沈鼎明 张小实 张大志 叶珈 古柏燕
单位:沈鼎明 (400010 重庆医科大学附属第二医院消化科);陶小红 (第一附属医院消化科,400016);任红 张大志 叶珈 古柏燕 (附属第二医院肝炎研究所);张小实 (附属第一医院消化科)
关键词:肝炎病毒,乙型;细胞周期
中华医学杂志990819 【摘要】 目的 研究乙型肝炎病毒x(HBx)蛋白对细胞周期影响,探讨HBx蛋白致细胞周期紊乱的分子机理。方法 构建HBx基因真核表达载体pCEP4-X,电转染入HepG2细胞(X细胞),以pCEP4空载体为对照(X0细胞),潮霉素选择培养,克隆扩增转染细胞,经无血清培养同步化后,流式细胞仪检测细胞周期变化;细胞组化和Western blot检测增殖细胞核抗原(PCNA)和p21CIP1/WAF1表达变化。结果 流式细胞仪检测示对照X0细胞70%进入G0-G1期,而转X细胞仅56%进入G0-G1期,与含血清培养的亲本细胞HepG2几乎相同。p21CIP1/WAF1D表达在X0细胞阳性率为(86±8)%,X细胞为(16±6)%。PCNA表达在X0细胞阳性率为(9±5)%,X细胞为(86±3)%。结论 HBx有推进细胞周期作用,并使细胞生长对血清依赖减少。HBx可抑制细胞周期抑制蛋白p21CIP1/WAF1表达,同时增强细胞DNA合成。
, 百拇医药
The effect of hepatitis B virus x protein on cell cycling
TAO Xiaohong REN Hong SHEN Dingming et al.
(Chongqing University of Medical Sciences,Chongqing 400010)
【Abstract】 Objective To study the effect of HBx protein on cell cycle progression and its molecular mechanism.Methods The eucaryotic expression vector pCEP4 of HBx gene was constructed and introduced into HepG2 cells.The HepG2 cells transfected with X gene (X cell) were synchronized in a quiescent state by culture of serum deprivation.Flow cytometry,immunohistochemical and Western Blot analysis were performed.Results 70% HepG2 cells transfected with pCEP4 (X0 cells) was induced in G0-G1 phase,only 56% X cells in G0-G1 phase,almost identical to its parental HepG2 cells cultured in serum medium.To further understand the molecular mechanism of cell cycle progression,the p21CIP1/WAF1 and PCNA were examined.HBx was found to strongly increase the level of PCNA in X cells (86±3)% compared with X0 cells (9±5)%,and greatly decrease the level of p21CIP1/WAF1 protein in X cells (16±6)% compared with X0 cells (86±8)% (P<0.001).Conclusions These data suggest a molecular mechanism by which HBx likely contributes to viral carcinogenesis.By deregulating cell cycle checkpoint control,HBx could participate in the selection of cells that are genetically unstable,some of which would accumulate unrepaired transfroming mutations.
, http://www.100md.com
【Key words】 Hepatitis B virus Cell cycle
肿瘤细胞代谢的显著特点就是细胞周期调控紊乱。乙型肝炎病毒x(hepatitis B virus x,HBx)蛋白具有广泛的反式激活作用,并认为参与肝细胞癌(hepatocellular carcinoma,HCC)发生的分子机理[1,2]。HBx蛋白有明显推进细胞周期作用,使细胞快速进入S期[3,4]。我们选用转染HBx基因并能稳定表达x蛋白的HepG2细胞作为实验模型,以探讨HBx蛋白对细胞周期调控的影响及其在HCC发生中的分子机理。
材料和方法
1.材料:pBluescript KS+(pBKS+),宿主菌为XL1-blue。pCEP4为EB病毒真核表达载体,宿主菌为Top10F′。pEcob6为含双拷贝HBV DNA(adw亚型),保存于HB101菌。以上载体和菌株由重庆医科大学肝炎研究所保存。鼠抗p21CIP1/WAF1单抗、鼠抗增殖细胞核抗原(proliferating cell nucler antigen,PCNA)单抗(PC10)、抗鼠生物素化IgG(2抗)、链霉亲合素结合的碱性磷酸酶(3抗)购自北京中山公司(美国Santa Cruse 公司产品分装)。ABC免疫组织化学试剂盒购自福州迈新公司。
, http://www.100md.com
2.分子克隆和细胞培养:将x片段亚克隆于pBKS+中,再连接到真核表达载体pCEP4上。电转染法将pCEP4-X、pCEP4导入HepG2中(分别命名为X细胞和X0细胞),潮霉素选择培养,挑取单细胞克隆扩增,RT-PCR鉴定表达[5]。细胞同步化用无血清DMEM培养16小时。
3.流式细胞检测:将同步化细胞消化,磷酸缓冲液洗涤离心,保证细胞数在5×104/ml以上,细胞在2小时内碘化丙啶标记后,上流式细胞仪(美国Becton-Dickinson公司),Cell Quest和ModFitLT软件分析结果。
4.免疫印渍法(Western blot)检测PCNA、p21CIP1/WAF1:抽提同步化细胞蛋白质,质量浓度为12%的丙烯酰胺电泳分离后电转移至硝酸纤维素膜上。质量浓度为5%的脱脂奶粉封闭1小时,加一抗(单抗p21CIP1/WAF1和PCNA工作浓度分别为1∶200、1∶300)4℃过夜。洗膜,加二抗(工作浓度1∶800),22℃ 1小时,洗膜,加三抗(工作浓度1∶800),22℃1小时。底物显色,图像存入计算机。
, 百拇医药
5.细胞组织化学染色:将细胞在玻片上培养24小时,经同步化处理后,质量浓度为4%的多聚甲醛固定,质量浓度为0.1%的Triton X 100透膜,按ABC试剂盒说明操作染色。单抗PCNA、p21CIP1/WAF1工作浓度分别为1∶100和1∶40。结果判定:细胞核内见棕黄色颗粒为阳性,染色按阳性和阴性计数,100个细胞/低倍视野,共计数5个视野,作t检验。
结果
1.流式细胞检测:结果见图1~3。图1为未同步化含血清培养的HepG2亲本细胞,G0-G1期细胞占56.77%。图2为X0同步化细胞,G0-G1期细胞占69.67%,约70%细胞进入静止期。图3为X同步化细胞,G0-G1期细胞占56.15%。图3与图2相比,静止期细胞明显减少,与未同步化图1相比,静止期细胞几乎相同,提示在无血清培养下x蛋白仍能刺激细胞增殖。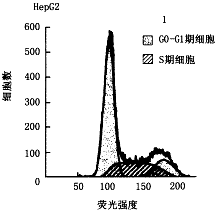
, 百拇医药
图1 血清培养HepG2细胞
图2 无血清同步化处理HepG2-X细胞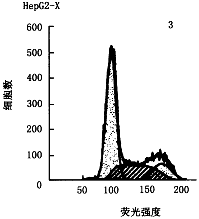
图3 无血清同步化处理HepG2-X0细胞
图1~3 流式细胞检测HBx蛋白对细胞周期影响
2.p21CIP1/WAF1测定:(1)细胞组织化学:结果见图4,5。X细胞p21CIP1/WAF1表达明显降低。而X0细胞明显增高。按每低倍视野计100个细胞,共500个细胞平均阳性率作统计处理,结果X0阳性细胞为(86±8)%,X细胞为(16±6)%,差异有非常显著意义(P<0.001)。(2)Western Blot:结果见图6,p21CIP1/WAF1在X细胞无明显转印带,X0细胞有显著转印带。表明HBx蛋白可明显抑制p21CIP1/WAF1的表达。
, http://www.100md.com
图4 HepG2细胞转染X基因
图5 HepG2细胞转染空载体
图4,5 细胞组化检测同步化HepG2转染细胞p21CIP1/WAF1蛋白表达ABC染色 ×200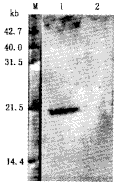
M:中分子量蛋白质标准;1: HepG2-X0细胞;2:HepG2-X细胞(图9同)
图6 同步化处理HepG2-X0和HepG2-X细胞p21CIP1/WAF表达
3.PCNA测定:(1)细胞组织化学:结果见图7,8。X细胞PCNA表达明显高于X0细胞。计数阳性细胞,X0阳性细胞为(9±5)%,X细胞为(86±3)%(P<0.001)。(2)Western Blot:结果见图9,X细胞有明显转印带,而X0细胞无转印带。表明x蛋白有明显增强PCNA表达作用。
, 百拇医药
图7 为HepG2细胞转染X基因
图8 为HepG2细胞转染空载体
图7,8 细胞组化检测同步化HepG2转染细胞PCNA蛋白表达ABC染色 ×200
图9 同步化处理HepG2-X0和HepG2-X细胞p21CIP1/WAF1及PCNA表达
讨论
1.HBx蛋白对细胞周期的影响:Koike等[3]用X基因重组体pMTV转染NIH3T3细胞,无血清同步化后,地塞米松诱导HBx蛋白表达,结果X蛋白表达18小时后细胞开始进入S期,同时伴有DNA合成增加,而对照组仍停留在静止期。Benn等[4]选择Chang cell同步化后,用x基因腺病毒重组体感染细胞,结果细胞提前12小时进入S期。我们采用稳定表达HBx蛋白的转X基因HepG2细胞,经同步化后,结果示对照X0细胞70%进入静止期,而X细胞与对照亲本细胞HepG2(未经同步化)无差别,表明无血清培养后,X细胞仍处增殖、分裂、生长期。提示HBx蛋白可减少细胞对血清的依赖性,使细胞获得了新的转化表型。
, 百拇医药
2.HBx蛋白对细胞周期抑制蛋白p21CIP1/WAF1的影响:p21CIP1/WAF1是一细胞周期抑制蛋白,可广泛抑制各种周期素-周期素依赖激酶复合物,使细胞周期停留在G1期,对DNA损伤介导的细胞周期抑制及损伤修复起有重要作用[5]。本实验用静止期诱导后,观察HBx蛋白对p21CIP1/WAF1表达调控影响,结果X细胞无p21CIP1/WAF1表达,而X0细胞有p21CIP1/WAF1表达。由于p21CIP1/WAF1表达受p53调控,HBx蛋白可与p53结合并使其失活[7],因此推测X细胞p21CIP1/WAF1表达降低是HBx蛋白使p53失活的结果。Puisieux等[8]报道用doxorubicin处理2215细胞和HepG2细胞后,p53和p21CIP1/WAF1表达均增高,结果与本实验相反。我们认为这是实验设计的原因。DNA损伤剂doxorubicin处理细胞可强烈诱导p53表达,但若没有HBx蛋白的伴随增加,p53仍具激活p21CIP1/WAF1的能力。本实验采用无血清培养静止期细胞诱导,对照组X0静止期细胞达70%,理论上p21CIP1/WAF1表达增高,而实验组X静止期细胞仅56%,p21CIP1/WAF1表达应降低,本实验结果与预期值相同。
, 百拇医药
3.HBx蛋白对PCNA的影响:PCNA是DNA聚合酶δ的一个亚基。在DNA复制过程中,促进DNA聚合酶δ延伸DNA。本实验通过细胞静止期诱导,理论上PCNA表达降低,而HBx有推进细胞周期作用,PCNA表达应增高。实验结果与预期相同,表明HBx蛋白有推进细胞周期,促进DNA合成作用。
p21CIP1/WAF1可与PCNA结合,使PCNA不能与DNA聚合酶δ形成复合物,DNA全酶复合物不能在DNA单链上滑动,影响DNA复制[9]。本文图9是在一张硝酸纤维膜上同时加PCNA和p21CIP1/WAF1两个单抗获得,图中可见X有PCNA条带,却无p21CIP1/WAF1条带;X0有p21CIP1/WAF1条带,但无PCNA条带,也正好说明两者之间呈负相关。
本课题为国家杰出青年科学基金和国家自然科学基金资助项目(39630280)
, 百拇医药
参考文献
1 Rossner MT.Review: hepatitis B virus X-gene product: A promiscuous transcriptional activator.J Med Virol,1992,36:101-117.
2 陶小红,沈鼎明.乙肝病毒x蛋白与肝细胞癌变.中华肝脏病杂志,1997,5:115-117.
3 Koike K,Moriya K,Yotosuyanagi H,et al.Induction of cell cycle progression by hepatitis B virus HBx gene expression in quiescent mouse fibroblasts.J Clin Invest,1994,94:44-49.
4 Benn J,Schneider RJ.Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls.Proc Natl Acad Sci USA,1995,92:11215-11219.
, 百拇医药
5 Xiong Y,Zhang H,Beach D,et al.D type cyclins associate with muyltiple protein kinases and the DNA replication and repair factor PCNA.Cell,1992,71:505-514.
6 El-deiry WS,Tokino T,Veleulescu VE,et al.WAF1,a potential mediator of p53 tumor suppression.Cell,1993,75:817-825.
7 Ueda H,Ullrich SJ,Gangemi JD,et al.Functional inactivation but not structural mutation of p53 causes liver cancer.Nat Genet,1995,9:41-47.
, 百拇医药
8 Puisieux A,Ji J,Guillot C,et al.p53-mediated cellular response to DNA damage in cell with replicative hepatitis B virus.Proc Natl Acad Sci USA,1995,92:1 342-1 346.
9 Waga S,Hannon GJ,Beach D,et al.The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA.Nature,1994,369:574-578.
(收稿:1998-08-03 修回:1999-05-04), http://www.100md.com
单位:沈鼎明 (400010 重庆医科大学附属第二医院消化科);陶小红 (第一附属医院消化科,400016);任红 张大志 叶珈 古柏燕 (附属第二医院肝炎研究所);张小实 (附属第一医院消化科)
关键词:肝炎病毒,乙型;细胞周期
中华医学杂志990819 【摘要】 目的 研究乙型肝炎病毒x(HBx)蛋白对细胞周期影响,探讨HBx蛋白致细胞周期紊乱的分子机理。方法 构建HBx基因真核表达载体pCEP4-X,电转染入HepG2细胞(X细胞),以pCEP4空载体为对照(X0细胞),潮霉素选择培养,克隆扩增转染细胞,经无血清培养同步化后,流式细胞仪检测细胞周期变化;细胞组化和Western blot检测增殖细胞核抗原(PCNA)和p21CIP1/WAF1表达变化。结果 流式细胞仪检测示对照X0细胞70%进入G0-G1期,而转X细胞仅56%进入G0-G1期,与含血清培养的亲本细胞HepG2几乎相同。p21CIP1/WAF1D表达在X0细胞阳性率为(86±8)%,X细胞为(16±6)%。PCNA表达在X0细胞阳性率为(9±5)%,X细胞为(86±3)%。结论 HBx有推进细胞周期作用,并使细胞生长对血清依赖减少。HBx可抑制细胞周期抑制蛋白p21CIP1/WAF1表达,同时增强细胞DNA合成。
, 百拇医药
The effect of hepatitis B virus x protein on cell cycling
TAO Xiaohong REN Hong SHEN Dingming et al.
(Chongqing University of Medical Sciences,Chongqing 400010)
【Abstract】 Objective To study the effect of HBx protein on cell cycle progression and its molecular mechanism.Methods The eucaryotic expression vector pCEP4 of HBx gene was constructed and introduced into HepG2 cells.The HepG2 cells transfected with X gene (X cell) were synchronized in a quiescent state by culture of serum deprivation.Flow cytometry,immunohistochemical and Western Blot analysis were performed.Results 70% HepG2 cells transfected with pCEP4 (X0 cells) was induced in G0-G1 phase,only 56% X cells in G0-G1 phase,almost identical to its parental HepG2 cells cultured in serum medium.To further understand the molecular mechanism of cell cycle progression,the p21CIP1/WAF1 and PCNA were examined.HBx was found to strongly increase the level of PCNA in X cells (86±3)% compared with X0 cells (9±5)%,and greatly decrease the level of p21CIP1/WAF1 protein in X cells (16±6)% compared with X0 cells (86±8)% (P<0.001).Conclusions These data suggest a molecular mechanism by which HBx likely contributes to viral carcinogenesis.By deregulating cell cycle checkpoint control,HBx could participate in the selection of cells that are genetically unstable,some of which would accumulate unrepaired transfroming mutations.
, http://www.100md.com
【Key words】 Hepatitis B virus Cell cycle
肿瘤细胞代谢的显著特点就是细胞周期调控紊乱。乙型肝炎病毒x(hepatitis B virus x,HBx)蛋白具有广泛的反式激活作用,并认为参与肝细胞癌(hepatocellular carcinoma,HCC)发生的分子机理[1,2]。HBx蛋白有明显推进细胞周期作用,使细胞快速进入S期[3,4]。我们选用转染HBx基因并能稳定表达x蛋白的HepG2细胞作为实验模型,以探讨HBx蛋白对细胞周期调控的影响及其在HCC发生中的分子机理。
材料和方法
1.材料:pBluescript KS+(pBKS+),宿主菌为XL1-blue。pCEP4为EB病毒真核表达载体,宿主菌为Top10F′。pEcob6为含双拷贝HBV DNA(adw亚型),保存于HB101菌。以上载体和菌株由重庆医科大学肝炎研究所保存。鼠抗p21CIP1/WAF1单抗、鼠抗增殖细胞核抗原(proliferating cell nucler antigen,PCNA)单抗(PC10)、抗鼠生物素化IgG(2抗)、链霉亲合素结合的碱性磷酸酶(3抗)购自北京中山公司(美国Santa Cruse 公司产品分装)。ABC免疫组织化学试剂盒购自福州迈新公司。
, http://www.100md.com
2.分子克隆和细胞培养:将x片段亚克隆于pBKS+中,再连接到真核表达载体pCEP4上。电转染法将pCEP4-X、pCEP4导入HepG2中(分别命名为X细胞和X0细胞),潮霉素选择培养,挑取单细胞克隆扩增,RT-PCR鉴定表达[5]。细胞同步化用无血清DMEM培养16小时。
3.流式细胞检测:将同步化细胞消化,磷酸缓冲液洗涤离心,保证细胞数在5×104/ml以上,细胞在2小时内碘化丙啶标记后,上流式细胞仪(美国Becton-Dickinson公司),Cell Quest和ModFitLT软件分析结果。
4.免疫印渍法(Western blot)检测PCNA、p21CIP1/WAF1:抽提同步化细胞蛋白质,质量浓度为12%的丙烯酰胺电泳分离后电转移至硝酸纤维素膜上。质量浓度为5%的脱脂奶粉封闭1小时,加一抗(单抗p21CIP1/WAF1和PCNA工作浓度分别为1∶200、1∶300)4℃过夜。洗膜,加二抗(工作浓度1∶800),22℃ 1小时,洗膜,加三抗(工作浓度1∶800),22℃1小时。底物显色,图像存入计算机。
, 百拇医药
5.细胞组织化学染色:将细胞在玻片上培养24小时,经同步化处理后,质量浓度为4%的多聚甲醛固定,质量浓度为0.1%的Triton X 100透膜,按ABC试剂盒说明操作染色。单抗PCNA、p21CIP1/WAF1工作浓度分别为1∶100和1∶40。结果判定:细胞核内见棕黄色颗粒为阳性,染色按阳性和阴性计数,100个细胞/低倍视野,共计数5个视野,作t检验。
结果
1.流式细胞检测:结果见图1~3。图1为未同步化含血清培养的HepG2亲本细胞,G0-G1期细胞占56.77%。图2为X0同步化细胞,G0-G1期细胞占69.67%,约70%细胞进入静止期。图3为X同步化细胞,G0-G1期细胞占56.15%。图3与图2相比,静止期细胞明显减少,与未同步化图1相比,静止期细胞几乎相同,提示在无血清培养下x蛋白仍能刺激细胞增殖。

, 百拇医药
图1 血清培养HepG2细胞

图2 无血清同步化处理HepG2-X细胞

图3 无血清同步化处理HepG2-X0细胞
图1~3 流式细胞检测HBx蛋白对细胞周期影响
2.p21CIP1/WAF1测定:(1)细胞组织化学:结果见图4,5。X细胞p21CIP1/WAF1表达明显降低。而X0细胞明显增高。按每低倍视野计100个细胞,共500个细胞平均阳性率作统计处理,结果X0阳性细胞为(86±8)%,X细胞为(16±6)%,差异有非常显著意义(P<0.001)。(2)Western Blot:结果见图6,p21CIP1/WAF1在X细胞无明显转印带,X0细胞有显著转印带。表明HBx蛋白可明显抑制p21CIP1/WAF1的表达。

, http://www.100md.com
图4 HepG2细胞转染X基因

图5 HepG2细胞转染空载体
图4,5 细胞组化检测同步化HepG2转染细胞p21CIP1/WAF1蛋白表达ABC染色 ×200

M:中分子量蛋白质标准;1: HepG2-X0细胞;2:HepG2-X细胞(图9同)
图6 同步化处理HepG2-X0和HepG2-X细胞p21CIP1/WAF表达
3.PCNA测定:(1)细胞组织化学:结果见图7,8。X细胞PCNA表达明显高于X0细胞。计数阳性细胞,X0阳性细胞为(9±5)%,X细胞为(86±3)%(P<0.001)。(2)Western Blot:结果见图9,X细胞有明显转印带,而X0细胞无转印带。表明x蛋白有明显增强PCNA表达作用。

, 百拇医药
图7 为HepG2细胞转染X基因

图8 为HepG2细胞转染空载体
图7,8 细胞组化检测同步化HepG2转染细胞PCNA蛋白表达ABC染色 ×200

图9 同步化处理HepG2-X0和HepG2-X细胞p21CIP1/WAF1及PCNA表达
讨论
1.HBx蛋白对细胞周期的影响:Koike等[3]用X基因重组体pMTV转染NIH3T3细胞,无血清同步化后,地塞米松诱导HBx蛋白表达,结果X蛋白表达18小时后细胞开始进入S期,同时伴有DNA合成增加,而对照组仍停留在静止期。Benn等[4]选择Chang cell同步化后,用x基因腺病毒重组体感染细胞,结果细胞提前12小时进入S期。我们采用稳定表达HBx蛋白的转X基因HepG2细胞,经同步化后,结果示对照X0细胞70%进入静止期,而X细胞与对照亲本细胞HepG2(未经同步化)无差别,表明无血清培养后,X细胞仍处增殖、分裂、生长期。提示HBx蛋白可减少细胞对血清的依赖性,使细胞获得了新的转化表型。
, 百拇医药
2.HBx蛋白对细胞周期抑制蛋白p21CIP1/WAF1的影响:p21CIP1/WAF1是一细胞周期抑制蛋白,可广泛抑制各种周期素-周期素依赖激酶复合物,使细胞周期停留在G1期,对DNA损伤介导的细胞周期抑制及损伤修复起有重要作用[5]。本实验用静止期诱导后,观察HBx蛋白对p21CIP1/WAF1表达调控影响,结果X细胞无p21CIP1/WAF1表达,而X0细胞有p21CIP1/WAF1表达。由于p21CIP1/WAF1表达受p53调控,HBx蛋白可与p53结合并使其失活[7],因此推测X细胞p21CIP1/WAF1表达降低是HBx蛋白使p53失活的结果。Puisieux等[8]报道用doxorubicin处理2215细胞和HepG2细胞后,p53和p21CIP1/WAF1表达均增高,结果与本实验相反。我们认为这是实验设计的原因。DNA损伤剂doxorubicin处理细胞可强烈诱导p53表达,但若没有HBx蛋白的伴随增加,p53仍具激活p21CIP1/WAF1的能力。本实验采用无血清培养静止期细胞诱导,对照组X0静止期细胞达70%,理论上p21CIP1/WAF1表达增高,而实验组X静止期细胞仅56%,p21CIP1/WAF1表达应降低,本实验结果与预期值相同。
, 百拇医药
3.HBx蛋白对PCNA的影响:PCNA是DNA聚合酶δ的一个亚基。在DNA复制过程中,促进DNA聚合酶δ延伸DNA。本实验通过细胞静止期诱导,理论上PCNA表达降低,而HBx有推进细胞周期作用,PCNA表达应增高。实验结果与预期相同,表明HBx蛋白有推进细胞周期,促进DNA合成作用。
p21CIP1/WAF1可与PCNA结合,使PCNA不能与DNA聚合酶δ形成复合物,DNA全酶复合物不能在DNA单链上滑动,影响DNA复制[9]。本文图9是在一张硝酸纤维膜上同时加PCNA和p21CIP1/WAF1两个单抗获得,图中可见X有PCNA条带,却无p21CIP1/WAF1条带;X0有p21CIP1/WAF1条带,但无PCNA条带,也正好说明两者之间呈负相关。
本课题为国家杰出青年科学基金和国家自然科学基金资助项目(39630280)
, 百拇医药
参考文献
1 Rossner MT.Review: hepatitis B virus X-gene product: A promiscuous transcriptional activator.J Med Virol,1992,36:101-117.
2 陶小红,沈鼎明.乙肝病毒x蛋白与肝细胞癌变.中华肝脏病杂志,1997,5:115-117.
3 Koike K,Moriya K,Yotosuyanagi H,et al.Induction of cell cycle progression by hepatitis B virus HBx gene expression in quiescent mouse fibroblasts.J Clin Invest,1994,94:44-49.
4 Benn J,Schneider RJ.Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls.Proc Natl Acad Sci USA,1995,92:11215-11219.
, 百拇医药
5 Xiong Y,Zhang H,Beach D,et al.D type cyclins associate with muyltiple protein kinases and the DNA replication and repair factor PCNA.Cell,1992,71:505-514.
6 El-deiry WS,Tokino T,Veleulescu VE,et al.WAF1,a potential mediator of p53 tumor suppression.Cell,1993,75:817-825.
7 Ueda H,Ullrich SJ,Gangemi JD,et al.Functional inactivation but not structural mutation of p53 causes liver cancer.Nat Genet,1995,9:41-47.
, 百拇医药
8 Puisieux A,Ji J,Guillot C,et al.p53-mediated cellular response to DNA damage in cell with replicative hepatitis B virus.Proc Natl Acad Sci USA,1995,92:1 342-1 346.
9 Waga S,Hannon GJ,Beach D,et al.The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA.Nature,1994,369:574-578.
(收稿:1998-08-03 修回:1999-05-04), http://www.100md.com