微量脑样本采集及钠钾水含量测定△
作者:胡卫星 李立新 顾培元
单位:南京医科大学第一附属医院神经外科 邮政编码:210029
关键词:电解质 脑梗死 微量分析 MR
江苏医药991101 摘要 目的:实现微量标本测定脑组织Na+、K+和水的含量。方法:SD大鼠脑梗死模型,用B-D18G腰穿针自制微量取样器,重新设定火焰光谱分析仪测定程序实现微量测定。结果:微量脑标本湿重仅1.93±0.33mg,干重0.43±0.08mg,梗死区Na+542.74±135mEq/kg;K+163.35±116.6mEq/kg。结论:本文用单一微样即可完成Na+、K+和水的微量测定,其结果与大标本测定相一致;本方法为今后脑微小区域水电解质分析奠定了基础。其研究结果表明,脑梗死早期脑水肿的形成与钠离子内流及伴随其移动的水的积聚有关。
, http://www.100md.com
A New Method for Microanalysis of Cations and Water
Content in Micro-brain-tissues
Hu Weixing et al
Department of Neurosurgery, First Affiliated Hospital,Nanjing Medical University,Nanjing
Abstract Objective:To create a new method for determining sodium(Na+),potassium(K+) and water content in micro-brain tissue.Methods:A puncher was made of B-D 18 G spinal needle.The determining programs of IL943 TM Automatic Flame Photometer was reset for micro-sample analysis.Microbrain samples were taken from ischemic model of SD rats.Results:The samples were 1.93±0.33mg/wet-w and 0.43±0.08mg/dry-w,respectively.They were much smaller than the reported weights, which were typically about 35 mg or more.The concentrations of Na+ and K+ were 542.74±135.0 and 163.35±116.6mEq/kg(dry-w) in IC, respectively.Conclusions:One micro-sample can successfully be used for the determination of Na+,K+ and water content.The method is very useful in future for the research of cations and water content in a certain region of the brain.
, http://www.100md.com
Key words Cation Brain ischemia Micro-analysis MR
现有研究分析脑组织水和电解质的方法已不能适应于微小区域的微量样本的分析。本文创用自制特殊采样器并改进火焰光谱仪Na+、K+分析的方法。该方法可适用不同微小区域的采样和微量样本的分析,现报道如下。
材料和方法
脑梗死模型:18只SD大鼠(302±32g),2.5%~1.5%Isoflurane,68%NO,30%O2混合气体诱导和维持麻醉动物。Chen氏法制作脑梗死模型[1,2]。实验中控制动物肛温于37℃、血压、血气于正常范围。
核磁共振扫描梗死灶定位:用GE公司生产的GE4.7T扫描仪,先获取矢状面中线图像,由此确定MCA供血区,获取梗死区冠状位图像。
, http://www.100md.com
脑组织取样:脑梗死2~6小时,MR扫描后断头,在干冰预冷的-40℃丙酮中速冻整个头颅,在-20℃冷冻切片箱中完整取出脑组织并切削至冠状位MR所示的脑梗死层面,在高倍放大镜下观察切面组织结构以确认与MR所示层面相一致,用自制并预冷至-40℃的微量取样器(图1)采取脑梗死区(IC)、梗死周围边区(IB)及对侧大脑皮层相应部位(CB、NC)的微量标本(图2)。样本置入90℃预干燥3天并称重的2ml无钠玻璃瓶(ART.No60810-Kimble Division of Owens-Illinois)中,称取标本湿重后90℃再烘烤3天至标本恒重。将标本瓶直接移入预干燥的干燥盒中使标本和瓶冷却至室温后再称取干重(Model C-44数字式微量分析天平Analytical Technology,Inc.NJ),并计算出标本的含水量,最后置入400℃烧烤箱中碳化标本24小时。整个操作过程中注意避免任何潮湿、尘埃污染以免影响称重准确性及钠钾的污染。
, http://www.100md.com
图1 自制微量取样器由B-D18G腰穿针制成,针外层用金属套管加粗,最外层套以硅胶管,使之便于操作和隔热。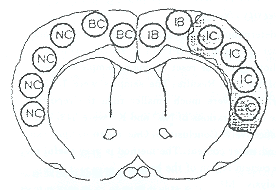
图2 脑冠状切面:IC脑梗死区,IB梗死周边区,BC和NC为对侧半球相应区域。
脑组织钠和钾测定:采用火焰光谱法分别测定钠、钾含量。火焰光谱法分析仪(IL943TM Automatic Flame Photometer,Instrumentation Laboratory,MA)的测定程序重新设定。用铯稀释剂33359(3-Way Standard Diluent Cesium33359)在自取样模式下校准钠至140,钾至5.0,机器自动校0后用铯稀释剂33310(Cesiu Diluent 33310)校准钠、钾均至0。在预稀释模式下,设定取样速度于1ml/40秒,再用1∶100(铯稀释剂33359∶稀释剂33310)再次校准钠至140和钾至5.0,最后单用铯稀释剂33310再校准至钠、钾至0。测定标本时加入1ml33310稀释剂,小心震荡瓶中液体使钠、钾自样本中完全吸出,在预稀释模式下测定其含量。每份标本测定后仪器用火焰光谱分析洗涤液342-873清洗。钠、钾浓度用下列公式计算:
, 百拇医药
钠或钾mEq/kg=(读取数值/101)×(0.001/标本重量)
用ANOVA统计软件检验组间显著性。
结 果
一、本组动物术前与断头前的平均动脉压及血气指标无显著性差异,P均>0.05。
二、样本大小及重量 不同区域(IC、IB及CB、NC)样本大小基本相同(约2mm3),但IC区域样本湿重大于其它区域,P<0.05(见附表)。不同区域样本干重无显著性差异,P均>0.05。
三、脑组织钠、钾及水含量 IC区域钠和水的含量明显高于其它区域,而钾含量则完全相反(见附表)。在IB、CB、NC之间各观测值无明显差异。Na+含量随着梗死时间的延长而增加(y=0.17x+60,r2=0.74)。
, http://www.100md.com
附表 不同区域样本重量及脑组织Na+、K+及水含量( ±s) 取样部位
±s) 取样部位
n
湿重(mg)
干重(mg)
含水量%
Na+(mEq/kg)
K+(mEq/kg)
IC
, http://www.100md.com 68
2.06±0.41*
0.40±0.10
80.3±2.9**
542.74±135.0**
163.35±116.6**
IB
32
1.85±0.43
0.44±0.11
76.3±2.8
, 百拇医药
241.16±71.01
415.68±66.01
CB
32
1.80±0.45
0.43±0.11
75.7±3.9
250.45±71.08
420.36±82.94
NC
80
1.82±0.38
, 百拇医药
0.43±0.09
75.9±3.4
245.03±59.09
431.47±79.97
*P<0.05,**P<0.001
讨 论
测定脑组织电解质和水含量已有几十年的历史。但既往文献所采用的组织标本均较大(N.Nakao,T.K.McIntosh1990用全脑作标本;G.Y.Yang 1992,H.C.Klein1993用脑片作标本;W.Young 1987,J.Mintorovitch1994,S.A.Menzies1993,F.J.Schaier1980,P.H.Chen1983用30~60mg脑组织作为分析标本,绝大多数需用35mg以上的样本[3,4],这难以满足当今和今后进一步研究的需要,也难以阐明不同区域电解质与水的变化。本文创用一套微量标本的采集,脑组织钠、钾、水含量的微量分析方法。由于采样器的创新和测定方法的改进,我们的标本平均湿重仅1.93±0.33mg,干重0.43±0.08mg(N=212)。微样分析为进一步研究创造了便利条件 ,可使之应用更小动物用于研究成为可能,如gerbil、新生鼠甚至胎鼠。对于研究常用的SD大鼠脑梗死模型来说,微样分析可允许分别获取研究所感兴趣的微小区域样本,这十分有利于更深入的研究工作,使之有可能对梗死区、梗死周边区等进行比较研究。
, 百拇医药
文献报道用重力比重法测定小块组织水含量,测定时确实比较简单、快速,但制备精确的比重梯度液柱要求十分高[5]。该技术同时要求预先估计所测样本的两个参数范围,即湿样和干样的特殊重力(spgrt和spgrs)。此外脑组织内蛋白成分增加会导致含水量测定的显著误差,更重要的是此法一个样本仅能测定组织水含量的单项指标[5]。本文详细叙述了新创用的微量采样,微量精确测定钠、钾的完整过程,应用该方法,一个样本可同时一次完成组织含水量及钠、钾的测定。
火焰光谱法用于测定脑组织内钠、钾已有几十年的历史,它快速、简便,但常常由于实验过程中的污染而影响其测定的精确性,且测定微量样本还未见报道。测定过程中应用去离子水已作为一种常规措施。但既往所用的玻璃容器本身常含有钠、钾成分,文献报告中又常常用强酸来吸出组织中的离子成分[5],这可影响测定的精确性。本文选用特殊的无钠玻瓶,并用Cesium Diluent33310(pH7.18)替代强酸吸出离子成分,有效地保证了测定的精确性。另外,机器取样的速度是测定过程中的又一关键,反复测试所得的经验数据为1ml/40秒。
, http://www.100md.com
据文献报道,脑梗死早期(4~6小时内)BBB通透性正常,并认为脑梗死早期脑水肿属细胞毒性水肿[6]。从本文的资料,不难发现梗死区(IC区)的Na+、水含量明显高于IB和NC、CB区域(P<0.01),而K+含量又明显低于其它区域(P<0.01)。正常时Na+、K+梯度完全依赖细胞膜的正常功能,脑梗死后由于能量供应障碍,Na+-K+-ATP泵失常,使细胞膜对离子的通透性发生变化,Na+、K+各自顺梯度移动,随时间推移Na+自细胞外间隙不断向细胞内积聚,K+不断外流出细胞[5]。IC区Na+与水含量均随梗死时间的延长而增加,Na+与水的变化明显呈相关关系[7]。本组标本取自脑梗死后2~6小时,不同时段梗死组织内Na+、K+含量存在差异,这就不难说明为什么IC区Na+、K+含量的SD大于其它区域。W.Young1987报道Na+流入是K+流出的2~3倍,存在着净离子内流。水正是伴随这部分净离子流的内移而向组织内积聚,这正是脑梗死后,早期脑水肿形成的主要动因。
, http://www.100md.com
本文创用的一套微样采集脑组织Na+、K+、水含量的微量分析方法,为进一步研究提供了便利条件。本研究表明,脑梗死早期脑水肿的形成与钠离子内流及伴随其移动的水的积聚有关。
△ 本课题为省教委自然科学基金资助课题(93090)
参考文献
[1] Chen ST,et al.Soke 1986;17:738.
[2] Tamura A,et al.J Cereb Blood Flow Metab 1981;1:53.
[3] Young W,et al.Stroke 1987;18:751.
[4] Chan PH,et al.Ann Neurol 1983;13:625.
[5] Marmarou A,et al.J Neurosurg 1982;56:246.
[6] Warren DL,et al.Stroke 1987;18(1):150.
[7] Hatashita S, et al.Stroke 1990;21:582.
(1999年3月27日收稿 同年6月15日修回), 百拇医药
单位:南京医科大学第一附属医院神经外科 邮政编码:210029
关键词:电解质 脑梗死 微量分析 MR
江苏医药991101 摘要 目的:实现微量标本测定脑组织Na+、K+和水的含量。方法:SD大鼠脑梗死模型,用B-D18G腰穿针自制微量取样器,重新设定火焰光谱分析仪测定程序实现微量测定。结果:微量脑标本湿重仅1.93±0.33mg,干重0.43±0.08mg,梗死区Na+542.74±135mEq/kg;K+163.35±116.6mEq/kg。结论:本文用单一微样即可完成Na+、K+和水的微量测定,其结果与大标本测定相一致;本方法为今后脑微小区域水电解质分析奠定了基础。其研究结果表明,脑梗死早期脑水肿的形成与钠离子内流及伴随其移动的水的积聚有关。
, http://www.100md.com
A New Method for Microanalysis of Cations and Water
Content in Micro-brain-tissues
Hu Weixing et al
Department of Neurosurgery, First Affiliated Hospital,Nanjing Medical University,Nanjing
Abstract Objective:To create a new method for determining sodium(Na+),potassium(K+) and water content in micro-brain tissue.Methods:A puncher was made of B-D 18 G spinal needle.The determining programs of IL943 TM Automatic Flame Photometer was reset for micro-sample analysis.Microbrain samples were taken from ischemic model of SD rats.Results:The samples were 1.93±0.33mg/wet-w and 0.43±0.08mg/dry-w,respectively.They were much smaller than the reported weights, which were typically about 35 mg or more.The concentrations of Na+ and K+ were 542.74±135.0 and 163.35±116.6mEq/kg(dry-w) in IC, respectively.Conclusions:One micro-sample can successfully be used for the determination of Na+,K+ and water content.The method is very useful in future for the research of cations and water content in a certain region of the brain.
, http://www.100md.com
Key words Cation Brain ischemia Micro-analysis MR
现有研究分析脑组织水和电解质的方法已不能适应于微小区域的微量样本的分析。本文创用自制特殊采样器并改进火焰光谱仪Na+、K+分析的方法。该方法可适用不同微小区域的采样和微量样本的分析,现报道如下。
材料和方法
脑梗死模型:18只SD大鼠(302±32g),2.5%~1.5%Isoflurane,68%NO,30%O2混合气体诱导和维持麻醉动物。Chen氏法制作脑梗死模型[1,2]。实验中控制动物肛温于37℃、血压、血气于正常范围。
核磁共振扫描梗死灶定位:用GE公司生产的GE4.7T扫描仪,先获取矢状面中线图像,由此确定MCA供血区,获取梗死区冠状位图像。
, http://www.100md.com
脑组织取样:脑梗死2~6小时,MR扫描后断头,在干冰预冷的-40℃丙酮中速冻整个头颅,在-20℃冷冻切片箱中完整取出脑组织并切削至冠状位MR所示的脑梗死层面,在高倍放大镜下观察切面组织结构以确认与MR所示层面相一致,用自制并预冷至-40℃的微量取样器(图1)采取脑梗死区(IC)、梗死周围边区(IB)及对侧大脑皮层相应部位(CB、NC)的微量标本(图2)。样本置入90℃预干燥3天并称重的2ml无钠玻璃瓶(ART.No60810-Kimble Division of Owens-Illinois)中,称取标本湿重后90℃再烘烤3天至标本恒重。将标本瓶直接移入预干燥的干燥盒中使标本和瓶冷却至室温后再称取干重(Model C-44数字式微量分析天平Analytical Technology,Inc.NJ),并计算出标本的含水量,最后置入400℃烧烤箱中碳化标本24小时。整个操作过程中注意避免任何潮湿、尘埃污染以免影响称重准确性及钠钾的污染。
, http://www.100md.com
图1 自制微量取样器由B-D18G腰穿针制成,针外层用金属套管加粗,最外层套以硅胶管,使之便于操作和隔热。

图2 脑冠状切面:IC脑梗死区,IB梗死周边区,BC和NC为对侧半球相应区域。
脑组织钠和钾测定:采用火焰光谱法分别测定钠、钾含量。火焰光谱法分析仪(IL943TM Automatic Flame Photometer,Instrumentation Laboratory,MA)的测定程序重新设定。用铯稀释剂33359(3-Way Standard Diluent Cesium33359)在自取样模式下校准钠至140,钾至5.0,机器自动校0后用铯稀释剂33310(Cesiu Diluent 33310)校准钠、钾均至0。在预稀释模式下,设定取样速度于1ml/40秒,再用1∶100(铯稀释剂33359∶稀释剂33310)再次校准钠至140和钾至5.0,最后单用铯稀释剂33310再校准至钠、钾至0。测定标本时加入1ml33310稀释剂,小心震荡瓶中液体使钠、钾自样本中完全吸出,在预稀释模式下测定其含量。每份标本测定后仪器用火焰光谱分析洗涤液342-873清洗。钠、钾浓度用下列公式计算:
, 百拇医药
钠或钾mEq/kg=(读取数值/101)×(0.001/标本重量)
用ANOVA统计软件检验组间显著性。
结 果
一、本组动物术前与断头前的平均动脉压及血气指标无显著性差异,P均>0.05。
二、样本大小及重量 不同区域(IC、IB及CB、NC)样本大小基本相同(约2mm3),但IC区域样本湿重大于其它区域,P<0.05(见附表)。不同区域样本干重无显著性差异,P均>0.05。
三、脑组织钠、钾及水含量 IC区域钠和水的含量明显高于其它区域,而钾含量则完全相反(见附表)。在IB、CB、NC之间各观测值无明显差异。Na+含量随着梗死时间的延长而增加(y=0.17x+60,r2=0.74)。
, http://www.100md.com
附表 不同区域样本重量及脑组织Na+、K+及水含量(
n
湿重(mg)
干重(mg)
含水量%
Na+(mEq/kg)
K+(mEq/kg)
IC
, http://www.100md.com 68
2.06±0.41*
0.40±0.10
80.3±2.9**
542.74±135.0**
163.35±116.6**
IB
32
1.85±0.43
0.44±0.11
76.3±2.8
, 百拇医药
241.16±71.01
415.68±66.01
CB
32
1.80±0.45
0.43±0.11
75.7±3.9
250.45±71.08
420.36±82.94
NC
80
1.82±0.38
, 百拇医药
0.43±0.09
75.9±3.4
245.03±59.09
431.47±79.97
*P<0.05,**P<0.001
讨 论
测定脑组织电解质和水含量已有几十年的历史。但既往文献所采用的组织标本均较大(N.Nakao,T.K.McIntosh1990用全脑作标本;G.Y.Yang 1992,H.C.Klein1993用脑片作标本;W.Young 1987,J.Mintorovitch1994,S.A.Menzies1993,F.J.Schaier1980,P.H.Chen1983用30~60mg脑组织作为分析标本,绝大多数需用35mg以上的样本[3,4],这难以满足当今和今后进一步研究的需要,也难以阐明不同区域电解质与水的变化。本文创用一套微量标本的采集,脑组织钠、钾、水含量的微量分析方法。由于采样器的创新和测定方法的改进,我们的标本平均湿重仅1.93±0.33mg,干重0.43±0.08mg(N=212)。微样分析为进一步研究创造了便利条件 ,可使之应用更小动物用于研究成为可能,如gerbil、新生鼠甚至胎鼠。对于研究常用的SD大鼠脑梗死模型来说,微样分析可允许分别获取研究所感兴趣的微小区域样本,这十分有利于更深入的研究工作,使之有可能对梗死区、梗死周边区等进行比较研究。
, 百拇医药
文献报道用重力比重法测定小块组织水含量,测定时确实比较简单、快速,但制备精确的比重梯度液柱要求十分高[5]。该技术同时要求预先估计所测样本的两个参数范围,即湿样和干样的特殊重力(spgrt和spgrs)。此外脑组织内蛋白成分增加会导致含水量测定的显著误差,更重要的是此法一个样本仅能测定组织水含量的单项指标[5]。本文详细叙述了新创用的微量采样,微量精确测定钠、钾的完整过程,应用该方法,一个样本可同时一次完成组织含水量及钠、钾的测定。
火焰光谱法用于测定脑组织内钠、钾已有几十年的历史,它快速、简便,但常常由于实验过程中的污染而影响其测定的精确性,且测定微量样本还未见报道。测定过程中应用去离子水已作为一种常规措施。但既往所用的玻璃容器本身常含有钠、钾成分,文献报告中又常常用强酸来吸出组织中的离子成分[5],这可影响测定的精确性。本文选用特殊的无钠玻瓶,并用Cesium Diluent33310(pH7.18)替代强酸吸出离子成分,有效地保证了测定的精确性。另外,机器取样的速度是测定过程中的又一关键,反复测试所得的经验数据为1ml/40秒。
, http://www.100md.com
据文献报道,脑梗死早期(4~6小时内)BBB通透性正常,并认为脑梗死早期脑水肿属细胞毒性水肿[6]。从本文的资料,不难发现梗死区(IC区)的Na+、水含量明显高于IB和NC、CB区域(P<0.01),而K+含量又明显低于其它区域(P<0.01)。正常时Na+、K+梯度完全依赖细胞膜的正常功能,脑梗死后由于能量供应障碍,Na+-K+-ATP泵失常,使细胞膜对离子的通透性发生变化,Na+、K+各自顺梯度移动,随时间推移Na+自细胞外间隙不断向细胞内积聚,K+不断外流出细胞[5]。IC区Na+与水含量均随梗死时间的延长而增加,Na+与水的变化明显呈相关关系[7]。本组标本取自脑梗死后2~6小时,不同时段梗死组织内Na+、K+含量存在差异,这就不难说明为什么IC区Na+、K+含量的SD大于其它区域。W.Young1987报道Na+流入是K+流出的2~3倍,存在着净离子内流。水正是伴随这部分净离子流的内移而向组织内积聚,这正是脑梗死后,早期脑水肿形成的主要动因。
, http://www.100md.com
本文创用的一套微样采集脑组织Na+、K+、水含量的微量分析方法,为进一步研究提供了便利条件。本研究表明,脑梗死早期脑水肿的形成与钠离子内流及伴随其移动的水的积聚有关。
△ 本课题为省教委自然科学基金资助课题(93090)
参考文献
[1] Chen ST,et al.Soke 1986;17:738.
[2] Tamura A,et al.J Cereb Blood Flow Metab 1981;1:53.
[3] Young W,et al.Stroke 1987;18:751.
[4] Chan PH,et al.Ann Neurol 1983;13:625.
[5] Marmarou A,et al.J Neurosurg 1982;56:246.
[6] Warren DL,et al.Stroke 1987;18(1):150.
[7] Hatashita S, et al.Stroke 1990;21:582.
(1999年3月27日收稿 同年6月15日修回), 百拇医药