实验性肝纤维化过程中间质胶原酶表达的研究
作者:王宇 高毅 杨继震
单位:中国人民解放军第一军医大学附属珠江医院肝胆外科 广东省广州市 510282
关键词:肝硬化;胶原酶;基因表达
世界华人消化杂志991133 中国图书馆分类号 R 575.2
Subject headings liver cirrhosis; collagenase; gene expression
肝纤维化是多种慢性肝损伤的不良结局,为慢性肝病向肝硬变发展的病理过程. 其实质是Ⅰ,Ⅲ为主的胶原纤维等细胞外基质(extracellular matrix, ECM)合成与降解失衡,导致在ECM肝内过度沉积而形成的. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一族参与降解ECM的主要水解蛋白酶,目前为止该家族至少已有20个成员,肝内发现了8种,其中间质胶原酶(interstitial collagenase,mmp-1 in human, mmp-13 in rat)主要参与Ⅰ,Ⅲ型胶原的降解,与肝纤维化的发生发展紧密相关[1]. 研究表明,肝损伤或肝纤维化早期间质胶原酶活性常升高,但随着肝纤维化的发展,其活性进行性下降,ECM降解水平也明显下降[2]. 其原因可能是基因表达及酶原合成减少或激活受到抑制以及其抑制因子的作用. 为了了解肝纤维化过程中mmp-13基因及酶原表达是否呈相应变化,我们应用四氯化碳(CCl4)建立大鼠肝纤维化模型,通过逆转录定量PCR方法及Western印迹法分别对肝内mmp-13 mRNA和酶原蛋白的表达水平作了检测,现报道如下.
, 百拇医药
1 材料和方法
1.1 材料 清洁型Wistar ♂大鼠120只,体质量200 g~300 g,第一军医大学实验动物中心提供. CCl4为汕头化工厂产品,含量>99.5%. 总RNA提取试剂盒(Trizol reagent)、M-MLV逆转录酶、RNA酶抑制剂均为Gibco产品;Oligo(dT)15 primers,PCR marker及琼脂糖为Promega公司产品;TAG酶为Sangon公司产品. Bio-Rad蛋白抽提及定量试剂盒为Bio-Rad产品,mmp-13多克隆抗体由美国(NIH) William G.Stetler-Stevenson惠赠. 辣根过氧化物酶标二抗(羊抗兔IgG-HRP),SABC产品. PCR仪为珠海黑马公司产品;电转膜仪,Bio-Rad公司产品;凝胶成象系统系第一军医大学中心实验室提供的Gel Documentarion Analysis System, GDAS.
1.2 方法 ①肝纤维化模型制备:参照Montfort et al[2]方法,400 mL/ L CCl4花生油溶液按2 mL/ kg予Wistar大鼠ip,2次/ wk,共12 wk. 120只大鼠分模型组和正常对照组,模型组70只,按上述方法造模;正常对照组50只,用相应量生理盐水ip. 在0,2,5,7,9,12,14 wk时对照组活杀7只,模型组活杀10只,切取肝脏,除留作常规HE,VG染色外,其余迅速投入液氮,之后转入-70℃保存. ②肝组织总RNA提取:按照Trizol reagent说明书进行,紫外分光光度计检测总RNA纯度和定量,A260/ A280值须在1.8~2.0之间. ③cDNA的合成:采用20 μL逆转录反应体系. 其中含待测总RNA 1 μg,M-MLV 200 U,Oligo(dT) (15 primer) 50 mg/ L,4×dNTP (10 mmol/ L) 2 μL,5×RT buffer 4 μL,RNA酶抑制剂20 U,无RNase酶水补至20 μL. 37℃反应60min,95℃灭活M-MLV酶5min. ④共扩增PCR:根据Genebank资料自行设计引物(表1). 参照Noonan et al[3]方法进行共扩PCR,设GAPDH为内参照. PCR体系为50 μL,包含cDNA 10 μL,5×buffer 10 μL,4×dNTP (10 mmol/ L) 1 μL,mmp-13,GAPDH上下游引物(12.5 μmol/ L)各2 μL,TAG酶2 U,用水补至50 μL. PCR反应参数为:95℃预变性5min,94℃变性50s,56℃退火70s,72℃延伸90s,选定30个循环,最后72℃再延伸7min. mmp-13的PCR产物经测序证实为大鼠mmp-13的基因序列. PCR产物在20 g/ L琼脂糖凝胶上进行电泳后经GDAS系统扫描定量分析,用mmp-13/ GAPDH比值表示mmp-13相对表达水平. ⑤蛋白质的提取及定量:参考Bio-Rad试剂盒说明书进行,并根据各个样品蛋白质A595值的差异行标准化处理. 取等量变性后的标准化蛋白溶液,进行Western印迹[4],SDS聚丙烯酰胺凝胶电泳,每孔上样量为25 μL,并以电转膜仪将蛋白转移至硝酸纤维素膜(90mA, 1 h),经丽春红S染色鉴定并标记标准蛋白位置,再以50 g/ L脱脂奶粉封闭、一抗及二抗温育、DAB显色. 硝酸纤维素膜显色条带为Mr 54 000的mmp-13酶原蛋白,将结果照相并扫描定量分析.
, http://www.100md.com
表1 引物序列
引物名称
上游引物序列
下游引物序列
扩增产物长度
MMP-13
5'-TACCTACACTGGCAAAAGCC-3'
5'-ATGTCATACCCATTCAGGGCC-3'
354 bp
GAPDH
5'-GACATCAAGAAGGTGGTGAAGC-3'
, http://www.100md.com
5'-TGTCATTGAGAGCAATGCCAGC-3'
148 bp
统计学处理 实验结果以 ±s表示. 组内、组间比较采用单因素方差分析方法.
±s表示. 组内、组间比较采用单因素方差分析方法.
2 结果
2.1 mmp-13基因的表达 正常大鼠肝内有mmp-13的基因表达,整个实验过程中正常对照组和模型组mmp-13基因表达均无显著性差异变化(P>0.05),模型组与正常组相比亦无明显差异(P>0.05) (表2,图1,2).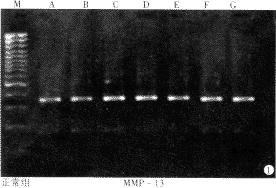
图1 正常组mmp-13 RT-PCR产物电泳图.
, 百拇医药
图2 模型组mmp-13 RT-PCR产物电泳图.
表2 大鼠CCl4性肝纤维化mmp-13基因表达水平 ( ±s)
±s)
分组
0 wk
2 wk
5 wk
7 wk
9 wk
12 wk
14 wk
, 百拇医药
对照组
0.49±0.13
0.55±0.11
0.56±0.20
0.58±0.18
0.57±0.15
0.49±0.14
0.59±0.09
模型组
0.50±0.18
0.54±0.18
0.58±0.13
, http://www.100md.com
0.56±0.12
0.61±0.10
0.51±0.08
0.60±0.15
2.2 mmp-13酶原蛋白的表达 正常大鼠肝内有mmp-13的酶原蛋白表达,整个实验过程中正常对照组和模型组mmp-13酶原蛋白表达均无显著性差异变化(P>0.05),模型组与正常组相比亦无明显差异(P>0.05) (表3,图3,4).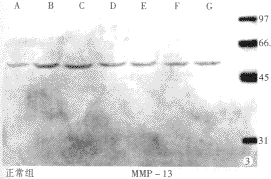
图3 正常组mmp-13 Wsestern blot转膜图.
图4 模型组mmp-13 Wsestern blot转膜图.
, 百拇医药
A,B,C,D,E,F,G分别代表0,2,5,7,9,12,14 wk,M为100 bp ladder marker, RT-PCR产物上带mmp-13,下带为GAPDH.
表3 大鼠CCl4性肝纤维化mmp-13蛋白表达水平 ( ±s,×103) 分组
±s,×103) 分组
0 wk
2 wk
5 wk
7 wk
9 wk
12 wk
, 百拇医药
14 wk
对照组
54.7±3.3
56.8±1.8
57.1±1.6
55.2±1.8
55.7±3.4
56.6±2.3
54.8±2.3
模型组
54.5±4.1
57.2±5.2
, 百拇医药
56.7±3.9
55.6±4.8
55.7±3.3
56.3±5.2
56.9±4.7
3 讨论
肝内基质金属蛋白酶(MMPs)直接参与调节ECM合成与降解的动态平衡,在肝纤维化发生、发展及形成过程中发挥着重要的作用. 既往实验表明,肝损伤或肝纤维化早期间质胶原酶活性常升高,但随着肝纤维化发展到中晚期直至肝硬变阶段,其活性进行性下降,ECM降解水平也明显下降. 而MMPs的调节基于4个水平即基因表达、酶原合成、酶原的活化以及金属蛋白酶组织抑制因子(TIMPs)的作用. 本研究表明间质胶原酶(mmp-13 in rat)在正常肝组织有表达,肝纤维化发生、发展、形成过程中及肝硬变阶段(14 wk左右)时mmp-13基因表达无显著性差异变化,其酶原蛋白表达水平与基因表达水平一致,在肝纤维化过程中及肝硬变阶段亦无明显改变. 另外,有研究证实[5]在肝纤维化过程中TIMPs表达逐渐增强,到肝硬变阶段到达最高峰. 可见,间质胶原酶在肝纤维化过程中的活性变化不是其基因或酶原蛋白表达水平变化造成的,而是与TIMPs的抑制作用和酶原活化过程有关. 肝纤维化早期酶原活化过程相对加强可能是导致mmp-13活性有所升高的主要原因,随着肝纤维化的发展,TIMPs的进行性升高使间质胶原酶活性下降,造成肝损伤后增生的ECM成分尤其是Ⅰ,Ⅲ型胶原降解减少,沉积增多,从而促进了肝纤维化乃至肝硬变的形成.注:广东省自然科学基金资助项目,No.960362
, 百拇医药
通讯作者 王宇
4 参考文献
1 Arthur MJP. Fibrosis and altered matrix degradation. Digestion, 1998;59:376-380
2 Montfort I, Perez-Tamayo R. Collagenase in exprimental carbon tetrachloride cirrhosis of the liver. Am J Pathol, 1978;92:411-420
3 Noonan KE, Beck C, Holzmayer TA. Quantitative analysis of MDR1 (multidrug resistance) gene expression in human tumors by polymerase chain reaction. Proc Natl Acad Sci USA, 1990;87:7160-7164
, 百拇医药
4 J.萨姆布鲁克,EF.弗里奇,T.曼尼阿蒂斯. 分子克隆实验指南. 第2版. 北京:科学出版社,1998:888-897
5 Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997;150:1647-1659
收稿日期 1999-07-21, 百拇医药
单位:中国人民解放军第一军医大学附属珠江医院肝胆外科 广东省广州市 510282
关键词:肝硬化;胶原酶;基因表达
世界华人消化杂志991133 中国图书馆分类号 R 575.2
Subject headings liver cirrhosis; collagenase; gene expression
肝纤维化是多种慢性肝损伤的不良结局,为慢性肝病向肝硬变发展的病理过程. 其实质是Ⅰ,Ⅲ为主的胶原纤维等细胞外基质(extracellular matrix, ECM)合成与降解失衡,导致在ECM肝内过度沉积而形成的. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一族参与降解ECM的主要水解蛋白酶,目前为止该家族至少已有20个成员,肝内发现了8种,其中间质胶原酶(interstitial collagenase,mmp-1 in human, mmp-13 in rat)主要参与Ⅰ,Ⅲ型胶原的降解,与肝纤维化的发生发展紧密相关[1]. 研究表明,肝损伤或肝纤维化早期间质胶原酶活性常升高,但随着肝纤维化的发展,其活性进行性下降,ECM降解水平也明显下降[2]. 其原因可能是基因表达及酶原合成减少或激活受到抑制以及其抑制因子的作用. 为了了解肝纤维化过程中mmp-13基因及酶原表达是否呈相应变化,我们应用四氯化碳(CCl4)建立大鼠肝纤维化模型,通过逆转录定量PCR方法及Western印迹法分别对肝内mmp-13 mRNA和酶原蛋白的表达水平作了检测,现报道如下.
, 百拇医药
1 材料和方法
1.1 材料 清洁型Wistar ♂大鼠120只,体质量200 g~300 g,第一军医大学实验动物中心提供. CCl4为汕头化工厂产品,含量>99.5%. 总RNA提取试剂盒(Trizol reagent)、M-MLV逆转录酶、RNA酶抑制剂均为Gibco产品;Oligo(dT)15 primers,PCR marker及琼脂糖为Promega公司产品;TAG酶为Sangon公司产品. Bio-Rad蛋白抽提及定量试剂盒为Bio-Rad产品,mmp-13多克隆抗体由美国(NIH) William G.Stetler-Stevenson惠赠. 辣根过氧化物酶标二抗(羊抗兔IgG-HRP),SABC产品. PCR仪为珠海黑马公司产品;电转膜仪,Bio-Rad公司产品;凝胶成象系统系第一军医大学中心实验室提供的Gel Documentarion Analysis System, GDAS.
1.2 方法 ①肝纤维化模型制备:参照Montfort et al[2]方法,400 mL/ L CCl4花生油溶液按2 mL/ kg予Wistar大鼠ip,2次/ wk,共12 wk. 120只大鼠分模型组和正常对照组,模型组70只,按上述方法造模;正常对照组50只,用相应量生理盐水ip. 在0,2,5,7,9,12,14 wk时对照组活杀7只,模型组活杀10只,切取肝脏,除留作常规HE,VG染色外,其余迅速投入液氮,之后转入-70℃保存. ②肝组织总RNA提取:按照Trizol reagent说明书进行,紫外分光光度计检测总RNA纯度和定量,A260/ A280值须在1.8~2.0之间. ③cDNA的合成:采用20 μL逆转录反应体系. 其中含待测总RNA 1 μg,M-MLV 200 U,Oligo(dT) (15 primer) 50 mg/ L,4×dNTP (10 mmol/ L) 2 μL,5×RT buffer 4 μL,RNA酶抑制剂20 U,无RNase酶水补至20 μL. 37℃反应60min,95℃灭活M-MLV酶5min. ④共扩增PCR:根据Genebank资料自行设计引物(表1). 参照Noonan et al[3]方法进行共扩PCR,设GAPDH为内参照. PCR体系为50 μL,包含cDNA 10 μL,5×buffer 10 μL,4×dNTP (10 mmol/ L) 1 μL,mmp-13,GAPDH上下游引物(12.5 μmol/ L)各2 μL,TAG酶2 U,用水补至50 μL. PCR反应参数为:95℃预变性5min,94℃变性50s,56℃退火70s,72℃延伸90s,选定30个循环,最后72℃再延伸7min. mmp-13的PCR产物经测序证实为大鼠mmp-13的基因序列. PCR产物在20 g/ L琼脂糖凝胶上进行电泳后经GDAS系统扫描定量分析,用mmp-13/ GAPDH比值表示mmp-13相对表达水平. ⑤蛋白质的提取及定量:参考Bio-Rad试剂盒说明书进行,并根据各个样品蛋白质A595值的差异行标准化处理. 取等量变性后的标准化蛋白溶液,进行Western印迹[4],SDS聚丙烯酰胺凝胶电泳,每孔上样量为25 μL,并以电转膜仪将蛋白转移至硝酸纤维素膜(90mA, 1 h),经丽春红S染色鉴定并标记标准蛋白位置,再以50 g/ L脱脂奶粉封闭、一抗及二抗温育、DAB显色. 硝酸纤维素膜显色条带为Mr 54 000的mmp-13酶原蛋白,将结果照相并扫描定量分析.
, http://www.100md.com
表1 引物序列
引物名称
上游引物序列
下游引物序列
扩增产物长度
MMP-13
5'-TACCTACACTGGCAAAAGCC-3'
5'-ATGTCATACCCATTCAGGGCC-3'
354 bp
GAPDH
5'-GACATCAAGAAGGTGGTGAAGC-3'
, http://www.100md.com
5'-TGTCATTGAGAGCAATGCCAGC-3'
148 bp
统计学处理 实验结果以
 ±s表示. 组内、组间比较采用单因素方差分析方法.
±s表示. 组内、组间比较采用单因素方差分析方法.2 结果
2.1 mmp-13基因的表达 正常大鼠肝内有mmp-13的基因表达,整个实验过程中正常对照组和模型组mmp-13基因表达均无显著性差异变化(P>0.05),模型组与正常组相比亦无明显差异(P>0.05) (表2,图1,2).

图1 正常组mmp-13 RT-PCR产物电泳图.

, 百拇医药
图2 模型组mmp-13 RT-PCR产物电泳图.
表2 大鼠CCl4性肝纤维化mmp-13基因表达水平 (
 ±s)
±s)分组
0 wk
2 wk
5 wk
7 wk
9 wk
12 wk
14 wk
, 百拇医药
对照组
0.49±0.13
0.55±0.11
0.56±0.20
0.58±0.18
0.57±0.15
0.49±0.14
0.59±0.09
模型组
0.50±0.18
0.54±0.18
0.58±0.13
, http://www.100md.com
0.56±0.12
0.61±0.10
0.51±0.08
0.60±0.15
2.2 mmp-13酶原蛋白的表达 正常大鼠肝内有mmp-13的酶原蛋白表达,整个实验过程中正常对照组和模型组mmp-13酶原蛋白表达均无显著性差异变化(P>0.05),模型组与正常组相比亦无明显差异(P>0.05) (表3,图3,4).

图3 正常组mmp-13 Wsestern blot转膜图.

图4 模型组mmp-13 Wsestern blot转膜图.
, 百拇医药
A,B,C,D,E,F,G分别代表0,2,5,7,9,12,14 wk,M为100 bp ladder marker, RT-PCR产物上带mmp-13,下带为GAPDH.
表3 大鼠CCl4性肝纤维化mmp-13蛋白表达水平 (
 ±s,×103) 分组
±s,×103) 分组0 wk
2 wk
5 wk
7 wk
9 wk
12 wk
, 百拇医药
14 wk
对照组
54.7±3.3
56.8±1.8
57.1±1.6
55.2±1.8
55.7±3.4
56.6±2.3
54.8±2.3
模型组
54.5±4.1
57.2±5.2
, 百拇医药
56.7±3.9
55.6±4.8
55.7±3.3
56.3±5.2
56.9±4.7
3 讨论
肝内基质金属蛋白酶(MMPs)直接参与调节ECM合成与降解的动态平衡,在肝纤维化发生、发展及形成过程中发挥着重要的作用. 既往实验表明,肝损伤或肝纤维化早期间质胶原酶活性常升高,但随着肝纤维化发展到中晚期直至肝硬变阶段,其活性进行性下降,ECM降解水平也明显下降. 而MMPs的调节基于4个水平即基因表达、酶原合成、酶原的活化以及金属蛋白酶组织抑制因子(TIMPs)的作用. 本研究表明间质胶原酶(mmp-13 in rat)在正常肝组织有表达,肝纤维化发生、发展、形成过程中及肝硬变阶段(14 wk左右)时mmp-13基因表达无显著性差异变化,其酶原蛋白表达水平与基因表达水平一致,在肝纤维化过程中及肝硬变阶段亦无明显改变. 另外,有研究证实[5]在肝纤维化过程中TIMPs表达逐渐增强,到肝硬变阶段到达最高峰. 可见,间质胶原酶在肝纤维化过程中的活性变化不是其基因或酶原蛋白表达水平变化造成的,而是与TIMPs的抑制作用和酶原活化过程有关. 肝纤维化早期酶原活化过程相对加强可能是导致mmp-13活性有所升高的主要原因,随着肝纤维化的发展,TIMPs的进行性升高使间质胶原酶活性下降,造成肝损伤后增生的ECM成分尤其是Ⅰ,Ⅲ型胶原降解减少,沉积增多,从而促进了肝纤维化乃至肝硬变的形成.注:广东省自然科学基金资助项目,No.960362
, 百拇医药
通讯作者 王宇
4 参考文献
1 Arthur MJP. Fibrosis and altered matrix degradation. Digestion, 1998;59:376-380
2 Montfort I, Perez-Tamayo R. Collagenase in exprimental carbon tetrachloride cirrhosis of the liver. Am J Pathol, 1978;92:411-420
3 Noonan KE, Beck C, Holzmayer TA. Quantitative analysis of MDR1 (multidrug resistance) gene expression in human tumors by polymerase chain reaction. Proc Natl Acad Sci USA, 1990;87:7160-7164
, 百拇医药
4 J.萨姆布鲁克,EF.弗里奇,T.曼尼阿蒂斯. 分子克隆实验指南. 第2版. 北京:科学出版社,1998:888-897
5 Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997;150:1647-1659
收稿日期 1999-07-21, 百拇医药