实验性肝纤维化过程中明胶酶A基因表达的动态变化
作者:高 毅 王 宇 杨继震 黄宇琦
单位:中国人民解放军第一军医大学附属珠江医院肝胆外科 广东省广州市 510282
关键词:肝硬化;明胶酶A;基因表达
世界华人消化杂志991132 Subject headings liver corrhosis; gelatinase A; gene expression
中国图书馆分类号 R 575.2
肝纤维化的实质是Ⅰ,Ⅲ型为主胶原纤维等细胞外基质(extracellular matrix, ECM)合成与降解失衡,导致在ECM肝内过度沉积而形成的. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一族参与降解ECM的主要水解蛋白酶,目前为止该家族至少已有20个成员,肝内发现了8种. 其中明胶酶A(MMP-2),即Ⅳ型胶原酶,主要参与基底膜Ⅳ型胶原的代谢,与肝纤维化的发生发展紧密相关[1]. 为了了解肝纤维化过程中mmp-2基因变化,我们应用四氯化碳(CCl4)中毒性方法建立大鼠肝纤维化模型,通过逆转录定量PCR方法对肝内mmp-2 mRNA的表达水平作了检测,现报道如下.
, 百拇医药
1 材料和方法
1.1 材料 清洁型Wistar ♂大鼠120只,体质量180 g~300 g,第一军医大学实验动物中心提供. CCl4为汕头化工厂产品,含量>99.5%. 总RNA提取试剂盒(Trizol reagent)、M-MLV逆转录酶、RNA酶抑制剂为Gibco产品;Oligo(dT) 15 primers, PCR marker及琼脂糖为Promega公司产品;DEPC,TAG酶为Sangon公司产品. PCR仪为珠海黑马公司产品;台式低温冷冻离心机为Heraeus德国公司产品;凝胶成象分析系统系第一军医大学中心实验室提供的Gel Documentarion Analysis System, GDAS.
1.2 方法 ①肝纤维化模型制备:参照Takahara et al[2]方法,50 mL/ L CCl4蓖麻油溶液按2 mL/ kg体重予Wistar大鼠,sc,2次/ wk,共14 wk. 120只大鼠分模型组和正常对照组,模型组70只,按上述方法造模;正常对照组50只,用相应量蓖麻油腔皮下注射. 在0,2,5,7,9,12,14 wk时对照组活杀7只,模型组活杀10只,切取肝脏,除留作常规HE,VG染色外,其余迅速投入液氮,之后转入-70℃保存. ②肝组织总RNA提取:按照Trizol reagent说明书进行,紫外分光光度计检测总RNA纯度和定量,A260/ A280值须在1.8~2.0之间. ③cDNA的合成:采用20 μL逆转录反应体系. 其中含待测总RNA 1 μg,M-MLV 200 U,Oligo(dT)(15 primer)50 mg/ L,dNTP(10 mmol/ L)2 μL,5×RT buffer 4 μL,RNA酶抑制剂20 U,无RNase酶水补至20 μL. 37℃反应60min,95℃灭活M-MLV酶5min. ④共扩增PCR:根据Genebank资料自行设计以下引物(表1). 参照Noonan et al[3]方法进行共扩PCR,设GAPDH为内参照. PCR体系为50 μL,包含cDNA 10 μL,5×buffer 10 μL,4×dNTP(10 mmol/ L)1 μL,mmp-2,GAPDH上下游引物(12.5 μmol/ L)各2 μL,TAG酶2 U,用水补至50 μL. PCR反应参数为:95℃预变性4min,94℃变性50s,56℃退火60s,72℃延伸80s,选定30个循环,最后72℃再延伸7min. mmp-2的PCR产物经测序证实为大鼠mmp-2的基因序列. PCR产物在20 g/ L琼脂糖凝胶上进行电泳后经GDAS系统扫描定量分析,用mmp-2/ GAPDH比值表示mmp-2相对表达水平.
, 百拇医药
统计学处理 实验结果以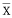 ±s表示. 组内、组间比较采用单因素方差分析方法.
±s表示. 组内、组间比较采用单因素方差分析方法.
2 结果
正常大鼠肝内有mmp-2基因的表达,整个实验过程中对照组mmp-2基因表达无显著性差异变化,模型组大鼠随肝纤维化的发展(2,5,7,9 wk)mmp-2基因表达逐渐增强,至肝纤维化中期(9 wk)达到高峰,肝纤维化晚期(12 wk)及肝硬变阶段(14 wk)又逐步下降,但仍高于对照组的表达水平(表2,图1,2).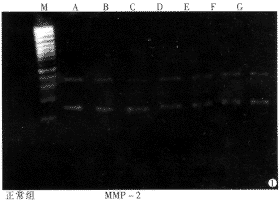
图1 对照组mmp-2 RT-PCR产物电泳图.
, 百拇医药
图2 模型组mmp-2 RT-PCR产物电泳图.
A,B,C,D,E,F,G分别代表0,2,5,7,9,12,14 wk,M为100 bp ladder marker, RT-PCR产物上带mmp-2,下带为GAPDH.
表1 引物序列 引物
名称
上游引物序列
下游引物序列
扩增产
物长度
MMP-2
5'-TTCTTCAAGGACCGGTTTATTTGG-3'
, 百拇医药
5'-CTTCTTCACTTCATTGTATCTCCA-3'
330 bp
GAPDH
5'-GACATCAAGAAGGTGGTGAAGC-3'
5'-TGTCATTGAGAGCAATGCCAGC-3'
148 bp
表2 CCl4中毒性大鼠肝纤维化mmp-2基因表达的变化 (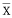 ±s) 分组
±s) 分组
0 wk
2 wk
, http://www.100md.com
5 wk
7 wk
9 wk
12 wk
14 wk
对照组
0.36±0.05
0.35±0.07
0.32±0.05
0.36±0.04
0.34±0.08
0.31±0.04
, 百拇医药
0.35±0.07
模型组
0.31±0.03
1.02±0.22b
1.65±0.52b
2.73±0.48b
4.03±0.62b
3.25±0.54b
1.26±0.34b
bP<0.01,vs 正常对照组;vs前期.
, 百拇医药
3 讨论
肝内基质金属蛋白酶(MMPs)直接参与调节ECM合成与降解的动态平衡,在肝纤维化发生、发展及形成过程中发挥着重要的作用. 明胶酶A即Ⅳ型胶原酶,是金属蛋白酶家族的主要成员之一,主要降解基底膜Ⅳ型胶原及明胶(变性胶原). 本实验研究表明明胶酶A(mmp-2)在正常肝组织有表达,肝纤维化发生、发展过程中mmp-2基因表达逐渐增强,至肝纤维化中期达到高峰,肝纤维化晚期及肝硬变阶段又逐步下降,但仍高于正常对照的表达水平. 这与有关Ⅳ型胶原酶在肝纤维化过程中的活性变化研究结果是一致的[4]. 正是由于mmp-2这类破坏基底膜样胶原的胶原酶可降解正常肝脏结缔组织,所以其表达增高,会加强Disse腔内皮下基质的降解,破坏肝小叶排列,影响细胞与基质、细胞与细胞间的正常关系而促使肝纤维化的形成. mmp-2基因表达调控机制目前尚不完全清楚,肝纤维化过程中高表达的转化生长因子β(TGFβ)对mmp-2的正性调节作用及早期肝损伤某些炎性因子的作用可能是mmp-2表达升高的机制之一. 肝硬变阶段的mmp-2表达较肝纤维化中期有所下降,其原因可能是此时胶原的代谢活动已较肝纤维化阶段缓慢,机体通过自身的反馈调节使mmp-2表达下降. 另外,有研究证实[5]在肝纤维化过程中金属蛋白酶组织抑制因子(TIMPs)表达逐渐增强,到肝硬变阶段到达最高峰. 随着肝纤维化的发展,TIMPs的进行性升高使包括明胶酶A在内的MMPs活性下降,造成肝损伤后增生的ECM成分降解减少,沉积增多,从而促进了肝纤维化乃至肝硬变的形成. 关于mmp-2在肝纤维化发病机制中的意义还有待于进一步探讨.
, 百拇医药
注:广东省自然科学基金资助项目,No.960362
通讯作者 高毅
4 参考文献
1 Arthur MJP. Fibrosis and altered matrix degradation. Digestion, 1998;59:376-380
2 Takahara T, Kojima T, Miyabayashi C, Inoue K, Sasaki H, Muragaki Y. Collagen production in fat-storing cells after carbon tetrachioride intoxication in the rat. Immunoelectron microscopic observation of type Ⅰ, type Ⅲ collagens and prolyl hydroxylase. Lab Invest, 1988;59:509-521
, http://www.100md.com
3 Noonan KE, Beck C, Holzmayer TA. Quantitative analysis of MDR1 (multidrug resistance) gene expression in human tumors by polymerase chain reaction. Proc Natl Acad Sci USA, 1990;87:7160-7164
4 王爱民,杨跃伟,张斌,张继友,梁保忠,孙志军. 实验性肝纤维化过程中Ⅳ型胶原酶活性的研究. 中华肝脏病杂志,1998;6:98-99
5 Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997;150:1647-1659
收稿日期 1999-07-21, 百拇医药
单位:中国人民解放军第一军医大学附属珠江医院肝胆外科 广东省广州市 510282
关键词:肝硬化;明胶酶A;基因表达
世界华人消化杂志991132 Subject headings liver corrhosis; gelatinase A; gene expression
中国图书馆分类号 R 575.2
肝纤维化的实质是Ⅰ,Ⅲ型为主胶原纤维等细胞外基质(extracellular matrix, ECM)合成与降解失衡,导致在ECM肝内过度沉积而形成的. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一族参与降解ECM的主要水解蛋白酶,目前为止该家族至少已有20个成员,肝内发现了8种. 其中明胶酶A(MMP-2),即Ⅳ型胶原酶,主要参与基底膜Ⅳ型胶原的代谢,与肝纤维化的发生发展紧密相关[1]. 为了了解肝纤维化过程中mmp-2基因变化,我们应用四氯化碳(CCl4)中毒性方法建立大鼠肝纤维化模型,通过逆转录定量PCR方法对肝内mmp-2 mRNA的表达水平作了检测,现报道如下.
, 百拇医药
1 材料和方法
1.1 材料 清洁型Wistar ♂大鼠120只,体质量180 g~300 g,第一军医大学实验动物中心提供. CCl4为汕头化工厂产品,含量>99.5%. 总RNA提取试剂盒(Trizol reagent)、M-MLV逆转录酶、RNA酶抑制剂为Gibco产品;Oligo(dT) 15 primers, PCR marker及琼脂糖为Promega公司产品;DEPC,TAG酶为Sangon公司产品. PCR仪为珠海黑马公司产品;台式低温冷冻离心机为Heraeus德国公司产品;凝胶成象分析系统系第一军医大学中心实验室提供的Gel Documentarion Analysis System, GDAS.
1.2 方法 ①肝纤维化模型制备:参照Takahara et al[2]方法,50 mL/ L CCl4蓖麻油溶液按2 mL/ kg体重予Wistar大鼠,sc,2次/ wk,共14 wk. 120只大鼠分模型组和正常对照组,模型组70只,按上述方法造模;正常对照组50只,用相应量蓖麻油腔皮下注射. 在0,2,5,7,9,12,14 wk时对照组活杀7只,模型组活杀10只,切取肝脏,除留作常规HE,VG染色外,其余迅速投入液氮,之后转入-70℃保存. ②肝组织总RNA提取:按照Trizol reagent说明书进行,紫外分光光度计检测总RNA纯度和定量,A260/ A280值须在1.8~2.0之间. ③cDNA的合成:采用20 μL逆转录反应体系. 其中含待测总RNA 1 μg,M-MLV 200 U,Oligo(dT)(15 primer)50 mg/ L,dNTP(10 mmol/ L)2 μL,5×RT buffer 4 μL,RNA酶抑制剂20 U,无RNase酶水补至20 μL. 37℃反应60min,95℃灭活M-MLV酶5min. ④共扩增PCR:根据Genebank资料自行设计以下引物(表1). 参照Noonan et al[3]方法进行共扩PCR,设GAPDH为内参照. PCR体系为50 μL,包含cDNA 10 μL,5×buffer 10 μL,4×dNTP(10 mmol/ L)1 μL,mmp-2,GAPDH上下游引物(12.5 μmol/ L)各2 μL,TAG酶2 U,用水补至50 μL. PCR反应参数为:95℃预变性4min,94℃变性50s,56℃退火60s,72℃延伸80s,选定30个循环,最后72℃再延伸7min. mmp-2的PCR产物经测序证实为大鼠mmp-2的基因序列. PCR产物在20 g/ L琼脂糖凝胶上进行电泳后经GDAS系统扫描定量分析,用mmp-2/ GAPDH比值表示mmp-2相对表达水平.
, 百拇医药
统计学处理 实验结果以
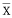 ±s表示. 组内、组间比较采用单因素方差分析方法.
±s表示. 组内、组间比较采用单因素方差分析方法.2 结果
正常大鼠肝内有mmp-2基因的表达,整个实验过程中对照组mmp-2基因表达无显著性差异变化,模型组大鼠随肝纤维化的发展(2,5,7,9 wk)mmp-2基因表达逐渐增强,至肝纤维化中期(9 wk)达到高峰,肝纤维化晚期(12 wk)及肝硬变阶段(14 wk)又逐步下降,但仍高于对照组的表达水平(表2,图1,2).

图1 对照组mmp-2 RT-PCR产物电泳图.

, 百拇医药
图2 模型组mmp-2 RT-PCR产物电泳图.
A,B,C,D,E,F,G分别代表0,2,5,7,9,12,14 wk,M为100 bp ladder marker, RT-PCR产物上带mmp-2,下带为GAPDH.
表1 引物序列 引物
名称
上游引物序列
下游引物序列
扩增产
物长度
MMP-2
5'-TTCTTCAAGGACCGGTTTATTTGG-3'
, 百拇医药
5'-CTTCTTCACTTCATTGTATCTCCA-3'
330 bp
GAPDH
5'-GACATCAAGAAGGTGGTGAAGC-3'
5'-TGTCATTGAGAGCAATGCCAGC-3'
148 bp
表2 CCl4中毒性大鼠肝纤维化mmp-2基因表达的变化 (
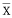 ±s) 分组
±s) 分组0 wk
2 wk
, http://www.100md.com
5 wk
7 wk
9 wk
12 wk
14 wk
对照组
0.36±0.05
0.35±0.07
0.32±0.05
0.36±0.04
0.34±0.08
0.31±0.04
, 百拇医药
0.35±0.07
模型组
0.31±0.03
1.02±0.22b
1.65±0.52b
2.73±0.48b
4.03±0.62b
3.25±0.54b
1.26±0.34b
bP<0.01,vs 正常对照组;vs前期.
, 百拇医药
3 讨论
肝内基质金属蛋白酶(MMPs)直接参与调节ECM合成与降解的动态平衡,在肝纤维化发生、发展及形成过程中发挥着重要的作用. 明胶酶A即Ⅳ型胶原酶,是金属蛋白酶家族的主要成员之一,主要降解基底膜Ⅳ型胶原及明胶(变性胶原). 本实验研究表明明胶酶A(mmp-2)在正常肝组织有表达,肝纤维化发生、发展过程中mmp-2基因表达逐渐增强,至肝纤维化中期达到高峰,肝纤维化晚期及肝硬变阶段又逐步下降,但仍高于正常对照的表达水平. 这与有关Ⅳ型胶原酶在肝纤维化过程中的活性变化研究结果是一致的[4]. 正是由于mmp-2这类破坏基底膜样胶原的胶原酶可降解正常肝脏结缔组织,所以其表达增高,会加强Disse腔内皮下基质的降解,破坏肝小叶排列,影响细胞与基质、细胞与细胞间的正常关系而促使肝纤维化的形成. mmp-2基因表达调控机制目前尚不完全清楚,肝纤维化过程中高表达的转化生长因子β(TGFβ)对mmp-2的正性调节作用及早期肝损伤某些炎性因子的作用可能是mmp-2表达升高的机制之一. 肝硬变阶段的mmp-2表达较肝纤维化中期有所下降,其原因可能是此时胶原的代谢活动已较肝纤维化阶段缓慢,机体通过自身的反馈调节使mmp-2表达下降. 另外,有研究证实[5]在肝纤维化过程中金属蛋白酶组织抑制因子(TIMPs)表达逐渐增强,到肝硬变阶段到达最高峰. 随着肝纤维化的发展,TIMPs的进行性升高使包括明胶酶A在内的MMPs活性下降,造成肝损伤后增生的ECM成分降解减少,沉积增多,从而促进了肝纤维化乃至肝硬变的形成. 关于mmp-2在肝纤维化发病机制中的意义还有待于进一步探讨.
, 百拇医药
注:广东省自然科学基金资助项目,No.960362
通讯作者 高毅
4 参考文献
1 Arthur MJP. Fibrosis and altered matrix degradation. Digestion, 1998;59:376-380
2 Takahara T, Kojima T, Miyabayashi C, Inoue K, Sasaki H, Muragaki Y. Collagen production in fat-storing cells after carbon tetrachioride intoxication in the rat. Immunoelectron microscopic observation of type Ⅰ, type Ⅲ collagens and prolyl hydroxylase. Lab Invest, 1988;59:509-521
, http://www.100md.com
3 Noonan KE, Beck C, Holzmayer TA. Quantitative analysis of MDR1 (multidrug resistance) gene expression in human tumors by polymerase chain reaction. Proc Natl Acad Sci USA, 1990;87:7160-7164
4 王爱民,杨跃伟,张斌,张继友,梁保忠,孙志军. 实验性肝纤维化过程中Ⅳ型胶原酶活性的研究. 中华肝脏病杂志,1998;6:98-99
5 Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol, 1997;150:1647-1659
收稿日期 1999-07-21, 百拇医药