内毒素血症 细胞因子 一氧化氮在重度失血性休克发展中的作用
作者:朱华栋 周玉淑 于学忠 邵孝
单位:朱华栋 周玉淑 于学忠 邵孝 中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730
关键词:休克,失血性;内毒素;肿瘤坏死因子;白细胞介素6;白细胞介素8;一氧化氮
中国急救医学991101朱华栋 周玉淑 于学忠 邵孝
摘要:目的 探讨内毒素血症、细胞因子、NO在重度失血性休克发展过程中的作用和机制。方法 选用大白兔26只,分为失血性休克组(14只),对照组(12只),休克组观察休克前后血浆内毒素、TNFα、IL-6、IL-8、NO的动态变化,对照组观察手术前后上述指标的变化,两组动物均观察24小时、48小时存活率。结果 大白兔发生失血性休克后血浆内毒素、TNFα、IL-6、IL-8、NO的水平与休克前及对照组比较有明显升高,死亡动物中血浆上述物质水平显著高于存活动物。结论 内毒素血症、细胞因子、NO等发挥重要的协同作用,促使失血性休克向不可逆方向进展。
, http://www.100md.com
中图分类号:R 631.4;R 605.971
文献标识码:A
文章编号:1002-1949(1999)11-0639-03
Studies on role of endotoximia, cytokines and nitric oxide in the development of prolonged hemorrhagic shock
ZHU Hua-dong, ZHOU Yu-shu, YU Xue-zhong, et al.
Department of Emergency, Peking Union Medical College Hospital, Beijing 100730, China
, 百拇医药
Abstract Objective To study the role of the mechanism of endotoxin, cytokines, NO in the development of prolonged hemorrhagic shock. Methods 26 rabbits were randomly divided into hemorrhagic shock group(14 rabbits), control group(12 rabbits). After establishing hemorrhagic shock model of rabbits, plasma levels of endotoxin, TNFα, IL-6, IL-8 and NO were detected at preshock and postshock. The survival rates of 24 h and 48 h were observed. Results The plasma levels of endotoxin, TNFα, IL-6, IL-8 and NO were markedly higher after shock than those of before shock and control group, and maintained at high level. The plasma levels of endotoxin, cytokines and NO in nonsurvivors were higher than those of surviving animals. Conclusions The endotoxin, cytokines and NO play an important role in the development of prolonged hemorrhagic shock.
, 百拇医药
Key words Shock, hemorrhagic; Endotoxin; Tumor necrosis factor; Interleukin-6; Interleukin-8; Nitric oxide
失血性休克是由于机体血容量丢失过多而引起的休克,经采取补液、输血等措施将血容量补足后,大多可得以纠正,但有部分患者却因为失血量大,救治不及时而发展成重度不可逆性休克,此时虽经应用各种措施积极治疗,仍会出现多器官功能衰竭,以至死亡。休克由可逆向不可逆转化是一个很复杂的病理过程,其中有许多因素参与,本研究拟从失血性休克后的内毒素血症以及血浆细胞因子、一氧化氮的动态变化着手,来探讨它们各自在失血性休克发展中的作用,从而为以后的临床治疗提供理论依据。
1 资料与方法
1.1 实验动物 新西兰大白兔26只由北京协和医院动物房提供,4~6月龄,雌雄各半,体重2.76±0.40 kg(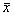 ±s),随机分成两组:失血性休克组14只,对照组12只,动物在实验前禁食12小时,禁水8小时。
±s),随机分成两组:失血性休克组14只,对照组12只,动物在实验前禁食12小时,禁水8小时。
, 百拇医药
1.2 实验步骤 失血性休克组经股动脉放血制作失血性休克模型。大白兔用3%戊巴比妥钠溶液30 mg/kg腹腔麻醉成功后,行右侧股动、静脉插管术,动脉插管接换能器与多功能监护仪连接,监测平均动脉压(MAP),静脉插管用作补液和留取血标本,上述手术完成后,静脉注射肝素6 mg/kg将大白兔全身肝素化后,经右股动脉快速放血(约10分钟)使MAP降至4~4.66 kPa(30~35 mmHg),维持120分钟,然后回输全部失血及等量的林格氏液进行复苏,复苏需30分钟,以后用5%葡萄糖盐水以2.5 ml.kg-1.h-1的速度静脉维持点滴。对照组动物仅做股动、静脉插管及全身肝素化,未行放血。
1.3 观察指标 休克组分别在休克前、休克末、复苏末、复苏后0.5小时、2小时、4小时记录MAP的变化,并测定血浆中内毒素、TNF α、IL-6、IL-8、NO的水平。对照组则在手术前、术后2 h、2.5 h、3 h、4.5 h、6.5 h测定血浆中上述指标。两组动物均观察24、48小时存活率。
, 百拇医药
1.4 检测方法 内毒素的测定采用显色鲎试剂定量测定法;TNF α、IL-6、IL-8的测定均用ELISA法;NO的测定采用Griess重氮化反应法。
1.5 统计学处理 组间相同指标的比较用单因素方差分析,组内不同条件下同一指标比较用无重复数据的两因素方差分析,均数两两比较采用q检验;不同指标间的相关性用直线相关分析,相关系数的显著性用t检验;率的比较用χ2检验。以P<0.05表示差异显著,有统计学意义。
2 结果
2.1 两组动物血浆内毒素、细胞因子、NO的变化 发生休克后,血浆中内毒素、TNFα、IL-6、IL-8、NO水平明显升高,而对照组则无明显变化,见表1、表2。
, 百拇医药
表1 休克组动物不同时点血浆内毒素、TNFα、IL-6、IL-8、NO变化(x±s)
休克前
休克末
复苏末
复苏后0.5 h
复苏后2 h
复苏后4 h
内毒素(Eu/ml)
0.139±0.039
0.53±0.096*
0.809±0.148*
, 百拇医药
0.841±0.158*
0.622±0.127*
0.519±0.133*
TNFα(ng/L)
19.09±4.17
70.31±10.4*
79.46±10.74*
76.21±9.73*
69.09±11.04*
, 百拇医药 65.99±11.72*
IL-6(ng/L)
10.94±2.54
12.1±2.36
25.2±5.29*
53.07±10.76*
80.1±15.78*
69.25±13.56*
IL-8(ng/L)
44.3±7.89
, http://www.100md.com
48.3±8.1
68.3±11.1*
154.3±30.6*
255.5±60.8*
226±53.2*
NO(μmol/L)
22±4.08
66.06±11.03*
76.59±10.52*
90.02±9.24*
, 百拇医药
82.82±9.46*
75.31±10.26*
与休克前比较,*P<0.01。表2 对照组动物不同时点血浆内毒素、TNFα、IL-6、IL-8、NO变化(x±s)
手术前
术后2 h
术后2.5 h
术后3 h
术后4.5 h
术后6.5 h
内毒素(Eu/ml)
, 百拇医药
0.141±0.042
0.145±0.037
0.148±0.035
0.151±0.037
0.152±0.034
0.149±0.037
TNFα(ng/L)
19.7±4.86
21.16±5.04
21.69±4.30
23.53±5.26
, http://www.100md.com
24.02±4.29
21.45±4.42
IL-6(ng/L)
9.95±3.65
10.33±4.01
10.72±3.94
12.41±4.11
11.85±3.34
10.59±3.22
IL-8(ng/L)
49.79±6.97
, http://www.100md.com
52.55±6.72
53.25±6.54
50.85±7.91
51.01±7.25
50.74±5.71
NO(μmol/L)
21.89±4.04
24.03±4.03
22.23±3.48
23.5±3.81
25.05±4.37
, 百拇医药
22.34±2.03
2.2 休克组动物血浆细胞因子、NO水平与内毒素水平的相关分析 休克组血浆TNFα、IL-6、IL-8、NO水平分别与内毒素水平呈显著相关(r=0.928,P<0.01;r=0.890,P<0.01;r=0.858,P<0.01;r=0.863,P<0.01)。
2.3 休克组动物IL-6、IL-8、NO水平与TNFα水平的相关分析 休克组血浆IL-6、IL-8、NO水平与TNFα水平呈显著相关(r=0.917,P<0.01;r=0.831,P<0.01;r=0.826,P<0.01)。
2.4 两组动物的预后 对照组动物48小时全部存活;休克组动物24小时存活7支,存活率为50%,48小时存活4只,存活率28.06%,死亡动物血浆中内毒素、TNFα、IL-6、IL-8、NO的水平与存活动物比较有明显差异,见表3。表3 休克组中存活动物和死亡动物血浆内毒素、细胞因子、NO水平比较(x±s)
, 百拇医药
存活动物
死亡动物
内毒素(Eu/ml)
0.685±0.16
0.905±0.111*
TNFα(ng/L)
66.1±14.19
85.11±6.27#
IL-6(ng/L)
66.1±14.19
85.68±13.07*
, 百拇医药
IL-8(ng/L)
205.5±5.8
275.5±61.4*
NO(μmol/L)
80.7±8.61
93.75±6.67#
与存活动物比较,*P<0.05;#P<0.01。
3 讨论
近来,一系列对失血性休克进行的动物和临床实验研究均证实:一定时限的失血性休克能够引起肠道细菌、内毒素移位发生菌血症、内毒素血症[1],其中内毒素血症比菌血症可能具有更重要的意义。
, 百拇医药
本实验结果显示:兔发生失血性休克后,血浆内毒素水平明显升高,复苏后0.5小时达高峰,其内毒素水平与大白兔的预后明显相关,表明内毒素血症在休克的发展中起着重要的作用。许多研究证实:应用内毒素拮抗剂如多粘菌素B、杀菌性/通透性增强蛋白质(BPI)或抗内毒素抗体来对抗或消除休克后的内毒素血症,可提高失血性休克动物存活率[2,3]。
目前认为失血性休克后的内毒素血症主要是肠道细菌、内毒素移位的结果。正常情况下,肠道能保护机体免受肠腔内细菌、内毒素的侵袭,主要依靠其完好的机械屏障、生态屏障、免疫屏障。当发生失血性休克后,由于肠粘膜缺血和复苏后的再灌注损伤,可以直接破坏肠道机械屏障的完整性,造成肠粘膜通透性增加[4],使细菌、毒素能够透过肠道屏障发生移位,而休克的打击还可引起肠道菌群失调,使革兰氏阴性细菌得以过度繁殖,更是促进了肠道细菌移位的发生。另外发生休克后肠道粘膜局部的免疫功能受损,及机体的网状内皮系统受到抑制,不能有效地清除致病菌侵入,也是促使细菌、内毒素发生移位的一个重要因素。
, 百拇医药
针对机体发生失血性休克后常伴有内源性内毒素血症,Deitch提出了“二次打击”假说,认为机体在受到任何一种损伤后往往处于一种致敏状态,任何一种继发性损伤,即使作用轻微,但只要超过宿主的清除能力,则可引起一系列的放大的连锁反应[5]。已有研究证实:失血性休克增加了机体对内毒素的致敏作用[6],可能使体内单核-巨噬细胞系统、中性粒细胞等处于致敏状态,随着休克后大量内毒素进入体内,则使休克致敏的细胞进一步激活,产生一种明显放大的炎症反应,加重器官功能受损。
本研究发现:兔发生失血性休克后,血浆TNFα、IL-6、IL-8明显升高,而且其水平与血浆内毒素水平呈明显的正相关,与兔的预后亦有相关性。许多研究表明:内毒素是刺激休克后细胞因子生成的重要因素,而拮抗内毒素治疗能明显抑制失血性休克时体内细胞因子的产生。失血性休克后,内毒素大量入侵,激活巨噬细胞,引起TNFα、IL-1、IL-6、IL-8等炎性因子大量释放。在本研究中TNFα在休克末即明显升高,复苏末达高峰,而IL-6、IL-8在复苏后0.5小时始升高,于复苏后2小时达高峰,且休克组血浆IL-6、IL-8水平与TNFα水平呈正相关。Ayala等的研究发现,失血性休克发生30分钟后,TNFα水平已开始升高[7],这表明TNFα可能是炎性介质链锁反应中最早的启动因子。TNFα主要参与机体炎症过程和免疫过程,它能激活中性粒细胞,引起中性粒细胞的趋化、聚集和粘附于血管内皮细胞,导致内皮细胞受损,它还可以诱导IL-6、IL-8等其他细胞因子的瀑布样释放。IL-6由单核细胞和纤维细胞分泌,它可以刺激活化B细胞增殖及其免疫球蛋白的转录和生成,能刺激肝细胞产生一系列的急性期蛋白,Wang等发现创伤失血性休克后肠道通透性增加与肠道局部和全身IL-6合成上调有关[8]。IL-8由单核-巨噬细胞、内皮细胞生成,IL-8对粒细胞有强大的趋化性,能使粒细胞脱颗粒,释放溶酶体酶、蛋白水解酶、氧自由基等,能刺激单核巨噬细胞、中性粒细胞分泌多种炎性介质。上述这些因子相互激发、协同作用,导致全身炎症反应,最终造成组织损害。
, 百拇医药
NO是极强的血管舒张因子,它在休克的发生发展过程中起着重要的作用,其生成增多被认为是造成休克顽固性低血压的主要因素[9]。本研究发现:失血性休克末血浆NO水平即明显升高,复苏后2小时达峰值,以后仍维持在高水平。内毒素、炎性因子使诱导型一氧化氮合酶(iNOS)活性增加是失血性休克后NO大量生成的主要原因。NO除了松弛血管平滑肌引起血管扩张外,还具有细胞毒性,可以灭活与能量代谢或抗氧化有关的酶;可以抑制非血红素铁-硫酶,干扰能量代谢和DNA合成;可以与超氧阴离子反应生成具有强氧化性的过氧化亚硝酸根(ONOO-),对组织、细胞造成损害[10]。另外,过量的NO还有负性肌力作用,使心功能受抑。NO的上述病理作用在休克向不可逆转化过程中起着重要作用。
总之,在重度失血性休克的发生发展过程中,有许多因素参与其中,而肠源性内毒素血症、细胞因子、NO等相互激发、相互影响,在这一过程中起着重要的协同作用。应想方设法来对抗或消除这些因素的作用,争取为该类休克的治疗带来突破。
, 百拇医药
作者单位: 朱华栋 周玉淑 于学忠 邵孝 中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730
中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730
参考文献
[1]Jiang JX, Bahrami S, Leichtfried G, et al. Kinetics of endotoxin and tumor necrosis factor appearance in portal and system circulation after hemorrhagic shock in rats[J]. Ann Surg, 1995, 221(1):100-106.
[2]Yao YM, Bahrami S, Leichtfried G, et al. Pathogensis of hemorrhage-induced bacteria/endotoxin translocation in rats: Effects of recombinant bactericidal-increasing protein(rBPI21)[J]. Ann Surg, 1995, 221: 398-405.
, http://www.100md.com
[3]Bahrami S, Yao YM, Leichtfried G, et al. Monocolnal antibody to endotoxin attenuates hemorrhage-induced lung injury and mortality in rats[J]. Crit Care Med, 1997, 25: 1030-1036.
[4]Russell DH, Barreto JC, Klemm K, et al. Hemorrhagic shock increases gut macromolecular permeability in the rat[J]. Shock, 1995, 4: 50.
[5]Deitch EA. Multiple organ failure: Pathophysiology and potential future therapy[J]. Ann Surg, 1992, 216: 117.
, http://www.100md.com
[6]Mileski WJ, Winn RK, Harlan JM, et al. Sensitivity to endotoxin in rabbits is incresed after hemorrhagic shock[J]. J Appl Phsiol, 1992, 73(3): 1146-1149.
[7]Ayala A, Perrin MM, Meldrum DR, et al. Hemorrhage induced an increase in serum TNF which is not associated with elevated levels of endotoxin[J]. Cytokine, 1990, 2:170.
[8]Wang W, Smail N, Wang P, et al. Increased gut permeability after hemorrhage is associated with upregulation of local and systemic IL-6[J]. J Surg Res, 1998, 79: 39.
, http://www.100md.com
[9]Yao YM, Bahrami S, Leichtfried G, et al. Significance of NO in hemorrhage-induced hemodynamic alterations, organ injury, and mortality in rats[J]. Am J Physiol, 1996, 270: H1616-H1623.
[10]Kooy NW, Royall JA, Ye YZ, et al. Evidence for in vivo peroxynitrite production in human acute lung injury[J]. Am J Respir Crit Care Med, 1995, 151: 1250.
收稿:1999-10-25, 百拇医药
单位:朱华栋 周玉淑 于学忠 邵孝 中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730
关键词:休克,失血性;内毒素;肿瘤坏死因子;白细胞介素6;白细胞介素8;一氧化氮
中国急救医学991101朱华栋 周玉淑 于学忠 邵孝

摘要:目的 探讨内毒素血症、细胞因子、NO在重度失血性休克发展过程中的作用和机制。方法 选用大白兔26只,分为失血性休克组(14只),对照组(12只),休克组观察休克前后血浆内毒素、TNFα、IL-6、IL-8、NO的动态变化,对照组观察手术前后上述指标的变化,两组动物均观察24小时、48小时存活率。结果 大白兔发生失血性休克后血浆内毒素、TNFα、IL-6、IL-8、NO的水平与休克前及对照组比较有明显升高,死亡动物中血浆上述物质水平显著高于存活动物。结论 内毒素血症、细胞因子、NO等发挥重要的协同作用,促使失血性休克向不可逆方向进展。
, http://www.100md.com
中图分类号:R 631.4;R 605.971
文献标识码:A
文章编号:1002-1949(1999)11-0639-03
Studies on role of endotoximia, cytokines and nitric oxide in the development of prolonged hemorrhagic shock
ZHU Hua-dong, ZHOU Yu-shu, YU Xue-zhong, et al.
Department of Emergency, Peking Union Medical College Hospital, Beijing 100730, China
, 百拇医药
Abstract Objective To study the role of the mechanism of endotoxin, cytokines, NO in the development of prolonged hemorrhagic shock. Methods 26 rabbits were randomly divided into hemorrhagic shock group(14 rabbits), control group(12 rabbits). After establishing hemorrhagic shock model of rabbits, plasma levels of endotoxin, TNFα, IL-6, IL-8 and NO were detected at preshock and postshock. The survival rates of 24 h and 48 h were observed. Results The plasma levels of endotoxin, TNFα, IL-6, IL-8 and NO were markedly higher after shock than those of before shock and control group, and maintained at high level. The plasma levels of endotoxin, cytokines and NO in nonsurvivors were higher than those of surviving animals. Conclusions The endotoxin, cytokines and NO play an important role in the development of prolonged hemorrhagic shock.
, 百拇医药
Key words Shock, hemorrhagic; Endotoxin; Tumor necrosis factor; Interleukin-6; Interleukin-8; Nitric oxide
失血性休克是由于机体血容量丢失过多而引起的休克,经采取补液、输血等措施将血容量补足后,大多可得以纠正,但有部分患者却因为失血量大,救治不及时而发展成重度不可逆性休克,此时虽经应用各种措施积极治疗,仍会出现多器官功能衰竭,以至死亡。休克由可逆向不可逆转化是一个很复杂的病理过程,其中有许多因素参与,本研究拟从失血性休克后的内毒素血症以及血浆细胞因子、一氧化氮的动态变化着手,来探讨它们各自在失血性休克发展中的作用,从而为以后的临床治疗提供理论依据。
1 资料与方法
1.1 实验动物 新西兰大白兔26只由北京协和医院动物房提供,4~6月龄,雌雄各半,体重2.76±0.40 kg(
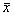 ±s),随机分成两组:失血性休克组14只,对照组12只,动物在实验前禁食12小时,禁水8小时。
±s),随机分成两组:失血性休克组14只,对照组12只,动物在实验前禁食12小时,禁水8小时。, 百拇医药
1.2 实验步骤 失血性休克组经股动脉放血制作失血性休克模型。大白兔用3%戊巴比妥钠溶液30 mg/kg腹腔麻醉成功后,行右侧股动、静脉插管术,动脉插管接换能器与多功能监护仪连接,监测平均动脉压(MAP),静脉插管用作补液和留取血标本,上述手术完成后,静脉注射肝素6 mg/kg将大白兔全身肝素化后,经右股动脉快速放血(约10分钟)使MAP降至4~4.66 kPa(30~35 mmHg),维持120分钟,然后回输全部失血及等量的林格氏液进行复苏,复苏需30分钟,以后用5%葡萄糖盐水以2.5 ml.kg-1.h-1的速度静脉维持点滴。对照组动物仅做股动、静脉插管及全身肝素化,未行放血。
1.3 观察指标 休克组分别在休克前、休克末、复苏末、复苏后0.5小时、2小时、4小时记录MAP的变化,并测定血浆中内毒素、TNF α、IL-6、IL-8、NO的水平。对照组则在手术前、术后2 h、2.5 h、3 h、4.5 h、6.5 h测定血浆中上述指标。两组动物均观察24、48小时存活率。
, 百拇医药
1.4 检测方法 内毒素的测定采用显色鲎试剂定量测定法;TNF α、IL-6、IL-8的测定均用ELISA法;NO的测定采用Griess重氮化反应法。
1.5 统计学处理 组间相同指标的比较用单因素方差分析,组内不同条件下同一指标比较用无重复数据的两因素方差分析,均数两两比较采用q检验;不同指标间的相关性用直线相关分析,相关系数的显著性用t检验;率的比较用χ2检验。以P<0.05表示差异显著,有统计学意义。
2 结果
2.1 两组动物血浆内毒素、细胞因子、NO的变化 发生休克后,血浆中内毒素、TNFα、IL-6、IL-8、NO水平明显升高,而对照组则无明显变化,见表1、表2。
, 百拇医药
表1 休克组动物不同时点血浆内毒素、TNFα、IL-6、IL-8、NO变化(x±s)
休克前
休克末
复苏末
复苏后0.5 h
复苏后2 h
复苏后4 h
内毒素(Eu/ml)
0.139±0.039
0.53±0.096*
0.809±0.148*
, 百拇医药
0.841±0.158*
0.622±0.127*
0.519±0.133*
TNFα(ng/L)
19.09±4.17
70.31±10.4*
79.46±10.74*
76.21±9.73*
69.09±11.04*
, 百拇医药 65.99±11.72*
IL-6(ng/L)
10.94±2.54
12.1±2.36
25.2±5.29*
53.07±10.76*
80.1±15.78*
69.25±13.56*
IL-8(ng/L)
44.3±7.89
, http://www.100md.com
48.3±8.1
68.3±11.1*
154.3±30.6*
255.5±60.8*
226±53.2*
NO(μmol/L)
22±4.08
66.06±11.03*
76.59±10.52*
90.02±9.24*
, 百拇医药
82.82±9.46*
75.31±10.26*
与休克前比较,*P<0.01。表2 对照组动物不同时点血浆内毒素、TNFα、IL-6、IL-8、NO变化(x±s)
手术前
术后2 h
术后2.5 h
术后3 h
术后4.5 h
术后6.5 h
内毒素(Eu/ml)
, 百拇医药
0.141±0.042
0.145±0.037
0.148±0.035
0.151±0.037
0.152±0.034
0.149±0.037
TNFα(ng/L)
19.7±4.86
21.16±5.04
21.69±4.30
23.53±5.26
, http://www.100md.com
24.02±4.29
21.45±4.42
IL-6(ng/L)
9.95±3.65
10.33±4.01
10.72±3.94
12.41±4.11
11.85±3.34
10.59±3.22
IL-8(ng/L)
49.79±6.97
, http://www.100md.com
52.55±6.72
53.25±6.54
50.85±7.91
51.01±7.25
50.74±5.71
NO(μmol/L)
21.89±4.04
24.03±4.03
22.23±3.48
23.5±3.81
25.05±4.37
, 百拇医药
22.34±2.03
2.2 休克组动物血浆细胞因子、NO水平与内毒素水平的相关分析 休克组血浆TNFα、IL-6、IL-8、NO水平分别与内毒素水平呈显著相关(r=0.928,P<0.01;r=0.890,P<0.01;r=0.858,P<0.01;r=0.863,P<0.01)。
2.3 休克组动物IL-6、IL-8、NO水平与TNFα水平的相关分析 休克组血浆IL-6、IL-8、NO水平与TNFα水平呈显著相关(r=0.917,P<0.01;r=0.831,P<0.01;r=0.826,P<0.01)。
2.4 两组动物的预后 对照组动物48小时全部存活;休克组动物24小时存活7支,存活率为50%,48小时存活4只,存活率28.06%,死亡动物血浆中内毒素、TNFα、IL-6、IL-8、NO的水平与存活动物比较有明显差异,见表3。表3 休克组中存活动物和死亡动物血浆内毒素、细胞因子、NO水平比较(x±s)
, 百拇医药
存活动物
死亡动物
内毒素(Eu/ml)
0.685±0.16
0.905±0.111*
TNFα(ng/L)
66.1±14.19
85.11±6.27#
IL-6(ng/L)
66.1±14.19
85.68±13.07*
, 百拇医药
IL-8(ng/L)
205.5±5.8
275.5±61.4*
NO(μmol/L)
80.7±8.61
93.75±6.67#
与存活动物比较,*P<0.05;#P<0.01。
3 讨论
近来,一系列对失血性休克进行的动物和临床实验研究均证实:一定时限的失血性休克能够引起肠道细菌、内毒素移位发生菌血症、内毒素血症[1],其中内毒素血症比菌血症可能具有更重要的意义。
, 百拇医药
本实验结果显示:兔发生失血性休克后,血浆内毒素水平明显升高,复苏后0.5小时达高峰,其内毒素水平与大白兔的预后明显相关,表明内毒素血症在休克的发展中起着重要的作用。许多研究证实:应用内毒素拮抗剂如多粘菌素B、杀菌性/通透性增强蛋白质(BPI)或抗内毒素抗体来对抗或消除休克后的内毒素血症,可提高失血性休克动物存活率[2,3]。
目前认为失血性休克后的内毒素血症主要是肠道细菌、内毒素移位的结果。正常情况下,肠道能保护机体免受肠腔内细菌、内毒素的侵袭,主要依靠其完好的机械屏障、生态屏障、免疫屏障。当发生失血性休克后,由于肠粘膜缺血和复苏后的再灌注损伤,可以直接破坏肠道机械屏障的完整性,造成肠粘膜通透性增加[4],使细菌、毒素能够透过肠道屏障发生移位,而休克的打击还可引起肠道菌群失调,使革兰氏阴性细菌得以过度繁殖,更是促进了肠道细菌移位的发生。另外发生休克后肠道粘膜局部的免疫功能受损,及机体的网状内皮系统受到抑制,不能有效地清除致病菌侵入,也是促使细菌、内毒素发生移位的一个重要因素。
, 百拇医药
针对机体发生失血性休克后常伴有内源性内毒素血症,Deitch提出了“二次打击”假说,认为机体在受到任何一种损伤后往往处于一种致敏状态,任何一种继发性损伤,即使作用轻微,但只要超过宿主的清除能力,则可引起一系列的放大的连锁反应[5]。已有研究证实:失血性休克增加了机体对内毒素的致敏作用[6],可能使体内单核-巨噬细胞系统、中性粒细胞等处于致敏状态,随着休克后大量内毒素进入体内,则使休克致敏的细胞进一步激活,产生一种明显放大的炎症反应,加重器官功能受损。
本研究发现:兔发生失血性休克后,血浆TNFα、IL-6、IL-8明显升高,而且其水平与血浆内毒素水平呈明显的正相关,与兔的预后亦有相关性。许多研究表明:内毒素是刺激休克后细胞因子生成的重要因素,而拮抗内毒素治疗能明显抑制失血性休克时体内细胞因子的产生。失血性休克后,内毒素大量入侵,激活巨噬细胞,引起TNFα、IL-1、IL-6、IL-8等炎性因子大量释放。在本研究中TNFα在休克末即明显升高,复苏末达高峰,而IL-6、IL-8在复苏后0.5小时始升高,于复苏后2小时达高峰,且休克组血浆IL-6、IL-8水平与TNFα水平呈正相关。Ayala等的研究发现,失血性休克发生30分钟后,TNFα水平已开始升高[7],这表明TNFα可能是炎性介质链锁反应中最早的启动因子。TNFα主要参与机体炎症过程和免疫过程,它能激活中性粒细胞,引起中性粒细胞的趋化、聚集和粘附于血管内皮细胞,导致内皮细胞受损,它还可以诱导IL-6、IL-8等其他细胞因子的瀑布样释放。IL-6由单核细胞和纤维细胞分泌,它可以刺激活化B细胞增殖及其免疫球蛋白的转录和生成,能刺激肝细胞产生一系列的急性期蛋白,Wang等发现创伤失血性休克后肠道通透性增加与肠道局部和全身IL-6合成上调有关[8]。IL-8由单核-巨噬细胞、内皮细胞生成,IL-8对粒细胞有强大的趋化性,能使粒细胞脱颗粒,释放溶酶体酶、蛋白水解酶、氧自由基等,能刺激单核巨噬细胞、中性粒细胞分泌多种炎性介质。上述这些因子相互激发、协同作用,导致全身炎症反应,最终造成组织损害。
, 百拇医药
NO是极强的血管舒张因子,它在休克的发生发展过程中起着重要的作用,其生成增多被认为是造成休克顽固性低血压的主要因素[9]。本研究发现:失血性休克末血浆NO水平即明显升高,复苏后2小时达峰值,以后仍维持在高水平。内毒素、炎性因子使诱导型一氧化氮合酶(iNOS)活性增加是失血性休克后NO大量生成的主要原因。NO除了松弛血管平滑肌引起血管扩张外,还具有细胞毒性,可以灭活与能量代谢或抗氧化有关的酶;可以抑制非血红素铁-硫酶,干扰能量代谢和DNA合成;可以与超氧阴离子反应生成具有强氧化性的过氧化亚硝酸根(ONOO-),对组织、细胞造成损害[10]。另外,过量的NO还有负性肌力作用,使心功能受抑。NO的上述病理作用在休克向不可逆转化过程中起着重要作用。
总之,在重度失血性休克的发生发展过程中,有许多因素参与其中,而肠源性内毒素血症、细胞因子、NO等相互激发、相互影响,在这一过程中起着重要的协同作用。应想方设法来对抗或消除这些因素的作用,争取为该类休克的治疗带来突破。
, 百拇医药
作者单位: 朱华栋 周玉淑 于学忠 邵孝
 中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730
中国医学科学院 中国协和医科大学北京协和医院急诊科,北京 100730参考文献
[1]Jiang JX, Bahrami S, Leichtfried G, et al. Kinetics of endotoxin and tumor necrosis factor appearance in portal and system circulation after hemorrhagic shock in rats[J]. Ann Surg, 1995, 221(1):100-106.
[2]Yao YM, Bahrami S, Leichtfried G, et al. Pathogensis of hemorrhage-induced bacteria/endotoxin translocation in rats: Effects of recombinant bactericidal-increasing protein(rBPI21)[J]. Ann Surg, 1995, 221: 398-405.
, http://www.100md.com
[3]Bahrami S, Yao YM, Leichtfried G, et al. Monocolnal antibody to endotoxin attenuates hemorrhage-induced lung injury and mortality in rats[J]. Crit Care Med, 1997, 25: 1030-1036.
[4]Russell DH, Barreto JC, Klemm K, et al. Hemorrhagic shock increases gut macromolecular permeability in the rat[J]. Shock, 1995, 4: 50.
[5]Deitch EA. Multiple organ failure: Pathophysiology and potential future therapy[J]. Ann Surg, 1992, 216: 117.
, http://www.100md.com
[6]Mileski WJ, Winn RK, Harlan JM, et al. Sensitivity to endotoxin in rabbits is incresed after hemorrhagic shock[J]. J Appl Phsiol, 1992, 73(3): 1146-1149.
[7]Ayala A, Perrin MM, Meldrum DR, et al. Hemorrhage induced an increase in serum TNF which is not associated with elevated levels of endotoxin[J]. Cytokine, 1990, 2:170.
[8]Wang W, Smail N, Wang P, et al. Increased gut permeability after hemorrhage is associated with upregulation of local and systemic IL-6[J]. J Surg Res, 1998, 79: 39.
, http://www.100md.com
[9]Yao YM, Bahrami S, Leichtfried G, et al. Significance of NO in hemorrhage-induced hemodynamic alterations, organ injury, and mortality in rats[J]. Am J Physiol, 1996, 270: H1616-H1623.
[10]Kooy NW, Royall JA, Ye YZ, et al. Evidence for in vivo peroxynitrite production in human acute lung injury[J]. Am J Respir Crit Care Med, 1995, 151: 1250.
收稿:1999-10-25, 百拇医药