中药清胰汤及双歧杆菌合剂对急性坏死性胰腺炎肠道细菌移位影响的比较研究
作者:吴承堂 黎沾良 黄祥成 齐德林
单位:吴承堂 黄祥成 齐德林 第一军医大学南方医院普外科,广州 510515;黎沾良 解放军第304医院普外科,北京 100037
关键词:
中国急救医学991113 急性坏死性胰腺炎(ANP)后感染发生率高达40%,是导致死亡的主要因素[1]。研究证实,ANP后继发的胰腺感染主要是肠道细菌移位(BT)所致[1,2],而细菌移位的发生又取决于肠粘膜屏障的功能状态。目前临床上尚无特效方法用于保护肠屏障功能,阻止ANP后肠道细菌移位的发生。本研究观察了中药清胰汤和肠道微生态调理剂(双歧杆菌合剂)对ANP犬的肠屏障功能和肠道细菌移位的影响,结果报道如下。
1 资料与方法
, 百拇医药
1.1 动物模型与分组 杂种犬24只, 体重15±2 kg。 剖腹后经主胰管内注入5%牛磺胆酸钠 (0.5 ml/kg) 和胰蛋白酶(3 000 U/kg),制作ANP模型。然后随机分为3组:ANP组(8只),术后根据需要输液;中药组(CM,8只),每日经胃管灌服清胰汤20 ml/kg,连用7天,清胰汤组成:大黄(后下)、南柴胡、白芍各24 g,黄芩、胡黄连、元胡、木香、芒硝(冲服)各18 g,用水煎成300 ml;微生态调理组(MM,8只),每天经胃管灌入双歧杆菌合剂(0.5 g/kg,每g用生理盐水1 ml溶解),其组成:双歧杆菌(109 CFU/g),嗜酸乳杆菌(108 CFU/g),肠球菌(108 CFU/g)。第7天活杀。
1.2 观察指标
1.2.1 肠通透性 分别于手术后第1、2、4、7天各给犬灌服5%甘露醇和10%乳果糖混合液100 ml,收集6小时尿,参照Dumas法[3],对尿中乳果糖和甘露醇作肟化和硅烷化处理后,气相色谱法测定其含量,以乳果糖/甘露醇比率(L/M)表示肠通透性大小[4]。
, 百拇医药
1.2.2 肠道微生态分析 处死后无菌操作剪取空、回、盲肠标本,立即置于无菌试管用生理盐水边漂洗边通入高纯氮(99.99%),反复漂洗3次,然后取出组织,匀浆,接种至E.coli、肠球菌、双歧杆菌、类杆菌和乳杆菌五种选择性平板,需氧菌37℃培养24小时,厌氧菌37℃厌氧箱中培养48小时,作细菌计数。
1.2.3 血浆内毒素(LPS),淀粉酶(AMY)和血清磷脂酶A(PLA2)活性 术后第1、2、4、7天采血,LPS采用鲎试剂基质显色定量法、AMY应用碘—淀粉法,PLA2应用放射免疫法进行测定。
1.2.4 肠道细菌移位 活杀后无菌操作剪取肝、胰、脾、肺、肾及肠系膜淋巴结(MLN)0.1~0.2 g,匀浆后接种于需氧菌、厌氧菌平板,培养,计数。
1.2.5 病理观察 取胰腺及回肠组织标本作光镜及透射电镜观察。
, 百拇医药
1.2.6 动物死亡率。
1.3 统计学处理 数据作F检验,结果以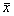 ±s表示。
±s表示。
2 结果
2.1 病理学结果 光镜观察:ANP组胰腺腺泡有大片坏死,出血,大量炎细胞侵润;肠绒毛顶端部分破损,粘膜上皮内有细菌侵入。中药组胰腺腺泡完整,间质充血水肿,炎性细胞浸润,无坏死,出血;肠粘膜上皮基本完整,未见细菌侵入。微生态组胰腺腺泡有个别小坏死灶,间质亦见充血水肿和炎性细胞浸润;肠粘膜上皮尚完整,未见细菌侵入。电镜观察:ANP组胰腺腺泡粗面内质网扩张,线粒体退变,结构模糊;肠上皮微绒毛缩短,部分脱落。中药组和微生态组胰腺腺泡内质网仅轻度扩张,线粒体无明显肿胀;肠粘膜微绒毛尚整齐,胞内细胞器结构基本正常。
, 百拇医药
2.2 脏器细菌移位发生率 ANP组MLN培养全部阳性,其余脏器细菌培养结果:胰、肝7/8,肾、肺6/8,脾4/8。中药组细菌培养结果:MLN 4/8,胰、肺、脾3/8,肝、肾2/8。微生态组细菌培养结果:MLN 5/8,胰、肺、脾3/8,肝1/8,肾2/8。与ANP组比较中药组细菌移位发生率减少50%(P<0.05),微生态组减少37.5%(P<0.05),两组脏器移位细菌数量减少了10~40倍(P<0.05或P<0.01)。
2.3 血清PLA2 结果见表1。
表1 各组血清PLA2水平变化(ng/ml) 组别
d1
d2
, 百拇医药
d4
d7
ANP
38.24±3.61
31.31±4.63
24.68±2.17
20.58±1.81
CM
36.78±4.99
25.45±3.02
15.66±1.94*
, 百拇医药
13.87±2.13*
MM
35.76±5.36
26.20±3.67
16.03±1.33*
14.18±1.46*
与ANP组比较,*P<0.05
2.4 肠通透性 结果见表2。表2 尿中乳果糖和甘露醇含量(mg,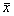 ±s)及L/M比值 组别
±s)及L/M比值 组别
, 百拇医药 天数
乳果糖
甘露醇
L/M
ANP
1
51.14±14.34
172.50±26.92
0.281±0.073
2
81.71±20.95
209.55±29.34
, http://www.100md.com 0.372±0.118
4
49.68±19.44
219.25±39.58
0.251±0.062
7
27.94±8.87
222.37±34.19
0.105±0.024
CM
1
50.89±11.64
, 百拇医药
168.38±31.37
0.212±0.061
2
48.93±13.22**
211.95±26.49
0.265±0.097**
4
23.74±8.31**
231.88±30.93
0.089±0.075**
, http://www.100md.com 7
7.93±1.45**
245.11±31.43
0.041±0.009*
MM
1
49.98±15.02
181.54±25.16
0.219±0.058
2
50.69±12.02**
, 百拇医药
208.50±35.19
0.234±0.072**
4
21.77±7.67**
198.37±17.32
0.097±0.098**
7
8.42±2.14**
229.62±24.01
0.044±0.008
, http://www.100md.com
与ANP组比较,*P<0.05 **P<0.01
2.5 肠道微生态分析 结果见表3。表3 各组肠粘膜菌群计数(CFUlog/g,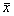 ±s)及粘膜菌群中双歧杆菌/大肠杆菌(B/E)比值 组别
±s)及粘膜菌群中双歧杆菌/大肠杆菌(B/E)比值 组别
标本
大肠杆菌
肠球菌
类杆菌
双歧杆菌
乳杆菌
B/E
, 百拇医药 ANP
空肠粘膜
5.42±0.93
0
5.75±0.77
3.75±0.95
2.13±0.80
0.51±0.36
回肠粘膜
6.80±1.27
1.17±0.95
6.35±0.98
, 百拇医药
4.89±0.86
3.78±0.79
0.62±0.38
盲肠粘膜
7.88±1.18
1.27±1.04
8.01±1.17
4.70±0.88
4.81±0.73
0.46±0.24
CM
空肠粘膜
, 百拇医药
4.14±0.36*
1.87±0.89**
4.52±0.74*
4.33±0.76*
3.62±0.78*
1.08±0.47*
回肠粘膜
5.43±0.62*
2.19±0.54*
5.56±0.94*
, 百拇医药
5.56±0.66**
5.28±0.67**
1.02±0.46*
盲肠粘膜
6.36±0.89*
2.31±0.45*
5.88±0.95**
6.48±0.67**
5.88±0.60*
, http://www.100md.com 1.01±0.38*
MM
空肠粘膜
4.11±0.44*
1.78±0.29**
3.82±0.38**
5.24±1.01**
3.92±0.54*
1.53±0.39*
回肠粘膜
, 百拇医药
5.37±0.75*
2.02±0.61*
4.96±0.67**
6.18±1.21**
5.67±0.88**
1.24±0.44*
盲肠粘膜
6.89±0.78*
2.25±0.56*
4.89±0.82**
, 百拇医药
7.16±0.84**
5.38±0.62*
1.02±0.48*
与ANP组比较,*P<0.05 **P<0.01
2.6 血浆LPS含量 与ANP组相比,中药组及微生态组血浆LPS水平第2天以后均显著降低(1~2倍,P<0.01),第4、7天已接近术前水平(P<0.01)。
2.7 血清AMY水平 与ANP组相比,中药组及微生态组4天以后血中胰淀粉酶显著降低(2~3倍,P<0.01),并于第7天降至术前水平,而ANP组仍维持在较高水平。
, 百拇医药 2.8 死亡率 ANP组为42.86%(6/14),CM和MM组均为27.27%(3/11)。
3 讨论
中药清胰汤以清热解毒、疏肝理气、活血化瘀和通里攻下为治法,有抑菌、抗炎、利胆和促进肠蠕动的作用,被证明是治疗急性胰腺炎的有效方剂。最近研究表明,清胰汤能显著减轻ANP时的内毒素血症和多器官损害[4],其中的大黄能明显改善胃肠粘膜血流灌注[5]。本实验结果表明,清胰汤能①明显减轻ANP时胰腺及肠组织的病理损害;②显著抑制肠道大肠杆菌和条件致病菌类杆菌的增殖,保护双歧杆菌和乳杆菌,提高肠道定植抗力,使B/E比值接近于正常的1.03~1.23,说明肠道微生态趋于平衡;③显著降低血浆内毒素水平;④血AMY水平、PLA活性也明显降低,减轻由此引起的器官损伤;⑤显著降低肠粘膜的通透性;⑥肠道细菌总移位率下降一倍,移位菌数量减少。研究结果提示,清胰汤能全面减轻ANP引发的多方面的病理生理变化,维护肠粘膜屏障功能,减少肠道细菌移位和感染的发生机会,从而降低病死率。其对肠粘膜屏障的保护效应,可能是通过促进肠蠕动和毒素排泄,调整肠道微生态平衡,减轻内毒素和各种细胞因子的损伤,并调节机体的免疫功能等综合作用来实现的。
, http://www.100md.com
我们以往研究证实[7],ANP时肠道菌群出现明显的微生态失调,表现为肠道中以大肠杆菌为主的革兰阴性需氧菌过度生长,而双歧杆菌及乳杆菌数量显著下降。据此,我们试用活菌制剂—双歧杆菌合剂进行针对性治疗。双歧杆菌合剂由双歧杆菌、乳杆菌、肠球菌组成,是由健康犬粪便分离出来的菌种,经体外培养、繁殖,并用赋形剂(氧化铝、淀粉等),可保护其免受胃酸的破坏。业已证实,外源性双歧杆菌可在受体肠道内存活,并与肠粘膜牢固结合[8]。通过对双歧杆菌的扶植,可抑制肠道杆菌的过度繁殖,减少肠道中内毒素含量,从而减少ANP后肠道细菌和内毒素的移位。本实验结果亦证实,在ANP时,双歧杆菌合剂能①显著提高肠道中双歧杆菌和乳杆菌的含量,显著拮抗肠道需氧菌中大肠杆菌和条件致病菌的增殖,使B/E比值维持正常微生态趋于平衡;②使血中LPS水平下降1~2倍;③显著降低肠粘膜的通透性;④减轻ANP时胰腺及肠组织的病理损害;⑤降低血中AMY及PLA2水平;⑥使脏器细菌移位率下降。
综上所述,清胰汤和双歧杆菌合剂对减轻ANP的病情,保护肠屏障功能,减少肠道细菌移位及其可能导致的胰腺感染都有肯定的效果,从我们的实验数据看,难分优劣。清胰汤引起明显腹泄,但动物的一般情况并未因腹泄而恶化,相反,多种指标检测结果似乎更好一些。国内应用中药治疗急性水肿型胰腺炎已有比较成熟的经验,我们的实验提示对坏死性胰腺炎中药治疗也是有效的。清胰汤的强烈泻下作用,可以部分克服肠麻痹造成服药困难的障碍。微生态制剂服用量小(10~20 ml),没有副作用。治疗费用低廉是这两种方法的另一个优点,但中药易得,微生态制剂需要相应的制备和质量监控条件,临床推广的难度要大一些。急性坏死性胰腺炎的发病机制十分复杂,临床上需要进行综合治疗。这两种治疗方法虽然显示出一定的减轻病情、减少肠道细菌移位和肠源性感染发生机会的作用,但并不能替代综合治疗,而只是对现有治疗措施的一项有益补充。
, 百拇医药
本研究系全军重点科研基金资助项目
参考文献
[1]Foitzik T,Castillo CF,Ferraro MJ,et al.Pathogenesis and prevention of early pancreatic infection in experimental acute necrotizing pancreatitis.Ann Surg,1995,222:179.
[2]Kazantsev GB,Hecht DW,Rao R, et al.Plasmid labeling confirms bacterial translocation in pancreatitis. Am J Surg,1994,167:201.
[3]Dumas F,Aussel C, Pernel P,et al. Gas chromatography applied to the lactulose-mannitol intestinal permeability test. J Chromatogr B,1994,654:276.
, http://www.100md.com
[4]吴承堂,黎沾良,祝小枫,等.两种糖分子探针用于测定重症胰腺炎时肠通透性的改变. 中华实验外科杂志,1997,14:195.
[5]雷文章,韦靖江,沈文律,等.实验性坏死性胰腺炎多器官损害与内毒素血症的关系.中华实验外科杂志,1995,12:131.
[6]陈德昌,景炳文,杨兴易,等.大黄对胃肠功能衰竭的治疗作用.解放军医学杂志,1996,21:24.
[7]吴承堂,黎沾良,熊德鑫,等.急性坏死性胰腺炎时肠道细菌微生态改变与胰腺感染的实验研究. 中国危重病急救医学,1997,9:403.
[8]康白主编.微生态学. 第一版. 大连:大连出版社,1988.384.
收稿:1998-10-21
修回:1999-05-17, http://www.100md.com
单位:吴承堂 黄祥成 齐德林 第一军医大学南方医院普外科,广州 510515;黎沾良 解放军第304医院普外科,北京 100037
关键词:
中国急救医学991113 急性坏死性胰腺炎(ANP)后感染发生率高达40%,是导致死亡的主要因素[1]。研究证实,ANP后继发的胰腺感染主要是肠道细菌移位(BT)所致[1,2],而细菌移位的发生又取决于肠粘膜屏障的功能状态。目前临床上尚无特效方法用于保护肠屏障功能,阻止ANP后肠道细菌移位的发生。本研究观察了中药清胰汤和肠道微生态调理剂(双歧杆菌合剂)对ANP犬的肠屏障功能和肠道细菌移位的影响,结果报道如下。
1 资料与方法
, 百拇医药
1.1 动物模型与分组 杂种犬24只, 体重15±2 kg。 剖腹后经主胰管内注入5%牛磺胆酸钠 (0.5 ml/kg) 和胰蛋白酶(3 000 U/kg),制作ANP模型。然后随机分为3组:ANP组(8只),术后根据需要输液;中药组(CM,8只),每日经胃管灌服清胰汤20 ml/kg,连用7天,清胰汤组成:大黄(后下)、南柴胡、白芍各24 g,黄芩、胡黄连、元胡、木香、芒硝(冲服)各18 g,用水煎成300 ml;微生态调理组(MM,8只),每天经胃管灌入双歧杆菌合剂(0.5 g/kg,每g用生理盐水1 ml溶解),其组成:双歧杆菌(109 CFU/g),嗜酸乳杆菌(108 CFU/g),肠球菌(108 CFU/g)。第7天活杀。
1.2 观察指标
1.2.1 肠通透性 分别于手术后第1、2、4、7天各给犬灌服5%甘露醇和10%乳果糖混合液100 ml,收集6小时尿,参照Dumas法[3],对尿中乳果糖和甘露醇作肟化和硅烷化处理后,气相色谱法测定其含量,以乳果糖/甘露醇比率(L/M)表示肠通透性大小[4]。
, 百拇医药
1.2.2 肠道微生态分析 处死后无菌操作剪取空、回、盲肠标本,立即置于无菌试管用生理盐水边漂洗边通入高纯氮(99.99%),反复漂洗3次,然后取出组织,匀浆,接种至E.coli、肠球菌、双歧杆菌、类杆菌和乳杆菌五种选择性平板,需氧菌37℃培养24小时,厌氧菌37℃厌氧箱中培养48小时,作细菌计数。
1.2.3 血浆内毒素(LPS),淀粉酶(AMY)和血清磷脂酶A(PLA2)活性 术后第1、2、4、7天采血,LPS采用鲎试剂基质显色定量法、AMY应用碘—淀粉法,PLA2应用放射免疫法进行测定。
1.2.4 肠道细菌移位 活杀后无菌操作剪取肝、胰、脾、肺、肾及肠系膜淋巴结(MLN)0.1~0.2 g,匀浆后接种于需氧菌、厌氧菌平板,培养,计数。
1.2.5 病理观察 取胰腺及回肠组织标本作光镜及透射电镜观察。
, 百拇医药
1.2.6 动物死亡率。
1.3 统计学处理 数据作F检验,结果以
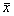 ±s表示。
±s表示。2 结果
2.1 病理学结果 光镜观察:ANP组胰腺腺泡有大片坏死,出血,大量炎细胞侵润;肠绒毛顶端部分破损,粘膜上皮内有细菌侵入。中药组胰腺腺泡完整,间质充血水肿,炎性细胞浸润,无坏死,出血;肠粘膜上皮基本完整,未见细菌侵入。微生态组胰腺腺泡有个别小坏死灶,间质亦见充血水肿和炎性细胞浸润;肠粘膜上皮尚完整,未见细菌侵入。电镜观察:ANP组胰腺腺泡粗面内质网扩张,线粒体退变,结构模糊;肠上皮微绒毛缩短,部分脱落。中药组和微生态组胰腺腺泡内质网仅轻度扩张,线粒体无明显肿胀;肠粘膜微绒毛尚整齐,胞内细胞器结构基本正常。
, 百拇医药
2.2 脏器细菌移位发生率 ANP组MLN培养全部阳性,其余脏器细菌培养结果:胰、肝7/8,肾、肺6/8,脾4/8。中药组细菌培养结果:MLN 4/8,胰、肺、脾3/8,肝、肾2/8。微生态组细菌培养结果:MLN 5/8,胰、肺、脾3/8,肝1/8,肾2/8。与ANP组比较中药组细菌移位发生率减少50%(P<0.05),微生态组减少37.5%(P<0.05),两组脏器移位细菌数量减少了10~40倍(P<0.05或P<0.01)。
2.3 血清PLA2 结果见表1。
表1 各组血清PLA2水平变化(ng/ml) 组别
d1
d2
, 百拇医药
d4
d7
ANP
38.24±3.61
31.31±4.63
24.68±2.17
20.58±1.81
CM
36.78±4.99
25.45±3.02
15.66±1.94*
, 百拇医药
13.87±2.13*
MM
35.76±5.36
26.20±3.67
16.03±1.33*
14.18±1.46*
与ANP组比较,*P<0.05
2.4 肠通透性 结果见表2。表2 尿中乳果糖和甘露醇含量(mg,
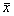 ±s)及L/M比值 组别
±s)及L/M比值 组别, 百拇医药 天数
乳果糖
甘露醇
L/M
ANP
1
51.14±14.34
172.50±26.92
0.281±0.073
2
81.71±20.95
209.55±29.34
, http://www.100md.com 0.372±0.118
4
49.68±19.44
219.25±39.58
0.251±0.062
7
27.94±8.87
222.37±34.19
0.105±0.024
CM
1
50.89±11.64
, 百拇医药
168.38±31.37
0.212±0.061
2
48.93±13.22**
211.95±26.49
0.265±0.097**
4
23.74±8.31**
231.88±30.93
0.089±0.075**
, http://www.100md.com 7
7.93±1.45**
245.11±31.43
0.041±0.009*
MM
1
49.98±15.02
181.54±25.16
0.219±0.058
2
50.69±12.02**
, 百拇医药
208.50±35.19
0.234±0.072**
4
21.77±7.67**
198.37±17.32
0.097±0.098**
7
8.42±2.14**
229.62±24.01
0.044±0.008
, http://www.100md.com
与ANP组比较,*P<0.05 **P<0.01
2.5 肠道微生态分析 结果见表3。表3 各组肠粘膜菌群计数(CFUlog/g,
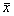 ±s)及粘膜菌群中双歧杆菌/大肠杆菌(B/E)比值 组别
±s)及粘膜菌群中双歧杆菌/大肠杆菌(B/E)比值 组别标本
大肠杆菌
肠球菌
类杆菌
双歧杆菌
乳杆菌
B/E
, 百拇医药 ANP
空肠粘膜
5.42±0.93
0
5.75±0.77
3.75±0.95
2.13±0.80
0.51±0.36
回肠粘膜
6.80±1.27
1.17±0.95
6.35±0.98
, 百拇医药
4.89±0.86
3.78±0.79
0.62±0.38
盲肠粘膜
7.88±1.18
1.27±1.04
8.01±1.17
4.70±0.88
4.81±0.73
0.46±0.24
CM
空肠粘膜
, 百拇医药
4.14±0.36*
1.87±0.89**
4.52±0.74*
4.33±0.76*
3.62±0.78*
1.08±0.47*
回肠粘膜
5.43±0.62*
2.19±0.54*
5.56±0.94*
, 百拇医药
5.56±0.66**
5.28±0.67**
1.02±0.46*
盲肠粘膜
6.36±0.89*
2.31±0.45*
5.88±0.95**
6.48±0.67**
5.88±0.60*
, http://www.100md.com 1.01±0.38*
MM
空肠粘膜
4.11±0.44*
1.78±0.29**
3.82±0.38**
5.24±1.01**
3.92±0.54*
1.53±0.39*
回肠粘膜
, 百拇医药
5.37±0.75*
2.02±0.61*
4.96±0.67**
6.18±1.21**
5.67±0.88**
1.24±0.44*
盲肠粘膜
6.89±0.78*
2.25±0.56*
4.89±0.82**
, 百拇医药
7.16±0.84**
5.38±0.62*
1.02±0.48*
与ANP组比较,*P<0.05 **P<0.01
2.6 血浆LPS含量 与ANP组相比,中药组及微生态组血浆LPS水平第2天以后均显著降低(1~2倍,P<0.01),第4、7天已接近术前水平(P<0.01)。
2.7 血清AMY水平 与ANP组相比,中药组及微生态组4天以后血中胰淀粉酶显著降低(2~3倍,P<0.01),并于第7天降至术前水平,而ANP组仍维持在较高水平。
, 百拇医药 2.8 死亡率 ANP组为42.86%(6/14),CM和MM组均为27.27%(3/11)。
3 讨论
中药清胰汤以清热解毒、疏肝理气、活血化瘀和通里攻下为治法,有抑菌、抗炎、利胆和促进肠蠕动的作用,被证明是治疗急性胰腺炎的有效方剂。最近研究表明,清胰汤能显著减轻ANP时的内毒素血症和多器官损害[4],其中的大黄能明显改善胃肠粘膜血流灌注[5]。本实验结果表明,清胰汤能①明显减轻ANP时胰腺及肠组织的病理损害;②显著抑制肠道大肠杆菌和条件致病菌类杆菌的增殖,保护双歧杆菌和乳杆菌,提高肠道定植抗力,使B/E比值接近于正常的1.03~1.23,说明肠道微生态趋于平衡;③显著降低血浆内毒素水平;④血AMY水平、PLA活性也明显降低,减轻由此引起的器官损伤;⑤显著降低肠粘膜的通透性;⑥肠道细菌总移位率下降一倍,移位菌数量减少。研究结果提示,清胰汤能全面减轻ANP引发的多方面的病理生理变化,维护肠粘膜屏障功能,减少肠道细菌移位和感染的发生机会,从而降低病死率。其对肠粘膜屏障的保护效应,可能是通过促进肠蠕动和毒素排泄,调整肠道微生态平衡,减轻内毒素和各种细胞因子的损伤,并调节机体的免疫功能等综合作用来实现的。
, http://www.100md.com
我们以往研究证实[7],ANP时肠道菌群出现明显的微生态失调,表现为肠道中以大肠杆菌为主的革兰阴性需氧菌过度生长,而双歧杆菌及乳杆菌数量显著下降。据此,我们试用活菌制剂—双歧杆菌合剂进行针对性治疗。双歧杆菌合剂由双歧杆菌、乳杆菌、肠球菌组成,是由健康犬粪便分离出来的菌种,经体外培养、繁殖,并用赋形剂(氧化铝、淀粉等),可保护其免受胃酸的破坏。业已证实,外源性双歧杆菌可在受体肠道内存活,并与肠粘膜牢固结合[8]。通过对双歧杆菌的扶植,可抑制肠道杆菌的过度繁殖,减少肠道中内毒素含量,从而减少ANP后肠道细菌和内毒素的移位。本实验结果亦证实,在ANP时,双歧杆菌合剂能①显著提高肠道中双歧杆菌和乳杆菌的含量,显著拮抗肠道需氧菌中大肠杆菌和条件致病菌的增殖,使B/E比值维持正常微生态趋于平衡;②使血中LPS水平下降1~2倍;③显著降低肠粘膜的通透性;④减轻ANP时胰腺及肠组织的病理损害;⑤降低血中AMY及PLA2水平;⑥使脏器细菌移位率下降。
综上所述,清胰汤和双歧杆菌合剂对减轻ANP的病情,保护肠屏障功能,减少肠道细菌移位及其可能导致的胰腺感染都有肯定的效果,从我们的实验数据看,难分优劣。清胰汤引起明显腹泄,但动物的一般情况并未因腹泄而恶化,相反,多种指标检测结果似乎更好一些。国内应用中药治疗急性水肿型胰腺炎已有比较成熟的经验,我们的实验提示对坏死性胰腺炎中药治疗也是有效的。清胰汤的强烈泻下作用,可以部分克服肠麻痹造成服药困难的障碍。微生态制剂服用量小(10~20 ml),没有副作用。治疗费用低廉是这两种方法的另一个优点,但中药易得,微生态制剂需要相应的制备和质量监控条件,临床推广的难度要大一些。急性坏死性胰腺炎的发病机制十分复杂,临床上需要进行综合治疗。这两种治疗方法虽然显示出一定的减轻病情、减少肠道细菌移位和肠源性感染发生机会的作用,但并不能替代综合治疗,而只是对现有治疗措施的一项有益补充。
, 百拇医药
本研究系全军重点科研基金资助项目
参考文献
[1]Foitzik T,Castillo CF,Ferraro MJ,et al.Pathogenesis and prevention of early pancreatic infection in experimental acute necrotizing pancreatitis.Ann Surg,1995,222:179.
[2]Kazantsev GB,Hecht DW,Rao R, et al.Plasmid labeling confirms bacterial translocation in pancreatitis. Am J Surg,1994,167:201.
[3]Dumas F,Aussel C, Pernel P,et al. Gas chromatography applied to the lactulose-mannitol intestinal permeability test. J Chromatogr B,1994,654:276.
, http://www.100md.com
[4]吴承堂,黎沾良,祝小枫,等.两种糖分子探针用于测定重症胰腺炎时肠通透性的改变. 中华实验外科杂志,1997,14:195.
[5]雷文章,韦靖江,沈文律,等.实验性坏死性胰腺炎多器官损害与内毒素血症的关系.中华实验外科杂志,1995,12:131.
[6]陈德昌,景炳文,杨兴易,等.大黄对胃肠功能衰竭的治疗作用.解放军医学杂志,1996,21:24.
[7]吴承堂,黎沾良,熊德鑫,等.急性坏死性胰腺炎时肠道细菌微生态改变与胰腺感染的实验研究. 中国危重病急救医学,1997,9:403.
[8]康白主编.微生态学. 第一版. 大连:大连出版社,1988.384.
收稿:1998-10-21
修回:1999-05-17, http://www.100md.com