pHi对急性分离大鼠新皮层神经元KATP通道的影响
作者:肖中举 苏平 高天明 佟振清
单位:第一军医大学生理教研室,广州 510515
关键词:pHi;ATP敏感钾通道;皮层神经元
中国应用生理学杂志000101摘要 目的和方法:采用膜片钳技术之膜内面向外记录方法,在急性分离大鼠皮层 神经元上,研究胞内酸碱环境改变对神经元ATP敏感钾通道的影响。结果:Vp=+6 0 mV时,pH 6.0组开放概率2.20%±0.57%(n=10)较pH7.3时的开放概率8.41% ±1.20%(n=16)显著降低(P<0.01);pH 8.0组开放概率18.29%±4.05%( n=8)较pH 7.3时明显增加(P<0.01)。当浴液由pH 7.3降为pH 6.0时,有40%出现 多级通道电流并可逆转。当浴液pH 6.0及pH 8.0时,ATP抑制通道开放概率的量效曲 线,与pH 7.3时比较无明显改变(P>0.05)。结论:脑细胞内氢离子可能 参与KATP通道的调节:胞内酸化环境可进一步激活KATP通道多级电流,保护脑 缺血缺氧损伤;而KATP,通道开放,膜超极化到一定程度,胞内酸化环境又可抑制通 道开放。
, 百拇医药
中图分类号: R338.8文献标识码:A 文章编号:1000-6834(2000)01-0001-05
THE EFFECTS OF INTRACELLULAR pHi ON ATP-SENSITIVE POTASSIUM CHANNELS IN ACUTELY DISSOCIATED-CEREBRAL NEURONS OF RATS
XIAO Zhong-ju, SHU Ping, GAO Tian-ming, TONG Zhen-qing
(Physiological Department, First Military Medical University, Gua ngzhou 510515)
ABSTRACT
, 百拇医药 Aim and Methods: Using inside-out configuration of patch-clamp techniq ue, the effects of intracellular pH on KATP channels were studied in acute ly dissociated cerebral neurons of rats. Results: The probability of group pH 6.0 (2.20%±0.57%,n=10) was lower than pH 7.3(8.41%±1.2%,n=16 ,P<0.01), and that of group pH 8.0 (18.29%±4.05%,n=8) higher than pH 7. 3(P<0.01) as the membrane potential held at hyperpolarization (+60 mV). Lowi ng pH of bath solution from 7.3 to 6.0, multichannel currents were seen at 40%. After reversing, that could recover to its original level. The inhibitory eff ect of ATP on channel open probabilities at pH 6.0 or 8.0 didn't change obviousl y from pH 7.3(P>0.05). Conclution: Intracellular H+ could prob ably take part in regulating KATP channel by activating multi-channel cur rents of KATP channel or by inhibiting exceed activity of KATPchann el.
, 百拇医药
KEY WORDS: pHi; ATP-sensitive K+ channel; cerebral neurons
脑在缺氧情况下,葡萄糖无氧酵解增加,脑细胞内酸化是其早期改变之一。我室对脑缺血缺氧的长期研究表明,脑在缺血缺氧情况下,ATP敏感钾(KATP)通道可通过神经 节苷脂的门控作用大量开放,使细胞膜超极化,降低神经元兴奋性,从而防止神经细胞的兴 奋毒作用[1,2]。Davies[3]及Proks[4]等证明骨骼肌细胞内pH 值下降可减低胞内ATP对细胞膜上KATP通道的抑制作用,而在神经元上尚未见类似报 道。本实验用膜片钳内面向外式记录方法,观察浴液酸碱环境改变对急性分离大鼠新皮层神 经元KATP通道特性及其对ATP敏感性的影响,进一步探索KATP通道活动对脑神 经细胞缺血缺氧的保护机制。
, http://www.100md.com
1 材料和方法
1.1 大鼠皮层神经元的急性分离
取3~7日龄SD大鼠断头,取大脑皮层,切成厚约0.4 mm的冠状脑片,置于通有95%O2和5%CO2混合气体的人工脑脊液[ACSF(mmol/L):NaCl 142,KCl 5,CaCl2 2,MgSO4 2,D-Glucose 10,HEPES 10,pH 7.3]中孵育1 h后 ,再在通有95%O2和5%CO2混合气体的0.1%胰蛋白酶(用ACSF配制)溶液中消化3 mi n。消化好的脑片以ACSF冲洗、剪碎,于ACSF中以玻璃吸管吹打成细胞悬液,并移数滴至覆 盖有多聚赖氨酸的盖玻片上,待细胞贴壁(5~10 min后,置浴槽进行实验。浴槽液成分为(m mol/L):KCl 140,CaCl2 0.9,EGTA 1,MgCl2 1,HEPSE 10,pH 7.3(KOH)。整个 实验在18~25℃下进行。1.2 单通道电流记录
, 百拇医药
本实验采用膜片钳技术的内面向外式方法记录单通道电流。经火抛光的玻璃微电极直径0.6~1 μm,电阻8~10 MΩ,微电极内充灌电极内液(mmol/L:KCl 140,CaCl2 2,EGTA 1,MgCl2 1,CdCl2 0.2,HEPES 10,pH 7.3(KOH)。玻璃 微电极由氯化银乏极化电极与CEZ-2200膜片钳放大器(日本光电公司)连接电流信号通过四 级低温滤波器滤波(频率1~3 kHz)后以RMG-5204四通磁带记录仪(日本光电公司)记录。
1.3 实验步骤
玻璃微电极经微电极操纵器(PF5-1,Narishige)推入浴槽与细胞接近,轻抽吸微电极,使细胞膜与玻璃微电极尖端紧密封接(电阻>10 GΩ);然后快速提起微电极,使电极下的膜片与细胞分离,形成内面向外式记录形式。由膜片钳放大器在+80~-80 mV范围内输出钳位电压,观察膜片上离子通道电流变化情况。选一易感钳位电压,待记录电流稳定后,于浴槽中加入不同浓度(0.001,0.01.0.1,1,2 mmol/L)ATP,观察ATP对通道 电流的影响(pH 7.3)。取能为ATP所阻断的离子通道,经浴槽灌流洗去浴槽液中ATP, 恢复离子通道活动;改变pH为6.0和8.0,观察酸、碱对离子通道电流的影响;再于浴槽液中加入不同浓度ATP,观察酸碱环境对通道ATP敏感性的影响。
, 百拇医药
1.4 实验试剂
Poly-L-lysine(多聚赖氨酸)、Trypsin(胰蛋白酶)、K2-ATP(三磷酸腺甘钾盐)、CdCl 2(氯化隔)均来源于Sigma公司,EGTA为进口分装,HEPES为日本Dojindo产品,乳酸钠为广州制剂公司生产,其余试剂来自国内制剂公司。
1.5 数据分析
用TL-1型125 kHz Labmaster DMA数据采集系统接口和Pclamp(5.5.1Axon Instrument US A)采集程序将原始数据采入计算机(Casper,PC 386/33),以 Pclamp分析程序进行自动测量,并进行通道电流幅度、通道开放时间和关闭时间等统计学处理。采样频率(数字化水平)5~10 kHz,测量开关忽视水平300 μm。全部数据用均数±标准差([ AKx-D]±s)表示,参数比较用t检验,P<0.05为相差显著。
, 百拇医药
2 结果
2.1 单通道的特性
2.1.1 通道的动力学特性 内面向外式记录形成后,由膜片钳放大器在± 8 mV范围内递级(±10 mV)输出钳位电压,可记录到一类常呈簇状(cluster openings)和猝 发样开放(burst openings)的双向单通道电流。其幅度随超极化或去极化程度加大而增大; 钳位电压为正值时,电流-电压(I-V)曲线近似直线,钳位电压为负值时,则为递增幅度逐 步减小的曲线(图1),呈外向整流。I-V曲线的斜率为通道电导,I-V曲线与电压横坐标相 交点即通道翻转电位。该类通道电导为200 pS左右(202±12.65 pS,n=16),翻转电位 为0 mV。通道的平均开放时间和开放概率(通道开放时间与总时间的比值Po)随去极化程度增 大而增加,随超极化程度增大而减少(图2)。
2.1.2 通道对ATP的敏感性 Vp=-40 mV时,浴槽液(pH7.3)中0.001 mm ol/L ATP可使其开放概率略有增加;而后,随ATP浓度增加,ATP对通道开放概率的抑制作用 逐步增强;当浴槽中ATP浓度逐步增高到1或2 mmol/L时,通道电流被阻断(n=6,图3)。
, 百拇医药
2.2 pH对通道的影响
2.2.1 pH对通道电流及电导的影响 在相同钳位电压下,浴槽液pH为6 .0和8.0时,通道电流幅度与pH 7.3时比较无明显改变。pH 6.0时,通道电导为(198.65 ±10.43)pS(n=10);pH8.0时,其电导为(201.72±12.26) pS(n=8);较pH7.3 时的电导(202±12.65pS)(n=16)无显著差异(P>0.05)。
Fig.1 Relationship between currents and clamp-voltges(n=16). Reversal potential was 0 mV. A outward current rec tification can be seen during depolarization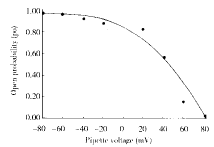
, 百拇医药
Fig.2 Voltage dependence of open pro bability of the channel. The curve is fitted with lease square method
Fig.3 Open probabilities (Po) w ith various concentration of ATP in bath solution. Vp=-60 mV. Pomax in 0.001 m mol/L ATP
2.2.2 pH对通道开放时间及概率的影响 当膜去极化时,通道开放己接近 最大限度,pH改变对通道的平均开放时间和开放概率无明显影响。而当膜超极化时,pH 6.0 组平均开放时间减少,开放概率降低;pH 8.0组通道平均开放时间及开放概率增加;Vp=+6 0 mV时,pH 6.0组和pH8.0组开放概率分别为2,20%±0.57%(n=10)和18.29%±4.0 5%(n=8);与pH 7.3时的开放概率8.41%±1.20%(n=16)比较有显 著差异(P<0.01,图4)。
, 百拇医药
Fig.4 Currents of KATP wi th pH 8.0(A),7.3(B),6.0(C)
The open probatbility with pH 8.0 was more and pH 6 .0 lease than pH7.3. vP=+60mV. Openings are upward
2.2.3 pH下降诱发多通道电流 当浴液由pH 7.3降为pH6.0时,有4 0% 通道,在原有一级开放的基础上出现二级甚至三级开放。在同一钳位电压下,第二级或第三 级电流幅度与第一级基本一致;Vp=+40 mV时,第一级电流幅度为(8.14±0.78)pA,第二 级电流幅度为(7.97±0.65)pA,无明显统计学差异(n=4,P>0.05,图5),表明为 单电导多通道电流。而当浴液pH重新调回7.3后,均能恢复原开放状态。
, http://www.100md.com
Fig.5 Doublechannel currents or multichannel currents with pH 6.0 at clamp voltage -60 mV. Openings are downwar d
2.2.4 pH对ATP作用的影响 当浴液pH 6.0时,ATP抑制通道开放概率的 量效曲线,与pH7.3时十分接近(n=6,P>0.05)。浴液pH 8.0时,ATP抑制通道开 放概率的量效曲线,也与pH 7.3时基本一致(n=5,P>0.05)。即表明浴液酸碱改 变对通道ATP敏感性无明显影响(图6)。
Fig.6 Open probabilities(Po) wi th various concentration of ATP is bath solution, when pHi is 6.0( ● )and 8.0 (○) Vp=-60 mV. Poma x in 0.001 mmol/L ATP
, http://www.100md.com
3 讨论
本实验内面向外式膜片内外采用对称高K+浓度,其K+平衡电位应为0 mV,与通道 翻转电位一致,所记录到的通道电流表明通道可能选择性地通透K+;电极液和浴槽液均 不含Na+,并用EGTA和CdCl2分别络合浴槽液中的Ca2+及阻断Ca2+通道;而 Cl-通道电导极大、一般不易记录,故实验所记录到的通道电流应为K+通道电流。该电 流能为ATP所阻断,即可确定该通道为ATP敏感钾通道。
本实验在急性分离的大鼠新皮层神经元上所记录到的KATP通道的平均开放时间 和开放概率随去极化程度的增加而增加,随超极化程度的增加而减小,与国外的大多数报道 一致[5,6,7]。通道电流随去极化程度增大而递增幅度逐步减小,表现出外向整 流现象,而非内向整流,这与Ohno-Shosaku[7]所记录到的KATP通道的外 向整流性相同。而所记录到的通道电导分布200 pS左右,较Achford[6]和Ohno-Sh osaku[7]在培养大鼠皮层神经元上报道的KATP通道电导略有不同;可能与 细胞的不同发育时期及细胞急性分离和培养间的差别有关。
, 百拇医药
本实验采用膜内面向外式记录方法在急性分离的大鼠皮层神经元上发现:1.膜超极化时,膜内pH下降,通道平均开放时间缩短,关闭时间延长,开放概率减小,pHi升高则相反;而去极化时,pHi改变对外向电流的影响不明显:pHi改变对单通道的电导无明显影响。2.ATP对通道的半效最大抑制浓度与正常对照无明显差别,提示:pHi改变不影响通道对ATP的敏感性。Davtes等[3]在蛙骨骼肌上发现胞内pH下降能轻微降低KATP通 道电导、增加外向电流平均开放时间和开放概率,而Fan等[8,9]在胰腺分泌细胞 上发现当pH下降到5.7以下时对通道活性有轻微的抑制作用,Prob等[4]却观察到 pHi下降对KATP通道有明显抑制作用。这些报道虽略有差异,而pHi下降可降低通道对 ATP的敏感是一致的。我们的实验结果与以上报道有差别,这可能与种属及组织差异有关, 就象琢鼠和猫心肌KATP通道的结构差异一样;也可能与实验条件和方法不同有关。3 .pHi下降可记录到通道的多级电流,第一级电流与第二级电流基本一致,分析表明为单电 导多通道电流。Fan等[10]在胞内酸时所记录到KATP通道的亚电导状态,并 认为,可能因pHi下降到6.5以下时改变KATP通道构型所致。提示:1 pHi下降可能改 变KATP通道构型导致多通道电流,2细胞膜上可能存在部分未开放的通道(或低敏感性 通道),并能为pHi下降所激活。由于实验条件有限,我们的实验只观察了pHi 8.0~6.0的 通道活性变化,pHi 6.0以下的变化有待于进一步实验。
, 百拇医药
从本实验结果可以推测:脑缺血缺氧时,神经细胞无氧代谢增强,胞内环境酸化,可激活KATP通道的多通道电流,使细胞膜超极化,降低神经元兴奋性,防止神经细胞的 兴奋毒作用,从而起到保护作用。而在酸化环境下,KATP通道开放所导致的膜超极化 又可通过减少通道开放概率而部分抑制通道开放。这表明:胞内氢离子可能是调节KA TP通道活动的因子和连接KATP通道与代谢活动的环节之一。有关证明尚待进一步研 究。
基金项目:国家自然科学基金(39570263)和广东省自然科学基金(950537) 资助项目
作者简介:肖中举(1965-),男,湖北仙桃人,讲师,硕士,从事神经生理 研究
参考文献
[1] TONG Zhen-qing, TANG Xiang-dong, YANG Wen-jun. Double-gating me chanism and diversity of an adenosine triphosphate (ATP)-sensitive K+ channel in neurons acutely dissociated from rat neocortex[J]. Science in China (Se ries C), 1997,40(1):10
, 百拇医药
[2] Tang X D,Tong X Q. An adenosine triphosphate(ATP)-sensitive K+ chan nel of rat neocortical neurons is bi-gated by intracellular ATP and voltage: a novel channel ga-ting me-chanism[J]? Neuroscience Letters, 1995 ,193(2):93
[3] Davies N W. Modulation of ATP-sensitive K+ channels in skeletal muscl e by intracellular protons. Nature, 1990,343(6256):375-377.
[4] Proks P, Takano M, Ashcroft F M. Effects of intracellular pH on ATP-sen sitive K+ channels in mouse pancreatic beta-cells[J]. J Physiol (Lond) ,1994,475(1):33-44.
, 百拇医药
[5] Rowe I C, Boden P R, Ashford M L. Potassium channel dysfunction in hyp othalamic glucose-receptive neurones of obese Zucker rats[J]. J Physiol (L ond),1996,497(Pt 2):365-377.
[6] Ashford M L J, Boden P R, Treherne J M. Glucose-induced excitation of hypo-thalamic neurons is mediated by ATP-sensitive K+ channels[J]. Pfl ugers Arch, 1990,415:479-483.
[7] Ohno-Shosaku T, Yamamoto C. Identification of an ATP-sensitive K+cha nnel in rat cultured cortical neurons[J]. Pflugers Arch, 1992,422(3):260 -266.
, 百拇医药
[8] Fan Z, Tokuyama Y, Makielski J C. Modulation of ATP-sensitive K+ chan nels by internal acidification in insulin-secreting cells[J]. Am J Physiol , 1994,267(4 Pt 1):C1036-1044.
[9] Fan Z, Makielski J C. Intracellular H+ and Ca2+ modulation of tr ypsin-modified ATP-sensitive K+ channels in rabbit ventricular myocytes[J ]. Circ Res, 1993,72(3):715-722.
[10] Fan Z, Furukawa T, Makielski J C, et al. Cytoplasmic acidosis induce s multiple conductance states in ATP-sensitive potassium channels of cardiac myo cytes[J]. J Membr Biol, 1993,136(2):169-179.
收稿日期:1998年6月25日;修回日期:1999年6月28日, http://www.100md.com
单位:第一军医大学生理教研室,广州 510515
关键词:pHi;ATP敏感钾通道;皮层神经元
中国应用生理学杂志000101摘要 目的和方法:采用膜片钳技术之膜内面向外记录方法,在急性分离大鼠皮层 神经元上,研究胞内酸碱环境改变对神经元ATP敏感钾通道的影响。结果:Vp=+6 0 mV时,pH 6.0组开放概率2.20%±0.57%(n=10)较pH7.3时的开放概率8.41% ±1.20%(n=16)显著降低(P<0.01);pH 8.0组开放概率18.29%±4.05%( n=8)较pH 7.3时明显增加(P<0.01)。当浴液由pH 7.3降为pH 6.0时,有40%出现 多级通道电流并可逆转。当浴液pH 6.0及pH 8.0时,ATP抑制通道开放概率的量效曲 线,与pH 7.3时比较无明显改变(P>0.05)。结论:脑细胞内氢离子可能 参与KATP通道的调节:胞内酸化环境可进一步激活KATP通道多级电流,保护脑 缺血缺氧损伤;而KATP,通道开放,膜超极化到一定程度,胞内酸化环境又可抑制通 道开放。
, 百拇医药
中图分类号: R338.8文献标识码:A 文章编号:1000-6834(2000)01-0001-05
THE EFFECTS OF INTRACELLULAR pHi ON ATP-SENSITIVE POTASSIUM CHANNELS IN ACUTELY DISSOCIATED-CEREBRAL NEURONS OF RATS
XIAO Zhong-ju, SHU Ping, GAO Tian-ming, TONG Zhen-qing
(Physiological Department, First Military Medical University, Gua ngzhou 510515)
ABSTRACT
, 百拇医药 Aim and Methods: Using inside-out configuration of patch-clamp techniq ue, the effects of intracellular pH on KATP channels were studied in acute ly dissociated cerebral neurons of rats. Results: The probability of group pH 6.0 (2.20%±0.57%,n=10) was lower than pH 7.3(8.41%±1.2%,n=16 ,P<0.01), and that of group pH 8.0 (18.29%±4.05%,n=8) higher than pH 7. 3(P<0.01) as the membrane potential held at hyperpolarization (+60 mV). Lowi ng pH of bath solution from 7.3 to 6.0, multichannel currents were seen at 40%. After reversing, that could recover to its original level. The inhibitory eff ect of ATP on channel open probabilities at pH 6.0 or 8.0 didn't change obviousl y from pH 7.3(P>0.05). Conclution: Intracellular H+ could prob ably take part in regulating KATP channel by activating multi-channel cur rents of KATP channel or by inhibiting exceed activity of KATPchann el.
, 百拇医药
KEY WORDS: pHi; ATP-sensitive K+ channel; cerebral neurons
脑在缺氧情况下,葡萄糖无氧酵解增加,脑细胞内酸化是其早期改变之一。我室对脑缺血缺氧的长期研究表明,脑在缺血缺氧情况下,ATP敏感钾(KATP)通道可通过神经 节苷脂的门控作用大量开放,使细胞膜超极化,降低神经元兴奋性,从而防止神经细胞的兴 奋毒作用[1,2]。Davies[3]及Proks[4]等证明骨骼肌细胞内pH 值下降可减低胞内ATP对细胞膜上KATP通道的抑制作用,而在神经元上尚未见类似报 道。本实验用膜片钳内面向外式记录方法,观察浴液酸碱环境改变对急性分离大鼠新皮层神 经元KATP通道特性及其对ATP敏感性的影响,进一步探索KATP通道活动对脑神 经细胞缺血缺氧的保护机制。
, http://www.100md.com
1 材料和方法
1.1 大鼠皮层神经元的急性分离
取3~7日龄SD大鼠断头,取大脑皮层,切成厚约0.4 mm的冠状脑片,置于通有95%O2和5%CO2混合气体的人工脑脊液[ACSF(mmol/L):NaCl 142,KCl 5,CaCl2 2,MgSO4 2,D-Glucose 10,HEPES 10,pH 7.3]中孵育1 h后 ,再在通有95%O2和5%CO2混合气体的0.1%胰蛋白酶(用ACSF配制)溶液中消化3 mi n。消化好的脑片以ACSF冲洗、剪碎,于ACSF中以玻璃吸管吹打成细胞悬液,并移数滴至覆 盖有多聚赖氨酸的盖玻片上,待细胞贴壁(5~10 min后,置浴槽进行实验。浴槽液成分为(m mol/L):KCl 140,CaCl2 0.9,EGTA 1,MgCl2 1,HEPSE 10,pH 7.3(KOH)。整个 实验在18~25℃下进行。1.2 单通道电流记录
, 百拇医药
本实验采用膜片钳技术的内面向外式方法记录单通道电流。经火抛光的玻璃微电极直径0.6~1 μm,电阻8~10 MΩ,微电极内充灌电极内液(mmol/L:KCl 140,CaCl2 2,EGTA 1,MgCl2 1,CdCl2 0.2,HEPES 10,pH 7.3(KOH)。玻璃 微电极由氯化银乏极化电极与CEZ-2200膜片钳放大器(日本光电公司)连接电流信号通过四 级低温滤波器滤波(频率1~3 kHz)后以RMG-5204四通磁带记录仪(日本光电公司)记录。
1.3 实验步骤
玻璃微电极经微电极操纵器(PF5-1,Narishige)推入浴槽与细胞接近,轻抽吸微电极,使细胞膜与玻璃微电极尖端紧密封接(电阻>10 GΩ);然后快速提起微电极,使电极下的膜片与细胞分离,形成内面向外式记录形式。由膜片钳放大器在+80~-80 mV范围内输出钳位电压,观察膜片上离子通道电流变化情况。选一易感钳位电压,待记录电流稳定后,于浴槽中加入不同浓度(0.001,0.01.0.1,1,2 mmol/L)ATP,观察ATP对通道 电流的影响(pH 7.3)。取能为ATP所阻断的离子通道,经浴槽灌流洗去浴槽液中ATP, 恢复离子通道活动;改变pH为6.0和8.0,观察酸、碱对离子通道电流的影响;再于浴槽液中加入不同浓度ATP,观察酸碱环境对通道ATP敏感性的影响。
, 百拇医药
1.4 实验试剂
Poly-L-lysine(多聚赖氨酸)、Trypsin(胰蛋白酶)、K2-ATP(三磷酸腺甘钾盐)、CdCl 2(氯化隔)均来源于Sigma公司,EGTA为进口分装,HEPES为日本Dojindo产品,乳酸钠为广州制剂公司生产,其余试剂来自国内制剂公司。
1.5 数据分析
用TL-1型125 kHz Labmaster DMA数据采集系统接口和Pclamp(5.5.1Axon Instrument US A)采集程序将原始数据采入计算机(Casper,PC 386/33),以 Pclamp分析程序进行自动测量,并进行通道电流幅度、通道开放时间和关闭时间等统计学处理。采样频率(数字化水平)5~10 kHz,测量开关忽视水平300 μm。全部数据用均数±标准差([ AKx-D]±s)表示,参数比较用t检验,P<0.05为相差显著。
, 百拇医药
2 结果
2.1 单通道的特性
2.1.1 通道的动力学特性 内面向外式记录形成后,由膜片钳放大器在± 8 mV范围内递级(±10 mV)输出钳位电压,可记录到一类常呈簇状(cluster openings)和猝 发样开放(burst openings)的双向单通道电流。其幅度随超极化或去极化程度加大而增大; 钳位电压为正值时,电流-电压(I-V)曲线近似直线,钳位电压为负值时,则为递增幅度逐 步减小的曲线(图1),呈外向整流。I-V曲线的斜率为通道电导,I-V曲线与电压横坐标相 交点即通道翻转电位。该类通道电导为200 pS左右(202±12.65 pS,n=16),翻转电位 为0 mV。通道的平均开放时间和开放概率(通道开放时间与总时间的比值Po)随去极化程度增 大而增加,随超极化程度增大而减少(图2)。
2.1.2 通道对ATP的敏感性 Vp=-40 mV时,浴槽液(pH7.3)中0.001 mm ol/L ATP可使其开放概率略有增加;而后,随ATP浓度增加,ATP对通道开放概率的抑制作用 逐步增强;当浴槽中ATP浓度逐步增高到1或2 mmol/L时,通道电流被阻断(n=6,图3)。
, 百拇医药
2.2 pH对通道的影响
2.2.1 pH对通道电流及电导的影响 在相同钳位电压下,浴槽液pH为6 .0和8.0时,通道电流幅度与pH 7.3时比较无明显改变。pH 6.0时,通道电导为(198.65 ±10.43)pS(n=10);pH8.0时,其电导为(201.72±12.26) pS(n=8);较pH7.3 时的电导(202±12.65pS)(n=16)无显著差异(P>0.05)。

Fig.1 Relationship between currents and clamp-voltges(n=16). Reversal potential was 0 mV. A outward current rec tification can be seen during depolarization

, 百拇医药
Fig.2 Voltage dependence of open pro bability of the channel. The curve is fitted with lease square method

Fig.3 Open probabilities (Po) w ith various concentration of ATP in bath solution. Vp=-60 mV. Pomax in 0.001 m mol/L ATP
2.2.2 pH对通道开放时间及概率的影响 当膜去极化时,通道开放己接近 最大限度,pH改变对通道的平均开放时间和开放概率无明显影响。而当膜超极化时,pH 6.0 组平均开放时间减少,开放概率降低;pH 8.0组通道平均开放时间及开放概率增加;Vp=+6 0 mV时,pH 6.0组和pH8.0组开放概率分别为2,20%±0.57%(n=10)和18.29%±4.0 5%(n=8);与pH 7.3时的开放概率8.41%±1.20%(n=16)比较有显 著差异(P<0.01,图4)。

, 百拇医药
Fig.4 Currents of KATP wi th pH 8.0(A),7.3(B),6.0(C)
The open probatbility with pH 8.0 was more and pH 6 .0 lease than pH7.3. vP=+60mV. Openings are upward
2.2.3 pH下降诱发多通道电流 当浴液由pH 7.3降为pH6.0时,有4 0% 通道,在原有一级开放的基础上出现二级甚至三级开放。在同一钳位电压下,第二级或第三 级电流幅度与第一级基本一致;Vp=+40 mV时,第一级电流幅度为(8.14±0.78)pA,第二 级电流幅度为(7.97±0.65)pA,无明显统计学差异(n=4,P>0.05,图5),表明为 单电导多通道电流。而当浴液pH重新调回7.3后,均能恢复原开放状态。

, http://www.100md.com
Fig.5 Doublechannel currents or multichannel currents with pH 6.0 at clamp voltage -60 mV. Openings are downwar d
2.2.4 pH对ATP作用的影响 当浴液pH 6.0时,ATP抑制通道开放概率的 量效曲线,与pH7.3时十分接近(n=6,P>0.05)。浴液pH 8.0时,ATP抑制通道开 放概率的量效曲线,也与pH 7.3时基本一致(n=5,P>0.05)。即表明浴液酸碱改 变对通道ATP敏感性无明显影响(图6)。

Fig.6 Open probabilities(Po) wi th various concentration of ATP is bath solution, when pHi is 6.0( ● )and 8.0 (○) Vp=-60 mV. Poma x in 0.001 mmol/L ATP
, http://www.100md.com
3 讨论
本实验内面向外式膜片内外采用对称高K+浓度,其K+平衡电位应为0 mV,与通道 翻转电位一致,所记录到的通道电流表明通道可能选择性地通透K+;电极液和浴槽液均 不含Na+,并用EGTA和CdCl2分别络合浴槽液中的Ca2+及阻断Ca2+通道;而 Cl-通道电导极大、一般不易记录,故实验所记录到的通道电流应为K+通道电流。该电 流能为ATP所阻断,即可确定该通道为ATP敏感钾通道。
本实验在急性分离的大鼠新皮层神经元上所记录到的KATP通道的平均开放时间 和开放概率随去极化程度的增加而增加,随超极化程度的增加而减小,与国外的大多数报道 一致[5,6,7]。通道电流随去极化程度增大而递增幅度逐步减小,表现出外向整 流现象,而非内向整流,这与Ohno-Shosaku[7]所记录到的KATP通道的外 向整流性相同。而所记录到的通道电导分布200 pS左右,较Achford[6]和Ohno-Sh osaku[7]在培养大鼠皮层神经元上报道的KATP通道电导略有不同;可能与 细胞的不同发育时期及细胞急性分离和培养间的差别有关。
, 百拇医药
本实验采用膜内面向外式记录方法在急性分离的大鼠皮层神经元上发现:1.膜超极化时,膜内pH下降,通道平均开放时间缩短,关闭时间延长,开放概率减小,pHi升高则相反;而去极化时,pHi改变对外向电流的影响不明显:pHi改变对单通道的电导无明显影响。2.ATP对通道的半效最大抑制浓度与正常对照无明显差别,提示:pHi改变不影响通道对ATP的敏感性。Davtes等[3]在蛙骨骼肌上发现胞内pH下降能轻微降低KATP通 道电导、增加外向电流平均开放时间和开放概率,而Fan等[8,9]在胰腺分泌细胞 上发现当pH下降到5.7以下时对通道活性有轻微的抑制作用,Prob等[4]却观察到 pHi下降对KATP通道有明显抑制作用。这些报道虽略有差异,而pHi下降可降低通道对 ATP的敏感是一致的。我们的实验结果与以上报道有差别,这可能与种属及组织差异有关, 就象琢鼠和猫心肌KATP通道的结构差异一样;也可能与实验条件和方法不同有关。3 .pHi下降可记录到通道的多级电流,第一级电流与第二级电流基本一致,分析表明为单电 导多通道电流。Fan等[10]在胞内酸时所记录到KATP通道的亚电导状态,并 认为,可能因pHi下降到6.5以下时改变KATP通道构型所致。提示:1 pHi下降可能改 变KATP通道构型导致多通道电流,2细胞膜上可能存在部分未开放的通道(或低敏感性 通道),并能为pHi下降所激活。由于实验条件有限,我们的实验只观察了pHi 8.0~6.0的 通道活性变化,pHi 6.0以下的变化有待于进一步实验。
, 百拇医药
从本实验结果可以推测:脑缺血缺氧时,神经细胞无氧代谢增强,胞内环境酸化,可激活KATP通道的多通道电流,使细胞膜超极化,降低神经元兴奋性,防止神经细胞的 兴奋毒作用,从而起到保护作用。而在酸化环境下,KATP通道开放所导致的膜超极化 又可通过减少通道开放概率而部分抑制通道开放。这表明:胞内氢离子可能是调节KA TP通道活动的因子和连接KATP通道与代谢活动的环节之一。有关证明尚待进一步研 究。
基金项目:国家自然科学基金(39570263)和广东省自然科学基金(950537) 资助项目
作者简介:肖中举(1965-),男,湖北仙桃人,讲师,硕士,从事神经生理 研究
参考文献
[1] TONG Zhen-qing, TANG Xiang-dong, YANG Wen-jun. Double-gating me chanism and diversity of an adenosine triphosphate (ATP)-sensitive K+ channel in neurons acutely dissociated from rat neocortex[J]. Science in China (Se ries C), 1997,40(1):10
, 百拇医药
[2] Tang X D,Tong X Q. An adenosine triphosphate(ATP)-sensitive K+ chan nel of rat neocortical neurons is bi-gated by intracellular ATP and voltage: a novel channel ga-ting me-chanism[J]? Neuroscience Letters, 1995 ,193(2):93
[3] Davies N W. Modulation of ATP-sensitive K+ channels in skeletal muscl e by intracellular protons. Nature, 1990,343(6256):375-377.
[4] Proks P, Takano M, Ashcroft F M. Effects of intracellular pH on ATP-sen sitive K+ channels in mouse pancreatic beta-cells[J]. J Physiol (Lond) ,1994,475(1):33-44.
, 百拇医药
[5] Rowe I C, Boden P R, Ashford M L. Potassium channel dysfunction in hyp othalamic glucose-receptive neurones of obese Zucker rats[J]. J Physiol (L ond),1996,497(Pt 2):365-377.
[6] Ashford M L J, Boden P R, Treherne J M. Glucose-induced excitation of hypo-thalamic neurons is mediated by ATP-sensitive K+ channels[J]. Pfl ugers Arch, 1990,415:479-483.
[7] Ohno-Shosaku T, Yamamoto C. Identification of an ATP-sensitive K+cha nnel in rat cultured cortical neurons[J]. Pflugers Arch, 1992,422(3):260 -266.
, 百拇医药
[8] Fan Z, Tokuyama Y, Makielski J C. Modulation of ATP-sensitive K+ chan nels by internal acidification in insulin-secreting cells[J]. Am J Physiol , 1994,267(4 Pt 1):C1036-1044.
[9] Fan Z, Makielski J C. Intracellular H+ and Ca2+ modulation of tr ypsin-modified ATP-sensitive K+ channels in rabbit ventricular myocytes[J ]. Circ Res, 1993,72(3):715-722.
[10] Fan Z, Furukawa T, Makielski J C, et al. Cytoplasmic acidosis induce s multiple conductance states in ATP-sensitive potassium channels of cardiac myo cytes[J]. J Membr Biol, 1993,136(2):169-179.
收稿日期:1998年6月25日;修回日期:1999年6月28日, http://www.100md.com