阵发性心房颤动局灶性消融治疗的方法学
作者:马长生 杨延宗 刘旭 刘兴鹏
单位:马长生(中日友好医院心内科 北京 100029);杨延宗(大连医科大学第一附属医院心内科);刘旭(上海胸科医院心内科);刘兴鹏(中日友好医院心内科 北京 100029)
关键词:
中国心脏起搏与心电生理杂志000121分类号:R541.7+5 R454.1 文献标识码:A
文章编号:1007—2659(2000)01—0057—10▲
目前认为,绝大多数阵发性心房颤动(简称房颤)均为局灶性起源。局灶性消融是应用射频能量消融诱发房颤的异位兴奋灶来根治阵发性房颤的一项技术,其疗效已得到临床研究的证实,被认为是近年来房颤非药物治疗的一项重要进展[1~4]。由于阵发性房颤的异位兴奋灶绝大多数(约占90%以上)位于肺静脉,特别是双上肺静脉[3,4],使得这一治疗的操作程序有别于其他心律失常的射频消融治疗,其技术难度高、并发症的风险亦显著增大。由于这一治疗最近2~3年才在国内外的少数医疗中心开展,故目前尚缺少有关技术操作的论述。笔者于1998年8月至2000年1月已完成54例阵发性房颤的电生理检查,其中42例同时进行了局灶性消融治疗,现就其方法学做一介绍。
, http://www.100md.com
1 标测电极置放
一般常规放置4根标测电极导管,即高位右房(HRA)或右房Halo电极、冠状静脉窦(CS)及双上肺静脉(PV)电极。由于肺静脉在单纯X线影像上并无特殊标志,而左肺静脉和左心耳的毗邻关系又很近[5],故操作不当可能导致左房穿孔。为避免或最大限度减少这一并发症的发生,我们一般在行房间隔穿刺前常规行主肺动脉造影观察双上肺静脉走行及其与左房,特别是左心耳的关系。以下就标测电极置放的3个主要步骤分别进行介绍。
1.1 肺动脉造影 ①将6F端孔右心导管送至肺动脉,经0.035 inch直径的260 cm长交换导丝送入肺动脉远端,然后沿导丝送入6F猪尾造影管。②在左前斜位(LAO)45°投照下用高压注射器进行造影,观察左、右上肺静脉显影情况(图1A)。记录时间应包括肺动脉、双上肺静脉及左房显影的全过程。造影剂总量一般在35~40 ml、速度16 ml/s、压力400 kpa。③如显影下肺静脉,则须行选择性下肺动脉造影。在行左下肺动脉造影时,笔者体会LAO 60°较45°能更清楚地展示左下肺静脉与左房的关系(图1B)。从而有利于避免标测导管误穿左心耳,导致穿孔和严重的心包填塞等并发症。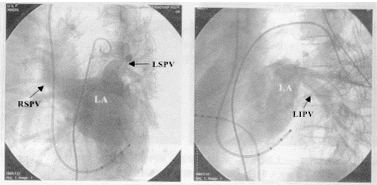
, 百拇医药
图1 肺动脉造影显示肺静脉解剖 左图:LAO 45°主肺动脉造影显示左、右上肺静脉(LSPV,RSPV)走行与开口;右图:LAO 60°左下肺动脉选择性造影显示左下肺静脉(LIPV)开口与走行
1.2 房间隔穿刺 房间隔穿刺术的关键是穿刺部位和穿刺方向的判断,笔者体会后前位结合右前斜位(RAO)45°透视是选择房间隔穿刺点的最佳选择[6]。其操作要领可简单归纳为“后前位定高低,RAO 45°定方向”。后前位透视下以左心房影下缘(相当于冠状静脉窦口水平)上方一个椎体高度为穿刺点高度,在这一高度上以RAO 45°透视下心房影左(后)缘前方2~3 cm处(相当于一个椎体高度)处为穿刺点,然后辅以RAO 45°透视观察穿刺针远段走形,即按前面的原则定点后适当调整穿刺针的方向,以穿刺针远段呈一直线为好,但允许微小偏移。确定好穿刺点后,将穿刺针轻轻向前推送即可刺破卵圆窝进入左心房。穿刺成功最为简便可靠的征象是从穿刺针注射造影剂时在左房内显影(图2)。已证实穿刺针进入左心房后,逐一沿穿刺针推送Swartz内、外鞘管(L1或R0)进入左房,退出内鞘管与穿刺针后静脉注射肝素5 000单位,以后每小时注射1 000单位。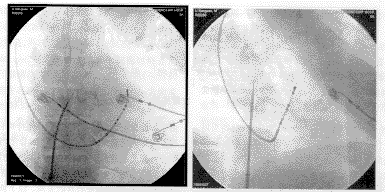
, http://www.100md.com
图2 房间隔穿刺术 左图:后前位;右图:RAO 45°
1.3 肺静脉电极置放 不同实验室放置肺静脉电极的方法略有不同。我们及台湾Chen的实验室一般常规放置2根10极(2-8-2 mm)标测电极至左、右上肺静脉进行同步标测[7~9],而法国Haissaguerre的实验室则是根据电生理检查时房性早搏(简称房早)的多少决定是放置一根还是两根标测导管,房早少时行双上肺静脉同步标测,房早多时则仅放置一根标测电极(根据'99NASPE会议发言)。此外,还有作者报道于4个肺静脉各放置1根标测电极导管进行同步标测[10,11]。我们体会,同时放置双上肺静脉电极的优点是可最大限度地覆盖异位兴奋灶的常见部位,从而缩短标测时间,并有利于消融时做固定参照;其不足之处是须行两次房间隔穿刺,但已有研究表明这一方法不会造成有病理意义的房间隔缺损[12]。在置入肺静脉电极的方法上我们采用大头导管法,即依次将8F SR0和SL1型号的Swartz鞘管送入左房后,经鞘管送入7F顶端可弯曲部分为2.5 inch的消融导管,在肺静脉影像的指示下依次将其置入左、右上肺静脉较深处,然后再沿消融导管推送鞘管至左、右上肺静脉内,SR0鞘管进入左上肺静脉,SL1鞘管进入右上肺静脉,到位后撤出消融导管,推送两根5F 10级标测导管(2-8-2mm,Diag)至左、右上肺静脉(图3)。用Swartz鞘管行选择性左、右上肺静脉造影,在LAO 45°下确定肺静脉开口部位(定义为肺静脉与左心房的交界处),然后回撤鞘管,调整标测电极9,10(近端电极)至肺静脉开口部(图4,5)。如电生理检查提示异位兴奋灶位于下肺静脉,则行左下和(或)右下肺静脉标测。因标测电极需经过的Swartz鞘管较硬,不易进入下肺静脉(特别是右下肺静脉),且标测下肺静脉的机会较少,标测的范围亦较上肺静脉局限,故常使用消融导管进行标测(图6)。
, 百拇医药
图3 肺静脉电极的置放——大头导管法 A:大头导管进入RSPV;B:沿鞘管将标测电极置入RSPV后,行第二次房间隔穿刺;C:调整大头导管进入LSPV;D:沿鞘管将标测电极置入LSPV
图4 选择性肺静脉造影显示肺静脉开口部位 左图:RSPV造影;右图:LSPV造影
图5 双上肺静脉标测电极放置到位
图6 下肺静脉标测电极的置放 左图:右下肺静脉(RIPV)标测(RAO 30°)。选择性右下肺动脉造影(经右心导管)显示RIPV走行及开口后指引消融导管进入RIPV。右图:LIPV标测(LAO 60°)。选择性肺静脉造影(经鞘管)显示LIPV开口及消融导管在LIPV内的位置
, http://www.100md.com
2 电生理检查
2.1 肺静脉电图特征 窦性心律时在肺静脉内常可记录到双电位:前一电位频率较低,为心房电位;后一电位频率较高,被称做尖峰电位(spike potential)或肺静脉电位(pulmonary vein potential)。肺静脉内能记录到尖峰电位的部位多在距肺静脉开口4 cm以内。在肺静脉开口部,尖峰电位常紧随心房电位或与心房电位的终末部融合;而在肺静脉深部,尖峰电位则与心房电位明显分开,甚至出现等电位线,呈现由肺静脉开口部向深部的激动传导模式。当有起源于肺静脉的房早或房颤时,肺静脉内的尖峰电位跃至心房电位之前,且肺静脉的激动顺序与窦性心律(简称窦律)时相反,表现为由深部向开口部传导(图7,8),在传导过程中可出现文氏传导甚至传导阻滞(图9)[13]。提前出现的单个尖峰电位往往仅能诱发孤立性房早,而连续多个尖峰电位则往往引发房颤。局灶异位兴奋发动房颤常呈两种形式,最常见的形式是多个(少数情况下为1个)快速异位激动仅发动房颤,而无明显证据表明其参与了房颤的维持,即局灶触发(focal trigger)机制(图9,10)。另一种形式是局灶异位兴奋持续以恒定的顺序激动整个心房,而体表心电图表现为房颤,即局灶驱动(focal driver)机制(图11)[14]。异位灶发放快速冲动的机制尚不清楚,但其周长明显不规则及程序期前刺激难以将其诱发的特性基本可排除折返机制,而β-受体阻断剂和钙通道阻断剂均可抑制由房早诱发的房颤则表明自律性升高和触发活动是可能的机制[4]。
, http://www.100md.com
图7 窦律及房早时的肺静脉电图 LSPV 9,10位于LSPV开口部,LSPV 5,6位于LSPV开口内2 cm处。窦律时尖峰电位在心房电位之后,且呈由肺静脉开口部→深部的传导方向;房早时尖峰电位跃至心房电位之前。因异位兴奋灶位于距肺静脉开口1 cm处(LSPV 7,8),故激动同时向深部及开口部传导(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:197)
图8 房早时双上肺静脉同步标测电图 R(L)SPV 5,6位于肺静脉开口部,R(L)SPV 1,2位于肺静脉内2 cm处。窦律时RSPV内尖峰电位位于心房电位之后,房早时尖峰电位跃至心房电位之前。而窦律及房早时LSPV的激动相均为开口→深部传导。箭头所示为尖峰电位(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:134)
, 百拇医药
图9 肺静脉内的递减传导及传导阻滞现象 异位兴奋灶位于RSPV开口内1cm处(RSPV 7,8),由其发放的快速激动在向开口部(RSPV 9,10)的传导过程中发生递减传导直至传导阻滞,同时诱发了房颤(引自马长生,等.中华心律失常学杂志,2000,4:19)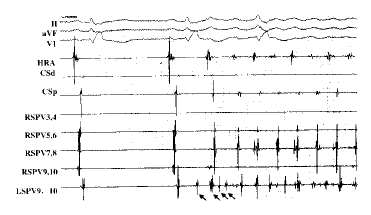
图10 阵发性房颤发生的局灶触发机制 体表心电图显示两个窦性激动之后出现一个房早(未下传),该房早随后诱发了房颤。心内记录显示房早时心房最早激动位于LSPV开口部(LSPV 9,10),该处出现短阵快速尖峰电位(箭头所指)并触发了房颤。尖峰电位的周长显著不规则(引自马长生,等.中华心律失常学杂志,2000,4:19)
图11 阵发性房颤发生和维持的局灶驱动机制 异位兴奋灶位于RSPV开口内1 cm处(RSPV 7,8),第一个尖峰电位(*)引发房颤后,随后的尖峰电位节律不规则,但心房激动顺序恒定,均为RSPV7,8处最早激动,体表心电图表现为房颤(引自马长生,等.中华心律失常学杂志,2000,4:19)
, 百拇医药
2.2 房早/房颤的诱发 异位兴奋灶的确定无疑需要有足够多的房早/房颤可供分析,由于部分患者在电生理检查过程中自发的房早/房颤数目过少及出于对消融效果进行术中评价的考虑,使得在绝大多数情况下必须进行房早/房颤的诱发。尽管目前文献报道没有一种诱发方案的成功率超过50%,但Shah 等[15]报道静脉滴注(简称静滴)异丙肾上腺素、Valsalva动作、慢频率(100~200bpm)及快频率(200~300 bpm)心房起搏等四种诱发方案的总成功率已达85%。Hsieh等[16]报道静滴异丙肾上腺素、心房起搏、burst刺激诱发房颤后电复律等三种方案诱发房颤的总成功率可高达89.7%。这些结果表明,尽管寻找一种可靠、高效、重复性好的诱发方案仍是今后重要的研究方向之一,但现有的方法已有足够的可行性。需要指出的是,以上研究中的病人均属高度选择(房颤发作频繁且伴有频发房早)的对象,对发作不频繁的阵发性房颤的诱发率可能较此为低。我们在术中一般单独或合并应用静滴异丙肾上腺素(2~4 μg/min)、心房起搏(200~300 bpm)、Valsalva动作、burst刺激诱发房颤后电复律等四种方法,如术中房颤持续(时间>20 min)则静脉推注普罗帕酮或者电复律。
, 百拇医药
2.3 消融靶点的确定 由于就现有的研究结果尚难以在房颤发作时确定异位兴奋灶的部位,而与房颤并存的房早又常和房颤具有共同起源,故目前房颤的局灶性消融实际上是根据房早或房颤开始发作时的心内激动顺序,以局部激动较体表心电图P′波起点或其它参考电位最为提前处为消融靶点。由于与房颤并存的房早有的能诱发房颤,而有的仅为孤立性房早,究竟何种房早需要消融目前尚无一致意见。Chen等[4]仅消融能够诱发房颤或快速、反复性心房搏动的房早,而对于孤立性房早则不予处理。我们的方法是,根据心内多部位同步标测确定的房早起源部位的不同而给与不同的处理。对起源于肺静脉的房早无论是否诱发房颤或反复性心房搏动均予消融,而对起源于心房或上腔静脉的房早除非有引发房颤的证据,否则不予消融。这一原则的理论基础包括:①引发房颤的房早绝大多数起源于肺静脉已是公认的事实,而这其中不可能每个房早均一定诱发房颤;②由于左房后壁肌纤维具有高度的各向异性传导特性,所以某些起源于肺静脉的房早尽管在术中并未引发房颤,但却难以保证其在术后不引发房颤。
在消融靶点的确定上,肺静脉电图具有关键作用。房早时如双上肺静脉多点同步标测显示为完全不同的激动传导方向,常表明异位兴奋灶即位于其中的一根肺静脉,该肺静脉的激动顺序呈由深部至开口部的传导方向,而对侧肺静脉则与窦律时相同,仍呈由开口部至深部的传导模式(图8,12)。但应注意的是,当异位灶位于某一肺静脉的正开口部位时,双上肺静脉都可呈现由开口部向深部传导的顺序,但此时靶点所在肺静脉的局部电位常较对侧明显提前(图13)。若双上肺静脉开口部几乎同时激动,且各自的激动顺序均显示由开口部向深部的传导,则表明双上肺静脉均为被动激动,提示异位兴奋灶可能位于下肺静脉(图14)。若右肺静脉开口部几乎同时激动且冠状窦远端电位提前常表明靶点位于左肺静脉(图15)。总之,在根据肺静脉电图判断靶点所在肺静脉时,应强调局部电位的提前程度与心内激动顺序相结合的方法。对于异位灶位于心房的阵发性房颤,其靶点亦根据局部电位的提前程度来确定(图16)。
, http://www.100md.com
图12 异位兴奋灶位于LSPV内4 cm处的靶点电位图 房早时,LSPV呈深部→开口部的传导,且LSPV1,2(开口内4 cm)处最早激动,以消融电极于此处及附近细标,记录到较体表心电图P'波起点提前131ms的尖峰电位,于此处消融获得成功(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:197)
图13 靶点电位图(异位兴奋灶位于LSPV开口部) 房早时,LSPV开口(LSPV9,10)部尖峰电位跃至心房电位之前,于LSPV 9,10电极附近记录到较体表心电图P′起点提前86 ms的靶点,于此处消融获得成功
图14 双上肺静脉同步标测提示异位灶位于下肺静脉 RSPV和LSPV在窦律和诱发房颤的房早发生时均呈由开口部向深部的传导顺序,且开口部几乎同时激动,排除异位灶位于上肺静脉的可能性,该例经行下肺静脉标测及射频消融证实异位灶位于LIPV
, 百拇医药
图15 右肺静脉及CS同步标测提示异位灶位于左肺静脉 房颤发作时CS远端电极最先激动,且右上、下肺静脉几乎同时激动,二者均提示异位灶位于左肺静脉。最终电生理检查证实异位灶位于左下肺静脉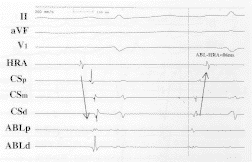
图16 靶点电位图(异位兴奋灶位于左房后侧壁) 房早时CS呈由远及近的传导顺序,且高右房激动落后,提示异位灶位于左肺静脉,最终于左房后侧壁LIPV下方1cm处标测到最提前电位并消融成功。
右房及CS内标测简便易行,仔细分析其电图特征不仅对于判断异位灶位于右房的阵发性房颤具有重要意义,有时还能为肺静脉异位灶具体部位的判断提供线索。Haissaguerre等[3]认为,房早时如右房内多点记录的双极电图较体表ECG异位P′波的起点提前程度>10ms,则不能排除异位灶位于右房的可能。Roithinger等[17]对18例无器质性心脏病的房颤患者于左房后壁进行起搏,发现有5例右房最早激动点位于Bachmann束的假定插入点(即高位右房附近),表明来自肺静脉的激动可能通过Bachmann束的传导而使高位右房提前激动。Ashar等[18]报道7例阵发性房颤患者,起搏右肺静脉时,CS均呈由近及远的激动顺序;起搏左肺静脉时,CS呈由远及近传导顺序者占86%(12/14),另有2根左上肺静脉在起搏时其最早激动部位在CS中部。Hwang等[19]亦发现,起源于左上肺静脉的房早常存在CS的较早激动,并认为其原因可能与左上肺静脉和CS之间有Marshall韧带相连有关。
, 百拇医药
体表心电图亦在靶点位置的初步确定上具有一定的作用。Haissaguerre等[20]曾报道体表心电图呈P′on T现象的房早其异位灶绝大多数位于肺静脉,且起源于上肺静脉的房早其P′波在Ⅱ、Ⅲ、aVF导联呈正向,而起源于下肺静脉者P′波在上述导联呈负向。但我们的经验表明,部分下肺静脉起源的房早其P′波可呈双向或极性不明显,少数情况下甚至呈正向。后者可能和该下肺静脉较为粗大及异位灶位于肺静脉的上壁有关。此外,多数阵发性房颤病人难以记录到房早的12导联心电图,故我们认为根据P′波形态判断房早的具体起源部位价值不大,确切定位仍有赖于对心内电图的识别。
靶点电位图的特征包括:局部双极电位较体表心电图P′波起点最为提前;多个房早或多阵房颤开始发作时的心房激动顺序具有一致性;肺静脉起源者,靶点处的尖峰电位越至心房电位之前。
消融靶点的确定应尽可能精确,以减少无效放电对肺静脉的损伤。
, 百拇医药
3 射频消融
确定房颤/房早起源的肺静脉后,保持该肺静脉内的电极位置不动,并将另一鞘管改为消融导管的通路,送入7F消融导管(顶端电极4或8 mm)于靶肺静脉内以标测电极为路标进行精细标测,直至获得最佳靶点。肺静脉内消融的最佳能量选择、放电时间及安全性评价目前尚未得到完全阐明。一般选用温控消融,Chen等[4]的经验是预设温度50~60℃,每次放电20~40 s,Haissaguerre等[3]的方法是右房内消融预设温度70℃,左房及肺静脉内消融预设温度55~60℃,每次放电60~120 s。我们选用温控消融,预设温度50~60℃,功率20~30W,每次放电30~60 s,每次放电后均通过鞘管行靶肺静脉的选择性造影观察是否发生肺静脉狭窄(图18)。少数情况下,尽管反复尝试仍难以将肺静脉内的异位灶彻底消融,此时可供选择的办法是在异位灶到肺静脉开口之间或在肺静脉开口部做环状消融,从而将异位灶与心房之间实现电学隔离,间接起到消融异位灶的作用。这一方法如在X线影像下操作,技术上存在较大困难,难以保证环状消融的连续性,而且由于对肺静脉的损伤增大,术后肺静脉狭窄的发生率可能增加,故应尽量少用。国内外均有采用心腔内超声(ICE)引导行房颤射频消融的报道,我们在这方面也进行了一定的尝试,初步体会是ICE对于房间隔穿刺术和寻找肺静脉开口的帮助不大,因单纯依靠X线影像进行房间隔穿刺及进入肺静脉即有足够的可靠性和安全性,然而ICE对判断消融导管顶端与肺静脉壁贴靠的稳定性具有一定的帮助。
, 百拇医药
图17 肺静脉起源的房早的P′on T现象(Holter记录) 图中2个房早均呈P′ on T现象。第1个房早虽未能引发房颤,但其P′波的形态及与窦性P波的联律间期均与诱发房颤的第2个房早相同,提示这2个房早具有共同的起源部位。该例最终证实异位灶位于LSPV
图18 RSPV内消融的X线影像 左图:消融导管的位置;右图:肺静脉造影显示消融部位无明显狭窄
房颤局灶性消融的终点目前尚无一致意见。Haissaguerre等[3]认为应包括以下两点:①房早/房颤消失,且重复消融前的诱发方案不能再次诱发;②肺静脉电图出现以下特征:a尖峰电位消失;b尖峰电位虽仍然存在,但振幅显著降低; c尖峰电位虽仍然存在,但与心房电活动无关。我们体会,限于目前消融技术很难实现Haissaguerre标准中的第二点,临床实用的终点应包括:①特异性房早消失,且重复消融前诱发方案亦不能诱发;②房颤不被诱发;③出现严重并发症(如左房穿孔并发心包填塞)。上述判断标准与远期成功率之间的关系尚须大样本、较长时间随访的临床研究加以评价。因房颤本身即可自行终止,故放电过程中房颤立即终止一般不能作为消融终点,但少数局灶驱动的房颤可能例外[21]。心房短阵猝发刺激不宜作为评价消融是否成功的指标。Lau 等[22]报道7例局灶性房颤患者,射频消融位于上肺静脉的异位兴奋灶后行心房短阵猝发刺激,结果所有患者均可诱发出房颤,但术后随访8±4个月,仅1例房颤复发。对这一结果可能的解释是:长期房颤所导致的电重构使心房肌在受到快速电刺激时易于发生房颤,故此时发生的房颤为非特异性的。射频消融异位兴奋灶后,随着窦律维持时间的延长,心房肌的电重构亦逐渐得以逆转,后者又使窦性心律更易维持。
, 百拇医药
4 消融并发症及其处理
房颤局灶性消融的并发症主要包括心房穿孔、肺静脉狭窄、血栓栓塞等。心房穿孔可发生于房间隔穿刺、肺静脉电极置放及左房内消融等过程中。马长生等[13]报道38例阵发性房颤的局灶性消融治疗,其中3例发生心房穿孔,均发生于我们开展这一工作初期的前22例患者中。1例为尝试置放RSPV标测导管时误穿左房上壁,半小时后撤除导管未发生心包积血与填塞(图19)。另2例为放置左肺静脉标测电极时导管走行判断不准确,导致导管误入左心耳,进一步推送导管后发生左心耳穿孔并导致急性心包填塞。之后,笔者在放置肺静脉标测电极前均常规行肺动脉造影显示左心耳、肺静脉开口及其走行,特别注意在置放左上、下肺静脉电极时避免进入左心耳,如进入左心耳亦可根据造影的影像及时发现而回撤,避免进一步向左心耳深部推送致使穿孔,至今已连续为32例阵发性房颤患者进行了电生理检查和/或射频消融术,未再发生心包填塞。术中急性心包填塞的及时识别与正确处理对于预后具有重要意义。对此,我们的经验是,急性心包填塞的诊断一旦成立(最直观的征象是X线透视下心影搏动消失并伴有严重低血压),应立即在X线透视下行心包穿刺引流[23,24],其操作过程如下(见图20):平卧位下用18号静脉穿刺针在X线指引下穿刺,针尾带5 ml造影剂,从剑突和右肋弓交角处进针。穿刺针进入心包后打入5 ml造影剂,如果造影剂沿心包分布则证明穿刺针在心包内,然后在X线指示下通过穿刺针送145 cm 0.035 inch导丝于心包腔内,然后沿导丝将6~7F动脉鞘管及猪尾导管送入心包腔,用猪尾导管进行引流。引流完毕并稳定后保留猪尾导管24 h。需要指出的是,尽管采用这一措施对于心房壁的穿孔多数情况下可避免开胸手术,但因左心耳缺乏收缩力,其穿孔难于自行闭合,加之少数心房穿孔出血不止者,故具备紧急开胸条件仍必不可少。
, http://www.100md.com
图19 左房穿孔但未发生心包积液及填塞1例 该例未经肺动脉造影显示上肺静脉走行及开口即按常见解剖关系放置肺静脉电极。放置LSPV电极成功后,以7F顶端可弯曲部分为2.5 inch的Webster消融导管尝试进入RSPV。导管顶端送出左房后误认为已进入RSPV,但继续推送导管不能出心影右缘,且患者有胸痛,强烈提示导管进入的是心包腔而非肺静脉。以鞘管带张力顶紧左房壁穿孔处,撤出导管,造影证实左房穿孔(左图)。立即送入导管至心包腔内,并回撤鞘管(右图),等待外科开胸准备就绪后撤出导管。连续超声心动图观察未发生心包积血与填塞。
图20 急性心包填塞X线透视与造影剂指示下心包穿刺引流示意图 详见文中说明(引自马长生,等.主编. 介入心脏病学. 北京:人民卫生出版社,1998. 692)
肺静脉内消融所导致的肺静脉狭窄是另一主要并发症,其发生率因各家的标准不同而差异较大。Shah等[14]报道经造影证实的肺静脉狭窄(定义为≥50%的直径狭窄)发生率为4%,而Chen等[4]应用经食管超声心动图进行随访,发现42.2%的被消融肺静脉出现狭窄(肺静脉血流峰值>80 cm/s)。肺静脉狭窄的远期预后仍不清楚,但近期的随访资料显示,多数患者并无症状。但Robbins等[25]曾报道18例慢性房颤患者,在左房内做经过肺静脉口的多条线性消融后,有2例发生多个肺静脉口的狭窄,并导致严重肺动脉高压,其原因尚不清楚。这2例病人在行肺静脉球囊扩张术后肺动脉压力均明显下降。我们已发现3例经造影证实术中即发生肺静脉狭窄(≥50%的直径狭窄)的病例(图21),均具有放电功率偏高的特点。Shah等[14]认为高功率及肺静脉深部放电和肺静脉狭窄的发生有关,强调应尽量在肺静脉近开口部以低功率放电,同时避免无效放电。
, 百拇医药
图21 肺静脉内消融导致肺静脉狭窄 左图:消融前;右图:预设温度60℃,30W消融120 s后发生70%的肺静脉狭窄
肺静脉放电过程中还常出现一种类似Bezold-Jarisch反射的表现[26],包括一过性严重的窦性心动过缓、窦性停搏、完全性房室阻滞及血压下降等,这一现象发生比例约为15%,故对于有这类表现的病人在肺静脉放电过程中,应在右室放置起搏电极以备必要时及时起搏。左房及肺静脉内消融有导致血栓栓塞并发症的危险,为此在术中除给予肝素外还应注意反复冲洗鞘管,术后还应继续一段时间的抗凝治疗。建议方案为术后速必凝0.4ml皮下注射3日,同时华法令3 mg每日口服一次,维持一个月,其间通过测定凝血酶原时间酌情增减剂量,维持国际正常化比率在2.0~3.0之间。
5 目前消融方法的局限性
虽然阵发性房颤发生的局灶机制学说作为一项重要的理论突破已为其治疗确定了明确无误的方向,即标测出异位兴奋灶并对其进行消融,然而目前应用传统的标测和消融系统在技术上遇到了许多较难克服的困难(见附表)。
, 百拇医药
附表 目前消融方法在房颤局灶性消融治疗中的局限性 1.肺静脉为三维、具有多个分支的管腔结构,目前消融系统在应用上有一定难度
2.尚无特效的房早/房颤诱发方案
3.对于局灶触发者,无法在房颤发作时进行标测与消融
4.射频消融的终点尚存争议
5.多个肺静脉起源者成功率低
6.复发率高
(引自Lesh MD,et al. Thorac Cardiovasc Surg, 1999,47(Suppl III): 333)
(1)靶点的选择基于经验。电极在肺静脉内标测靶点时,只能提示在某一个深度的局部电位最早,由于肺静脉的直径约1~3 cm,周长可达3~9 cm,实际上只有在肺静脉内标测一圈,找到最提前的局部电位,才能确定精确的靶点。此外,如肺静脉的分支较多且靶点靠近分支开口处, 还必须标测每一分支的电激动情况。目前,靶点的选择还是基于经验,到底在肺静脉的那一侧并不能确定,当靶点并不很准确时放电,由于距离真正的靶点位置很近,射频能量也有可能扩散到真正的靶点位置,使消融成功或暂时成功。故靶点不精确可能是复发率比较高的原因之一。在这一情况下一些崭新的治疗思路应运而生,其中最引人注目的是以新的器械做沿肺静脉口的环状消融,使起源于肺静脉深部的异位激动不能传导至心房,从而间接达到消融异位灶的效果。有作者报道用经球囊超声消融(Through the Balloon Ultrasound Ablation, TTB-USA)做沿肺静脉口环形消融,动物实验已获成功,进一步的临床实验已经开始[27, 28]。适当的超声能量可达到较深的组织深度,而且因不同深度的组织温度恒定(不似射频能量组织温度由表及里逐渐降低),故以较低温度(如50℃)进行消融既可保证消融的透壁完整,而又不致损伤血管内膜,从而降低血栓形成和狭窄的发生率。此外,亦有作者探讨用射频球囊或环状电极等方法做沿肺静脉口行环状消融的可能性,但目前均在研究之中[29]。
, http://www.100md.com
(2)有效终点判定困难。这一点与病例的选择和缺乏可靠的诱发手段有关。如果病人每分钟都有频发的房早、房颤发作,而消融后不再发作,当然消融成功就很令人信服。如果房颤的发作没有规律可循,诱发房颤的早搏也时有时无,消融成功终点的可信度就打了折扣。前面提到,在电生理检查时没有自发的房早或房颤时,需要选择一些方法来诱发,而目前没有一种可靠性好、重复性高的诱发方法。如果消融前房早或房颤的诱发有很好重复性,而消融后不再诱发,也提示是比较可靠的消融终点。因此,目前报告的高即刻成功率和高的复发率实际上可能是低的即刻成功率的反应。
(3)对于局灶触发的房颤,无法在房颤发作过程中判断靶点。局灶异位兴奋在房颤发生中的作用已被较好阐明,而其在房颤维持中的作用目前尚不清楚。有作者报道,房颤发作时,其起源点及附近的电活动较为有序(organized),提示有序电活动区可能是房颤发作时的消融靶点[30],但由于房内电传导的复杂性,对这一假说尚需进行深入的研究。
, 百拇医药 (4)慢性或持续性房颤是否适于局灶性消融。尽管多数学者认为,慢性和持续性房颤是由阵发性房颤发展而来,而绝大多数阵发性房颤为局灶机制,但慢性和持续性房颤是否也存在异位兴奋灶,如果存在,那么将其消除是否也能够根治慢性或持续性房颤。
6 适应目前条件的病例选择标准
虽然局灶性射频消融治疗阵发性房颤作为房颤非药物治疗的重要组成部分其前景令人鼓舞,但在现阶段还是一项正在完善的技术,远期效果亦有待观察,故在其病例选择上应仔细权衡患者的风险/获益比。目前的适应证选择宜严格。在Haissaguerre实验室这一技术作为拟行房室结消融术病人的另一种选择,仅限于多种药物治疗无效且症状明显的阵发性房颤患者[14]。笔者认为,适应目前条件的病例选择标准应为:①年龄≤70岁的阵发性房颤,>70岁者根据患者体质决定;②24 h动态心电图显示同时伴有频发房早(>700/24 h);③多种药物治疗无效且发作频繁、症状明显;④既往有栓塞史或房颤发作时血液动力学明显恶化者优先考虑;⑤非瓣膜病房颤;⑥如为慢性或持续性房颤,应具有复律指征,且复律后有频发房早。
, 百拇医药
目前认为,绝大多数阵发性房颤均为局灶性房颤,可以预见,在现有房颤理论突破的基础上,如经球囊超声消融和其它能将肺静脉进行电学隔离的技术被证实不会造成肺静脉狭窄,那么适于房颤局灶消融治疗的适应证将大为拓宽。
作者简介:马长生(1963— ),男(汉族),主任医师,硕士,研究方向为心脏电生理与射频消融。
参考文献:
[1] Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation [J], 1997, 95: 572
[2] 刘兴鹏,马长生,曹林生. 射频消融治疗局灶性心房颤动的现状[J]. 中国心脏起搏与心电生理杂志,1999,13:159
, 百拇医药
[3] Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J]. N Engl J Med, 1998, 339:659
[4] Chen SA, Hsieh MH, Tai CT, et al. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: eletrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation[J]. Circulation, 1999, 100: 1 876
, 百拇医药
[5] Ho SY, Sanchez-Quintana D, Cabrera JA, et al. Anatomy of the left atrium: implications for radiofrequency ablation of atrial fibrillation[J]. J Cardiovasc Electrophysiol, 1999, 10: 1 525
[6] 马长生,秦永文. 房间隔穿刺术[M]. 见:马长生,盖鲁粤,张奎俊,等主编. 介入心脏病学. 北京:人民卫生出版社,1998. 533
[7] 马长生,刘兴鹏,董建增,等. 经导管射频消融治疗起源于肺静脉的心房颤动(附二例报告)[J]. 中国心脏起搏与心电生理杂志,1999,13:134
[8] 马长生,刘兴鹏,颜红兵,等. 经导管射频消融治疗局灶性心房颤动[J].中国心脏起搏与心电生理杂志,1999,13:197
, 百拇医药
[9] Hsieh MH, Chen SA, Tai CT, et al. Double multielectrode mapping catheters faciliate radiofrequency catheter ablation of focal atrial fibrillation originating from pulmonary veins[J].J Cardiovasc Electrophysiol, 1999, 10: 136
[10] Schwartzman D, Predis L. Simultaneous multielectrode microcatheter mapping of the pulmonary veins in patients with paroxysmal atrial fibrillation[J].PACE, 1999, 22(pt II): 710
[11] Kumagai K, Gondo N, Matsumoto N, et al. New technique of simultaneous catheter mapping of four pulmonary veins for catheter ablation in focal atrial fibrillation[J].Circulation, 1999, 100(suppl I): I-66
, 百拇医药
[12] 马长生, 刘旭, 胡大一, 等. 房间隔穿刺行射频消融及二尖瓣球囊扩张对房间隔完整性的影响[J]. 临床心血管病杂志, 1996, 12(2):104
[13]马长生,刘兴鹏,王勇,等. 起源于肺静脉的局灶性心房颤动的电生理特征与射频消融治疗[J]. 中华心律失常学杂志,2000,4(1):19
[14] Shah DC, Haissaguerre M, Jais P. Catheter ablation of pulmonary vein foci for atrial fibrillation: PV foci ablation for atrial fibrillation[J]. Thorac Cardiovasc surg, 1999,47(suppl III):352
[15] Shah DC, Haissaguerre M, Jais P, et al. Provocative manoeuvers for inducing pulmonary vein ectopy[J]. PACE, 1999, 22(pt Ⅱ): 738
, 百拇医药
[16] Hsieh MH, Tai CT, Tsai CF, et al. An algorithm for facilitating spontaneous initiation of pulmonary vein-dependent focal atrial fibrillation[J]. PACE, 1999, 22(6 pt II): A76
[17] Roithinger FX, Cheng J, SippenGroenewegen A, et al. Use of electroanatomic mapping to delineate transseptal atrial conduction in humans[J]. Circulation, 1999, 10: 1791
[18] Ashar MS, Pennington JC, Nayak H, et al. Localization of arrhythmogenic triggers of atrial fibrillation in right versus left pulmonary veins from coronary sinus activation sequence[J]. Circulation, 1999, 100(suppl I): I-435
, 百拇医药
[19] Hwang C, Karagueuzian HS, Chen PS. Idiopathic paroxysmal atrial fibrillation induced by a focal discharge mechanism in the left superior pulmonary vein: possible roles of the ligament of Marshall[J]. J Cardiovasc Electrophsiol, 1999, 10: 636
[20] Haissaguerre M, Shah DC, Jais P, et al. P on T extrasystoles are highly predictive of a pulmonary vein origin[J]. PACE, 1999, 22(pt Ⅱ): 836
[21] Wu TJ, Hwang C, Chen PS. The relation between rapid focal activation in pulmonary veins and the maintenance of paroxysmal atrial fibrillation[J]. Circulation, 1999, 100(suppl I): I-360
, 百拇医药
[22] Lau CP, Tse HF, Ayers GM. Defibrillation-guided radiofrequency ablation of atrial fibrillation secondary to an atrial focus[J]. J Am Coll Cardiol, 1999, 33:1 217
[23] 马长生,张薇,李淑梅,等. 心脏介入治疗中急性心包填塞X线透视与造影剂指示下穿刺引流[J]. 中华心律失常学杂志,1998,2(增刊):12
[24] 马长生. 经导管射频消融的程序、适应证和基础操作[M]. 见:马长生,盖鲁粤,张奎俊等主编. 介入心脏病学. 北京:人民卫生出版社,1998.692
[25] Robbins IM, Colvin EV, Doyle TP, et al. Pulmonary vein stenosis after catheter ablation of atrial fibrillation[J]. Circulation, 1998, 98: 1769
, 百拇医药
[26] Tsai CF, Chen SA, Tai CT, et al. Bezold-Jarisch-like reflex during radiofrequency ablation of the pulmonary vein tissues in patients with paroxysmal focal atrial fibrillation[J]. J Cardiovasc Electrophsiol, 1999, 10: 27
[27] Wilber DJ, Arruda M, Wang ZG, et al. Circumferential ablation of pulmonary vein ostia with an ultrasound ablation catheter: acute and chronic studies in a canine model[J]. Circulation, 1999, 100(suppl I): I-373
, 百拇医药
[28] Lesh MD, Diederich C, Guerra PG, et al. An anatomic approach to prevention of atrial fibrillation: pulmonary vein isolation with through—the balloon ultrasound ablation(TTB—USA)[J]. Thorac Cardiovasc Surg, 1999,47(Suppl III): 333
[29] Swartz J, Hassett J,Bednared M, et al. Single burn pulmonary vein isolation with a virtual circumferential electrode[J]. PACE, 1998, 21(pt II): 803
[30] Saksena S, Shankar A, Prakash A, et al. Catheter mapping of spontaneous and induced atrial fibrillation in man[J]. J Interv Card Electrophysiol, 2000, 4: 21
收稿日期:000-02-01, 百拇医药
单位:马长生(中日友好医院心内科 北京 100029);杨延宗(大连医科大学第一附属医院心内科);刘旭(上海胸科医院心内科);刘兴鹏(中日友好医院心内科 北京 100029)
关键词:
中国心脏起搏与心电生理杂志000121分类号:R541.7+5 R454.1 文献标识码:A
文章编号:1007—2659(2000)01—0057—10▲
目前认为,绝大多数阵发性心房颤动(简称房颤)均为局灶性起源。局灶性消融是应用射频能量消融诱发房颤的异位兴奋灶来根治阵发性房颤的一项技术,其疗效已得到临床研究的证实,被认为是近年来房颤非药物治疗的一项重要进展[1~4]。由于阵发性房颤的异位兴奋灶绝大多数(约占90%以上)位于肺静脉,特别是双上肺静脉[3,4],使得这一治疗的操作程序有别于其他心律失常的射频消融治疗,其技术难度高、并发症的风险亦显著增大。由于这一治疗最近2~3年才在国内外的少数医疗中心开展,故目前尚缺少有关技术操作的论述。笔者于1998年8月至2000年1月已完成54例阵发性房颤的电生理检查,其中42例同时进行了局灶性消融治疗,现就其方法学做一介绍。
, http://www.100md.com
1 标测电极置放
一般常规放置4根标测电极导管,即高位右房(HRA)或右房Halo电极、冠状静脉窦(CS)及双上肺静脉(PV)电极。由于肺静脉在单纯X线影像上并无特殊标志,而左肺静脉和左心耳的毗邻关系又很近[5],故操作不当可能导致左房穿孔。为避免或最大限度减少这一并发症的发生,我们一般在行房间隔穿刺前常规行主肺动脉造影观察双上肺静脉走行及其与左房,特别是左心耳的关系。以下就标测电极置放的3个主要步骤分别进行介绍。
1.1 肺动脉造影 ①将6F端孔右心导管送至肺动脉,经0.035 inch直径的260 cm长交换导丝送入肺动脉远端,然后沿导丝送入6F猪尾造影管。②在左前斜位(LAO)45°投照下用高压注射器进行造影,观察左、右上肺静脉显影情况(图1A)。记录时间应包括肺动脉、双上肺静脉及左房显影的全过程。造影剂总量一般在35~40 ml、速度16 ml/s、压力400 kpa。③如显影下肺静脉,则须行选择性下肺动脉造影。在行左下肺动脉造影时,笔者体会LAO 60°较45°能更清楚地展示左下肺静脉与左房的关系(图1B)。从而有利于避免标测导管误穿左心耳,导致穿孔和严重的心包填塞等并发症。

, 百拇医药
图1 肺动脉造影显示肺静脉解剖 左图:LAO 45°主肺动脉造影显示左、右上肺静脉(LSPV,RSPV)走行与开口;右图:LAO 60°左下肺动脉选择性造影显示左下肺静脉(LIPV)开口与走行
1.2 房间隔穿刺 房间隔穿刺术的关键是穿刺部位和穿刺方向的判断,笔者体会后前位结合右前斜位(RAO)45°透视是选择房间隔穿刺点的最佳选择[6]。其操作要领可简单归纳为“后前位定高低,RAO 45°定方向”。后前位透视下以左心房影下缘(相当于冠状静脉窦口水平)上方一个椎体高度为穿刺点高度,在这一高度上以RAO 45°透视下心房影左(后)缘前方2~3 cm处(相当于一个椎体高度)处为穿刺点,然后辅以RAO 45°透视观察穿刺针远段走形,即按前面的原则定点后适当调整穿刺针的方向,以穿刺针远段呈一直线为好,但允许微小偏移。确定好穿刺点后,将穿刺针轻轻向前推送即可刺破卵圆窝进入左心房。穿刺成功最为简便可靠的征象是从穿刺针注射造影剂时在左房内显影(图2)。已证实穿刺针进入左心房后,逐一沿穿刺针推送Swartz内、外鞘管(L1或R0)进入左房,退出内鞘管与穿刺针后静脉注射肝素5 000单位,以后每小时注射1 000单位。

, http://www.100md.com
图2 房间隔穿刺术 左图:后前位;右图:RAO 45°
1.3 肺静脉电极置放 不同实验室放置肺静脉电极的方法略有不同。我们及台湾Chen的实验室一般常规放置2根10极(2-8-2 mm)标测电极至左、右上肺静脉进行同步标测[7~9],而法国Haissaguerre的实验室则是根据电生理检查时房性早搏(简称房早)的多少决定是放置一根还是两根标测导管,房早少时行双上肺静脉同步标测,房早多时则仅放置一根标测电极(根据'99NASPE会议发言)。此外,还有作者报道于4个肺静脉各放置1根标测电极导管进行同步标测[10,11]。我们体会,同时放置双上肺静脉电极的优点是可最大限度地覆盖异位兴奋灶的常见部位,从而缩短标测时间,并有利于消融时做固定参照;其不足之处是须行两次房间隔穿刺,但已有研究表明这一方法不会造成有病理意义的房间隔缺损[12]。在置入肺静脉电极的方法上我们采用大头导管法,即依次将8F SR0和SL1型号的Swartz鞘管送入左房后,经鞘管送入7F顶端可弯曲部分为2.5 inch的消融导管,在肺静脉影像的指示下依次将其置入左、右上肺静脉较深处,然后再沿消融导管推送鞘管至左、右上肺静脉内,SR0鞘管进入左上肺静脉,SL1鞘管进入右上肺静脉,到位后撤出消融导管,推送两根5F 10级标测导管(2-8-2mm,Diag)至左、右上肺静脉(图3)。用Swartz鞘管行选择性左、右上肺静脉造影,在LAO 45°下确定肺静脉开口部位(定义为肺静脉与左心房的交界处),然后回撤鞘管,调整标测电极9,10(近端电极)至肺静脉开口部(图4,5)。如电生理检查提示异位兴奋灶位于下肺静脉,则行左下和(或)右下肺静脉标测。因标测电极需经过的Swartz鞘管较硬,不易进入下肺静脉(特别是右下肺静脉),且标测下肺静脉的机会较少,标测的范围亦较上肺静脉局限,故常使用消融导管进行标测(图6)。

, 百拇医药
图3 肺静脉电极的置放——大头导管法 A:大头导管进入RSPV;B:沿鞘管将标测电极置入RSPV后,行第二次房间隔穿刺;C:调整大头导管进入LSPV;D:沿鞘管将标测电极置入LSPV

图4 选择性肺静脉造影显示肺静脉开口部位 左图:RSPV造影;右图:LSPV造影

图5 双上肺静脉标测电极放置到位

图6 下肺静脉标测电极的置放 左图:右下肺静脉(RIPV)标测(RAO 30°)。选择性右下肺动脉造影(经右心导管)显示RIPV走行及开口后指引消融导管进入RIPV。右图:LIPV标测(LAO 60°)。选择性肺静脉造影(经鞘管)显示LIPV开口及消融导管在LIPV内的位置
, http://www.100md.com
2 电生理检查
2.1 肺静脉电图特征 窦性心律时在肺静脉内常可记录到双电位:前一电位频率较低,为心房电位;后一电位频率较高,被称做尖峰电位(spike potential)或肺静脉电位(pulmonary vein potential)。肺静脉内能记录到尖峰电位的部位多在距肺静脉开口4 cm以内。在肺静脉开口部,尖峰电位常紧随心房电位或与心房电位的终末部融合;而在肺静脉深部,尖峰电位则与心房电位明显分开,甚至出现等电位线,呈现由肺静脉开口部向深部的激动传导模式。当有起源于肺静脉的房早或房颤时,肺静脉内的尖峰电位跃至心房电位之前,且肺静脉的激动顺序与窦性心律(简称窦律)时相反,表现为由深部向开口部传导(图7,8),在传导过程中可出现文氏传导甚至传导阻滞(图9)[13]。提前出现的单个尖峰电位往往仅能诱发孤立性房早,而连续多个尖峰电位则往往引发房颤。局灶异位兴奋发动房颤常呈两种形式,最常见的形式是多个(少数情况下为1个)快速异位激动仅发动房颤,而无明显证据表明其参与了房颤的维持,即局灶触发(focal trigger)机制(图9,10)。另一种形式是局灶异位兴奋持续以恒定的顺序激动整个心房,而体表心电图表现为房颤,即局灶驱动(focal driver)机制(图11)[14]。异位灶发放快速冲动的机制尚不清楚,但其周长明显不规则及程序期前刺激难以将其诱发的特性基本可排除折返机制,而β-受体阻断剂和钙通道阻断剂均可抑制由房早诱发的房颤则表明自律性升高和触发活动是可能的机制[4]。

, http://www.100md.com
图7 窦律及房早时的肺静脉电图 LSPV 9,10位于LSPV开口部,LSPV 5,6位于LSPV开口内2 cm处。窦律时尖峰电位在心房电位之后,且呈由肺静脉开口部→深部的传导方向;房早时尖峰电位跃至心房电位之前。因异位兴奋灶位于距肺静脉开口1 cm处(LSPV 7,8),故激动同时向深部及开口部传导(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:197)

图8 房早时双上肺静脉同步标测电图 R(L)SPV 5,6位于肺静脉开口部,R(L)SPV 1,2位于肺静脉内2 cm处。窦律时RSPV内尖峰电位位于心房电位之后,房早时尖峰电位跃至心房电位之前。而窦律及房早时LSPV的激动相均为开口→深部传导。箭头所示为尖峰电位(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:134)

, 百拇医药
图9 肺静脉内的递减传导及传导阻滞现象 异位兴奋灶位于RSPV开口内1cm处(RSPV 7,8),由其发放的快速激动在向开口部(RSPV 9,10)的传导过程中发生递减传导直至传导阻滞,同时诱发了房颤(引自马长生,等.中华心律失常学杂志,2000,4:19)

图10 阵发性房颤发生的局灶触发机制 体表心电图显示两个窦性激动之后出现一个房早(未下传),该房早随后诱发了房颤。心内记录显示房早时心房最早激动位于LSPV开口部(LSPV 9,10),该处出现短阵快速尖峰电位(箭头所指)并触发了房颤。尖峰电位的周长显著不规则(引自马长生,等.中华心律失常学杂志,2000,4:19)

图11 阵发性房颤发生和维持的局灶驱动机制 异位兴奋灶位于RSPV开口内1 cm处(RSPV 7,8),第一个尖峰电位(*)引发房颤后,随后的尖峰电位节律不规则,但心房激动顺序恒定,均为RSPV7,8处最早激动,体表心电图表现为房颤(引自马长生,等.中华心律失常学杂志,2000,4:19)
, 百拇医药
2.2 房早/房颤的诱发 异位兴奋灶的确定无疑需要有足够多的房早/房颤可供分析,由于部分患者在电生理检查过程中自发的房早/房颤数目过少及出于对消融效果进行术中评价的考虑,使得在绝大多数情况下必须进行房早/房颤的诱发。尽管目前文献报道没有一种诱发方案的成功率超过50%,但Shah 等[15]报道静脉滴注(简称静滴)异丙肾上腺素、Valsalva动作、慢频率(100~200bpm)及快频率(200~300 bpm)心房起搏等四种诱发方案的总成功率已达85%。Hsieh等[16]报道静滴异丙肾上腺素、心房起搏、burst刺激诱发房颤后电复律等三种方案诱发房颤的总成功率可高达89.7%。这些结果表明,尽管寻找一种可靠、高效、重复性好的诱发方案仍是今后重要的研究方向之一,但现有的方法已有足够的可行性。需要指出的是,以上研究中的病人均属高度选择(房颤发作频繁且伴有频发房早)的对象,对发作不频繁的阵发性房颤的诱发率可能较此为低。我们在术中一般单独或合并应用静滴异丙肾上腺素(2~4 μg/min)、心房起搏(200~300 bpm)、Valsalva动作、burst刺激诱发房颤后电复律等四种方法,如术中房颤持续(时间>20 min)则静脉推注普罗帕酮或者电复律。
, 百拇医药
2.3 消融靶点的确定 由于就现有的研究结果尚难以在房颤发作时确定异位兴奋灶的部位,而与房颤并存的房早又常和房颤具有共同起源,故目前房颤的局灶性消融实际上是根据房早或房颤开始发作时的心内激动顺序,以局部激动较体表心电图P′波起点或其它参考电位最为提前处为消融靶点。由于与房颤并存的房早有的能诱发房颤,而有的仅为孤立性房早,究竟何种房早需要消融目前尚无一致意见。Chen等[4]仅消融能够诱发房颤或快速、反复性心房搏动的房早,而对于孤立性房早则不予处理。我们的方法是,根据心内多部位同步标测确定的房早起源部位的不同而给与不同的处理。对起源于肺静脉的房早无论是否诱发房颤或反复性心房搏动均予消融,而对起源于心房或上腔静脉的房早除非有引发房颤的证据,否则不予消融。这一原则的理论基础包括:①引发房颤的房早绝大多数起源于肺静脉已是公认的事实,而这其中不可能每个房早均一定诱发房颤;②由于左房后壁肌纤维具有高度的各向异性传导特性,所以某些起源于肺静脉的房早尽管在术中并未引发房颤,但却难以保证其在术后不引发房颤。
在消融靶点的确定上,肺静脉电图具有关键作用。房早时如双上肺静脉多点同步标测显示为完全不同的激动传导方向,常表明异位兴奋灶即位于其中的一根肺静脉,该肺静脉的激动顺序呈由深部至开口部的传导方向,而对侧肺静脉则与窦律时相同,仍呈由开口部至深部的传导模式(图8,12)。但应注意的是,当异位灶位于某一肺静脉的正开口部位时,双上肺静脉都可呈现由开口部向深部传导的顺序,但此时靶点所在肺静脉的局部电位常较对侧明显提前(图13)。若双上肺静脉开口部几乎同时激动,且各自的激动顺序均显示由开口部向深部的传导,则表明双上肺静脉均为被动激动,提示异位兴奋灶可能位于下肺静脉(图14)。若右肺静脉开口部几乎同时激动且冠状窦远端电位提前常表明靶点位于左肺静脉(图15)。总之,在根据肺静脉电图判断靶点所在肺静脉时,应强调局部电位的提前程度与心内激动顺序相结合的方法。对于异位灶位于心房的阵发性房颤,其靶点亦根据局部电位的提前程度来确定(图16)。

, http://www.100md.com
图12 异位兴奋灶位于LSPV内4 cm处的靶点电位图 房早时,LSPV呈深部→开口部的传导,且LSPV1,2(开口内4 cm)处最早激动,以消融电极于此处及附近细标,记录到较体表心电图P'波起点提前131ms的尖峰电位,于此处消融获得成功(引自马长生,等.中国心脏起搏与心电生理杂志,1999,13:197)

图13 靶点电位图(异位兴奋灶位于LSPV开口部) 房早时,LSPV开口(LSPV9,10)部尖峰电位跃至心房电位之前,于LSPV 9,10电极附近记录到较体表心电图P′起点提前86 ms的靶点,于此处消融获得成功

图14 双上肺静脉同步标测提示异位灶位于下肺静脉 RSPV和LSPV在窦律和诱发房颤的房早发生时均呈由开口部向深部的传导顺序,且开口部几乎同时激动,排除异位灶位于上肺静脉的可能性,该例经行下肺静脉标测及射频消融证实异位灶位于LIPV

, 百拇医药
图15 右肺静脉及CS同步标测提示异位灶位于左肺静脉 房颤发作时CS远端电极最先激动,且右上、下肺静脉几乎同时激动,二者均提示异位灶位于左肺静脉。最终电生理检查证实异位灶位于左下肺静脉

图16 靶点电位图(异位兴奋灶位于左房后侧壁) 房早时CS呈由远及近的传导顺序,且高右房激动落后,提示异位灶位于左肺静脉,最终于左房后侧壁LIPV下方1cm处标测到最提前电位并消融成功。
右房及CS内标测简便易行,仔细分析其电图特征不仅对于判断异位灶位于右房的阵发性房颤具有重要意义,有时还能为肺静脉异位灶具体部位的判断提供线索。Haissaguerre等[3]认为,房早时如右房内多点记录的双极电图较体表ECG异位P′波的起点提前程度>10ms,则不能排除异位灶位于右房的可能。Roithinger等[17]对18例无器质性心脏病的房颤患者于左房后壁进行起搏,发现有5例右房最早激动点位于Bachmann束的假定插入点(即高位右房附近),表明来自肺静脉的激动可能通过Bachmann束的传导而使高位右房提前激动。Ashar等[18]报道7例阵发性房颤患者,起搏右肺静脉时,CS均呈由近及远的激动顺序;起搏左肺静脉时,CS呈由远及近传导顺序者占86%(12/14),另有2根左上肺静脉在起搏时其最早激动部位在CS中部。Hwang等[19]亦发现,起源于左上肺静脉的房早常存在CS的较早激动,并认为其原因可能与左上肺静脉和CS之间有Marshall韧带相连有关。
, 百拇医药
体表心电图亦在靶点位置的初步确定上具有一定的作用。Haissaguerre等[20]曾报道体表心电图呈P′on T现象的房早其异位灶绝大多数位于肺静脉,且起源于上肺静脉的房早其P′波在Ⅱ、Ⅲ、aVF导联呈正向,而起源于下肺静脉者P′波在上述导联呈负向。但我们的经验表明,部分下肺静脉起源的房早其P′波可呈双向或极性不明显,少数情况下甚至呈正向。后者可能和该下肺静脉较为粗大及异位灶位于肺静脉的上壁有关。此外,多数阵发性房颤病人难以记录到房早的12导联心电图,故我们认为根据P′波形态判断房早的具体起源部位价值不大,确切定位仍有赖于对心内电图的识别。
靶点电位图的特征包括:局部双极电位较体表心电图P′波起点最为提前;多个房早或多阵房颤开始发作时的心房激动顺序具有一致性;肺静脉起源者,靶点处的尖峰电位越至心房电位之前。
消融靶点的确定应尽可能精确,以减少无效放电对肺静脉的损伤。
, 百拇医药
3 射频消融
确定房颤/房早起源的肺静脉后,保持该肺静脉内的电极位置不动,并将另一鞘管改为消融导管的通路,送入7F消融导管(顶端电极4或8 mm)于靶肺静脉内以标测电极为路标进行精细标测,直至获得最佳靶点。肺静脉内消融的最佳能量选择、放电时间及安全性评价目前尚未得到完全阐明。一般选用温控消融,Chen等[4]的经验是预设温度50~60℃,每次放电20~40 s,Haissaguerre等[3]的方法是右房内消融预设温度70℃,左房及肺静脉内消融预设温度55~60℃,每次放电60~120 s。我们选用温控消融,预设温度50~60℃,功率20~30W,每次放电30~60 s,每次放电后均通过鞘管行靶肺静脉的选择性造影观察是否发生肺静脉狭窄(图18)。少数情况下,尽管反复尝试仍难以将肺静脉内的异位灶彻底消融,此时可供选择的办法是在异位灶到肺静脉开口之间或在肺静脉开口部做环状消融,从而将异位灶与心房之间实现电学隔离,间接起到消融异位灶的作用。这一方法如在X线影像下操作,技术上存在较大困难,难以保证环状消融的连续性,而且由于对肺静脉的损伤增大,术后肺静脉狭窄的发生率可能增加,故应尽量少用。国内外均有采用心腔内超声(ICE)引导行房颤射频消融的报道,我们在这方面也进行了一定的尝试,初步体会是ICE对于房间隔穿刺术和寻找肺静脉开口的帮助不大,因单纯依靠X线影像进行房间隔穿刺及进入肺静脉即有足够的可靠性和安全性,然而ICE对判断消融导管顶端与肺静脉壁贴靠的稳定性具有一定的帮助。

, 百拇医药
图17 肺静脉起源的房早的P′on T现象(Holter记录) 图中2个房早均呈P′ on T现象。第1个房早虽未能引发房颤,但其P′波的形态及与窦性P波的联律间期均与诱发房颤的第2个房早相同,提示这2个房早具有共同的起源部位。该例最终证实异位灶位于LSPV

图18 RSPV内消融的X线影像 左图:消融导管的位置;右图:肺静脉造影显示消融部位无明显狭窄
房颤局灶性消融的终点目前尚无一致意见。Haissaguerre等[3]认为应包括以下两点:①房早/房颤消失,且重复消融前的诱发方案不能再次诱发;②肺静脉电图出现以下特征:a尖峰电位消失;b尖峰电位虽仍然存在,但振幅显著降低; c尖峰电位虽仍然存在,但与心房电活动无关。我们体会,限于目前消融技术很难实现Haissaguerre标准中的第二点,临床实用的终点应包括:①特异性房早消失,且重复消融前诱发方案亦不能诱发;②房颤不被诱发;③出现严重并发症(如左房穿孔并发心包填塞)。上述判断标准与远期成功率之间的关系尚须大样本、较长时间随访的临床研究加以评价。因房颤本身即可自行终止,故放电过程中房颤立即终止一般不能作为消融终点,但少数局灶驱动的房颤可能例外[21]。心房短阵猝发刺激不宜作为评价消融是否成功的指标。Lau 等[22]报道7例局灶性房颤患者,射频消融位于上肺静脉的异位兴奋灶后行心房短阵猝发刺激,结果所有患者均可诱发出房颤,但术后随访8±4个月,仅1例房颤复发。对这一结果可能的解释是:长期房颤所导致的电重构使心房肌在受到快速电刺激时易于发生房颤,故此时发生的房颤为非特异性的。射频消融异位兴奋灶后,随着窦律维持时间的延长,心房肌的电重构亦逐渐得以逆转,后者又使窦性心律更易维持。
, 百拇医药
4 消融并发症及其处理
房颤局灶性消融的并发症主要包括心房穿孔、肺静脉狭窄、血栓栓塞等。心房穿孔可发生于房间隔穿刺、肺静脉电极置放及左房内消融等过程中。马长生等[13]报道38例阵发性房颤的局灶性消融治疗,其中3例发生心房穿孔,均发生于我们开展这一工作初期的前22例患者中。1例为尝试置放RSPV标测导管时误穿左房上壁,半小时后撤除导管未发生心包积血与填塞(图19)。另2例为放置左肺静脉标测电极时导管走行判断不准确,导致导管误入左心耳,进一步推送导管后发生左心耳穿孔并导致急性心包填塞。之后,笔者在放置肺静脉标测电极前均常规行肺动脉造影显示左心耳、肺静脉开口及其走行,特别注意在置放左上、下肺静脉电极时避免进入左心耳,如进入左心耳亦可根据造影的影像及时发现而回撤,避免进一步向左心耳深部推送致使穿孔,至今已连续为32例阵发性房颤患者进行了电生理检查和/或射频消融术,未再发生心包填塞。术中急性心包填塞的及时识别与正确处理对于预后具有重要意义。对此,我们的经验是,急性心包填塞的诊断一旦成立(最直观的征象是X线透视下心影搏动消失并伴有严重低血压),应立即在X线透视下行心包穿刺引流[23,24],其操作过程如下(见图20):平卧位下用18号静脉穿刺针在X线指引下穿刺,针尾带5 ml造影剂,从剑突和右肋弓交角处进针。穿刺针进入心包后打入5 ml造影剂,如果造影剂沿心包分布则证明穿刺针在心包内,然后在X线指示下通过穿刺针送145 cm 0.035 inch导丝于心包腔内,然后沿导丝将6~7F动脉鞘管及猪尾导管送入心包腔,用猪尾导管进行引流。引流完毕并稳定后保留猪尾导管24 h。需要指出的是,尽管采用这一措施对于心房壁的穿孔多数情况下可避免开胸手术,但因左心耳缺乏收缩力,其穿孔难于自行闭合,加之少数心房穿孔出血不止者,故具备紧急开胸条件仍必不可少。

, http://www.100md.com
图19 左房穿孔但未发生心包积液及填塞1例 该例未经肺动脉造影显示上肺静脉走行及开口即按常见解剖关系放置肺静脉电极。放置LSPV电极成功后,以7F顶端可弯曲部分为2.5 inch的Webster消融导管尝试进入RSPV。导管顶端送出左房后误认为已进入RSPV,但继续推送导管不能出心影右缘,且患者有胸痛,强烈提示导管进入的是心包腔而非肺静脉。以鞘管带张力顶紧左房壁穿孔处,撤出导管,造影证实左房穿孔(左图)。立即送入导管至心包腔内,并回撤鞘管(右图),等待外科开胸准备就绪后撤出导管。连续超声心动图观察未发生心包积血与填塞。

图20 急性心包填塞X线透视与造影剂指示下心包穿刺引流示意图 详见文中说明(引自马长生,等.主编. 介入心脏病学. 北京:人民卫生出版社,1998. 692)
肺静脉内消融所导致的肺静脉狭窄是另一主要并发症,其发生率因各家的标准不同而差异较大。Shah等[14]报道经造影证实的肺静脉狭窄(定义为≥50%的直径狭窄)发生率为4%,而Chen等[4]应用经食管超声心动图进行随访,发现42.2%的被消融肺静脉出现狭窄(肺静脉血流峰值>80 cm/s)。肺静脉狭窄的远期预后仍不清楚,但近期的随访资料显示,多数患者并无症状。但Robbins等[25]曾报道18例慢性房颤患者,在左房内做经过肺静脉口的多条线性消融后,有2例发生多个肺静脉口的狭窄,并导致严重肺动脉高压,其原因尚不清楚。这2例病人在行肺静脉球囊扩张术后肺动脉压力均明显下降。我们已发现3例经造影证实术中即发生肺静脉狭窄(≥50%的直径狭窄)的病例(图21),均具有放电功率偏高的特点。Shah等[14]认为高功率及肺静脉深部放电和肺静脉狭窄的发生有关,强调应尽量在肺静脉近开口部以低功率放电,同时避免无效放电。

, 百拇医药
图21 肺静脉内消融导致肺静脉狭窄 左图:消融前;右图:预设温度60℃,30W消融120 s后发生70%的肺静脉狭窄
肺静脉放电过程中还常出现一种类似Bezold-Jarisch反射的表现[26],包括一过性严重的窦性心动过缓、窦性停搏、完全性房室阻滞及血压下降等,这一现象发生比例约为15%,故对于有这类表现的病人在肺静脉放电过程中,应在右室放置起搏电极以备必要时及时起搏。左房及肺静脉内消融有导致血栓栓塞并发症的危险,为此在术中除给予肝素外还应注意反复冲洗鞘管,术后还应继续一段时间的抗凝治疗。建议方案为术后速必凝0.4ml皮下注射3日,同时华法令3 mg每日口服一次,维持一个月,其间通过测定凝血酶原时间酌情增减剂量,维持国际正常化比率在2.0~3.0之间。
5 目前消融方法的局限性
虽然阵发性房颤发生的局灶机制学说作为一项重要的理论突破已为其治疗确定了明确无误的方向,即标测出异位兴奋灶并对其进行消融,然而目前应用传统的标测和消融系统在技术上遇到了许多较难克服的困难(见附表)。
, 百拇医药
附表 目前消融方法在房颤局灶性消融治疗中的局限性 1.肺静脉为三维、具有多个分支的管腔结构,目前消融系统在应用上有一定难度
2.尚无特效的房早/房颤诱发方案
3.对于局灶触发者,无法在房颤发作时进行标测与消融
4.射频消融的终点尚存争议
5.多个肺静脉起源者成功率低
6.复发率高
(引自Lesh MD,et al. Thorac Cardiovasc Surg, 1999,47(Suppl III): 333)
(1)靶点的选择基于经验。电极在肺静脉内标测靶点时,只能提示在某一个深度的局部电位最早,由于肺静脉的直径约1~3 cm,周长可达3~9 cm,实际上只有在肺静脉内标测一圈,找到最提前的局部电位,才能确定精确的靶点。此外,如肺静脉的分支较多且靶点靠近分支开口处, 还必须标测每一分支的电激动情况。目前,靶点的选择还是基于经验,到底在肺静脉的那一侧并不能确定,当靶点并不很准确时放电,由于距离真正的靶点位置很近,射频能量也有可能扩散到真正的靶点位置,使消融成功或暂时成功。故靶点不精确可能是复发率比较高的原因之一。在这一情况下一些崭新的治疗思路应运而生,其中最引人注目的是以新的器械做沿肺静脉口的环状消融,使起源于肺静脉深部的异位激动不能传导至心房,从而间接达到消融异位灶的效果。有作者报道用经球囊超声消融(Through the Balloon Ultrasound Ablation, TTB-USA)做沿肺静脉口环形消融,动物实验已获成功,进一步的临床实验已经开始[27, 28]。适当的超声能量可达到较深的组织深度,而且因不同深度的组织温度恒定(不似射频能量组织温度由表及里逐渐降低),故以较低温度(如50℃)进行消融既可保证消融的透壁完整,而又不致损伤血管内膜,从而降低血栓形成和狭窄的发生率。此外,亦有作者探讨用射频球囊或环状电极等方法做沿肺静脉口行环状消融的可能性,但目前均在研究之中[29]。
, http://www.100md.com
(2)有效终点判定困难。这一点与病例的选择和缺乏可靠的诱发手段有关。如果病人每分钟都有频发的房早、房颤发作,而消融后不再发作,当然消融成功就很令人信服。如果房颤的发作没有规律可循,诱发房颤的早搏也时有时无,消融成功终点的可信度就打了折扣。前面提到,在电生理检查时没有自发的房早或房颤时,需要选择一些方法来诱发,而目前没有一种可靠性好、重复性高的诱发方法。如果消融前房早或房颤的诱发有很好重复性,而消融后不再诱发,也提示是比较可靠的消融终点。因此,目前报告的高即刻成功率和高的复发率实际上可能是低的即刻成功率的反应。
(3)对于局灶触发的房颤,无法在房颤发作过程中判断靶点。局灶异位兴奋在房颤发生中的作用已被较好阐明,而其在房颤维持中的作用目前尚不清楚。有作者报道,房颤发作时,其起源点及附近的电活动较为有序(organized),提示有序电活动区可能是房颤发作时的消融靶点[30],但由于房内电传导的复杂性,对这一假说尚需进行深入的研究。
, 百拇医药 (4)慢性或持续性房颤是否适于局灶性消融。尽管多数学者认为,慢性和持续性房颤是由阵发性房颤发展而来,而绝大多数阵发性房颤为局灶机制,但慢性和持续性房颤是否也存在异位兴奋灶,如果存在,那么将其消除是否也能够根治慢性或持续性房颤。
6 适应目前条件的病例选择标准
虽然局灶性射频消融治疗阵发性房颤作为房颤非药物治疗的重要组成部分其前景令人鼓舞,但在现阶段还是一项正在完善的技术,远期效果亦有待观察,故在其病例选择上应仔细权衡患者的风险/获益比。目前的适应证选择宜严格。在Haissaguerre实验室这一技术作为拟行房室结消融术病人的另一种选择,仅限于多种药物治疗无效且症状明显的阵发性房颤患者[14]。笔者认为,适应目前条件的病例选择标准应为:①年龄≤70岁的阵发性房颤,>70岁者根据患者体质决定;②24 h动态心电图显示同时伴有频发房早(>700/24 h);③多种药物治疗无效且发作频繁、症状明显;④既往有栓塞史或房颤发作时血液动力学明显恶化者优先考虑;⑤非瓣膜病房颤;⑥如为慢性或持续性房颤,应具有复律指征,且复律后有频发房早。
, 百拇医药
目前认为,绝大多数阵发性房颤均为局灶性房颤,可以预见,在现有房颤理论突破的基础上,如经球囊超声消融和其它能将肺静脉进行电学隔离的技术被证实不会造成肺静脉狭窄,那么适于房颤局灶消融治疗的适应证将大为拓宽。
作者简介:马长生(1963— ),男(汉族),主任医师,硕士,研究方向为心脏电生理与射频消融。
参考文献:
[1] Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation [J], 1997, 95: 572
[2] 刘兴鹏,马长生,曹林生. 射频消融治疗局灶性心房颤动的现状[J]. 中国心脏起搏与心电生理杂志,1999,13:159
, 百拇医药
[3] Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J]. N Engl J Med, 1998, 339:659
[4] Chen SA, Hsieh MH, Tai CT, et al. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: eletrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation[J]. Circulation, 1999, 100: 1 876
, 百拇医药
[5] Ho SY, Sanchez-Quintana D, Cabrera JA, et al. Anatomy of the left atrium: implications for radiofrequency ablation of atrial fibrillation[J]. J Cardiovasc Electrophysiol, 1999, 10: 1 525
[6] 马长生,秦永文. 房间隔穿刺术[M]. 见:马长生,盖鲁粤,张奎俊,等主编. 介入心脏病学. 北京:人民卫生出版社,1998. 533
[7] 马长生,刘兴鹏,董建增,等. 经导管射频消融治疗起源于肺静脉的心房颤动(附二例报告)[J]. 中国心脏起搏与心电生理杂志,1999,13:134
[8] 马长生,刘兴鹏,颜红兵,等. 经导管射频消融治疗局灶性心房颤动[J].中国心脏起搏与心电生理杂志,1999,13:197
, 百拇医药
[9] Hsieh MH, Chen SA, Tai CT, et al. Double multielectrode mapping catheters faciliate radiofrequency catheter ablation of focal atrial fibrillation originating from pulmonary veins[J].J Cardiovasc Electrophysiol, 1999, 10: 136
[10] Schwartzman D, Predis L. Simultaneous multielectrode microcatheter mapping of the pulmonary veins in patients with paroxysmal atrial fibrillation[J].PACE, 1999, 22(pt II): 710
[11] Kumagai K, Gondo N, Matsumoto N, et al. New technique of simultaneous catheter mapping of four pulmonary veins for catheter ablation in focal atrial fibrillation[J].Circulation, 1999, 100(suppl I): I-66
, 百拇医药
[12] 马长生, 刘旭, 胡大一, 等. 房间隔穿刺行射频消融及二尖瓣球囊扩张对房间隔完整性的影响[J]. 临床心血管病杂志, 1996, 12(2):104
[13]马长生,刘兴鹏,王勇,等. 起源于肺静脉的局灶性心房颤动的电生理特征与射频消融治疗[J]. 中华心律失常学杂志,2000,4(1):19
[14] Shah DC, Haissaguerre M, Jais P. Catheter ablation of pulmonary vein foci for atrial fibrillation: PV foci ablation for atrial fibrillation[J]. Thorac Cardiovasc surg, 1999,47(suppl III):352
[15] Shah DC, Haissaguerre M, Jais P, et al. Provocative manoeuvers for inducing pulmonary vein ectopy[J]. PACE, 1999, 22(pt Ⅱ): 738
, 百拇医药
[16] Hsieh MH, Tai CT, Tsai CF, et al. An algorithm for facilitating spontaneous initiation of pulmonary vein-dependent focal atrial fibrillation[J]. PACE, 1999, 22(6 pt II): A76
[17] Roithinger FX, Cheng J, SippenGroenewegen A, et al. Use of electroanatomic mapping to delineate transseptal atrial conduction in humans[J]. Circulation, 1999, 10: 1791
[18] Ashar MS, Pennington JC, Nayak H, et al. Localization of arrhythmogenic triggers of atrial fibrillation in right versus left pulmonary veins from coronary sinus activation sequence[J]. Circulation, 1999, 100(suppl I): I-435
, 百拇医药
[19] Hwang C, Karagueuzian HS, Chen PS. Idiopathic paroxysmal atrial fibrillation induced by a focal discharge mechanism in the left superior pulmonary vein: possible roles of the ligament of Marshall[J]. J Cardiovasc Electrophsiol, 1999, 10: 636
[20] Haissaguerre M, Shah DC, Jais P, et al. P on T extrasystoles are highly predictive of a pulmonary vein origin[J]. PACE, 1999, 22(pt Ⅱ): 836
[21] Wu TJ, Hwang C, Chen PS. The relation between rapid focal activation in pulmonary veins and the maintenance of paroxysmal atrial fibrillation[J]. Circulation, 1999, 100(suppl I): I-360
, 百拇医药
[22] Lau CP, Tse HF, Ayers GM. Defibrillation-guided radiofrequency ablation of atrial fibrillation secondary to an atrial focus[J]. J Am Coll Cardiol, 1999, 33:1 217
[23] 马长生,张薇,李淑梅,等. 心脏介入治疗中急性心包填塞X线透视与造影剂指示下穿刺引流[J]. 中华心律失常学杂志,1998,2(增刊):12
[24] 马长生. 经导管射频消融的程序、适应证和基础操作[M]. 见:马长生,盖鲁粤,张奎俊等主编. 介入心脏病学. 北京:人民卫生出版社,1998.692
[25] Robbins IM, Colvin EV, Doyle TP, et al. Pulmonary vein stenosis after catheter ablation of atrial fibrillation[J]. Circulation, 1998, 98: 1769
, 百拇医药
[26] Tsai CF, Chen SA, Tai CT, et al. Bezold-Jarisch-like reflex during radiofrequency ablation of the pulmonary vein tissues in patients with paroxysmal focal atrial fibrillation[J]. J Cardiovasc Electrophsiol, 1999, 10: 27
[27] Wilber DJ, Arruda M, Wang ZG, et al. Circumferential ablation of pulmonary vein ostia with an ultrasound ablation catheter: acute and chronic studies in a canine model[J]. Circulation, 1999, 100(suppl I): I-373
, 百拇医药
[28] Lesh MD, Diederich C, Guerra PG, et al. An anatomic approach to prevention of atrial fibrillation: pulmonary vein isolation with through—the balloon ultrasound ablation(TTB—USA)[J]. Thorac Cardiovasc Surg, 1999,47(Suppl III): 333
[29] Swartz J, Hassett J,Bednared M, et al. Single burn pulmonary vein isolation with a virtual circumferential electrode[J]. PACE, 1998, 21(pt II): 803
[30] Saksena S, Shankar A, Prakash A, et al. Catheter mapping of spontaneous and induced atrial fibrillation in man[J]. J Interv Card Electrophysiol, 2000, 4: 21
收稿日期:000-02-01, 百拇医药