抗丙型肝炎病毒5′非编码区核酶在细胞内对病毒翻译启动的抑制作用
作者:贾战生 周永兴 冯志华 连建奇 李谨革 焦成松 李光玉 张文彬
单位:710038 西安,第四军医大学唐都医院传染病防治中心
关键词:肝炎病毒,丙型;核酶;基因治疗
中华传染病杂志000103【摘要】目的 研究抗丙型肝炎病毒(HCV)5′非编码区(NCR)双位点213和260核酶(Rz)在细胞内对HCV翻译 启动功能的抑制作用。方法 通过脂质体介导的基因转染方法,转染Rz基因和带荧光素酶(luc)的 靶基因真核表达载体于人肝癌细胞(HHCC),应用液体闪烁计数仪检测luc报告基因的表达活 性。结果 Rz213和Rz260均能在HHCC细胞内有效地抑制luc基因的表达,其抑制 率在45%~70%之间,而针对两个不同切割位点的Rz之间无显著差异。结论 我们构建的Rz213和Rz260真核表达载体能在HHCC细胞内表达,并有 效地抑制HCV 5′NCR介导的翻译启动作用。
, 百拇医药
Intracellular inhibition of viral gene expression by ribozymes against 5′-nonc oding region of hepatitis C virus
JIA Zhansheng ZHOU Yongxing FENG Zhihua et al.
(Center of Infectious Diseases,The Fourth Military Medical University,Xian 710038,China)
【Abstract】Objective To determine the effect of ribozymes 213 and 260 directed against 5′-noncoding region (5′-NCR) of hepatitis C virus (HCV) on viral gene expression in a human hepatic carcinoma cell (HHCC) line. Methods Cotransfection of pCMV NCR luc containing 5′-NCR-lu c f usion genes and eukaryotic vectors of ribozyme DNAs into HHCC was performed and the luciferase activity of reporter gene was measured by scintilation counter. Results 1)The pCMV NCR luc was efficiently expressed in HHCC;2)th e ribozymes 213 and 260 significantly suppressed the expression of HCV-luc by 45 ~70%, but there was no significant difference between the two ribozymes. Conclusion The ribozymes 213 and 260 against the HCV 5″-NCR can s ubstantially and specifically inhibit viral gene expression in HHCC.
, 百拇医药
【Key words】Hepatitis C virus; Ribozyme; Gene therapy
丙型肝炎病毒(HCV)5′非编码区(NCR)对病毒的复制、病毒蛋白的翻译和启动起重要的 调节作用[1]。我们以此为靶序列成功设计了抗HCV 5′NCR的213和260双位点锤头 结构核酶(Rz),并构建了该Rz的真核表达载体[2]。为了观察该双位点Rz在细胞 内的作 用,本研究应用Alt等[3]构建的pCMVNCRluc为靶基因,以荧光素酶(luciferase,lu c)为报告基因,通过脂质体介导的基因共转染方法,研究了抗HCV 5′NCR Rz213和Rz260与 靶基因共转染对luc基因表达的抑制作用。
材料与方法
一、细胞培养
人肝癌细胞(HHCC)株由中国科学院上海细胞生物学研究所细胞库引种,本校863研究室保存 [4]。用含10%小牛血清RPMI 1640培养液,加青、链霉素,HEPEs,在5%CO2,37℃,CO2孵箱中培养。
, 百拇医药
二、质粒DNA的细胞转染
核酶真核表达载体Rz213(pcEM213)和Rz260(pcEM260)由本室自行设计构建,并经测序和体外 切割证明[2]。靶基因pCMVNCRluc含有HCV 5′NCR和C区66 nt,并与luc基因融合, 由德国Alt 教授惠赠[3]。首先制备转染质粒,在无菌条件下取经聚乙二醇(PEG)纯化的质粒20 μg溶于100μl双蒸水(ddH2O),用无血清RPMI 1640稀释至1 μg/μl,-20℃保存备用 。转染前16~20h,用胰酶消化HHCC细胞,接种细胞于6孔培养板(1×105/孔),37℃,待细胞生长至50%~70% 融合时即可转染。转染方法按试剂盒说明操作(Lipofectamin为Gibco产品)。37℃培养6~16 h,吸去转染液,换含20%小牛血清RPMI 1640培养液,继续培养传代,不同时间收集细胞。
三、细胞的收集与提取液的制备
, 百拇医药
培养至预定时间的细胞,弃去培养液,用预冷的灭菌PBS洗细胞2次,根据细胞数加入100~200ml细胞裂解液,置室温15 min,待细胞裂解完全时,用橡皮刮取细胞及裂解液,将其转移至1.5 ml Eppendorf管,离心,收集上清,-70℃保存。
四、荧光素酶(luc)的活性检测
按试剂盒说明操作(Luciferase assay system为Promega产品)。取20 μl细胞裂解液,加入 1.5 ml Eppendorf管,加100 μl luc测试液,混匀;尽快用液体闪烁计数仪计1 min的cpm 值[5]。同时用Braford法测定20 μl裂解液中的蛋白含量,最后核算成每μg蛋白 所含的计数值。
五、统计学分析
本文中数据均以均值加减标准差表示(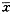 ±s)。两组间比较采用t 检验。
±s)。两组间比较采用t 检验。
, 百拇医药
结果
一、luc基因在HHCC细胞中的表达
pCMVNCRluc为一瞬时表达载体,当转染于HHCC细胞后,表达luc的活性随细胞转染后的时间 延长而下降。因此,我们分别于转染后48、72、96、120 h和10 d不同时间收集细胞,裂解 保留上清,检测luc的活性,以液体闪烁计数仪测得的每分钟计数(cpm值),用每μg蛋白所 含的 计数值表示luc的活性。结果表明,pCMVNCRluc载体能在HHCC细胞内有效表达,转染后48 h luc的活性最高,第2和第3天之间差异无显著性(P>0.05),第4天明显下降(与第2天比 较P<0.01),第10天降至本底水平(图1)。
二、Rz213与pCMVNCRluc共转染对luc活性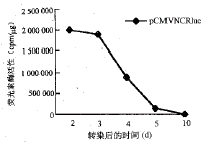
, 百拇医药
图1 pCMVNCRluc在HHCC细胞内的表达的抑制作用
将Rz213和pcDNA3(空载体作为对照)分别与pCMVNCRluc靶基因共转染HHCC细胞,分别于 转染 后第2、3、4、5、10、15和20天不同时间收集细胞,检测luc的活性,结果见图2。Rz213对l uc表达有明显的抑制作用,两组间在第3、4和第5天差异均有显著性(P<0.001)。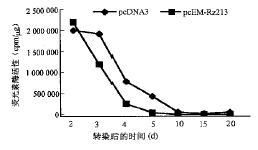
图2 Rz213与pCMVNCRluc共转染对luc表达抑制作 用
三、Rz213与Rz260对细胞luc活性表达的比较
213和260两个位点的锤头结构Rz,体外切割研究显示,两Rz均可特异性切割靶基因。为了解 两Rz在细胞内的作用,我们比较了两Rz分别与pCMVNCRluc共转染对luc活性的抑制作用,以 同一时间点的对照组cpm值为100%,计算Rz组的抑制率(对照组cpm-Rz组cpm/cpm×100)。结 果表明,Rz213和Rz260在转染后第3、4、5天的抑制率分别为:Rz213是36.7%、63.1%和51.2 %,Rz260是30%、56.7%和48.5%。
, 百拇医药
讨论
HCV 5′NCR区在病毒的复制和装配中起重要作用,是介导核糖体结合以非帽依赖方式翻译的 起始区[1,5];HCV基因组为一个大的开放读码框,5′NCR是病毒基因唯一的翻译起始区,因此,该区是抗病毒基因治疗的理想靶序列。我们已经成功设计了针对HCV 5′NCR的双位点Rz,体外切 割实验表明可位点特异性切割靶基因。
图3 Rz213与Rz260对luc活性抑制率的比较
luc作为报告基因的一种,已广泛用于基因表达和基因调控的研究。Luc检测试剂盒的设 计的原理是luc分解底物产生荧光的强弱与luc蛋白的含量成正比,用液闪计数仪(或化学发 光仪)测定其发光的强度就可知样品中luc蛋白的含量,用每μg蛋白所含的荧光值(cpm)表示 相同细胞数中luc蛋白的含量,此值越大表明luc含量越高。根据此原理,Alt等[3] 设计了pCMVNCRluc载体,其luc基因融合在HCV C区66 nt的下游,受HCV 5′NCR的调控,通 过检测luc活性,方便地研究了抗HCV 5′NCR的的反义寡核苷酸的抑制作用。本研究以pCMVN CRluc载体为靶基因,与抗HCV 5′NCR Rz共转染HHCC细胞,结果表明可有效地抑制luc的表 达,该结果说明我们设计构建的抗HCV 213和260位点的Rz可有效地抑制5′NCR的翻译启动功 能。
, 百拇医药
通过计算机选择切割位点所设计的Rz有可能减少抗病毒Rz研究中的盲目性。本研究应用的 Rz213和Rz260其能级参数前者低于后者,提示前者可能优于后者[2]。然而我们比 较了两Rz在细胞内对目的基因的抑制活性表明,Rz213和Rz260之间并没有显著差异,这可能 与细胞内环境复杂,影响因素多,其差异未能体现有关。
载体介导的内源性Rz在细胞内能否彻底清除病毒与Rz表达的copy数有直接关系[6] 。本研究选择pcDNA3作为真核载体是由于该载体表达效率高,克隆位点多,构建容易。转染 细胞总RNA用Rz特异性探针斑点杂交证明,Rz基因在细胞内有效表达。本研究应用检测luc活 性的方法,通过脂质体介导基因共转染证明,我们设计的HCV 5′NCR Rz可有效的抑制luc基 因的表达,抑制率在35%~70%之间,与Sakamoto等[7]的报道一致。然而,在细胞 内的抑制效率还取决于携带靶基因载体的表达效率,两者表达效率之比可能是影响Rz抑制率 的关键因素之一。
, 百拇医药
综上所述,本课题的研究可得出以下结论:pCMVNCRluc载体和抗HCV 5′NCR Rz可在HHCC内 有效表达,Rz213和Rz260能有效地抑制HCV 5′NCR的翻译启动功能。为进一步应 用多位点Rz提高抑制率奠定了基础。
本课题为军队医药卫生基金资助项目(89D048)
参考文献
1,Brown EA, Zhang H, Ping LH, et al. Secondary structure of the 5′non tra nslated regions of hepatitis C virus and pestivirus genomic RNAs. Nucleic Acids Res, 1992,20:5041-5045.
2,贾战生,周永兴,连建奇,等.抗丙型肝炎病毒5′锤头结构核酶的计算机设计与载体的 构建.中华肝脏病杂志,1999,7(增刊):20-23.
, http://www.100md.com
3,Alt M, Renz R, Hofschneider PH, et al. Specific inhibition of hepatitis C vir a l gene expression by antisense phosphorothioate oligodeoxynucleotides. Hepatolog y, 1995,22:707-717.
4,王茜,陈志南,王文亮,等.双特异单克隆抗体介导人单核-巨噬细胞对肝癌细胞的杀伤 作用.第四军医大学学报,1995,16:177-180.
5,李勇年,王勤环,斯崇文,等.丙型肝炎病毒基因调控细胞模型的建立及其意义.中华医 学杂志,1997,77:609-610.
6,Lieber A, He CY, Polyak SJ, et al. Elimination of hepatitis C virus RNA in in fected human hepatocytes by adenovirus-mediated expression of ribozymes. J Viro l, 1996,70:8782-8791.
7,Sakamoto N, Wu CH, Wu GY. Intracellular cleavage of hepatitis C virus RNA and inhibition of viral protein translation by hammerhead ribozymes. J Clin Invest, 1996,98:2720-2728.
收稿日期:1999-06-04, 百拇医药
单位:710038 西安,第四军医大学唐都医院传染病防治中心
关键词:肝炎病毒,丙型;核酶;基因治疗
中华传染病杂志000103【摘要】目的 研究抗丙型肝炎病毒(HCV)5′非编码区(NCR)双位点213和260核酶(Rz)在细胞内对HCV翻译 启动功能的抑制作用。方法 通过脂质体介导的基因转染方法,转染Rz基因和带荧光素酶(luc)的 靶基因真核表达载体于人肝癌细胞(HHCC),应用液体闪烁计数仪检测luc报告基因的表达活 性。结果 Rz213和Rz260均能在HHCC细胞内有效地抑制luc基因的表达,其抑制 率在45%~70%之间,而针对两个不同切割位点的Rz之间无显著差异。结论 我们构建的Rz213和Rz260真核表达载体能在HHCC细胞内表达,并有 效地抑制HCV 5′NCR介导的翻译启动作用。
, 百拇医药
Intracellular inhibition of viral gene expression by ribozymes against 5′-nonc oding region of hepatitis C virus
JIA Zhansheng ZHOU Yongxing FENG Zhihua et al.
(Center of Infectious Diseases,The Fourth Military Medical University,Xian 710038,China)
【Abstract】Objective To determine the effect of ribozymes 213 and 260 directed against 5′-noncoding region (5′-NCR) of hepatitis C virus (HCV) on viral gene expression in a human hepatic carcinoma cell (HHCC) line. Methods Cotransfection of pCMV NCR luc containing 5′-NCR-lu c f usion genes and eukaryotic vectors of ribozyme DNAs into HHCC was performed and the luciferase activity of reporter gene was measured by scintilation counter. Results 1)The pCMV NCR luc was efficiently expressed in HHCC;2)th e ribozymes 213 and 260 significantly suppressed the expression of HCV-luc by 45 ~70%, but there was no significant difference between the two ribozymes. Conclusion The ribozymes 213 and 260 against the HCV 5″-NCR can s ubstantially and specifically inhibit viral gene expression in HHCC.
, 百拇医药
【Key words】Hepatitis C virus; Ribozyme; Gene therapy
丙型肝炎病毒(HCV)5′非编码区(NCR)对病毒的复制、病毒蛋白的翻译和启动起重要的 调节作用[1]。我们以此为靶序列成功设计了抗HCV 5′NCR的213和260双位点锤头 结构核酶(Rz),并构建了该Rz的真核表达载体[2]。为了观察该双位点Rz在细胞 内的作 用,本研究应用Alt等[3]构建的pCMVNCRluc为靶基因,以荧光素酶(luciferase,lu c)为报告基因,通过脂质体介导的基因共转染方法,研究了抗HCV 5′NCR Rz213和Rz260与 靶基因共转染对luc基因表达的抑制作用。
材料与方法
一、细胞培养
人肝癌细胞(HHCC)株由中国科学院上海细胞生物学研究所细胞库引种,本校863研究室保存 [4]。用含10%小牛血清RPMI 1640培养液,加青、链霉素,HEPEs,在5%CO2,37℃,CO2孵箱中培养。
, 百拇医药
二、质粒DNA的细胞转染
核酶真核表达载体Rz213(pcEM213)和Rz260(pcEM260)由本室自行设计构建,并经测序和体外 切割证明[2]。靶基因pCMVNCRluc含有HCV 5′NCR和C区66 nt,并与luc基因融合, 由德国Alt 教授惠赠[3]。首先制备转染质粒,在无菌条件下取经聚乙二醇(PEG)纯化的质粒20 μg溶于100μl双蒸水(ddH2O),用无血清RPMI 1640稀释至1 μg/μl,-20℃保存备用 。转染前16~20h,用胰酶消化HHCC细胞,接种细胞于6孔培养板(1×105/孔),37℃,待细胞生长至50%~70% 融合时即可转染。转染方法按试剂盒说明操作(Lipofectamin为Gibco产品)。37℃培养6~16 h,吸去转染液,换含20%小牛血清RPMI 1640培养液,继续培养传代,不同时间收集细胞。
三、细胞的收集与提取液的制备
, 百拇医药
培养至预定时间的细胞,弃去培养液,用预冷的灭菌PBS洗细胞2次,根据细胞数加入100~200ml细胞裂解液,置室温15 min,待细胞裂解完全时,用橡皮刮取细胞及裂解液,将其转移至1.5 ml Eppendorf管,离心,收集上清,-70℃保存。
四、荧光素酶(luc)的活性检测
按试剂盒说明操作(Luciferase assay system为Promega产品)。取20 μl细胞裂解液,加入 1.5 ml Eppendorf管,加100 μl luc测试液,混匀;尽快用液体闪烁计数仪计1 min的cpm 值[5]。同时用Braford法测定20 μl裂解液中的蛋白含量,最后核算成每μg蛋白 所含的计数值。
五、统计学分析
本文中数据均以均值加减标准差表示(
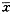 ±s)。两组间比较采用t 检验。
±s)。两组间比较采用t 检验。, 百拇医药
结果
一、luc基因在HHCC细胞中的表达
pCMVNCRluc为一瞬时表达载体,当转染于HHCC细胞后,表达luc的活性随细胞转染后的时间 延长而下降。因此,我们分别于转染后48、72、96、120 h和10 d不同时间收集细胞,裂解 保留上清,检测luc的活性,以液体闪烁计数仪测得的每分钟计数(cpm值),用每μg蛋白所 含的 计数值表示luc的活性。结果表明,pCMVNCRluc载体能在HHCC细胞内有效表达,转染后48 h luc的活性最高,第2和第3天之间差异无显著性(P>0.05),第4天明显下降(与第2天比 较P<0.01),第10天降至本底水平(图1)。
二、Rz213与pCMVNCRluc共转染对luc活性

, 百拇医药
图1 pCMVNCRluc在HHCC细胞内的表达的抑制作用
将Rz213和pcDNA3(空载体作为对照)分别与pCMVNCRluc靶基因共转染HHCC细胞,分别于 转染 后第2、3、4、5、10、15和20天不同时间收集细胞,检测luc的活性,结果见图2。Rz213对l uc表达有明显的抑制作用,两组间在第3、4和第5天差异均有显著性(P<0.001)。

图2 Rz213与pCMVNCRluc共转染对luc表达抑制作 用
三、Rz213与Rz260对细胞luc活性表达的比较
213和260两个位点的锤头结构Rz,体外切割研究显示,两Rz均可特异性切割靶基因。为了解 两Rz在细胞内的作用,我们比较了两Rz分别与pCMVNCRluc共转染对luc活性的抑制作用,以 同一时间点的对照组cpm值为100%,计算Rz组的抑制率(对照组cpm-Rz组cpm/cpm×100)。结 果表明,Rz213和Rz260在转染后第3、4、5天的抑制率分别为:Rz213是36.7%、63.1%和51.2 %,Rz260是30%、56.7%和48.5%。
, 百拇医药
讨论
HCV 5′NCR区在病毒的复制和装配中起重要作用,是介导核糖体结合以非帽依赖方式翻译的 起始区[1,5];HCV基因组为一个大的开放读码框,5′NCR是病毒基因唯一的翻译起始区,因此,该区是抗病毒基因治疗的理想靶序列。我们已经成功设计了针对HCV 5′NCR的双位点Rz,体外切 割实验表明可位点特异性切割靶基因。

图3 Rz213与Rz260对luc活性抑制率的比较
luc作为报告基因的一种,已广泛用于基因表达和基因调控的研究。Luc检测试剂盒的设 计的原理是luc分解底物产生荧光的强弱与luc蛋白的含量成正比,用液闪计数仪(或化学发 光仪)测定其发光的强度就可知样品中luc蛋白的含量,用每μg蛋白所含的荧光值(cpm)表示 相同细胞数中luc蛋白的含量,此值越大表明luc含量越高。根据此原理,Alt等[3] 设计了pCMVNCRluc载体,其luc基因融合在HCV C区66 nt的下游,受HCV 5′NCR的调控,通 过检测luc活性,方便地研究了抗HCV 5′NCR的的反义寡核苷酸的抑制作用。本研究以pCMVN CRluc载体为靶基因,与抗HCV 5′NCR Rz共转染HHCC细胞,结果表明可有效地抑制luc的表 达,该结果说明我们设计构建的抗HCV 213和260位点的Rz可有效地抑制5′NCR的翻译启动功 能。
, 百拇医药
通过计算机选择切割位点所设计的Rz有可能减少抗病毒Rz研究中的盲目性。本研究应用的 Rz213和Rz260其能级参数前者低于后者,提示前者可能优于后者[2]。然而我们比 较了两Rz在细胞内对目的基因的抑制活性表明,Rz213和Rz260之间并没有显著差异,这可能 与细胞内环境复杂,影响因素多,其差异未能体现有关。
载体介导的内源性Rz在细胞内能否彻底清除病毒与Rz表达的copy数有直接关系[6] 。本研究选择pcDNA3作为真核载体是由于该载体表达效率高,克隆位点多,构建容易。转染 细胞总RNA用Rz特异性探针斑点杂交证明,Rz基因在细胞内有效表达。本研究应用检测luc活 性的方法,通过脂质体介导基因共转染证明,我们设计的HCV 5′NCR Rz可有效的抑制luc基 因的表达,抑制率在35%~70%之间,与Sakamoto等[7]的报道一致。然而,在细胞 内的抑制效率还取决于携带靶基因载体的表达效率,两者表达效率之比可能是影响Rz抑制率 的关键因素之一。
, 百拇医药
综上所述,本课题的研究可得出以下结论:pCMVNCRluc载体和抗HCV 5′NCR Rz可在HHCC内 有效表达,Rz213和Rz260能有效地抑制HCV 5′NCR的翻译启动功能。为进一步应 用多位点Rz提高抑制率奠定了基础。
本课题为军队医药卫生基金资助项目(89D048)
参考文献
1,Brown EA, Zhang H, Ping LH, et al. Secondary structure of the 5′non tra nslated regions of hepatitis C virus and pestivirus genomic RNAs. Nucleic Acids Res, 1992,20:5041-5045.
2,贾战生,周永兴,连建奇,等.抗丙型肝炎病毒5′锤头结构核酶的计算机设计与载体的 构建.中华肝脏病杂志,1999,7(增刊):20-23.
, http://www.100md.com
3,Alt M, Renz R, Hofschneider PH, et al. Specific inhibition of hepatitis C vir a l gene expression by antisense phosphorothioate oligodeoxynucleotides. Hepatolog y, 1995,22:707-717.
4,王茜,陈志南,王文亮,等.双特异单克隆抗体介导人单核-巨噬细胞对肝癌细胞的杀伤 作用.第四军医大学学报,1995,16:177-180.
5,李勇年,王勤环,斯崇文,等.丙型肝炎病毒基因调控细胞模型的建立及其意义.中华医 学杂志,1997,77:609-610.
6,Lieber A, He CY, Polyak SJ, et al. Elimination of hepatitis C virus RNA in in fected human hepatocytes by adenovirus-mediated expression of ribozymes. J Viro l, 1996,70:8782-8791.
7,Sakamoto N, Wu CH, Wu GY. Intracellular cleavage of hepatitis C virus RNA and inhibition of viral protein translation by hammerhead ribozymes. J Clin Invest, 1996,98:2720-2728.
收稿日期:1999-06-04, 百拇医药