大黄对烫伤大鼠肝脏肿瘤坏死因子受体基因表达的影响
作者:陈德昌 李红江 高春芳 王皓 杨兴易 陈学云 景炳文
单位:第二军医大学长征医院急救科,上海 200003
关键词:大黄;烧伤;内毒素;肿瘤坏死因子;受体;白介素6
中国中西医结合急救杂志000103摘 要:目的:探讨大黄对烫伤和内毒素二次打击后肝细胞内肿瘤坏死因子受体TNFR1(p55)和TNFR2(p75)基因表达的影响。方法:应用随机、前瞻性研究方法,采用大鼠烫伤和内毒素二次打击模型,检测肝细胞TNFR1和TNFR2的基因表达情况以及血浆和肝组织内肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)浓度。结果:原位杂交显示烫伤和内毒素二次打击后肝细胞内TNFR大量表达,以TNFR1( p55)为主,TNFR2仅小量表达,大黄(50 mg/kg)治疗后两种受体表达均明显减少。烫伤和内毒素二次打击后血浆和肝组织内TNF-α浓度均明显增高,尤以肝组织内为甚(P<0.01);大黄治疗后TNF-α浓度明显降低(P<0.01)。大黄亦能显著降低血浆内IL-6浓度(P<0.01)。结论:大黄可抑制病理情况下TNFR1、TNFR2表达,降低血浆和肝组织内TNF-α和IL-6水平,具有明显抗炎作用。
, 百拇医药
分类号:Q786;R644 文献标识码:A
文章编号:1008-9691(2000)010005-04▲
肿瘤坏死因子α(TNFα)主要通过两种不同的细胞膜受体促发其生物学效应,即TNFR1(p55)和TNFR2(p75)[1]。研究表明TNFα主要通过p55发挥其强烈的炎性介质效应,相对分子质量为17 000,分泌型TNFα是其主要配体,而p75主要与相对分子质量为26 000的膜结合型TNFα结合,促发TNFα生理效应,同时调节TNFα与p55结合[2]。TNFα是脓毒症时主要炎性细胞因子,其损伤效应的发挥依赖于与细胞表面p55、p75结合。我们过去的工作证明大黄具有明显的抗炎作用[3],但其药理作用的机制尚未完全清楚。本实验旨在研究大黄对p55、p75基因表达的影响,以阐明大黄抗炎作用的机制。
, 百拇医药
1 材料与方法
1.1 动物模型制备:雄性SD大鼠17只(上海西普尔必凯实验动物中心提供)220~250 g,氯胺酮(80 mg/kg)腹腔注射麻醉,脱毛剂背部脱毛,右侧股静脉插管。烫伤模型根据Mason方法改良而成[4]。大鼠固定于烫伤模型架上,将背部浸泡于沸水12秒,烫伤面积约为30%,深度为Ⅲ度,大鼠即用100 ml/kg平衡盐液由股静脉输注复苏,12小时后经右侧股静脉持续输注内毒素(剂量20 mg/kg,溶解于10 ml生理盐水内,以1 ml/h速度持续泵入),24小时后活杀大鼠。
1.2 实验方法:随机将动物分为:正常对照组(5只),烫伤组(7只)和大黄治疗组(5只)。大黄(50 mg/kg)研成粉溶于1 ml生理盐水,于烫伤后即刻经胃管灌入(精制大黄片由上海香山中医医院大黄研究室研制,上海中药制药一厂生产,1 g精黄片相当于4 g生药)。烫伤组经胃管给予1 ml生理盐水替代大黄治疗;对照组除不予以烫伤外,其它处理同烫伤组。烫伤后24小时经左侧股静脉采血4 ml,离心(3 000 r/min)10分钟,血浆存于-70 ℃待测。开腹取少量右肝叶固定于10%甲醛。
, http://www.100md.com
1.3 检测方法:
1.3.1 TNF测定:试剂盒由第二军医大学三六九教研室提供,按所附操作程序操作。
1.3.2 白介素6(IL6)测定方法:血浆IL6测定采用MTT比色法[5]。肝脏蛋白质中IL6测定采用文献[6]方法。
1.4 探针制备和原位杂交:按Sambrook实验指南改良而成[7]。TNFR1、TNFR2 cDNA质粒由本院分子生物学室提供。
1.5 统计学方法:数据以均数±标准差(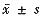 )表示。组内比较采用随机数量资料方差分析,以P<0.05为相差显著。
)表示。组内比较采用随机数量资料方差分析,以P<0.05为相差显著。
, 百拇医药
2 结 果
2.1 大黄对肝脏TNFR1和TNFR2表达的影响:正常情况下大鼠肝细胞不表达或微量表达TNFR1;烫伤和内毒素二次打击后24小时,肝细胞大量表达TNFR1,杂交信号呈强阳性,以肝小叶汇管区信号最强(图1);而大黄可明显抑制肝细胞TNFR1表达,杂交信号明显低于烫伤组(图2)。
图1 烫伤和内毒素二次打击后肝细胞TNFR1的表达(×200)
, 百拇医药
图2 大黄对烫伤和内毒素二次打击后
肝细胞表达TNFR1的影响(×200)
正常情况下大鼠肝脏基本不表达TNFR2;而烫伤和内毒素二次打击后肝脏表达TNFR2有所增加(图3),但与TNFR1相比,量少得多,说明肝细胞以表达TNFR1为主,大黄治疗后TNFR2有所减少(图4)。
图3 烫伤和内毒素二次打击对肝细胞
TNFR2表达的影响(×200)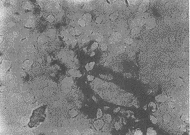
, http://www.100md.com
图4 大黄对烫伤和内毒素二次打击后
肝细胞表达TNFR2的影响(×200)
2.2 大黄对TNFα影响:正常大鼠血浆和肝脏内测不到TNFα;烫伤和内毒素二次打击后,血浆和肝脏内TNFα含量明显提高;大黄治疗后血浆和肝脏内TNFα浓度明显降低(P<0.001),但并不能完全抑制TNFα分泌(表1)。
表1 大黄对烫伤大鼠血浆和肝脏内
TNFα的影响(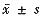 ) 组别
) 组别
动物数(只)
, 百拇医药 血浆(μg/L)
肝脏(mg/kg)
正常对照组
5
0
0
烫伤+内毒素组
7
278.37±58.64
12.24±4.86
烫伤+内毒素+大黄组
5
76.59±11.34**
, 百拇医药
4.38±1.59**
注:与烫伤+内毒素组比较:**P<0.001
2.3 大黄对血浆IL6影响:正常对照组大鼠血浆IL6水平低于10 kU/L(表2);经烫伤和内毒素二次打击后,血浆IL6水平显著提高;而经大黄治疗后,血浆IL6水平明显下降(P<0.001)。
表2 大黄对烫伤大鼠血浆内IL6的影响(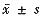 ) 组别
) 组别
动物数(只)
IL6(kU/L)
P值
, http://www.100md.com
正常对照组
5
<10.0
烫伤+内毒素组
7
95.8±11.4
<0.001
烫伤+内毒素+大黄组
5
32.1± 8.6
<0.001
3 讨 论
严重创伤、感染等病理情况下,体内白细胞系统被激活,合成和分泌TNF增加,通过细胞表面TNFR1、TNFR2,促发TNF的病理生理效应,研究表明TNFα主要通过TNFR1发挥其炎性细胞因子效应[2,8]。TNFR1也是“死亡受体”之一,在某些组织细胞,TNFR1可促发程序性细胞死亡(凋亡),但与凋亡受体CD95L不同,除非细胞内蛋白质合成受阻,TNFR1一般不会促发细胞凋亡[9]。TNFα与TNFR1结合,通过TRADD、TRAF2和RIP激活核转录因子NFκB,促发其它细胞因子转录,加剧炎症反应。Liu等[10]研究表明NFκB可抑制程序性细胞死亡。上述病理生理反应的意义在于某些病理情况下,大量NFκB激活,细胞内凋亡程序受抑,受损细胞“被迫”选择坏死的死亡方式。凋亡和死亡的区别在于前者是自洁式清除衰老或受损细胞的方式,而后者细胞死亡后释放细胞内容物和消化酶,损伤毗邻细胞的同时,加剧局部炎症反应,是一种危害较大的细胞死亡方式。动物实验证明,低血容量性休克和脓毒症等病理情况下实质性器官如肝、肾以炎性坏死为主,无明显的细胞凋亡[11]。因此在某种程度上讲,创伤、脓毒症患者更需要“凋亡”,而不是“炎性坏死”。如果通过某种治疗手段,改变病理情况下细胞基因表达程式,“迫使”不可逆受损细胞选择凋亡为死亡方式,可能会大大减轻病理情况下组织器官内炎症反应的程度,保护脏器功能。
, 百拇医药
本研究证明烫伤脓毒症情况下肝细胞主要表达TNFR1,少量表达TNFR2,这样在创伤、感染等情况下,肝细胞表面大量表达TNFR1,使其完全裸露于TNF的攻击之下而发生炎性坏死,严重时导致肝功能障碍和衰竭。临床上我们观察到危重病患者肝功能损害、失调比较常见,而且出现较早,与本研究结果比较吻合。本研究证明大黄治疗后肝细胞表达TNFR1明显减少,TNFR2表达亦有降低,但抑制程度低于TNFR1,大黄的这种药理作用,大大降低了TNF“攻击”肝细胞的机会。可见,脓毒症患者应用大黄治疗具有下列疗效:抗炎作用,抑制TNF受体表达,缓解TNFα生物学效应;保肝作用,通过降低肝细胞表面TNFα结合位点,阻断TNFα对肝细胞的毒性作用。临床上许多医生应用大黄治疗急性病毒性肝炎,其保肝作用的发挥,部分可能通过此途径实现。
本研究模拟临床肠粘膜屏障破坏,肠道内毒素持续少量侵入系统循环的病理现象,应用小剂量内毒素持续静注。结果显示血浆和肝脏内TNFα浓度显著升高,而肝组织内尤为明显,每公斤蛋白内TNFα含量达毫克级。因此临床上,危重症患者虽然其体内系统炎症反应相当剧烈,但其血浆内TNFα浓度可能较低,而在组织器官TNFα含量较高,充分发挥炎性介质效应,这给临床诊治带来困难。本研究表明大黄能显著降低血浆和肝组织内TNFα浓度,这与我们过去的工作相一致,即大黄可抑制TNFα基因表达[3]。大黄的这种药理作用可抑制组织内炎症反应的强度,同时能降低系统炎症反应给局部组织所构成的“炎性负荷”,既抑制了肝细胞TNFR表达,同时降低了肝组织内TNFα浓度,有可能促使受损肝细胞由炎性坏死切换成程序性细胞死亡,促进系统炎症反应由失控向代偿方向演变。
, http://www.100md.com
IL6是细胞因子网络中另一个重要介质,它既有生理性的一面,过度表达又有病理性的一面。作为急性相蛋白,对机体有保护作用,例如可拮抗蛋白酶和氧自由基[12],抑制单核细胞分泌TNFα和IL6[13]。然而血浆中IL6浓度也是危重症患者器官功能和疾病严重程度一个较为可靠的指标[14]。Johnson等[15]研究证明IL6可通过促进中性粒细胞释放弹性蛋白酶而增强中性粒细胞的毒性作用。本研究显示正常情况下大鼠能少量表达IL6,但大部分在10 kU/L以下,这是IL6发挥生理效应的浓度,对机体免疫等功能的调节有重要作用。烫伤和内毒素二次打击后血浆内IL6明显升高,这种由创伤等病理因素所致IL6过度表达,使IL6由生理效应转为病理效应,发挥其炎性介质作用。陈基岱等[16]测定了一组危重症患者血浆IL6浓度,结果显示多脏器功能失常综合征组患者血浆浓度明显高于全身炎性反应综合征组,死亡组血浆浓度高于生存组。血浆IL6持续升高,提示患者预后较差。本研究显示大黄可明显降低实验大鼠血浆IL6水平。由于IL6具有“双面刃”效应,即高浓度发挥病理效应,而低浓度发挥生理效应,故大黄的药理作用有可能使IL6由病理效应逆转为生理效应。
, 百拇医药
4 小 结
烫伤和内毒素二次打击可促进肝细胞内TNF受体大量表达,大黄可抑制TNFR1、TNFR2基因转录,同时尚可降低血浆、肝组织内TNFα浓度,降低血浆IL6水平,大黄的这种药理作用对逆转失控的创伤反应有重要意义。 基金项目:国家自然科学基金资助项目(39370666)
作者简介:陈德昌(1963-),男(汉族),上海市人,硕士,主治医师。1998~1999年在日本留学,主要研究方向为危重症患者胃肠功能衰竭的防治。获国家自然科学基金资助2项,获上海市优秀发明二等奖1项,军队科技进步二等奖1项,发表论著38篇。
参考文献:
[1]Tartaglia L A,Weber R F,Figari I S,et al.The two different receptors for tumor necrosis factor mediate distinct cellular response.Proc Natl Acad Sci USA,1991,88:9292-9296.
, 百拇医药
[2]Van Zee K J,Stackpole S A,Montegut W J,et al.A human tumor necrosis factor a mutant that binds exclusively to the p55 TNF receptor produces toxicity in the baboon.J Exp Med,1994,179:1185-1191.
[3]陈德昌,李红江,景炳文,等.大黄对烫伤后大鼠肝脏内细胞因子基因表达的影响.中国危重病急救医学,1999,11(8):587-590.
[4]Walker H L,Mason A D.A standard animal burn.J Trauma,1968,8(6):1049-1051.
[5]侯健,孔宪涛.MTT比色法检测血清IL-6.中华医学检验杂志,1993,16(4):531-533.
, 百拇医药
[6]叶伟民,韩焕兴,范列英,等.Bradford比色法简便、快速测定微量蛋白.上海医学检验杂志,1996,11(4):207-208.
[7]丁.萨姆布鲁克,E.T弗里奇,T.曼尼阿蒂斯.原位杂交:分子克隆实验指南.第2版.北京:科学出版社,1993.343-388.
[8]Leist M,Gantener F,Jilg S,et al.Activation of the 55 kda TNF receptor is necessary and sufficient for TNF-induced liver failure,hepatocyte apoptosis,and nitrite release.J Immunol,1995,154:1307-1316.
, 百拇医药
[9]Beg S S,Baltimore D.An essential role for NF-κB in preventing TNF-α induced cell death.Science,1996,274:782.
[10]Liu Z G,Hsu H,Goeddel D V,et al.Dissection of TNF receptor 1 effector functions:JNK activation is not linked to apoptosis while NF-κB activation prevents cell death.Cell,1996,87:566-576.
[11]Wang J H,Redmond H P,Watson RWG.Role of lipopolysaccharide and tumor necrosis factor-α in induction of hepatocyte necrosis.Am J Physiol,1995,269:G297.
, 百拇医药
[12]Tilg H,Dinarello C A,Mier J W.IL-6 and Apps:antiinflammatory and immunosuppressive mediators.Immunol Today,1997,18:428.
[13]Mizunara H,O′Neill E,Seki N,et al.T cell activation-associated hepatic injury:mediation by tumor necrosis factors and protection by interleukin-6.J Exp Med,1994,179:1529.
[14]Biffl W L,Moore E E,Moore F A.Interleukin-6 in the injury patients:marker of injury or mediator of inflammation?Ann Surg,1996,224:647.
[15]Johnson J L,Moore E E,Tamura D Y,et al.Interleukin-6 augments neutrophil cytotoxic potential via selective enhancement of elastase release.J Surg Res,1998,76:91-94.
[16]陈基岱,景炳文,李萍,等.多系统脏器衰竭和败血症患者肿瘤坏死因子和白介素6的水平和意义.中国危重病急救医学,1993, 5(6):325327.
收稿日期:1999-12-08, http://www.100md.com
单位:第二军医大学长征医院急救科,上海 200003
关键词:大黄;烧伤;内毒素;肿瘤坏死因子;受体;白介素6
中国中西医结合急救杂志000103摘 要:目的:探讨大黄对烫伤和内毒素二次打击后肝细胞内肿瘤坏死因子受体TNFR1(p55)和TNFR2(p75)基因表达的影响。方法:应用随机、前瞻性研究方法,采用大鼠烫伤和内毒素二次打击模型,检测肝细胞TNFR1和TNFR2的基因表达情况以及血浆和肝组织内肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)浓度。结果:原位杂交显示烫伤和内毒素二次打击后肝细胞内TNFR大量表达,以TNFR1( p55)为主,TNFR2仅小量表达,大黄(50 mg/kg)治疗后两种受体表达均明显减少。烫伤和内毒素二次打击后血浆和肝组织内TNF-α浓度均明显增高,尤以肝组织内为甚(P<0.01);大黄治疗后TNF-α浓度明显降低(P<0.01)。大黄亦能显著降低血浆内IL-6浓度(P<0.01)。结论:大黄可抑制病理情况下TNFR1、TNFR2表达,降低血浆和肝组织内TNF-α和IL-6水平,具有明显抗炎作用。
, 百拇医药
分类号:Q786;R644 文献标识码:A
文章编号:1008-9691(2000)010005-04▲
肿瘤坏死因子α(TNFα)主要通过两种不同的细胞膜受体促发其生物学效应,即TNFR1(p55)和TNFR2(p75)[1]。研究表明TNFα主要通过p55发挥其强烈的炎性介质效应,相对分子质量为17 000,分泌型TNFα是其主要配体,而p75主要与相对分子质量为26 000的膜结合型TNFα结合,促发TNFα生理效应,同时调节TNFα与p55结合[2]。TNFα是脓毒症时主要炎性细胞因子,其损伤效应的发挥依赖于与细胞表面p55、p75结合。我们过去的工作证明大黄具有明显的抗炎作用[3],但其药理作用的机制尚未完全清楚。本实验旨在研究大黄对p55、p75基因表达的影响,以阐明大黄抗炎作用的机制。
, 百拇医药
1 材料与方法
1.1 动物模型制备:雄性SD大鼠17只(上海西普尔必凯实验动物中心提供)220~250 g,氯胺酮(80 mg/kg)腹腔注射麻醉,脱毛剂背部脱毛,右侧股静脉插管。烫伤模型根据Mason方法改良而成[4]。大鼠固定于烫伤模型架上,将背部浸泡于沸水12秒,烫伤面积约为30%,深度为Ⅲ度,大鼠即用100 ml/kg平衡盐液由股静脉输注复苏,12小时后经右侧股静脉持续输注内毒素(剂量20 mg/kg,溶解于10 ml生理盐水内,以1 ml/h速度持续泵入),24小时后活杀大鼠。
1.2 实验方法:随机将动物分为:正常对照组(5只),烫伤组(7只)和大黄治疗组(5只)。大黄(50 mg/kg)研成粉溶于1 ml生理盐水,于烫伤后即刻经胃管灌入(精制大黄片由上海香山中医医院大黄研究室研制,上海中药制药一厂生产,1 g精黄片相当于4 g生药)。烫伤组经胃管给予1 ml生理盐水替代大黄治疗;对照组除不予以烫伤外,其它处理同烫伤组。烫伤后24小时经左侧股静脉采血4 ml,离心(3 000 r/min)10分钟,血浆存于-70 ℃待测。开腹取少量右肝叶固定于10%甲醛。
, http://www.100md.com
1.3 检测方法:
1.3.1 TNF测定:试剂盒由第二军医大学三六九教研室提供,按所附操作程序操作。
1.3.2 白介素6(IL6)测定方法:血浆IL6测定采用MTT比色法[5]。肝脏蛋白质中IL6测定采用文献[6]方法。
1.4 探针制备和原位杂交:按Sambrook实验指南改良而成[7]。TNFR1、TNFR2 cDNA质粒由本院分子生物学室提供。
1.5 统计学方法:数据以均数±标准差(
, 百拇医药
2 结 果
2.1 大黄对肝脏TNFR1和TNFR2表达的影响:正常情况下大鼠肝细胞不表达或微量表达TNFR1;烫伤和内毒素二次打击后24小时,肝细胞大量表达TNFR1,杂交信号呈强阳性,以肝小叶汇管区信号最强(图1);而大黄可明显抑制肝细胞TNFR1表达,杂交信号明显低于烫伤组(图2)。

图1 烫伤和内毒素二次打击后肝细胞TNFR1的表达(×200)

, 百拇医药
图2 大黄对烫伤和内毒素二次打击后
肝细胞表达TNFR1的影响(×200)
正常情况下大鼠肝脏基本不表达TNFR2;而烫伤和内毒素二次打击后肝脏表达TNFR2有所增加(图3),但与TNFR1相比,量少得多,说明肝细胞以表达TNFR1为主,大黄治疗后TNFR2有所减少(图4)。

图3 烫伤和内毒素二次打击对肝细胞
TNFR2表达的影响(×200)

, http://www.100md.com
图4 大黄对烫伤和内毒素二次打击后
肝细胞表达TNFR2的影响(×200)
2.2 大黄对TNFα影响:正常大鼠血浆和肝脏内测不到TNFα;烫伤和内毒素二次打击后,血浆和肝脏内TNFα含量明显提高;大黄治疗后血浆和肝脏内TNFα浓度明显降低(P<0.001),但并不能完全抑制TNFα分泌(表1)。
表1 大黄对烫伤大鼠血浆和肝脏内
TNFα的影响(
动物数(只)
, 百拇医药 血浆(μg/L)
肝脏(mg/kg)
正常对照组
5
0
0
烫伤+内毒素组
7
278.37±58.64
12.24±4.86
烫伤+内毒素+大黄组
5
76.59±11.34**
, 百拇医药
4.38±1.59**
注:与烫伤+内毒素组比较:**P<0.001
2.3 大黄对血浆IL6影响:正常对照组大鼠血浆IL6水平低于10 kU/L(表2);经烫伤和内毒素二次打击后,血浆IL6水平显著提高;而经大黄治疗后,血浆IL6水平明显下降(P<0.001)。
表2 大黄对烫伤大鼠血浆内IL6的影响(
动物数(只)
IL6(kU/L)
P值
, http://www.100md.com
正常对照组
5
<10.0
烫伤+内毒素组
7
95.8±11.4
<0.001
烫伤+内毒素+大黄组
5
32.1± 8.6
<0.001
3 讨 论
严重创伤、感染等病理情况下,体内白细胞系统被激活,合成和分泌TNF增加,通过细胞表面TNFR1、TNFR2,促发TNF的病理生理效应,研究表明TNFα主要通过TNFR1发挥其炎性细胞因子效应[2,8]。TNFR1也是“死亡受体”之一,在某些组织细胞,TNFR1可促发程序性细胞死亡(凋亡),但与凋亡受体CD95L不同,除非细胞内蛋白质合成受阻,TNFR1一般不会促发细胞凋亡[9]。TNFα与TNFR1结合,通过TRADD、TRAF2和RIP激活核转录因子NFκB,促发其它细胞因子转录,加剧炎症反应。Liu等[10]研究表明NFκB可抑制程序性细胞死亡。上述病理生理反应的意义在于某些病理情况下,大量NFκB激活,细胞内凋亡程序受抑,受损细胞“被迫”选择坏死的死亡方式。凋亡和死亡的区别在于前者是自洁式清除衰老或受损细胞的方式,而后者细胞死亡后释放细胞内容物和消化酶,损伤毗邻细胞的同时,加剧局部炎症反应,是一种危害较大的细胞死亡方式。动物实验证明,低血容量性休克和脓毒症等病理情况下实质性器官如肝、肾以炎性坏死为主,无明显的细胞凋亡[11]。因此在某种程度上讲,创伤、脓毒症患者更需要“凋亡”,而不是“炎性坏死”。如果通过某种治疗手段,改变病理情况下细胞基因表达程式,“迫使”不可逆受损细胞选择凋亡为死亡方式,可能会大大减轻病理情况下组织器官内炎症反应的程度,保护脏器功能。
, 百拇医药
本研究证明烫伤脓毒症情况下肝细胞主要表达TNFR1,少量表达TNFR2,这样在创伤、感染等情况下,肝细胞表面大量表达TNFR1,使其完全裸露于TNF的攻击之下而发生炎性坏死,严重时导致肝功能障碍和衰竭。临床上我们观察到危重病患者肝功能损害、失调比较常见,而且出现较早,与本研究结果比较吻合。本研究证明大黄治疗后肝细胞表达TNFR1明显减少,TNFR2表达亦有降低,但抑制程度低于TNFR1,大黄的这种药理作用,大大降低了TNF“攻击”肝细胞的机会。可见,脓毒症患者应用大黄治疗具有下列疗效:抗炎作用,抑制TNF受体表达,缓解TNFα生物学效应;保肝作用,通过降低肝细胞表面TNFα结合位点,阻断TNFα对肝细胞的毒性作用。临床上许多医生应用大黄治疗急性病毒性肝炎,其保肝作用的发挥,部分可能通过此途径实现。
本研究模拟临床肠粘膜屏障破坏,肠道内毒素持续少量侵入系统循环的病理现象,应用小剂量内毒素持续静注。结果显示血浆和肝脏内TNFα浓度显著升高,而肝组织内尤为明显,每公斤蛋白内TNFα含量达毫克级。因此临床上,危重症患者虽然其体内系统炎症反应相当剧烈,但其血浆内TNFα浓度可能较低,而在组织器官TNFα含量较高,充分发挥炎性介质效应,这给临床诊治带来困难。本研究表明大黄能显著降低血浆和肝组织内TNFα浓度,这与我们过去的工作相一致,即大黄可抑制TNFα基因表达[3]。大黄的这种药理作用可抑制组织内炎症反应的强度,同时能降低系统炎症反应给局部组织所构成的“炎性负荷”,既抑制了肝细胞TNFR表达,同时降低了肝组织内TNFα浓度,有可能促使受损肝细胞由炎性坏死切换成程序性细胞死亡,促进系统炎症反应由失控向代偿方向演变。
, http://www.100md.com
IL6是细胞因子网络中另一个重要介质,它既有生理性的一面,过度表达又有病理性的一面。作为急性相蛋白,对机体有保护作用,例如可拮抗蛋白酶和氧自由基[12],抑制单核细胞分泌TNFα和IL6[13]。然而血浆中IL6浓度也是危重症患者器官功能和疾病严重程度一个较为可靠的指标[14]。Johnson等[15]研究证明IL6可通过促进中性粒细胞释放弹性蛋白酶而增强中性粒细胞的毒性作用。本研究显示正常情况下大鼠能少量表达IL6,但大部分在10 kU/L以下,这是IL6发挥生理效应的浓度,对机体免疫等功能的调节有重要作用。烫伤和内毒素二次打击后血浆内IL6明显升高,这种由创伤等病理因素所致IL6过度表达,使IL6由生理效应转为病理效应,发挥其炎性介质作用。陈基岱等[16]测定了一组危重症患者血浆IL6浓度,结果显示多脏器功能失常综合征组患者血浆浓度明显高于全身炎性反应综合征组,死亡组血浆浓度高于生存组。血浆IL6持续升高,提示患者预后较差。本研究显示大黄可明显降低实验大鼠血浆IL6水平。由于IL6具有“双面刃”效应,即高浓度发挥病理效应,而低浓度发挥生理效应,故大黄的药理作用有可能使IL6由病理效应逆转为生理效应。
, 百拇医药
4 小 结
烫伤和内毒素二次打击可促进肝细胞内TNF受体大量表达,大黄可抑制TNFR1、TNFR2基因转录,同时尚可降低血浆、肝组织内TNFα浓度,降低血浆IL6水平,大黄的这种药理作用对逆转失控的创伤反应有重要意义。 基金项目:国家自然科学基金资助项目(39370666)
作者简介:陈德昌(1963-),男(汉族),上海市人,硕士,主治医师。1998~1999年在日本留学,主要研究方向为危重症患者胃肠功能衰竭的防治。获国家自然科学基金资助2项,获上海市优秀发明二等奖1项,军队科技进步二等奖1项,发表论著38篇。
参考文献:
[1]Tartaglia L A,Weber R F,Figari I S,et al.The two different receptors for tumor necrosis factor mediate distinct cellular response.Proc Natl Acad Sci USA,1991,88:9292-9296.
, 百拇医药
[2]Van Zee K J,Stackpole S A,Montegut W J,et al.A human tumor necrosis factor a mutant that binds exclusively to the p55 TNF receptor produces toxicity in the baboon.J Exp Med,1994,179:1185-1191.
[3]陈德昌,李红江,景炳文,等.大黄对烫伤后大鼠肝脏内细胞因子基因表达的影响.中国危重病急救医学,1999,11(8):587-590.
[4]Walker H L,Mason A D.A standard animal burn.J Trauma,1968,8(6):1049-1051.
[5]侯健,孔宪涛.MTT比色法检测血清IL-6.中华医学检验杂志,1993,16(4):531-533.
, 百拇医药
[6]叶伟民,韩焕兴,范列英,等.Bradford比色法简便、快速测定微量蛋白.上海医学检验杂志,1996,11(4):207-208.
[7]丁.萨姆布鲁克,E.T弗里奇,T.曼尼阿蒂斯.原位杂交:分子克隆实验指南.第2版.北京:科学出版社,1993.343-388.
[8]Leist M,Gantener F,Jilg S,et al.Activation of the 55 kda TNF receptor is necessary and sufficient for TNF-induced liver failure,hepatocyte apoptosis,and nitrite release.J Immunol,1995,154:1307-1316.
, 百拇医药
[9]Beg S S,Baltimore D.An essential role for NF-κB in preventing TNF-α induced cell death.Science,1996,274:782.
[10]Liu Z G,Hsu H,Goeddel D V,et al.Dissection of TNF receptor 1 effector functions:JNK activation is not linked to apoptosis while NF-κB activation prevents cell death.Cell,1996,87:566-576.
[11]Wang J H,Redmond H P,Watson RWG.Role of lipopolysaccharide and tumor necrosis factor-α in induction of hepatocyte necrosis.Am J Physiol,1995,269:G297.
, 百拇医药
[12]Tilg H,Dinarello C A,Mier J W.IL-6 and Apps:antiinflammatory and immunosuppressive mediators.Immunol Today,1997,18:428.
[13]Mizunara H,O′Neill E,Seki N,et al.T cell activation-associated hepatic injury:mediation by tumor necrosis factors and protection by interleukin-6.J Exp Med,1994,179:1529.
[14]Biffl W L,Moore E E,Moore F A.Interleukin-6 in the injury patients:marker of injury or mediator of inflammation?Ann Surg,1996,224:647.
[15]Johnson J L,Moore E E,Tamura D Y,et al.Interleukin-6 augments neutrophil cytotoxic potential via selective enhancement of elastase release.J Surg Res,1998,76:91-94.
[16]陈基岱,景炳文,李萍,等.多系统脏器衰竭和败血症患者肿瘤坏死因子和白介素6的水平和意义.中国危重病急救医学,1993, 5(6):325327.
收稿日期:1999-12-08, http://www.100md.com