窒息新生猪淋巴细胞凋亡的实验研究
作者:张峻梅 王晓蕾 刘晓平 刘凯 唐方 岑石强
单位:张峻梅 王晓蕾 刘晓平 刘凯 唐方(四川省成都市第三人民医院 610031);岑石强(华西医科大学)
关键词:缺血缺氧 淋巴细胞 凋亡
重庆医学000208摘 要:目的 探讨窒息新生儿T淋巴细胞亚群的 变化是否由于淋巴细胞凋亡的加速所致以及缺血缺氧(HI)对淋巴细胞凋亡的影响。方法 用琼脂电泳及流式细胞仪(FCM)对HI新生猪淋巴细胞凋亡动态定量分析 。结果 HI新生猪淋巴细胞经体外培养24~72小时后,其最大凋亡率 (MAR)较对照组明显增加(n=15,12,x±s=31.09±17.03,5.52±6.17%;F=10.03,P<0.01 ),其日均凋亡率(DAR)也较对照组明显增加(x±s=24.08±10.44,4.05±3.57,F=12.50,P <0.01);电泳观察到的“DNA梯带”与FCM结果一致。结论 HI新生 动物外周血淋巴细胞凋亡加速,提示窒息新生儿T淋巴细胞亚群的变化可能是由于淋巴细胞 凋亡的加速所致。
, http://www.100md.com
Study on Apoptosis in Lymphocytes of the Neonatal Piglets Followi ng Hypoxia-Ischemia
Zhang Junmei Wang Xiaolei Liu Xiaoping,et al.
(The Third People′s Hospital of Chengdu 610031)
Abstract:Objective:To detemine whether the chang e of T lymphocytes subsets in the neonates following prenatal asphyxia is proba bl y due to the accelerated apoptosis and the effect of hypoxia-ischemia(HI) on ap optosis.Methods:The `DNA ladder'was observed by gel electrophoresis and d ynamic changes of the apoptosis ratio were investigated via Flow Cytometry (FCM) in the neonatal piglets following hypoxia-ischemia.Results:T he max apoptosis rate (MAR) in lymphocytes (incubated for 24-72 hr in vitro) po st HI was higher than that in control group(n=15,12,X±S=31.09±17.03%,5.52±6.1 7% F=10. 03 P<0.01);the daily apoptosis ratio (DAR) was also higher than thatin conro l group ( X±S=24.08±10.44%,4.05±3.57% F=12.50,P<0.01).The appearance of `DNA ladder 'was corresponded to hypodiploid peak observed by FCM.Conclusion:The results sugest that there is accelerated apoptosis in lymphocytes of the neonates following prenatal asphyxia;The alteration of T lymhocyte subsets in th e n eonates folowing prenatal asphyxia is probably due to the accelerated apoptosis in lymphocytes.
, 百拇医药
Key words:Hypoxia-ischemia;Lymphocyte;Apoptosis▲
我们的早期研究[1]显示新生儿T细胞亚群(CD3+、CD4+、CD 8+ T细胞)明显降低,且在短期内不能恢复。国内的其它研究[2]也证实了这一现象。 窒息新生儿T淋巴细胞亚群变化是否由于淋巴细胞凋亡加速所致,国内外少有文献报道。我 们以缺血缺氧(HI)新生猪模型模拟新生儿HIE,以探讨窒息对新生动物淋巴细胞凋亡的影响 ,现报告如下。
1 材料与方法
1.1 对象 健康新生猪27只,日龄≤三天,体重530~1010g,雌雄不限。 每次按同窝随机分成2组。其中实验组(A组)15只,正常对照组(B组)12只,各 组体重无统计学显著差异(F=1.63,P>0.05)。
, 百拇医药
1.2 方法
1.2.1 随机、单盲法。
1.2.2 HI新生猪模型的制作 结扎 新生猪左颈总动脉并将其置于封闭舱内,舱内持续低流量输入含8%氧气和92%氮气的混合气 体,2小时后取出新生猪为HIE模型[3]。各组动物常规给口服羟氨苄青霉素(100mg *kg-1*d-1)3天。动物经处理后4小时、72小时采股动脉血,肝素化,并将0. 5ml肝素化全血在含10%小牛血清的RPMI-1640培养液15ml中37℃下培养24小时、48小时、72 小时后分离淋巴细胞备检[4]。
1.2.3 淋巴细胞悬液的制备 取肝素抗凝血或全血培养液加等量HanK′s液 稀释后,用Ficoll液做淋巴细胞常规分离、纯化[5]。所获淋巴细胞用70%乙醇固定 ,4℃下保存备检。
, 百拇医药
1.2.4 琼脂电泳 收集到的淋巴细胞按Sellins等[6]的方法提取D NA,经1%琼脂糖电泳分析,紫外灯下观察结果及照像。
1.2.5 流式细胞术(FCM)检测 制备好的淋巴细胞悬液以PBS(pH7.4)液洗涤 1~2次后,将细胞数调至1×106/ml,加Triton-100胞膜打孔,RNase消化RNA,碘化丙啶 (PI,Sigma chemical Co.)染液1.0ml 4℃下30分钟后上FCM分析(FACScan型,BD公司)。依 据 DNA指数值(DI)判定DNA倍体,DI=1.0±2cv为二倍体(G0/G1期);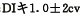 为异倍体 。DI<1.0±2cv为亚倍体(Sub-G0期)。用DNA细胞周期分析软件计算出DNA直方图各时相分 布的百分比,以亚二倍体(即Sub-G0期)比例表示细胞凋亡比例[7](A0PF),其计算公式为:
为异倍体 。DI<1.0±2cv为亚倍体(Sub-G0期)。用DNA细胞周期分析软件计算出DNA直方图各时相分 布的百分比,以亚二倍体(即Sub-G0期)比例表示细胞凋亡比例[7](A0PF),其计算公式为: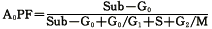
, 百拇医药
1.2.6 统计学处理 所有计量资料以x±s表示,用方差分析及q检验。
2 结 果
2.1 FCM检测 二组动物4小时、72小时活体内淋巴细胞未显示Sub-G0峰 。4小时全血经体外培养24、48、72小时后2组均出现了不同程度的淋巴细胞凋亡(图1)。以 日均淋巴细胞凋亡率(DA0R)表示3日淋巴细胞平均A0PF,以淋巴细胞最大凋亡率(MA0R )表示3日内测得的最大A0PF,结果(表1)显示MA0R F=10.03,P<0.01;DA0R F=12 .50 P<0.01。两组间各项指标(24小时、48小时、72小时)淋巴细胞凋亡率、DAOR、MAOR )比较,P(0.05~0.01)。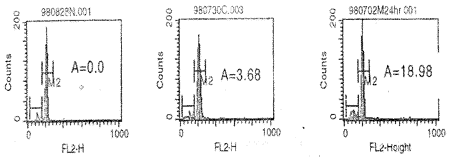
, 百拇医药
图1 FCM检测的淋巴细胞凋亡图
注:A图为活体内淋巴细胞DNA分析,未显示凋亡峰M1,凋亡率A=0.0%。
B图为B组(正常对照组)淋巴细胞DNA分析,显示凋亡峰M1,凋亡率A=3.68% 。
C图为A组(实验组)淋巴细胞DNA分析,显示凋亡峰M1,凋亡率A=18.98%。
2.2 DNA电泳分析 每组的部分样本作了琼脂电泳,“DNA梯带””的出 现与FCM结果一致(图2)。
, http://www.100md.com 图2 淋巴细胞的DNA电泳图
注:A为标准分子量Marker。
B为B组(正常对照组)淋巴细胞琼脂电泳,未显示凋亡梯带。
C为A组(实验组)淋巴细胞琼脂电泳,显示凋亡梯带。
表1 FCM检测的淋巴细胞凋亡情况
A组 n=15
B组 n=12
q 值
P值
24小时AOPF(%)
21.02±11.73
, http://www.100md.com
2.34±3.23
3.35
<0.05
48小时AOPF(%)
23.08±17.70
4.93±6.74
3.60
<0.05
72小时AOPF(%)
26.73±16.01
3.95±3.09
4.21
, 百拇医药
<0.01
DAOR(%)
24.08±10.44
4.05±3.57
4.39
<0.01
MAOR(%)
31.09±17.03
5.52±6.17
5.61
<0.01
3 讨 论
, http://www.100md.com
细胞凋亡也称细胞程序化死亡(PCD),是细胞生理性死亡的主要形式。在正常生理情况下细胞凋亡起着维持体内自身平衡的重要作用[8]。通过凋亡能及时清除过多的和/或受损的危险细胞。细胞凋亡的异常启动和抑制与一些疾病的发生,如获得性免疫缺陷综合征(AIDS)、肿瘤、自身免疫性疾病等等有着密切的关系。凋亡是在某些弱或亚致死量损伤刺激下,细胞产生核酸内切酶将DNA在核小体间剪切成180~200bp大小片段。凋亡细胞在形态学上呈特征性改变:核固缩、核边集、细胞质收缩、凋亡小体形成等。DNA片段在琼脂电泳上呈现“DNA梯带”。以前,凋亡的测定多采用经典的DNA片段测定法,凝胶电泳DNA片段测定法以及直接用显微镜计数凋亡细胞的方法,但上述方法操作过程繁琐,结果不稳定且有很大局限性。随着流式细胞术在细胞生物学及分子生物学领域的广泛应用,细胞凋亡的研究也取得了很大进展。碘化丙啶(PI)能嵌入DNA和RNA的碱基对上,将RNA消化后,PI可对DNA特异性荧光染色,在488nm激光下发出620nm的荧光,经FCM分析可见凋亡的细胞出现在直方图的亚二倍体峰位置,并与细胞的主峰G0/G1期分界清楚,可定量凋亡占整个细胞群的百分比。
, 百拇医药
新生儿窒息及窒息后并发症的防治仍然是我国儿科医务工作者面临的重要课题。我们的前期研究发现窒息新生儿急性期CD3+、CD4+、CD8+T细胞均明显降低(P<0.001~0.01),CD4+/CD8+无显著变化(P>0.05),恢复期T细胞亚群较急性期明显升高(P<0.05),但仍低于正常组(P<0.01),急性期T细胞亚群变化的程度并未显示出与窒息程度一致。1997年刘敬等的研究也证实了这一现象,并指出患儿血清IgM和C3亦明显降低,血清可溶性IL-2受体水平显著升高。以上研究揭示窒息可使新生儿T细胞减少,从而导致免疫功能低下,并在相当长一段时间内不能恢复,但发生这种变化的机理并不清楚,窒息时新生儿T淋巴细胞是否会出现凋亡的异常启动,国内外尚未见相关报道。本研究结果显示:(1)HI后4小时、72小时新生猪活体内淋巴细胞未检测到明显凋亡,推测原因可能是活体内网状内皮系统吞噬功能非常活跃,淋巴细胞一旦发生凋亡即迅速被清除,而导致难于在活体内测到大量的凋亡淋巴细胞。(2)二组动物淋巴细胞经体外孵育24小时~72小时后,实验组较对照组淋巴细胞凋亡率明显增加,提示HI急性期新生动物淋巴细胞凋亡机制的异常启动是导致T淋巴细胞亚群变化及免疫功能低下的重要原因之一;同时也证实了正常新生动物淋巴细胞归于凋亡这一现象,此与刘恩梅等的研究结果一致[9]。■
, 百拇医药
基金项目:本课题受四川省卫生厅及成都市卫生局科研基金赞助。
参考文献:
[1]王晓蕾,余涛,马文浩,等.窒息对新生儿T细胞亚群及细胞免疫功能 的影响.新生儿科杂志,1996,11:167
[2]刘敬,李华,赵莉,等.新生儿窒息的免疫学研究.中华儿童保健杂志 ,1997,5:105
[3]Rice JE,Vannucci Rc,Brienlg JB,et al.The influence of immat urity on hypoxic-ischemic brain damage in the rat.Ann Neurol,1991,9:131
[4]Emlen w,Nicbun J,Kader A.Accelerated in vitro apoptosis of lym phocyte from patients with sysemic lupus erythematosis.J Immunol,1994,152:3658
, 百拇医药
[5]左连富主编.流式细胞术样品制备技术.第1版,北京:华夏 出版社,1991:28
[6]Tccloskcy TW,Oyaizu N,Coroncsi M,et al.Use of a flow cytometri c assay to quantitate apoptosis in human lymphocytes.Clin Immuno Immunopathol,19 94,71:14
[7]Miche AH,Jianping G,Frank T,et al.Flow cytometric detection of apoptosis:comparison of the assays of in situ DNA degradation and chromatin cha nges.Cytometry,1994,15:234
[8]Duvall E,Wyllie AH.Death and the cell.Immunol Today,1986,7:115
[9]刘恩梅,李成荣,杨锡强,等.脐血淋巴细胞凋亡及其影响因素.中华 儿科杂志,1998,36(6):334, 百拇医药
单位:张峻梅 王晓蕾 刘晓平 刘凯 唐方(四川省成都市第三人民医院 610031);岑石强(华西医科大学)
关键词:缺血缺氧 淋巴细胞 凋亡
重庆医学000208摘 要:目的 探讨窒息新生儿T淋巴细胞亚群的 变化是否由于淋巴细胞凋亡的加速所致以及缺血缺氧(HI)对淋巴细胞凋亡的影响。方法 用琼脂电泳及流式细胞仪(FCM)对HI新生猪淋巴细胞凋亡动态定量分析 。结果 HI新生猪淋巴细胞经体外培养24~72小时后,其最大凋亡率 (MAR)较对照组明显增加(n=15,12,x±s=31.09±17.03,5.52±6.17%;F=10.03,P<0.01 ),其日均凋亡率(DAR)也较对照组明显增加(x±s=24.08±10.44,4.05±3.57,F=12.50,P <0.01);电泳观察到的“DNA梯带”与FCM结果一致。结论 HI新生 动物外周血淋巴细胞凋亡加速,提示窒息新生儿T淋巴细胞亚群的变化可能是由于淋巴细胞 凋亡的加速所致。
, http://www.100md.com
Study on Apoptosis in Lymphocytes of the Neonatal Piglets Followi ng Hypoxia-Ischemia
Zhang Junmei Wang Xiaolei Liu Xiaoping,et al.
(The Third People′s Hospital of Chengdu 610031)
Abstract:Objective:To detemine whether the chang e of T lymphocytes subsets in the neonates following prenatal asphyxia is proba bl y due to the accelerated apoptosis and the effect of hypoxia-ischemia(HI) on ap optosis.Methods:The `DNA ladder'was observed by gel electrophoresis and d ynamic changes of the apoptosis ratio were investigated via Flow Cytometry (FCM) in the neonatal piglets following hypoxia-ischemia.Results:T he max apoptosis rate (MAR) in lymphocytes (incubated for 24-72 hr in vitro) po st HI was higher than that in control group(n=15,12,X±S=31.09±17.03%,5.52±6.1 7% F=10. 03 P<0.01);the daily apoptosis ratio (DAR) was also higher than thatin conro l group ( X±S=24.08±10.44%,4.05±3.57% F=12.50,P<0.01).The appearance of `DNA ladder 'was corresponded to hypodiploid peak observed by FCM.Conclusion:The results sugest that there is accelerated apoptosis in lymphocytes of the neonates following prenatal asphyxia;The alteration of T lymhocyte subsets in th e n eonates folowing prenatal asphyxia is probably due to the accelerated apoptosis in lymphocytes.
, 百拇医药
Key words:Hypoxia-ischemia;Lymphocyte;Apoptosis▲
我们的早期研究[1]显示新生儿T细胞亚群(CD3+、CD4+、CD 8+ T细胞)明显降低,且在短期内不能恢复。国内的其它研究[2]也证实了这一现象。 窒息新生儿T淋巴细胞亚群变化是否由于淋巴细胞凋亡加速所致,国内外少有文献报道。我 们以缺血缺氧(HI)新生猪模型模拟新生儿HIE,以探讨窒息对新生动物淋巴细胞凋亡的影响 ,现报告如下。
1 材料与方法
1.1 对象 健康新生猪27只,日龄≤三天,体重530~1010g,雌雄不限。 每次按同窝随机分成2组。其中实验组(A组)15只,正常对照组(B组)12只,各 组体重无统计学显著差异(F=1.63,P>0.05)。
, 百拇医药
1.2 方法
1.2.1 随机、单盲法。
1.2.2 HI新生猪模型的制作 结扎 新生猪左颈总动脉并将其置于封闭舱内,舱内持续低流量输入含8%氧气和92%氮气的混合气 体,2小时后取出新生猪为HIE模型[3]。各组动物常规给口服羟氨苄青霉素(100mg *kg-1*d-1)3天。动物经处理后4小时、72小时采股动脉血,肝素化,并将0. 5ml肝素化全血在含10%小牛血清的RPMI-1640培养液15ml中37℃下培养24小时、48小时、72 小时后分离淋巴细胞备检[4]。
1.2.3 淋巴细胞悬液的制备 取肝素抗凝血或全血培养液加等量HanK′s液 稀释后,用Ficoll液做淋巴细胞常规分离、纯化[5]。所获淋巴细胞用70%乙醇固定 ,4℃下保存备检。
, 百拇医药
1.2.4 琼脂电泳 收集到的淋巴细胞按Sellins等[6]的方法提取D NA,经1%琼脂糖电泳分析,紫外灯下观察结果及照像。
1.2.5 流式细胞术(FCM)检测 制备好的淋巴细胞悬液以PBS(pH7.4)液洗涤 1~2次后,将细胞数调至1×106/ml,加Triton-100胞膜打孔,RNase消化RNA,碘化丙啶 (PI,Sigma chemical Co.)染液1.0ml 4℃下30分钟后上FCM分析(FACScan型,BD公司)。依 据 DNA指数值(DI)判定DNA倍体,DI=1.0±2cv为二倍体(G0/G1期);
, 百拇医药
1.2.6 统计学处理 所有计量资料以x±s表示,用方差分析及q检验。
2 结 果
2.1 FCM检测 二组动物4小时、72小时活体内淋巴细胞未显示Sub-G0峰 。4小时全血经体外培养24、48、72小时后2组均出现了不同程度的淋巴细胞凋亡(图1)。以 日均淋巴细胞凋亡率(DA0R)表示3日淋巴细胞平均A0PF,以淋巴细胞最大凋亡率(MA0R )表示3日内测得的最大A0PF,结果(表1)显示MA0R F=10.03,P<0.01;DA0R F=12 .50 P<0.01。两组间各项指标(24小时、48小时、72小时)淋巴细胞凋亡率、DAOR、MAOR )比较,P(0.05~0.01)。

, 百拇医药
图1 FCM检测的淋巴细胞凋亡图
注:A图为活体内淋巴细胞DNA分析,未显示凋亡峰M1,凋亡率A=0.0%。
B图为B组(正常对照组)淋巴细胞DNA分析,显示凋亡峰M1,凋亡率A=3.68% 。
C图为A组(实验组)淋巴细胞DNA分析,显示凋亡峰M1,凋亡率A=18.98%。
2.2 DNA电泳分析 每组的部分样本作了琼脂电泳,“DNA梯带””的出 现与FCM结果一致(图2)。

, http://www.100md.com 图2 淋巴细胞的DNA电泳图
注:A为标准分子量Marker。
B为B组(正常对照组)淋巴细胞琼脂电泳,未显示凋亡梯带。
C为A组(实验组)淋巴细胞琼脂电泳,显示凋亡梯带。
表1 FCM检测的淋巴细胞凋亡情况
A组 n=15
B组 n=12
q 值
P值
24小时AOPF(%)
21.02±11.73
, http://www.100md.com
2.34±3.23
3.35
<0.05
48小时AOPF(%)
23.08±17.70
4.93±6.74
3.60
<0.05
72小时AOPF(%)
26.73±16.01
3.95±3.09
4.21
, 百拇医药
<0.01
DAOR(%)
24.08±10.44
4.05±3.57
4.39
<0.01
MAOR(%)
31.09±17.03
5.52±6.17
5.61
<0.01
3 讨 论
, http://www.100md.com
细胞凋亡也称细胞程序化死亡(PCD),是细胞生理性死亡的主要形式。在正常生理情况下细胞凋亡起着维持体内自身平衡的重要作用[8]。通过凋亡能及时清除过多的和/或受损的危险细胞。细胞凋亡的异常启动和抑制与一些疾病的发生,如获得性免疫缺陷综合征(AIDS)、肿瘤、自身免疫性疾病等等有着密切的关系。凋亡是在某些弱或亚致死量损伤刺激下,细胞产生核酸内切酶将DNA在核小体间剪切成180~200bp大小片段。凋亡细胞在形态学上呈特征性改变:核固缩、核边集、细胞质收缩、凋亡小体形成等。DNA片段在琼脂电泳上呈现“DNA梯带”。以前,凋亡的测定多采用经典的DNA片段测定法,凝胶电泳DNA片段测定法以及直接用显微镜计数凋亡细胞的方法,但上述方法操作过程繁琐,结果不稳定且有很大局限性。随着流式细胞术在细胞生物学及分子生物学领域的广泛应用,细胞凋亡的研究也取得了很大进展。碘化丙啶(PI)能嵌入DNA和RNA的碱基对上,将RNA消化后,PI可对DNA特异性荧光染色,在488nm激光下发出620nm的荧光,经FCM分析可见凋亡的细胞出现在直方图的亚二倍体峰位置,并与细胞的主峰G0/G1期分界清楚,可定量凋亡占整个细胞群的百分比。
, 百拇医药
新生儿窒息及窒息后并发症的防治仍然是我国儿科医务工作者面临的重要课题。我们的前期研究发现窒息新生儿急性期CD3+、CD4+、CD8+T细胞均明显降低(P<0.001~0.01),CD4+/CD8+无显著变化(P>0.05),恢复期T细胞亚群较急性期明显升高(P<0.05),但仍低于正常组(P<0.01),急性期T细胞亚群变化的程度并未显示出与窒息程度一致。1997年刘敬等的研究也证实了这一现象,并指出患儿血清IgM和C3亦明显降低,血清可溶性IL-2受体水平显著升高。以上研究揭示窒息可使新生儿T细胞减少,从而导致免疫功能低下,并在相当长一段时间内不能恢复,但发生这种变化的机理并不清楚,窒息时新生儿T淋巴细胞是否会出现凋亡的异常启动,国内外尚未见相关报道。本研究结果显示:(1)HI后4小时、72小时新生猪活体内淋巴细胞未检测到明显凋亡,推测原因可能是活体内网状内皮系统吞噬功能非常活跃,淋巴细胞一旦发生凋亡即迅速被清除,而导致难于在活体内测到大量的凋亡淋巴细胞。(2)二组动物淋巴细胞经体外孵育24小时~72小时后,实验组较对照组淋巴细胞凋亡率明显增加,提示HI急性期新生动物淋巴细胞凋亡机制的异常启动是导致T淋巴细胞亚群变化及免疫功能低下的重要原因之一;同时也证实了正常新生动物淋巴细胞归于凋亡这一现象,此与刘恩梅等的研究结果一致[9]。■
, 百拇医药
基金项目:本课题受四川省卫生厅及成都市卫生局科研基金赞助。
参考文献:
[1]王晓蕾,余涛,马文浩,等.窒息对新生儿T细胞亚群及细胞免疫功能 的影响.新生儿科杂志,1996,11:167
[2]刘敬,李华,赵莉,等.新生儿窒息的免疫学研究.中华儿童保健杂志 ,1997,5:105
[3]Rice JE,Vannucci Rc,Brienlg JB,et al.The influence of immat urity on hypoxic-ischemic brain damage in the rat.Ann Neurol,1991,9:131
[4]Emlen w,Nicbun J,Kader A.Accelerated in vitro apoptosis of lym phocyte from patients with sysemic lupus erythematosis.J Immunol,1994,152:3658
, 百拇医药
[5]左连富主编.流式细胞术样品制备技术.第1版,北京:华夏 出版社,1991:28
[6]Tccloskcy TW,Oyaizu N,Coroncsi M,et al.Use of a flow cytometri c assay to quantitate apoptosis in human lymphocytes.Clin Immuno Immunopathol,19 94,71:14
[7]Miche AH,Jianping G,Frank T,et al.Flow cytometric detection of apoptosis:comparison of the assays of in situ DNA degradation and chromatin cha nges.Cytometry,1994,15:234
[8]Duvall E,Wyllie AH.Death and the cell.Immunol Today,1986,7:115
[9]刘恩梅,李成荣,杨锡强,等.脐血淋巴细胞凋亡及其影响因素.中华 儿科杂志,1998,36(6):334, 百拇医药