盐酸胺碘酮制剂质量研究:Ⅰ.市售片体外溶出度考查
作者:胡晋红 张立超 李珍 石晶
单位:胡晋红(第二军医大学长海医院药学部,上海 200433);张立超(第二军医大学长海医院药学部,上海 200433);李珍(第二军医大学长海医院药学部,上海 200433);石晶(第二军医大学长海医院药学部,上海 200433)
关键词:盐酸胺碘酮;溶出度;分光光度法;紫外线
摘 要摘 要:目的:比较国产和进口共6批盐酸胺碘酮片的体外溶出度,为其质量控制提供依据。方法:采用转篮法分别比较加和不加表面活性剂的释放介质中不同批次片剂的溶出度大小,并对T50,Td,m等参数进行方差分析。结果:在两种介质中,崩解时限检查都合格的进口片溶出度明显高于国产片剂,有非常显著性差异(P<0.01)。结论:建议控制制剂质量并规定溶出度标准,以保证临床疗效。
, 百拇医药 分类号:R 972.2 文献标识码:A
文章编号:0258-879X(2000)02-0140-03
Pharmaceutical quality study on amiodarone hydrochloride:Ⅰ.in vitro dissolution rate of market tablets
HU Jin-Hong
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
ZHANG Li-Chao
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
, 百拇医药
LI Zhen(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
SHI Jing
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
ABSTRACT:Objective: To compare dissolution of amiodarone hydrochloride tablets from 4 batches domestic products and 2 batches imported products in vitro. Methods: Rotating basket was used, and dissolution parameters of T50,Td,m were also analyzed by various analysis method. Results: In the 2 dissolution medium, dissolution rate of imported products were significantly higher than that of domestic products. Various analysis showed there were significant differences between the products from domestic and abroad factories(P<0.01). Conclusion: The dissolution of the product should be tested to control the quality and ensure clinical efficacy.
, 百拇医药
KEY WORDS:amiodarone hydrochloride;dissolution;spectrophotometry,ultraviolet▲
盐酸胺碘酮(amiodarone hydrochloride)为临床常用的抗心律失常药,对室性、室上性心动过速、早搏、阵发性心房扑动和颤动及预激综合症所致的心律失常均有治疗作用。本品难溶于水,因此其体内吸收受剂型因素影响较大。《中国药典》1995年版对该产品仅规定了崩解时限检查,对溶出度未作要求。目前临床使用的盐酸胺碘酮片中,进口片疗效优于国产片。为系统评价其产品质量,确保临床疗效,我们建立了用紫外分光光度法定量的盐酸胺碘酮片剂溶出度测定方法,通过采用不同释放介质对不同批号国产及进口片剂进行比较研究,来初步获得溶出度检测标准。这方面的工作国内外文献尚未见报道。
1 材料和方法
1.1 仪器和药品 RCD6-C型药物溶出仪(上海黄海药检仪器厂);UV-2100型分光光度计(日本岛津)。进口盐酸胺碘酮片(商品名:可达龙,法国Sanofi进口分装,Batch NO A片K10101999,B片M05021999);沪产盐酸胺碘酮片(C片批号970202,D片980601,E片970701,F片980801),规格均为每片200 mg;盐酸胺碘酮对照品,含量99.9% (上海九福药业公司提供),十二烷基硫酸钠(SLS,苏州振亚化工厂)。
, 百拇医药
1.2 测定条件的确定 分别在人工胃液和0.25% SLS溶液中,于200~400 nm波长范围扫描,盐酸胺碘酮在242 nm波长处有最大吸收,本研究确定在(242±1) nm波长处进行含量测定,在此波长下无水乙醇及其他辅料如淀粉等对测定均无干扰。
1.3 标准曲线的制备 精密称取17.7 mg盐酸胺碘酮对照品于100 ml容量瓶中,加入20 ml无水乙醇助溶,用人工胃液稀释至刻度。分别精密量取1.0,2.0,2.5,3.0,4.0,5.0 ml于50 ml容量瓶中,用人工胃液稀释至刻度。在242 nm处测定其吸光度D,经回归得直线方程:c=-0.018+ 19.701D (r = 0.999 8),线性范围是3~18 μg/ml,方法回收率为(101.7±2.2)%,日内RSD为0.79%,日间RSD为0.60%。同法建立盐酸胺碘酮在0.25%SLS液中的标准曲线为 :c=-0.124 +19.857 D (r = 0.999 9),线性范围是2~20 μg/ml,方法回收率为(104.6±0.7)%,日内RSD为0.29%,日间RSD为0.78%。
, 百拇医药
1.4 含量测定 随机取各批样品各10片,精密称定,研细,精密称取适量(约相当于盐酸胺碘酮50 mg)3份,分别加适量乙醇助溶,并用人工胃液稀释至100 ml,振摇,过滤,取续滤液1 ml稀释至50 ml,在242 nm测定D,用标准曲线法求出药物浓度并换算成标示量为质量分数。
1.5 溶出度测定 采用《中国药典》1995年版有关溶出度项下规定[1],采用转篮法,介质分别为1 000 ml人工胃液和0.25% SLS液,转速100 r/min,温度(37±1)℃进行实验。每一样品重复6次。分别于10,20,30,40,50,90,120 min取样5 ml,0.8 μm滤膜过滤,同时补充同温度5 ml新鲜人工胃液,取续滤液在242 nm处测定D(介质为0.25%SLS液时,稀释至1/10后测定)。
1.6 统计学处理 对含SLS释放介质的T50,Td,m等溶出参数进行方差分析。
, 百拇医药
2 结 果
2.1 样品含量测定 见表1。
表1 各批样品的含量测定结果
Tab 1 Contents determination of samples
(n=10, ±s)
±s)
Batches
Average mass(m/g)
Content(%)
, 百拇医药
A
0.358 1
96.36
B
0.354 1
96.72
C
0.346 7
95.96
D
0.367 5
99.89
E
, http://www.100md.com
0.355 9
97.75
F
0.356 6
100.05
2.2 溶出度测定 图1和图2分别为两种释放介质中累积溶出曲线,从图中可看出,盐酸胺碘酮在人工胃液中溶出很少,且进口与国产片及各批号间溶出度差异显著。为符合《中国药典》规定[1],本研究仅对含SLS介质的数据按Weibull函数公式计算参数T50 ,Td 及m。结果见表2。
, 百拇医药
图1 盐酸胺碘酮片在人工胃液中的累积溶出曲线
Fig 1 Cumulative dissolution profiles of amiodarone
tablets in simulated gastric fluid
○: A tablet; ●: B tablet; △: C tablet;
▲: D tablet; □: E tablet; ■: F tablet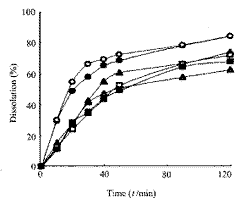
图2 盐酸胺碘酮片在0.25% SLS中的累积溶出曲线
, http://www.100md.com
Fig 2 Cumulative dissolution profiles of
amiodarone tablets in 0.25% SLS fluid
○: A tablet; ●: B tablet; △: C tablet;
▲: D tablet; □: E tablet; ■: F tablet
表2 SLS介质中盐酸胺碘酮片的溶出参数
Tab 2 Dissolution parameters of amiodarone
tablets in SLS media
(n=6, ±s)
±s)
, 百拇医药
Batches
T50
Td
m
A
6.6± 3.9
18.9± 5.8
0.33±0.11
B
13.7± 2.4
31.1± 1.5
0.45±0.07
, http://www.100md.com
C
46.4± 5.7
107.8± 7.7
0.44±0.07
D
32.7±10.2
60.3±10.0
0.60±0.13
E
48.9±14.5
78.9±19.8
0.76±0.10
, 百拇医药
F
45.2± 5.1
86.5±10.8
0.57±0.04
2.3 统计学处理结果 对含SLS释放介质的T50,Td,m等溶出参数进行方差分析,结果显示组内和组间均存在非常显著差异(P<0.01)。
3 讨 论
本法操作简便、快速、准确,回收率较好,符合溶出度测定要求。
目前中国药典仅收载盐酸胺碘酮片崩解度检查,作者发现各批片剂1 min内都迅速崩散,说明崩解合格。但国产片崩散颗粒粗,大量沉降而少许漂浮液面,测试液澄清;进口片颗粒较细,测试液呈混悬状,说明国产片在辅料和工艺等制剂学方面可能存在一些问题。我们先选用人工胃液为介质,结果虽显示了进口片比国产产品有较高溶出度,但在这种介质中,盐酸胺碘酮的溶出速度慢且量少,即使进口片最大溶出量也不到6%。为筛选一种符合药典规定在45 min内溶出不低于70%的测定方法,按有关文献[2,3]经预试,以加入0.25%润湿剂SLS的水溶液为介质,盐酸胺碘酮溶出量急剧增加。对溶出参数T50,Td,m经方差分析结果表明,进口片溶出度远大于国产片,这与临床疗效一致,进一步说明了国产片可能存在制剂学等问题。此外,无论进口还是国产片,同一厂家的产品均存在批间显著性差异。因此我们建议,为考察制剂质量,确保临床疗效,中国药典可增订溶出度检查项目:采用转篮法,转速100 r/min,用1 000 ml 0.25% SLS液作为释放介质,每片溶出量在45 min内不低于标示量的70%。
, 百拇医药
为优化筛选出更符合体内要求的溶出度测定方法。我们将对盐酸胺碘酮片做进一步的生物利用度研究。同时要解决国产制剂溶出度问题,可以采用改善制剂辅料和采用新工艺等方法,如固体分散体技术、对难溶性主药微粉化以及内加崩解剂或表面活性剂等。有关制剂学方面研究还有待进一步深入。
作者简介:胡晋红(1949~),女(汉族),硕士,主任药师,博士生导师
参考文献:
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[M].1995年版.北京:化学工业出版社,广州:广东科技出版社,1995.附录63.
[2]陈镇生.缓释制剂体外溶出考察方法的探讨[J]. 中国医药工业杂志,1997,28(1):43-47.
[3]张霖泽,王兰勤,Shah NH. 口服控释制剂的质量评价[J]. 中国药学杂志,1995,30(6):366-371.
收稿日期:1999-08-13
修稿日期:1999-11-15, 百拇医药
单位:胡晋红(第二军医大学长海医院药学部,上海 200433);张立超(第二军医大学长海医院药学部,上海 200433);李珍(第二军医大学长海医院药学部,上海 200433);石晶(第二军医大学长海医院药学部,上海 200433)
关键词:盐酸胺碘酮;溶出度;分光光度法;紫外线
摘 要摘 要:目的:比较国产和进口共6批盐酸胺碘酮片的体外溶出度,为其质量控制提供依据。方法:采用转篮法分别比较加和不加表面活性剂的释放介质中不同批次片剂的溶出度大小,并对T50,Td,m等参数进行方差分析。结果:在两种介质中,崩解时限检查都合格的进口片溶出度明显高于国产片剂,有非常显著性差异(P<0.01)。结论:建议控制制剂质量并规定溶出度标准,以保证临床疗效。
, 百拇医药 分类号:R 972.2 文献标识码:A
文章编号:0258-879X(2000)02-0140-03
Pharmaceutical quality study on amiodarone hydrochloride:Ⅰ.in vitro dissolution rate of market tablets
HU Jin-Hong
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
ZHANG Li-Chao
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
, 百拇医药
LI Zhen(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
SHI Jing
(Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433, China)
ABSTRACT:Objective: To compare dissolution of amiodarone hydrochloride tablets from 4 batches domestic products and 2 batches imported products in vitro. Methods: Rotating basket was used, and dissolution parameters of T50,Td,m were also analyzed by various analysis method. Results: In the 2 dissolution medium, dissolution rate of imported products were significantly higher than that of domestic products. Various analysis showed there were significant differences between the products from domestic and abroad factories(P<0.01). Conclusion: The dissolution of the product should be tested to control the quality and ensure clinical efficacy.
, 百拇医药
KEY WORDS:amiodarone hydrochloride;dissolution;spectrophotometry,ultraviolet▲
盐酸胺碘酮(amiodarone hydrochloride)为临床常用的抗心律失常药,对室性、室上性心动过速、早搏、阵发性心房扑动和颤动及预激综合症所致的心律失常均有治疗作用。本品难溶于水,因此其体内吸收受剂型因素影响较大。《中国药典》1995年版对该产品仅规定了崩解时限检查,对溶出度未作要求。目前临床使用的盐酸胺碘酮片中,进口片疗效优于国产片。为系统评价其产品质量,确保临床疗效,我们建立了用紫外分光光度法定量的盐酸胺碘酮片剂溶出度测定方法,通过采用不同释放介质对不同批号国产及进口片剂进行比较研究,来初步获得溶出度检测标准。这方面的工作国内外文献尚未见报道。
1 材料和方法
1.1 仪器和药品 RCD6-C型药物溶出仪(上海黄海药检仪器厂);UV-2100型分光光度计(日本岛津)。进口盐酸胺碘酮片(商品名:可达龙,法国Sanofi进口分装,Batch NO A片K10101999,B片M05021999);沪产盐酸胺碘酮片(C片批号970202,D片980601,E片970701,F片980801),规格均为每片200 mg;盐酸胺碘酮对照品,含量99.9% (上海九福药业公司提供),十二烷基硫酸钠(SLS,苏州振亚化工厂)。
, 百拇医药
1.2 测定条件的确定 分别在人工胃液和0.25% SLS溶液中,于200~400 nm波长范围扫描,盐酸胺碘酮在242 nm波长处有最大吸收,本研究确定在(242±1) nm波长处进行含量测定,在此波长下无水乙醇及其他辅料如淀粉等对测定均无干扰。
1.3 标准曲线的制备 精密称取17.7 mg盐酸胺碘酮对照品于100 ml容量瓶中,加入20 ml无水乙醇助溶,用人工胃液稀释至刻度。分别精密量取1.0,2.0,2.5,3.0,4.0,5.0 ml于50 ml容量瓶中,用人工胃液稀释至刻度。在242 nm处测定其吸光度D,经回归得直线方程:c=-0.018+ 19.701D (r = 0.999 8),线性范围是3~18 μg/ml,方法回收率为(101.7±2.2)%,日内RSD为0.79%,日间RSD为0.60%。同法建立盐酸胺碘酮在0.25%SLS液中的标准曲线为 :c=-0.124 +19.857 D (r = 0.999 9),线性范围是2~20 μg/ml,方法回收率为(104.6±0.7)%,日内RSD为0.29%,日间RSD为0.78%。
, 百拇医药
1.4 含量测定 随机取各批样品各10片,精密称定,研细,精密称取适量(约相当于盐酸胺碘酮50 mg)3份,分别加适量乙醇助溶,并用人工胃液稀释至100 ml,振摇,过滤,取续滤液1 ml稀释至50 ml,在242 nm测定D,用标准曲线法求出药物浓度并换算成标示量为质量分数。
1.5 溶出度测定 采用《中国药典》1995年版有关溶出度项下规定[1],采用转篮法,介质分别为1 000 ml人工胃液和0.25% SLS液,转速100 r/min,温度(37±1)℃进行实验。每一样品重复6次。分别于10,20,30,40,50,90,120 min取样5 ml,0.8 μm滤膜过滤,同时补充同温度5 ml新鲜人工胃液,取续滤液在242 nm处测定D(介质为0.25%SLS液时,稀释至1/10后测定)。
1.6 统计学处理 对含SLS释放介质的T50,Td,m等溶出参数进行方差分析。
, 百拇医药
2 结 果
2.1 样品含量测定 见表1。
表1 各批样品的含量测定结果
Tab 1 Contents determination of samples
(n=10,
Batches
Average mass(m/g)
Content(%)
, 百拇医药
A
0.358 1
96.36
B
0.354 1
96.72
C
0.346 7
95.96
D
0.367 5
99.89
E
, http://www.100md.com
0.355 9
97.75
F
0.356 6
100.05
2.2 溶出度测定 图1和图2分别为两种释放介质中累积溶出曲线,从图中可看出,盐酸胺碘酮在人工胃液中溶出很少,且进口与国产片及各批号间溶出度差异显著。为符合《中国药典》规定[1],本研究仅对含SLS介质的数据按Weibull函数公式计算参数T50 ,Td 及m。结果见表2。

, 百拇医药
图1 盐酸胺碘酮片在人工胃液中的累积溶出曲线
Fig 1 Cumulative dissolution profiles of amiodarone
tablets in simulated gastric fluid
○: A tablet; ●: B tablet; △: C tablet;
▲: D tablet; □: E tablet; ■: F tablet

图2 盐酸胺碘酮片在0.25% SLS中的累积溶出曲线
, http://www.100md.com
Fig 2 Cumulative dissolution profiles of
amiodarone tablets in 0.25% SLS fluid
○: A tablet; ●: B tablet; △: C tablet;
▲: D tablet; □: E tablet; ■: F tablet
表2 SLS介质中盐酸胺碘酮片的溶出参数
Tab 2 Dissolution parameters of amiodarone
tablets in SLS media
(n=6,
, 百拇医药
Batches
T50
Td
m
A
6.6± 3.9
18.9± 5.8
0.33±0.11
B
13.7± 2.4
31.1± 1.5
0.45±0.07
, http://www.100md.com
C
46.4± 5.7
107.8± 7.7
0.44±0.07
D
32.7±10.2
60.3±10.0
0.60±0.13
E
48.9±14.5
78.9±19.8
0.76±0.10
, 百拇医药
F
45.2± 5.1
86.5±10.8
0.57±0.04
2.3 统计学处理结果 对含SLS释放介质的T50,Td,m等溶出参数进行方差分析,结果显示组内和组间均存在非常显著差异(P<0.01)。
3 讨 论
本法操作简便、快速、准确,回收率较好,符合溶出度测定要求。
目前中国药典仅收载盐酸胺碘酮片崩解度检查,作者发现各批片剂1 min内都迅速崩散,说明崩解合格。但国产片崩散颗粒粗,大量沉降而少许漂浮液面,测试液澄清;进口片颗粒较细,测试液呈混悬状,说明国产片在辅料和工艺等制剂学方面可能存在一些问题。我们先选用人工胃液为介质,结果虽显示了进口片比国产产品有较高溶出度,但在这种介质中,盐酸胺碘酮的溶出速度慢且量少,即使进口片最大溶出量也不到6%。为筛选一种符合药典规定在45 min内溶出不低于70%的测定方法,按有关文献[2,3]经预试,以加入0.25%润湿剂SLS的水溶液为介质,盐酸胺碘酮溶出量急剧增加。对溶出参数T50,Td,m经方差分析结果表明,进口片溶出度远大于国产片,这与临床疗效一致,进一步说明了国产片可能存在制剂学等问题。此外,无论进口还是国产片,同一厂家的产品均存在批间显著性差异。因此我们建议,为考察制剂质量,确保临床疗效,中国药典可增订溶出度检查项目:采用转篮法,转速100 r/min,用1 000 ml 0.25% SLS液作为释放介质,每片溶出量在45 min内不低于标示量的70%。
, 百拇医药
为优化筛选出更符合体内要求的溶出度测定方法。我们将对盐酸胺碘酮片做进一步的生物利用度研究。同时要解决国产制剂溶出度问题,可以采用改善制剂辅料和采用新工艺等方法,如固体分散体技术、对难溶性主药微粉化以及内加崩解剂或表面活性剂等。有关制剂学方面研究还有待进一步深入。
作者简介:胡晋红(1949~),女(汉族),硕士,主任药师,博士生导师
参考文献:
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[M].1995年版.北京:化学工业出版社,广州:广东科技出版社,1995.附录63.
[2]陈镇生.缓释制剂体外溶出考察方法的探讨[J]. 中国医药工业杂志,1997,28(1):43-47.
[3]张霖泽,王兰勤,Shah NH. 口服控释制剂的质量评价[J]. 中国药学杂志,1995,30(6):366-371.
收稿日期:1999-08-13
修稿日期:1999-11-15, 百拇医药