果糖-1,6-二磷酸钙的制备研究
作者:王驰 潘黎军 徐昌喜
单位:重庆医科大学生物医学工程研究室,重庆 400016
关键词:果糖-1,6-二磷酸钙;制备;精制;质量控制
中国药物化学杂志000208 摘要 首次报道了一种简易,便于工业生产的分离精制果糖二磷酸钙(Ca2FDP)的新方法.本法主要改进之处是发酵液先采用调节pH生成沉淀步骤除去大量杂质,Ca2FDP粗品又经酸碱沉淀步骤除去剩余杂质;由以上二个缓和简便的固液分离操作,能除去难分离的己糖磷酸酯、磷酸盐、多糖等杂质.由本法获得的Ca2FDP不仅在FDP含量、杂质限量等主要质量控制指标上达到药用标准,而且为制备FDP类新衍生物提供了有效手段.
A Study on the Preparation of a New Drug Calcium Fructose-1,6-diphosphate
, http://www.100md.com
Wang Chi Pan Lijun Xu Changxi
(Department of Biomedical Engineering,Chongqing University of Medical Sciences,Chongqing 400016)
Abstract A new simple method for isolation and purification of a new drug calcium fructose-1,6-diphosphate from the fermentation mixture and its quality control have been reported in this paper.The major contaminating matter,which included inorganic phosphate and hexose monophosphates could be removed by adjusting the pH of the mixture to 8.5.After the crude was recovered,further purification was effected by dissolving the crude in an acid and reprecipitated by the addition of an alkali,the unknown impurities left were removed by this procedure.The calcium fructose diphosphate in a pure form was obtained.The method is commercially useful in the manufacture of pharmaceuticals.
, 百拇医药
Key words calcium fructose-1,6-diphosphate;preparation;purification;quality control 果糖-1,6-二磷酸(fructose-1,6-diphosphate,FDP,Ⅰ)早在20世纪30年代就被确认为糖代谢的重要中间体.20世纪80年代以来,美国Markov等〔1〕经实验动物及临床研究发现FDP钠盐治疗心肌梗死、休克等组织缺血、缺氧性疾病的疗效后,由意大利Foscama制药公司开发的FDP钠盐(注射级冻干粉,商品名为Esafosfina)和果糖二磷酸钙(calcium fructose-1,6-diphosphate,Ca2FDP,Ⅱ,片剂,商品名为Esafosfina Glutammica)先后于1987年和1992年上市.Esafosfina Glutammica用于脑代谢疾病、骨化疾病、骨骼肌代谢障碍、糖尿病等各种代谢性疾病的辅助治疗.有关FDP钙盐制备研究的文献报道很少.
目前(Ⅰ)的工业生产多采用Leisola〔2〕报道的发酵法(见图1),发酵过程简便,但分离精制困难.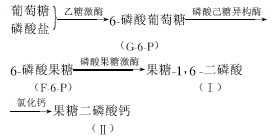
, http://www.100md.com
Fig.1 The continuously enzymatic phosphorylation
of glucose to FDP
(Ⅱ)本身是治疗药品,又可以作为研究制备FDP新衍生物的中间体,作者提出在钙盐沉淀法前后,采用调节发酵液pH、沉淀和酸溶碱沉出等分步沉淀的分离精制新方法.该法对(Ⅱ)和(Ⅰ)的工业生产具有简便实用价值,并为制备(Ⅰ)的新衍生物〔3〕提供纯净的中间体.(Ⅱ)的质量以红外光谱、薄层色谱、含量测定等质量研究进行控制.
1 实验部分
原料:啤酒酵母(S.cerevisiae)由重庆啤酒厂提供,所用菌体均取自生产现场.使用时用蒸馏水洗涤两次,离心分离,收集菌体.葡萄糖为重庆制药五厂产品.
分析试剂:果糖-1,6-二磷酸三钠盐(对照品)SIGMA;间苯二酚-硫脲试剂:0.1 g间苯二酚和0.25 g硫脲溶于100 mL冰醋酸,贮存于棕色瓶中备用;钼酸铵试剂:在200 mL水中慢慢加入浓H2SO4 45 mL,再加钼酸铵22 g,溶解后保存于试剂瓶中备用;对甲氨基酚硫酸试剂:溶解350 mg对甲氨基酚硫酸盐于50 mL水中,加亚硫酸氢钠20 g,混匀,加水稀释至100 mL.
, 百拇医药
仪器:SHZ-22型水浴恒温振荡器(江苏太仓县医疗器械厂);CS 501型超级恒温器(重庆试验设备厂);721型分光光度计(四川分析仪器厂);IR-440型红外光谱仪(日本岛津).
1.1 制备方法
发酵:参照Leisola等〔2〕的方法,发酵液组成中,原料改用葡萄糖代替蔗糖,NaH2PO4,MgCl2.调节pH 6.5左右,加入新鲜啤酒酵母和甲苯后,混匀,密闭,在30℃下进行恒温振摇,反应3~5 h,反应终点由快速分析发酵液中无机磷含量下降至最低点法确定.
分离、精制:发酵毕,离心,弃去酵母,用三氯醋酸沉淀除去蛋白质后,离心,取上清液加入氨水调节pH 8.5,有大量沉淀生成.待沉淀毕,离心弃去沉淀,再加入约200 mL 50%CaCl2溶液,即可得(Ⅱ)的粗制品.粗制品于100 mL蒸馏水中,缓慢滴加盐酸溶液至pH 1.0,离心,弃去不溶物.上清液中加入NaOH溶液至pH 8.5,离心,收集沉淀.重复操作一次.减压过滤,收集沉淀于真空干燥器中,干燥后得到白色粉末(Ⅱ)35 g.按发酵液(2L)中FDP浓度计算,收率约为50%.
, http://www.100md.com
1.2 主要质量指标分析测试
红外光谱:供试品用溴化钾压片,对照品同样处理.在岛津IR-440型红外仪上测定红外吸收光谱.
薄层色谱参照文献〔4〕方法进行测定.
FDP的测定:参照文献〔5〕方法,精密称取适量(约0.15 g)供试品,溶于蒸馏水中(若样品不溶可加几滴盐酸),稀释至100 mL,吸取10 mL再稀释至100 mL,吸取2 mL溶液以酚酞为指示剂加NaOH溶液至红色出现,加4滴25%醋酸钡溶液,放置15 min,离心,沉淀用5 mL 75%乙醇洗涤,离心,洗液弃去,向沉淀中加入预先混合并冷却的显色试剂(7 mL浓盐酸,2 mL间苯二酚-硫脲试剂和1 mL蒸馏水),搅拌,离心.将上清液置于80℃水浴中加热13 min,冷至室温后,用721分光光度计在570 nm波长处测定吸光度.以D-果糖二磷酸三钠盐(SIGMA)绘制标准曲线.据供试品吸光度在标准曲线上求出含量.
, http://www.100md.com
无机磷酸盐(Pi)的测定:精密称取约20 mg供试品,按照《中华人民共和国药典》1995年版二部地塞米松磷酸钠中游离磷酸项测定.
Ca2+的测定采用EDTA法.
2 结果
红外光谱测定结果:果糖-1,6-二磷酸钙具有单糖的酯类结构,分子中羟基较多,故特征峰为O—H键的伸缩振动(νO—H)和碳氧键的伸缩振动(νC—O)以及糖与磷酸基相连的C—O—P键的伸缩振动(νC—O—P),结果见表1.
由上述分析可知,样品与对照品在相同测试条件下录制的红外吸收光谱图及解析结果基本一致.证明了供试品No.5中果糖二磷酸的结构.
薄层色谱法检测结果:供试品与SIGMA公司的果糖二磷酸三钠对照品的Rf值及斑点颜色一致.
, http://www.100md.com
几种分离精制法比较:直接钙盐沉淀法〔2〕与分步沉淀分离法各步骤对(Ⅱ)的主要质量指标(FDP含量,杂质Pi限量)的影响见表2.
Tab.1 Infrared spectral analysis Reference standard
Sample(No.5)
Wave number/cm-1
Absorption peak
Wave number/cm-1
Absorption peak
3400~3200
, http://www.100md.com
νO—H
3600~3300
νO—H
1660~1630
νCO
1660~1620
νCO
1080~1030
νC—O
1080~1040
νC—O
, 百拇医药
940~920
νC—O—P
940~920
νC—O—P
Tab.2 The comparision of quality of Ca2FDP No.
Precipitation
FDP/%
Pi/%
Ca2+/%
Calcd.①
, http://www.100md.com
Found
Limit
Found
Calcd.①
Found
1
simple
80.95
42.21
<2
>5
19.05
>20
, http://www.100md.com
2
adjusted pH
80.95
48.20
<2
0.86
19.05
18.22
3
acid and alkali
80.95
69.44
<2
, 百拇医药
4.16
19.05
18.66
4
No.2+No.3
80.95
76.66
<2
0.67
19.05
18.75
5
No.2+No.3
, 百拇医药
80.95
76.60
<2
0.40
19.05
18.49
①Calculated on the anhydrous basis
3 讨论
FDP的化学性质活泼,对酸、碱、加热都很敏感.酸性介质中,FDP C1高能磷酸键易水解.在碱性介质中,FDP易发生异构化.细菌污染后则降解为三碳糖磷酸酯.
文献中(Ⅱ)的前体(Ⅰ)从发酵液中提取,分离精制的方法主要有下述几种:Sable等〔6〕报道将(Ⅰ)经FDP钡盐,再转化成士的宁盐,通过重结晶纯化FDP.其步骤冗繁且士的宁剧毒、价昂,无药用生产价值.Leisola〔2〕曾用钙盐直接沉淀法和反渗析法,并指出这一纯化过程不能去掉Pi,反渗析过程中FDP量有0%~50%的损失.意大利Foscama专利法〔7〕是在发酵液去蛋白质后,经阳离子树脂除去阳离子,阴离子树脂吸附FDP阴离子,再用NH4Cl/NH3,NaCl和HCl溶液洗脱,洗脱液中和后冻干制取(Ⅰ).此法树脂用量大,吸附、洗脱、大量稀释后浓缩过程周期长,易导致细菌性污染降解,设备昂贵,生产成本高.
, 百拇医药
表2中钙盐直接沉淀法(No.1)为参照Leisola〔2〕等方法所得实验结果,产品中FDP含量最低,而杂质Pi最高,Ca2+也高,其中含杂质Ca2+.与药用级标准FDP含量(按水合物计)>75%,Pi<2%的要求差距较大.表2所列本文提出的分步沉淀分离法中,分别观察仅单独使用一项分离步骤及综合使用两项步骤的结果有显著差别.将发酵液调节pH至沉淀产生(No.2),在大幅度减低Pi杂质的同时,提高FDP含量;单独用酸碱沉淀(No.3),FDP含量明显提高,但Pi杂质仍较高;综合使用两步骤(No.4,No.5)所获得的产品中FDP含量和Pi杂质两项指标均获得满意的结果.Ca2FDP总含量为95.41%,95.09%,Pi杂质限量均优于文献〔2〕报道.此外No.1,No.2产品在干燥器中干燥显淡黄色,50℃加热干燥变深黄色,而No.4,No.5产品颜色洁白,80℃加热干燥、留样观察一年组成稳定,亦不变色.应用精制(Ⅱ)作为中间体制备新衍生物能获得满意的结果.
, 百拇医药
参考文献
1,Markov AK.Hemodynamics and metabolic effects of fructose-1,6 - diphosphate in ischemia and shock-experimental and clinical observations.Annals of Emergency Medicine,1986,12(15):143~150
2,Leisola M,Linko M.Preparation and purification of fructose -1,6-diphosphate.Acta Chemica Scandinavica B,1974,28(5):555~558
3,王驰,徐昌喜,周远大,等.D-果糖-1,6-二磷酸钠镁的制备方法及其用途.中华人民共和国国家知识产权局,发明专利公报,1999,第15卷,第12号
, 百拇医药
4,陈心善,刘云.薄层色谱法检测果糖二磷酸和游离磷酸盐的研究.药物分析杂志,1996,16(5):303~305
5,Roe JH.The determination of fructose-1,6-diphosphate.J Biol Chem,1954,210:703~707
6,Carter HE,Sable HZ.Biochemical Preparation.Vol.2.New York:John Wiley & Sons Ine,1952.52~54
7,Diana Massimo,Bisso Guglielmo Mario.Fructose-1,6-diphosphatic acid.Ger Offen.DE 3446927,1985-07-04
收稿日期:2000-01-26, http://www.100md.com
单位:重庆医科大学生物医学工程研究室,重庆 400016
关键词:果糖-1,6-二磷酸钙;制备;精制;质量控制
中国药物化学杂志000208 摘要 首次报道了一种简易,便于工业生产的分离精制果糖二磷酸钙(Ca2FDP)的新方法.本法主要改进之处是发酵液先采用调节pH生成沉淀步骤除去大量杂质,Ca2FDP粗品又经酸碱沉淀步骤除去剩余杂质;由以上二个缓和简便的固液分离操作,能除去难分离的己糖磷酸酯、磷酸盐、多糖等杂质.由本法获得的Ca2FDP不仅在FDP含量、杂质限量等主要质量控制指标上达到药用标准,而且为制备FDP类新衍生物提供了有效手段.
A Study on the Preparation of a New Drug Calcium Fructose-1,6-diphosphate
, http://www.100md.com
Wang Chi Pan Lijun Xu Changxi
(Department of Biomedical Engineering,Chongqing University of Medical Sciences,Chongqing 400016)
Abstract A new simple method for isolation and purification of a new drug calcium fructose-1,6-diphosphate from the fermentation mixture and its quality control have been reported in this paper.The major contaminating matter,which included inorganic phosphate and hexose monophosphates could be removed by adjusting the pH of the mixture to 8.5.After the crude was recovered,further purification was effected by dissolving the crude in an acid and reprecipitated by the addition of an alkali,the unknown impurities left were removed by this procedure.The calcium fructose diphosphate in a pure form was obtained.The method is commercially useful in the manufacture of pharmaceuticals.
, 百拇医药
Key words calcium fructose-1,6-diphosphate;preparation;purification;quality control 果糖-1,6-二磷酸(fructose-1,6-diphosphate,FDP,Ⅰ)早在20世纪30年代就被确认为糖代谢的重要中间体.20世纪80年代以来,美国Markov等〔1〕经实验动物及临床研究发现FDP钠盐治疗心肌梗死、休克等组织缺血、缺氧性疾病的疗效后,由意大利Foscama制药公司开发的FDP钠盐(注射级冻干粉,商品名为Esafosfina)和果糖二磷酸钙(calcium fructose-1,6-diphosphate,Ca2FDP,Ⅱ,片剂,商品名为Esafosfina Glutammica)先后于1987年和1992年上市.Esafosfina Glutammica用于脑代谢疾病、骨化疾病、骨骼肌代谢障碍、糖尿病等各种代谢性疾病的辅助治疗.有关FDP钙盐制备研究的文献报道很少.
目前(Ⅰ)的工业生产多采用Leisola〔2〕报道的发酵法(见图1),发酵过程简便,但分离精制困难.

, http://www.100md.com
Fig.1 The continuously enzymatic phosphorylation
of glucose to FDP
(Ⅱ)本身是治疗药品,又可以作为研究制备FDP新衍生物的中间体,作者提出在钙盐沉淀法前后,采用调节发酵液pH、沉淀和酸溶碱沉出等分步沉淀的分离精制新方法.该法对(Ⅱ)和(Ⅰ)的工业生产具有简便实用价值,并为制备(Ⅰ)的新衍生物〔3〕提供纯净的中间体.(Ⅱ)的质量以红外光谱、薄层色谱、含量测定等质量研究进行控制.
1 实验部分
原料:啤酒酵母(S.cerevisiae)由重庆啤酒厂提供,所用菌体均取自生产现场.使用时用蒸馏水洗涤两次,离心分离,收集菌体.葡萄糖为重庆制药五厂产品.
分析试剂:果糖-1,6-二磷酸三钠盐(对照品)SIGMA;间苯二酚-硫脲试剂:0.1 g间苯二酚和0.25 g硫脲溶于100 mL冰醋酸,贮存于棕色瓶中备用;钼酸铵试剂:在200 mL水中慢慢加入浓H2SO4 45 mL,再加钼酸铵22 g,溶解后保存于试剂瓶中备用;对甲氨基酚硫酸试剂:溶解350 mg对甲氨基酚硫酸盐于50 mL水中,加亚硫酸氢钠20 g,混匀,加水稀释至100 mL.
, 百拇医药
仪器:SHZ-22型水浴恒温振荡器(江苏太仓县医疗器械厂);CS 501型超级恒温器(重庆试验设备厂);721型分光光度计(四川分析仪器厂);IR-440型红外光谱仪(日本岛津).
1.1 制备方法
发酵:参照Leisola等〔2〕的方法,发酵液组成中,原料改用葡萄糖代替蔗糖,NaH2PO4,MgCl2.调节pH 6.5左右,加入新鲜啤酒酵母和甲苯后,混匀,密闭,在30℃下进行恒温振摇,反应3~5 h,反应终点由快速分析发酵液中无机磷含量下降至最低点法确定.
分离、精制:发酵毕,离心,弃去酵母,用三氯醋酸沉淀除去蛋白质后,离心,取上清液加入氨水调节pH 8.5,有大量沉淀生成.待沉淀毕,离心弃去沉淀,再加入约200 mL 50%CaCl2溶液,即可得(Ⅱ)的粗制品.粗制品于100 mL蒸馏水中,缓慢滴加盐酸溶液至pH 1.0,离心,弃去不溶物.上清液中加入NaOH溶液至pH 8.5,离心,收集沉淀.重复操作一次.减压过滤,收集沉淀于真空干燥器中,干燥后得到白色粉末(Ⅱ)35 g.按发酵液(2L)中FDP浓度计算,收率约为50%.
, http://www.100md.com
1.2 主要质量指标分析测试
红外光谱:供试品用溴化钾压片,对照品同样处理.在岛津IR-440型红外仪上测定红外吸收光谱.
薄层色谱参照文献〔4〕方法进行测定.
FDP的测定:参照文献〔5〕方法,精密称取适量(约0.15 g)供试品,溶于蒸馏水中(若样品不溶可加几滴盐酸),稀释至100 mL,吸取10 mL再稀释至100 mL,吸取2 mL溶液以酚酞为指示剂加NaOH溶液至红色出现,加4滴25%醋酸钡溶液,放置15 min,离心,沉淀用5 mL 75%乙醇洗涤,离心,洗液弃去,向沉淀中加入预先混合并冷却的显色试剂(7 mL浓盐酸,2 mL间苯二酚-硫脲试剂和1 mL蒸馏水),搅拌,离心.将上清液置于80℃水浴中加热13 min,冷至室温后,用721分光光度计在570 nm波长处测定吸光度.以D-果糖二磷酸三钠盐(SIGMA)绘制标准曲线.据供试品吸光度在标准曲线上求出含量.
, http://www.100md.com
无机磷酸盐(Pi)的测定:精密称取约20 mg供试品,按照《中华人民共和国药典》1995年版二部地塞米松磷酸钠中游离磷酸项测定.
Ca2+的测定采用EDTA法.
2 结果
红外光谱测定结果:果糖-1,6-二磷酸钙具有单糖的酯类结构,分子中羟基较多,故特征峰为O—H键的伸缩振动(νO—H)和碳氧键的伸缩振动(νC—O)以及糖与磷酸基相连的C—O—P键的伸缩振动(νC—O—P),结果见表1.
由上述分析可知,样品与对照品在相同测试条件下录制的红外吸收光谱图及解析结果基本一致.证明了供试品No.5中果糖二磷酸的结构.
薄层色谱法检测结果:供试品与SIGMA公司的果糖二磷酸三钠对照品的Rf值及斑点颜色一致.
, http://www.100md.com
几种分离精制法比较:直接钙盐沉淀法〔2〕与分步沉淀分离法各步骤对(Ⅱ)的主要质量指标(FDP含量,杂质Pi限量)的影响见表2.
Tab.1 Infrared spectral analysis Reference standard
Sample(No.5)
Wave number/cm-1
Absorption peak
Wave number/cm-1
Absorption peak
3400~3200
, http://www.100md.com
νO—H
3600~3300
νO—H
1660~1630
νCO
1660~1620
νCO
1080~1030
νC—O
1080~1040
νC—O
, 百拇医药
940~920
νC—O—P
940~920
νC—O—P
Tab.2 The comparision of quality of Ca2FDP No.
Precipitation
FDP/%
Pi/%
Ca2+/%
Calcd.①
, http://www.100md.com
Found
Limit
Found
Calcd.①
Found
1
simple
80.95
42.21
<2
>5
19.05
>20
, http://www.100md.com
2
adjusted pH
80.95
48.20
<2
0.86
19.05
18.22
3
acid and alkali
80.95
69.44
<2
, 百拇医药
4.16
19.05
18.66
4
No.2+No.3
80.95
76.66
<2
0.67
19.05
18.75
5
No.2+No.3
, 百拇医药
80.95
76.60
<2
0.40
19.05
18.49
①Calculated on the anhydrous basis
3 讨论
FDP的化学性质活泼,对酸、碱、加热都很敏感.酸性介质中,FDP C1高能磷酸键易水解.在碱性介质中,FDP易发生异构化.细菌污染后则降解为三碳糖磷酸酯.
文献中(Ⅱ)的前体(Ⅰ)从发酵液中提取,分离精制的方法主要有下述几种:Sable等〔6〕报道将(Ⅰ)经FDP钡盐,再转化成士的宁盐,通过重结晶纯化FDP.其步骤冗繁且士的宁剧毒、价昂,无药用生产价值.Leisola〔2〕曾用钙盐直接沉淀法和反渗析法,并指出这一纯化过程不能去掉Pi,反渗析过程中FDP量有0%~50%的损失.意大利Foscama专利法〔7〕是在发酵液去蛋白质后,经阳离子树脂除去阳离子,阴离子树脂吸附FDP阴离子,再用NH4Cl/NH3,NaCl和HCl溶液洗脱,洗脱液中和后冻干制取(Ⅰ).此法树脂用量大,吸附、洗脱、大量稀释后浓缩过程周期长,易导致细菌性污染降解,设备昂贵,生产成本高.
, 百拇医药
表2中钙盐直接沉淀法(No.1)为参照Leisola〔2〕等方法所得实验结果,产品中FDP含量最低,而杂质Pi最高,Ca2+也高,其中含杂质Ca2+.与药用级标准FDP含量(按水合物计)>75%,Pi<2%的要求差距较大.表2所列本文提出的分步沉淀分离法中,分别观察仅单独使用一项分离步骤及综合使用两项步骤的结果有显著差别.将发酵液调节pH至沉淀产生(No.2),在大幅度减低Pi杂质的同时,提高FDP含量;单独用酸碱沉淀(No.3),FDP含量明显提高,但Pi杂质仍较高;综合使用两步骤(No.4,No.5)所获得的产品中FDP含量和Pi杂质两项指标均获得满意的结果.Ca2FDP总含量为95.41%,95.09%,Pi杂质限量均优于文献〔2〕报道.此外No.1,No.2产品在干燥器中干燥显淡黄色,50℃加热干燥变深黄色,而No.4,No.5产品颜色洁白,80℃加热干燥、留样观察一年组成稳定,亦不变色.应用精制(Ⅱ)作为中间体制备新衍生物能获得满意的结果.
, 百拇医药
参考文献
1,Markov AK.Hemodynamics and metabolic effects of fructose-1,6 - diphosphate in ischemia and shock-experimental and clinical observations.Annals of Emergency Medicine,1986,12(15):143~150
2,Leisola M,Linko M.Preparation and purification of fructose -1,6-diphosphate.Acta Chemica Scandinavica B,1974,28(5):555~558
3,王驰,徐昌喜,周远大,等.D-果糖-1,6-二磷酸钠镁的制备方法及其用途.中华人民共和国国家知识产权局,发明专利公报,1999,第15卷,第12号
, 百拇医药
4,陈心善,刘云.薄层色谱法检测果糖二磷酸和游离磷酸盐的研究.药物分析杂志,1996,16(5):303~305
5,Roe JH.The determination of fructose-1,6-diphosphate.J Biol Chem,1954,210:703~707
6,Carter HE,Sable HZ.Biochemical Preparation.Vol.2.New York:John Wiley & Sons Ine,1952.52~54
7,Diana Massimo,Bisso Guglielmo Mario.Fructose-1,6-diphosphatic acid.Ger Offen.DE 3446927,1985-07-04
收稿日期:2000-01-26, http://www.100md.com