大鼠创伤性脑损伤后神经细胞凋亡的实验研究
作者:冯海龙 高立达 黄光富 毛伯镛 谭海斌 廖晓灵 陈勇
单位:冯海龙 黄光富 谭海斌 廖晓灵 陈勇(成都,四川省人民医院神经外科 610072);高立达 毛伯镛(华西医科大学附属第一医院神经外科)
关键词:脑损伤;基因表达;凋亡细胞
中华创伤杂志000212摘 要:目的 探讨创伤性脑损伤后神经细胞凋亡机制及其时序空间分布。 方法 采用末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记法(TUNEL)、琼脂糖凝胶电泳、透射电镜、流式细胞术、凋亡调节蛋白(Bcl-2、Fas)免疫组织化学方法检测大鼠轻、重度脑损伤不同脑域神经细胞凋亡的动态变化。 结果 伤后 6 h出现凋亡神经细胞,高峰时间为伤后 2 ~ 3 d,持续时间可达 14 d。 TUNEL阳性染色细胞按电镜检测分为表现为坏死细胞特点的Ⅰ型细胞和表现为典型凋亡细胞特点的Ⅱ型细胞。TUNEL Ⅱ型细胞主要集中于海马和齿状回区域。琼脂糖凝胶电泳显示,创伤脑组织 DNA出现特异凋亡电泳带。流式细胞检测呈现典型亚二倍体核型峰(Ap峰)。重型脑伤后海马、齿状回Fas蛋白表达强度明显升高,而Bcl-2蛋白表达强度呈下降趋势。 结论 创伤性脑损伤后存在神经细胞凋亡现象。海马、齿状回区域神经细胞死亡以细胞凋亡为主。创伤性神经细胞凋亡的发生与凋亡调节基因的非平衡表达有关。
, http://www.100md.com
A study on neuro cells apoptosis after
traumatic brain injury in rats
FENG Hailong*, GAO Lida, HUANG Guangfu, et al.
(Dept. of Neurosurgery, Sichuan Provincial People's Hospital,Chengdu 610072, China)
Abstract:Objective To explore the mechanism and temporal and spatial pattern of neuro cells apoptosis after traumatic brain injury(TBI). Methods Terminal deoxynucleotidyl transferease-mediated biotinylated deoxyuridine triphosphate nick end labelling (TUNEL), gel electrophoresis, electromicroscopy, flow cytomehry and immunohistochemistry of apoptotic regulating gene (Bcl-2, Fas) were employed to detect the dynamic changes of neuro cells apoptosis in different regions of the rats' brains subjected to mild to severe traumatic injury. Results Apoptotic neuro cells were identified as early as 6 hours post injury,and reached maximum level 2 or 3 days later,and then declined after 14 days. The number of TUNEL-positive neurons were prominent in ipsilateral hippocampal and dentate gyrus. Two types of TUNEL-positive cells were demonstrated by electron microscopy, including type Ⅰ cells that displayed morphological features of necrocell and type Ⅱ cells that displayed morphological features of classic apoptotic cells. Gel electrophoresis of DNA extracted from traumatic brain tissues revealed internucleosomal fragmentation. Flow cytometry of damaged tissue showed a typical Ap wave. The strong expression of Fas protein was noted in hippocampus and dentate gyrus, where the expression of Bcl-2 protein was declined after severe TBI. Conclusions These data indicate that TBI associates with significant brain cells death. The mechanism of neuro cells apoptosis is related to the unbalanced expression of apoptotic regulating gene.
, 百拇医药
Key Words:Brain injuries; Gene expression; Apoptotic cells▲
目前,脑外伤后神经细胞凋亡与致伤程度及坏死的关系、创伤性神经细胞凋亡的时序空间分布及凋亡调节基因的表达尚未阐明。笔者拟对这些问题进行初步研究,力图为临床颅脑损伤治疗技术的提高提供新的理论依据。
材料与方法
一、大鼠创伤性脑损伤模型
1.实验分组:雄性SD大鼠75只,体重250~300 g。假手术组 5只,轻型和重型脑伤组各 35只。各分为伤后 6,12, 24, 48, 72, 168和336 h 7个组。
2.脑外伤动物模型的制作:采用 Shapira等[1]重物坠落致伤方法制作大鼠左顶颅脑损伤模型,致伤物重1 600 g,重型脑伤致伤高度 7 cm,轻型脑伤致伤高度 4 cm。假手术组不致伤。
, 百拇医药
3.标本取材:相应各时点处死动物,常规固定后取脑组织(包括左侧伤灶中心皮质,伤灶周边白质、海马、齿状回及对侧相应脑组织) 行凋亡染色和免疫组化检测。对以伤灶为中心 60°脑域内神经细胞进行计数[2]。新鲜脑组织在相应处理后行电泳、电镜、流式细胞术检测。
二、末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记法(TUNEL)染色
参照Gavrieli等[3]方法,按德国BM公司(In Situ Cell Death Detection Kit, AP)说明书操作,Fast Red (Sigma,美国)镜下监视成色。
三、透射电镜观察
常规处理后,JEM-100XS透射电子显微镜下观察、摄片。
, 百拇医药 四、琼脂糖凝胶电泳
采用BM公司凋亡电泳检测试剂盒(Apoptotic DNA Ladder Kit)进行。
五、流式细胞仪检测
采用PI单染色法[4]进行。取伤后72 h脑组织碎化,组织酶消化,RNAase水浴30 min,碘化丙啶4℃避光染色30 min,激发波长为488 nm处红色荧光,记录结果。
六、 Bcl-2及Fas免疫组织化学检测
鼠抗人 Bcl-2单抗 (100)和兔抗鼠Fas (c-20)多抗;采用Streptavidin Peroxidase Conjugate Method免疫组织化学方法,结果在图像分析系统中进行统计。
七、统计分析
, 百拇医药
采用单因素方差分析, SNK方法两两比较。
结 果
TUNEL染色及其他凋亡相关检测结果:本实验结果显示,脑外伤后存在两种类型 TUNEL阳性染色神经细胞。Ⅰ型TUNEL细胞表现为胞浆红染,核着色淡,结构疏松,细胞肿胀明显,胞质无浓缩现象,胞核无固缩。超微结构显示细胞不完整,胞膜破裂,线粒体肿胀破坏,胞核溶解,符合坏死细胞特点。Ⅱ型 TUNEL细胞表现为圆形、皱缩的形态特点,核固缩,细胞着色深,胞核红染明显。超微结构显示核固缩,染色质边聚,线粒体完整,符合凋亡神经细胞特点。 TUNELⅡ型神经细胞呈散在分布,相对集中于伤灶周边白质、海马和齿状回等区域(P<0.05) ,重伤组四叠体、脑干、丘脑、胼胝体、额叶、溴沟等区域也散在可见。脑外伤后 6 h即出现 TUNELⅡ型阳性染色细胞,高峰出现于伤后48 ~72 h ,持续达伤后 2周。 TUNELⅠ型神经细胞则主要集中在致伤灶中心部位,片状分布。峰值时间为伤后12 ~24 h ,轻伤组与重伤组有非常显著性差异(P<0.01) (表1)。伤灶对侧脑组织 TUNEL阳性染色细胞明显较少。
, 百拇医药
表1 脑外伤后72 h不同部位TUNEL细胞数量比较(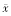 ±s,%) 组别
±s,%) 组别
皮质
白质
海马
齿状回
轻型脑伤组
TUNELⅠ型
98±10.5**
12±4.3*
4±1.1*
, http://www.100md.com
5±1.3*
TUNELⅡ型
31±6**
20±5.6*
10±2.7*
7±0.4*
重型脑伤组
TUNELⅠ型
158±12.4**
15± 5.1*
, http://www.100md.com
2±0.2*
4±0.7*
TUNELⅡ型
18±5.5**
25±3.2*
12±1.1*
9±0.6*
组间及组内比较:*P<0.05 **P<0.01 笔者采用流式细胞检测技术和琼脂糖凝胶电泳对伤后 72 h脑组织进行检测,发现流式细胞检测呈现亚二倍体核型峰 ( Ap峰),重伤组凋亡细胞数明显高于轻伤组,两者存在统计学差异 (表 2 ),假手术组及伤灶对侧脑组织无此峰型。琼脂糖凝胶电泳结果显示,创伤脑组织出现凋亡特异的梯状 (ladder)电泳带,大小约185 bp。
, 百拇医药
表2 不同程度脑外伤后72 h流式细胞检测结果 组别
凋亡细胞百分率(%)
对照组(A)
0.2
轻型脑伤组(B)
4.7
重型脑伤组(C)
11.6
轻伤组伤灶对侧组织(D)
0.5
重伤组伤灶对侧组织(E)
0.7
, http://www.100md.com
B组与C组比较:P<0.01;C组与D组、E组比较:P<0.01;B组与A组、D组、E组比较:P<0.01;A组与D组、E组两两比较:P>0.05
Bcl-2免疫组化染色结果显示:轻型脑伤后24 h,皮质和海马 Bcl-2合成增加,表达强度上升;重伤组 Bcl-2合成较正常减弱,峰值时间为伤后12~24 h。重伤组皮质和海马 Bcl-2表达强度与轻伤组比较存在显著性差异(P<0.05),说明凋亡抑制蛋白表达主要出现于伤后早期脑组织中,重型脑伤后凋亡抑制功能减弱。
Fas免疫组化染色结果显示:轻伤后 48~72 h, Fas在皮层及海马等区域合成增加;重伤后Fas在皮质及海马的合成强度明显增加,其中海马增强尤为明显, 48~72 h达到高峰,与轻伤组有显著性差异(P<0.05)。说明脑伤后晚期凋亡促进蛋白表达增强,导致神经细胞凋亡。
讨 论
, 百拇医药
笔者采用多种凋亡检测方法证实,脑伤后神经细胞存在细胞凋亡现象。实验中发现脑伤后 6 h即有 TUNEL阳性染色的神经细胞出现,持续时间长达 2周。流式细胞检测发现凋亡特征性亚二倍体核型峰;凝胶电泳出现阶梯型电泳带谱。Rink等[2]在脑伤后大鼠的皮质、白质、海马CA3及齿状回等区域均发现凋亡神经细胞。 Colicos等[5]采用TUNEL染色及电镜技术证实,大鼠脑伤后齿状回萎缩颗粒细胞即属凋亡的神经细胞。Pravdenkova等[6]发现大鼠脑外伤后 10 h,脑组织内钙镁离子依赖性核酶内切酶(CME) 活性达到高峰,持续时间长达10 d。 Thomas在脑穿通性损伤病人脑组织中发现,伤灶周边神经组织内存在 TUNEL阳性染色的神经细胞[7]。上述证据说明细胞凋亡参与脑外伤后神经细胞病理改变过程。
笔者发现,脑外伤后坏死及凋亡神经细胞均出现 TUNEL阳性染色。原因可能是神经细胞坏死过程中染色质裂解,小分子 DNA游离进入细胞浆而被 TUNEL染成红色,但两者超微结构明显不同[8]。同时笔者发现,神经细胞凋亡与坏死的时序空间分布有明显不同,这种差异与细胞毒性物质作用强度、创伤能量分布及脑组织敏感性差异有关[8]。研究证明,低浓度兴奋性氨基酸(EAA)长时间作用导致神经细胞凋亡;高浓度EAA则引起细胞坏死。脑外伤暴力直接作用的皮质神经细胞膜功能严重受损,膜电位逆转,跨膜离子转运功能丧失,线粒体呼吸功能被破坏,导致细胞内钙离子集聚,EAA大量生成,细胞肿胀坏死;外力打击相对较轻的伤灶周边部位,细胞处于相对静止状态,离子传递受到抑制,能量合成减少,细胞内钙离子缓慢升高,使内源性凋亡促进基因激活,活化CME,进而发生细胞凋亡[8]。
, 百拇医药
笔者发现,海马、齿状回为创伤性凋亡的易损区(most vulnerable area)。目前研究提示,脑伤后海马细胞迟发性凋亡可能与即刻早基因、热休克蛋白(HSPs)、P53活化表达有关[9]。近年研究表明,c-fos反义寡核苷酸能够明显减少海马CA1迟发性神经细胞死亡;HSP 70/72与 c-fos蛋白及微管相关蛋白存在协同表达现象。提示HSPs可能与海马神经细胞迟发性死亡有关;放线菌酮(cycloheximide)限制P53活性表达的同时,能抑制海马迟发性神经细胞凋亡。
笔者发现,脑外伤后凋亡调节基因存在表达不平衡的现象。重型脑外伤后凋亡抑制基因Bcl-2表达下降,其对神经细胞保护作用减弱,细胞凋亡阈值下降;脑伤后 48 h凋亡促进基因Fas表达增强,导致了神经细胞凋亡的发生。Kotapka等[10]的研究提示,Bcl-2在脑外伤后调节神经细胞死亡中可能起重要作用。Yakovlev等[12]发现,采用凋亡促进基因CPP32 特异性阻制剂能显著降低创伤性神经细胞凋亡。上述研究结果表明,脑外伤后凋亡调节基因表达的非平衡状态导致了创伤性神经细胞凋亡。但目前其机制尚未阐明。
, 百拇医药
细胞凋亡在脑外伤后神经细胞病理生理过程中具有重要作用。目前对于创伤性神经细胞凋亡与坏死在时序空间分布上的差异,海马、齿状回易损性机制,凋亡调节基因非平衡表达的机制等诸多方面尚不清楚,有待进一步研究。随着有关创伤性神经细胞凋亡研究的深入,无疑对颅脑损伤的临床治疗具有重要的理论指导意义。
参考文献:
[1]Shapira Y, Shohami E, SiDi A, et al. Experimental closed head injury in rats: mechanical, pathophysiological, and neurologic properties. Crit Care Med, 1988, 16: 258-265.
[2]Rink A , Fung KM, Trojanowski JQ, et al. Evidence of apoptotic cell death after experimental traumatic brain injury in the rat. Am J Pathol, 1995, 147: 1575-1583.
, 百拇医药
[3]Gavrieli Y, Sherman Y, Ben-Sasson S, et al. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol, 1992, 119: 493-501.
[4]姜泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京: 人民军医出版社, 1997. 177-179.
[5]Colicos MA, Dash PK. Apoptotic morphology of dentate gyrus granule cells following experimental cortical impact injury in rats: possible role in spatial memory deficits. Brain Res, 1996, 739: 120-131.
, 百拇医药
[6]Pravdenkova SV, Basnakian AG, James SJ, et al. DNA fragmentation and nuclear endonuclease activity in rat brain after severe closed head injury. Brain Res. 1996, 729: 151-155.
[7]Rosomoff HL, Kochanek PM, Clark R, et al. Resuscitation from severe brain trauma. Crit Care Med, 1996, 24 Suppl 2: 48-56.
[8]Marlangue CC, Zouaoui DA, Represa A, et al. Apoptotic features of selective neuronal death in ischemia, epilepsy and gp120 toxicity. TINS, 1996, 19: 109-114.
, 百拇医药
[9]Schreiber SS, Baudry M. Selective neuronal vulnerability in the hippocampus: a role for gene expression. TINS, 1995, 18: 446-451.
[10]Kotapka MJ, Gennarelli TA, Graham DI, et al. Selective vulnerability of hippocampal neurons in acceleration-induced experimental head injury. J Neurotrauma, 1991, 8: 247-258.
[11]Clark RS, Cheng J, Watkins SC, et al. Apoptosis-suppressor gene bcl-2 expression after traumatic brain injury in rats. J Neurosci, 1997, 17: 9172-9182.
[12]Yakovlev AG, Knoblach SM, Fan L, et al. Activation of CPP32-like caspases contributes to neuronal apoptosis and neurological dysfunction after traumatic brain injury. J Neurosci, 1997, 17: 7451-7424.
收稿日期:1999-03-06, 百拇医药
单位:冯海龙 黄光富 谭海斌 廖晓灵 陈勇(成都,四川省人民医院神经外科 610072);高立达 毛伯镛(华西医科大学附属第一医院神经外科)
关键词:脑损伤;基因表达;凋亡细胞
中华创伤杂志000212摘 要:目的 探讨创伤性脑损伤后神经细胞凋亡机制及其时序空间分布。 方法 采用末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记法(TUNEL)、琼脂糖凝胶电泳、透射电镜、流式细胞术、凋亡调节蛋白(Bcl-2、Fas)免疫组织化学方法检测大鼠轻、重度脑损伤不同脑域神经细胞凋亡的动态变化。 结果 伤后 6 h出现凋亡神经细胞,高峰时间为伤后 2 ~ 3 d,持续时间可达 14 d。 TUNEL阳性染色细胞按电镜检测分为表现为坏死细胞特点的Ⅰ型细胞和表现为典型凋亡细胞特点的Ⅱ型细胞。TUNEL Ⅱ型细胞主要集中于海马和齿状回区域。琼脂糖凝胶电泳显示,创伤脑组织 DNA出现特异凋亡电泳带。流式细胞检测呈现典型亚二倍体核型峰(Ap峰)。重型脑伤后海马、齿状回Fas蛋白表达强度明显升高,而Bcl-2蛋白表达强度呈下降趋势。 结论 创伤性脑损伤后存在神经细胞凋亡现象。海马、齿状回区域神经细胞死亡以细胞凋亡为主。创伤性神经细胞凋亡的发生与凋亡调节基因的非平衡表达有关。
, http://www.100md.com
A study on neuro cells apoptosis after
traumatic brain injury in rats
FENG Hailong*, GAO Lida, HUANG Guangfu, et al.
(Dept. of Neurosurgery, Sichuan Provincial People's Hospital,Chengdu 610072, China)
Abstract:Objective To explore the mechanism and temporal and spatial pattern of neuro cells apoptosis after traumatic brain injury(TBI). Methods Terminal deoxynucleotidyl transferease-mediated biotinylated deoxyuridine triphosphate nick end labelling (TUNEL), gel electrophoresis, electromicroscopy, flow cytomehry and immunohistochemistry of apoptotic regulating gene (Bcl-2, Fas) were employed to detect the dynamic changes of neuro cells apoptosis in different regions of the rats' brains subjected to mild to severe traumatic injury. Results Apoptotic neuro cells were identified as early as 6 hours post injury,and reached maximum level 2 or 3 days later,and then declined after 14 days. The number of TUNEL-positive neurons were prominent in ipsilateral hippocampal and dentate gyrus. Two types of TUNEL-positive cells were demonstrated by electron microscopy, including type Ⅰ cells that displayed morphological features of necrocell and type Ⅱ cells that displayed morphological features of classic apoptotic cells. Gel electrophoresis of DNA extracted from traumatic brain tissues revealed internucleosomal fragmentation. Flow cytometry of damaged tissue showed a typical Ap wave. The strong expression of Fas protein was noted in hippocampus and dentate gyrus, where the expression of Bcl-2 protein was declined after severe TBI. Conclusions These data indicate that TBI associates with significant brain cells death. The mechanism of neuro cells apoptosis is related to the unbalanced expression of apoptotic regulating gene.
, 百拇医药
Key Words:Brain injuries; Gene expression; Apoptotic cells▲
目前,脑外伤后神经细胞凋亡与致伤程度及坏死的关系、创伤性神经细胞凋亡的时序空间分布及凋亡调节基因的表达尚未阐明。笔者拟对这些问题进行初步研究,力图为临床颅脑损伤治疗技术的提高提供新的理论依据。
材料与方法
一、大鼠创伤性脑损伤模型
1.实验分组:雄性SD大鼠75只,体重250~300 g。假手术组 5只,轻型和重型脑伤组各 35只。各分为伤后 6,12, 24, 48, 72, 168和336 h 7个组。
2.脑外伤动物模型的制作:采用 Shapira等[1]重物坠落致伤方法制作大鼠左顶颅脑损伤模型,致伤物重1 600 g,重型脑伤致伤高度 7 cm,轻型脑伤致伤高度 4 cm。假手术组不致伤。
, 百拇医药
3.标本取材:相应各时点处死动物,常规固定后取脑组织(包括左侧伤灶中心皮质,伤灶周边白质、海马、齿状回及对侧相应脑组织) 行凋亡染色和免疫组化检测。对以伤灶为中心 60°脑域内神经细胞进行计数[2]。新鲜脑组织在相应处理后行电泳、电镜、流式细胞术检测。
二、末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记法(TUNEL)染色
参照Gavrieli等[3]方法,按德国BM公司(In Situ Cell Death Detection Kit, AP)说明书操作,Fast Red (Sigma,美国)镜下监视成色。
三、透射电镜观察
常规处理后,JEM-100XS透射电子显微镜下观察、摄片。
, 百拇医药 四、琼脂糖凝胶电泳
采用BM公司凋亡电泳检测试剂盒(Apoptotic DNA Ladder Kit)进行。
五、流式细胞仪检测
采用PI单染色法[4]进行。取伤后72 h脑组织碎化,组织酶消化,RNAase水浴30 min,碘化丙啶4℃避光染色30 min,激发波长为488 nm处红色荧光,记录结果。
六、 Bcl-2及Fas免疫组织化学检测
鼠抗人 Bcl-2单抗 (100)和兔抗鼠Fas (c-20)多抗;采用Streptavidin Peroxidase Conjugate Method免疫组织化学方法,结果在图像分析系统中进行统计。
七、统计分析
, 百拇医药
采用单因素方差分析, SNK方法两两比较。
结 果
TUNEL染色及其他凋亡相关检测结果:本实验结果显示,脑外伤后存在两种类型 TUNEL阳性染色神经细胞。Ⅰ型TUNEL细胞表现为胞浆红染,核着色淡,结构疏松,细胞肿胀明显,胞质无浓缩现象,胞核无固缩。超微结构显示细胞不完整,胞膜破裂,线粒体肿胀破坏,胞核溶解,符合坏死细胞特点。Ⅱ型 TUNEL细胞表现为圆形、皱缩的形态特点,核固缩,细胞着色深,胞核红染明显。超微结构显示核固缩,染色质边聚,线粒体完整,符合凋亡神经细胞特点。 TUNELⅡ型神经细胞呈散在分布,相对集中于伤灶周边白质、海马和齿状回等区域(P<0.05) ,重伤组四叠体、脑干、丘脑、胼胝体、额叶、溴沟等区域也散在可见。脑外伤后 6 h即出现 TUNELⅡ型阳性染色细胞,高峰出现于伤后48 ~72 h ,持续达伤后 2周。 TUNELⅠ型神经细胞则主要集中在致伤灶中心部位,片状分布。峰值时间为伤后12 ~24 h ,轻伤组与重伤组有非常显著性差异(P<0.01) (表1)。伤灶对侧脑组织 TUNEL阳性染色细胞明显较少。
, 百拇医药
表1 脑外伤后72 h不同部位TUNEL细胞数量比较(
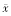 ±s,%) 组别
±s,%) 组别皮质
白质
海马
齿状回
轻型脑伤组
TUNELⅠ型
98±10.5**
12±4.3*
4±1.1*
, http://www.100md.com
5±1.3*
TUNELⅡ型
31±6**
20±5.6*
10±2.7*
7±0.4*
重型脑伤组
TUNELⅠ型
158±12.4**
15± 5.1*
, http://www.100md.com
2±0.2*
4±0.7*
TUNELⅡ型
18±5.5**
25±3.2*
12±1.1*
9±0.6*
组间及组内比较:*P<0.05 **P<0.01 笔者采用流式细胞检测技术和琼脂糖凝胶电泳对伤后 72 h脑组织进行检测,发现流式细胞检测呈现亚二倍体核型峰 ( Ap峰),重伤组凋亡细胞数明显高于轻伤组,两者存在统计学差异 (表 2 ),假手术组及伤灶对侧脑组织无此峰型。琼脂糖凝胶电泳结果显示,创伤脑组织出现凋亡特异的梯状 (ladder)电泳带,大小约185 bp。
, 百拇医药
表2 不同程度脑外伤后72 h流式细胞检测结果 组别
凋亡细胞百分率(%)
对照组(A)
0.2
轻型脑伤组(B)
4.7
重型脑伤组(C)
11.6
轻伤组伤灶对侧组织(D)
0.5
重伤组伤灶对侧组织(E)
0.7
, http://www.100md.com
B组与C组比较:P<0.01;C组与D组、E组比较:P<0.01;B组与A组、D组、E组比较:P<0.01;A组与D组、E组两两比较:P>0.05
Bcl-2免疫组化染色结果显示:轻型脑伤后24 h,皮质和海马 Bcl-2合成增加,表达强度上升;重伤组 Bcl-2合成较正常减弱,峰值时间为伤后12~24 h。重伤组皮质和海马 Bcl-2表达强度与轻伤组比较存在显著性差异(P<0.05),说明凋亡抑制蛋白表达主要出现于伤后早期脑组织中,重型脑伤后凋亡抑制功能减弱。
Fas免疫组化染色结果显示:轻伤后 48~72 h, Fas在皮层及海马等区域合成增加;重伤后Fas在皮质及海马的合成强度明显增加,其中海马增强尤为明显, 48~72 h达到高峰,与轻伤组有显著性差异(P<0.05)。说明脑伤后晚期凋亡促进蛋白表达增强,导致神经细胞凋亡。
讨 论
, 百拇医药
笔者采用多种凋亡检测方法证实,脑伤后神经细胞存在细胞凋亡现象。实验中发现脑伤后 6 h即有 TUNEL阳性染色的神经细胞出现,持续时间长达 2周。流式细胞检测发现凋亡特征性亚二倍体核型峰;凝胶电泳出现阶梯型电泳带谱。Rink等[2]在脑伤后大鼠的皮质、白质、海马CA3及齿状回等区域均发现凋亡神经细胞。 Colicos等[5]采用TUNEL染色及电镜技术证实,大鼠脑伤后齿状回萎缩颗粒细胞即属凋亡的神经细胞。Pravdenkova等[6]发现大鼠脑外伤后 10 h,脑组织内钙镁离子依赖性核酶内切酶(CME) 活性达到高峰,持续时间长达10 d。 Thomas在脑穿通性损伤病人脑组织中发现,伤灶周边神经组织内存在 TUNEL阳性染色的神经细胞[7]。上述证据说明细胞凋亡参与脑外伤后神经细胞病理改变过程。
笔者发现,脑外伤后坏死及凋亡神经细胞均出现 TUNEL阳性染色。原因可能是神经细胞坏死过程中染色质裂解,小分子 DNA游离进入细胞浆而被 TUNEL染成红色,但两者超微结构明显不同[8]。同时笔者发现,神经细胞凋亡与坏死的时序空间分布有明显不同,这种差异与细胞毒性物质作用强度、创伤能量分布及脑组织敏感性差异有关[8]。研究证明,低浓度兴奋性氨基酸(EAA)长时间作用导致神经细胞凋亡;高浓度EAA则引起细胞坏死。脑外伤暴力直接作用的皮质神经细胞膜功能严重受损,膜电位逆转,跨膜离子转运功能丧失,线粒体呼吸功能被破坏,导致细胞内钙离子集聚,EAA大量生成,细胞肿胀坏死;外力打击相对较轻的伤灶周边部位,细胞处于相对静止状态,离子传递受到抑制,能量合成减少,细胞内钙离子缓慢升高,使内源性凋亡促进基因激活,活化CME,进而发生细胞凋亡[8]。
, 百拇医药
笔者发现,海马、齿状回为创伤性凋亡的易损区(most vulnerable area)。目前研究提示,脑伤后海马细胞迟发性凋亡可能与即刻早基因、热休克蛋白(HSPs)、P53活化表达有关[9]。近年研究表明,c-fos反义寡核苷酸能够明显减少海马CA1迟发性神经细胞死亡;HSP 70/72与 c-fos蛋白及微管相关蛋白存在协同表达现象。提示HSPs可能与海马神经细胞迟发性死亡有关;放线菌酮(cycloheximide)限制P53活性表达的同时,能抑制海马迟发性神经细胞凋亡。
笔者发现,脑外伤后凋亡调节基因存在表达不平衡的现象。重型脑外伤后凋亡抑制基因Bcl-2表达下降,其对神经细胞保护作用减弱,细胞凋亡阈值下降;脑伤后 48 h凋亡促进基因Fas表达增强,导致了神经细胞凋亡的发生。Kotapka等[10]的研究提示,Bcl-2在脑外伤后调节神经细胞死亡中可能起重要作用。Yakovlev等[12]发现,采用凋亡促进基因CPP32 特异性阻制剂能显著降低创伤性神经细胞凋亡。上述研究结果表明,脑外伤后凋亡调节基因表达的非平衡状态导致了创伤性神经细胞凋亡。但目前其机制尚未阐明。
, 百拇医药
细胞凋亡在脑外伤后神经细胞病理生理过程中具有重要作用。目前对于创伤性神经细胞凋亡与坏死在时序空间分布上的差异,海马、齿状回易损性机制,凋亡调节基因非平衡表达的机制等诸多方面尚不清楚,有待进一步研究。随着有关创伤性神经细胞凋亡研究的深入,无疑对颅脑损伤的临床治疗具有重要的理论指导意义。
参考文献:
[1]Shapira Y, Shohami E, SiDi A, et al. Experimental closed head injury in rats: mechanical, pathophysiological, and neurologic properties. Crit Care Med, 1988, 16: 258-265.
[2]Rink A , Fung KM, Trojanowski JQ, et al. Evidence of apoptotic cell death after experimental traumatic brain injury in the rat. Am J Pathol, 1995, 147: 1575-1583.
, 百拇医药
[3]Gavrieli Y, Sherman Y, Ben-Sasson S, et al. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol, 1992, 119: 493-501.
[4]姜泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京: 人民军医出版社, 1997. 177-179.
[5]Colicos MA, Dash PK. Apoptotic morphology of dentate gyrus granule cells following experimental cortical impact injury in rats: possible role in spatial memory deficits. Brain Res, 1996, 739: 120-131.
, 百拇医药
[6]Pravdenkova SV, Basnakian AG, James SJ, et al. DNA fragmentation and nuclear endonuclease activity in rat brain after severe closed head injury. Brain Res. 1996, 729: 151-155.
[7]Rosomoff HL, Kochanek PM, Clark R, et al. Resuscitation from severe brain trauma. Crit Care Med, 1996, 24 Suppl 2: 48-56.
[8]Marlangue CC, Zouaoui DA, Represa A, et al. Apoptotic features of selective neuronal death in ischemia, epilepsy and gp120 toxicity. TINS, 1996, 19: 109-114.
, 百拇医药
[9]Schreiber SS, Baudry M. Selective neuronal vulnerability in the hippocampus: a role for gene expression. TINS, 1995, 18: 446-451.
[10]Kotapka MJ, Gennarelli TA, Graham DI, et al. Selective vulnerability of hippocampal neurons in acceleration-induced experimental head injury. J Neurotrauma, 1991, 8: 247-258.
[11]Clark RS, Cheng J, Watkins SC, et al. Apoptosis-suppressor gene bcl-2 expression after traumatic brain injury in rats. J Neurosci, 1997, 17: 9172-9182.
[12]Yakovlev AG, Knoblach SM, Fan L, et al. Activation of CPP32-like caspases contributes to neuronal apoptosis and neurological dysfunction after traumatic brain injury. J Neurosci, 1997, 17: 7451-7424.
收稿日期:1999-03-06, 百拇医药