细胞色素P-4501A1在人胎肾上腺细胞中的表达
作者:汪晖 彭仁琇 于皆平 孙来宝
单位:汪晖(湖北医科大学药理教研室,湖北 武汉 430071);彭仁琇(湖北医科大学药理教研室,湖北 武汉 430071);于皆平(湖北医科大学附属第一医院消化内科,湖北 武汉 430060);孙来宝(湖北医科大学附属第一医院消化内科,湖北 武汉 430060)
关键词:CYP1A1;胎儿;肾上腺;肝
癌症000204
【摘 要】目的:研究与前致癌物和致突变物代谢活化密切相关的细胞色素P-450(cytochrome P-450,CYP)1A1在人胎肾上腺细胞中的表达。方法:用酶学和RTPCR技术检测胎肾上腺和肝细胞中CYP1A1酶活性和mRNA表达,并进行比较。结果:人胎肾上腺和胎肝微粒体中不能检测到CYP1A1标志酶7-乙氧异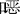 唑O-脱乙基酶(EROD)活性,同时在CYP1A1诱导剂3-甲基胆蒽(0.5~2.0μmol.L-1,24h)诱导的人胎肾上腺细胞中也不能检测到EROD活性。而动物在体实验表明,3-甲基胆蒽(25mg/kgip,qd×3)致成年大鼠肝脏EROD活性增强的同时,大鼠肾上腺EROD活性也提高。大鼠肾上腺EROD活性明显低于肝脏。RT-PCR结果进一步表明,胎肾上腺和胎肝中存在CYP1A1mRNA表达。结论:和胎肝一样,胎肾上腺中存在低表达量的CYP1A1,提示发育期间的胎肾上腺具有潜在的致癌可能性。
唑O-脱乙基酶(EROD)活性,同时在CYP1A1诱导剂3-甲基胆蒽(0.5~2.0μmol.L-1,24h)诱导的人胎肾上腺细胞中也不能检测到EROD活性。而动物在体实验表明,3-甲基胆蒽(25mg/kgip,qd×3)致成年大鼠肝脏EROD活性增强的同时,大鼠肾上腺EROD活性也提高。大鼠肾上腺EROD活性明显低于肝脏。RT-PCR结果进一步表明,胎肾上腺和胎肝中存在CYP1A1mRNA表达。结论:和胎肝一样,胎肾上腺中存在低表达量的CYP1A1,提示发育期间的胎肾上腺具有潜在的致癌可能性。
, 百拇医药
中图分类号:R730.231 文献标识码:A
文章编号:1000-467X(2000)02-0112-04
Expression of adrenal cytochrome P-450 1A1 in human fetuses
WANG Hui PENG Ren-xiu
(Department of Pharmacology, Hubei Medical University, Wuhan 430071, P.R.China)
YU Jie-pin
(Department of Gastroenterology, First Affiliated Hospital,Hubei Medical University,Wuhan 430060, P.R.China)
, 百拇医药
【Abstract】 Objective: To study the expression and inducibility in vitro of adrenal cytochrome P-450 (CYP) 1A1 implicated in precarcinogen and premutagen activation in human fetuses.Methods:CYP1A1 mRNA and 7-ethoxyresorufin O-deethylase (EROD) activity of fetal adrenals were detected by using the reverse transcriptase-polymerase chain reaction (RT-PCR) and enzyme method respectively, which were compared with those of fetal liver. Results: The activity of CYP1A1 enzyme marker, EROD, was undetected in either adrenal tissue or 3-methylcholanthrene (3MC)-treated adrenal cultured cells in vitro. However, in vivo study with adult rat showed that 3MC (25 mg/kg ip, qd× 3) could enhance EROD activities of the adrenal gland and liver. Using RT-PCR method, the expression of CYP1A1 mRNA was detected in both fetal adrenal and fetal liver, and the percentage of CYP1A1 mRNA expression in these organs was 78% and 73 % , respectively. Conclusion: Human fetal adrenal as well as fetal liver had lower and undetectable CYP1A1 enzyme suggesting it possesses the potential risk of carcinogenesis during fetal development.
, http://www.100md.com
Key words:CYP1A1; Human fetuses; Adrenal gland; Liver
已知细胞色素P-4501A1(cytochrome P-4501A1,CYP1A1)参与了机体对多种前致癌物和致突变物的活化代谢过程。有研究表明,CYP1A水平是反映化学致癌作用的有效指征[1]。因此研究CYP1A在人胎肝和肝外组织的表达具有毒理学上的意义。我们在证实人胎肝CYP具有药物代谢功能[2,3]的基础上,曾进一步发现参与甾体激素合成的胎肾上腺[4]也具有较强的药物代谢功能[5~7]。但人胎肾上腺细胞中CYP1A1的表达如何,至今尚未见报道。本文采用细胞培养、酶学和分子生物学技术,在细胞、亚细胞和基因水平系统地观察了人胎肾上腺细胞中CYP1A1的表达。
1 材料及方法
1.1 主要试剂
, http://www.100md.com
3-甲基胆蒽(3-methylcholanthrene)、异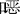 唑(resorufin)、7-乙氧异
唑(resorufin)、7-乙氧异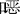 唑(7-ethoxyresorufin)、异柠檬酸(isocitric acid)、异柠檬酸脱氢酶(isocitric acid dehydrogenase)和胶原酶I(collagnaseI)均为美国Sigma公司产品。牛血清白蛋白(BSA)和氧化型辅酶Ⅱ等为国产分析纯。
唑(7-ethoxyresorufin)、异柠檬酸(isocitric acid)、异柠檬酸脱氢酶(isocitric acid dehydrogenase)和胶原酶I(collagnaseI)均为美国Sigma公司产品。牛血清白蛋白(BSA)和氧化型辅酶Ⅱ等为国产分析纯。
1.2 标本来源
成人肝和肾上腺分别来自肝癌和嗜铬细胞瘤手术切除标本。胎肝和肾上腺来源于临床经水囊引产标本。液氮中保存备用。
1.3 微粒体制备
差速离心法制备亚细胞组分。组织经剪碎、漂洗、吸干后称重。用Tris.HCl50mmol/L(pH7.4)制备组织匀浆,9000×g离心20min。上清液经105000×g离心60min得微粒体沉淀。以1g肾上腺(或2g肝)∶1ml0.25mol/L蔗糖的比例制备微粒体混悬液,-30℃保存备用。
, http://www.100md.com
1.4 胎肾上腺皮质细胞分离、培养及处理
与成人肾上腺皮质部不同,胎肾上腺皮质部90%~95%是由胎儿带(fetal zone)细胞组成,其细胞分离和培养的方法参照文献[4,8]。将肾上腺皮质剪碎与5倍量的0.4mg/ml胶原酶I消化液37℃作用15min。用McCoy's5A培养基(Gibco)对倍稀释。800×g离心10min,沉淀用McCoy's5A培养基漂洗。以5×106/mL的细胞密度接种于培养瓶中,5%CO2、饱和湿度、37℃培养36~48h,使细胞贴壁。更新培养基,用3-甲基胆蒽0.5~2μmol/L处理细胞24h。收集并超声破碎细胞3次,每次5s。样本用于CYP1A1活性分析。
1.5 动物及处理
成年雄性Sprague-Dawley大鼠155±40g,由湖北医科大学动物实验中心提供。大鼠随机均分为对照组和3-甲基胆蒽诱导组。经腹腔注射(ip)3-甲基胆蒽25mg/kg,qd×3,等容量生理盐水作对照。末次给药后16h,乙醚麻醉、剖腹摘取大鼠肝脏和肾上腺,制备组织匀浆。
, 百拇医药
1.6 酶学分析
7-乙氧异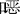 唑O-脱乙基酶(7-ethoxyresorufin O-deethylase,EROD)活性采用荧光法[9]测定。以异
唑O-脱乙基酶(7-ethoxyresorufin O-deethylase,EROD)活性采用荧光法[9]测定。以异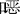 唑为标准品,在岛津RF-540荧光分光光度计上测定上清液荧光强度。激发波长530nm,发射波长586nm。
唑为标准品,在岛津RF-540荧光分光光度计上测定上清液荧光强度。激发波长530nm,发射波长586nm。
1.7 总RNA提取
取100mg液氮冰冻组织,按异硫氰酸胍-酚-氯仿一步抽提法[10]提取组织总RNA。测定A260、A280和进行琼脂糖凝胶电泳,计算所提RNA的含量和纯度。每一样品RNA的28S、18S和5S带完整(图1)。-70℃保存备用。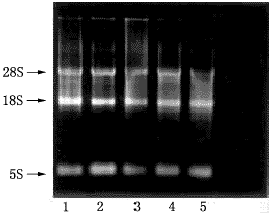
, 百拇医药
图1 总RNA的琼脂糖凝胶电泳(异硫氰酸胍-酚-氯仿
一步法提取).1~2.胎肾上腺;3~5.胎肝.
1.8 逆转录聚合酶链式反应(reverse transcriptase-polymerase chain reaction,RT-PCR)
CYP1A1引物设计按文献报道[11]。正义引物为:TCACAGACAGCCTGATTGAG(928~947),反义引物为:GATGGGTTGACCCATAGCTT(1341~1360),由上海生工生物工程公司合成。
cDNA合成和PCR扩增在一步内完成,由Boehringer Mannheim公司提供TitanTM One Tube RT-PCR System试剂盒。反应体系中含1×RT-PCR缓冲液(pH7.5),总RNA2μg,引物400μmol/L,dNTP500μmol/L,DTT5mmol/L,RNA酶抑制剂10u,MgCl2 3.0mmol/L,AMV逆转录酶4.5u(Promega)和TaqDNA聚合酶1.25u。反应总体积25μL。反应前将引物和总RNA经65℃变性10min。50℃逆转录30min。予变性94℃2min5s后,94℃45s,55℃45s,68℃1min,循环10次。接着94℃45s,55℃45s,68℃1min(每轮递增5s),循环35次。在Hema480cDNA扩增仪(珠海黑马医学仪器有限公司)上进行。平行的阴性对照管不含RNA模板。RTPCR扩增产物用1.5%琼脂糖凝胶电泳分析,分子量为432bp。所参照的PCR标准品(Promega)分子量分别为237、377、515、695、994和1543bp。
, http://www.100md.com
2 结果
2.1 大鼠肾上腺和肝CYP1A1酶学表达和诱导
已知EROD是CYP1A1的标志酶,3-甲基胆蒽则是EROD的选择性诱导剂[12]。本研究中,成年大鼠肝经3-甲基胆蒽诱导后,其EROD活性明显增强,达对照组的14倍(P<0.01)。对照组肾上腺中未检测到EROD活性,在经3-甲基胆蒽诱导后的肾上腺中可检测之。提示成年大鼠肾上腺中存在CYP1A1活性,其低于大鼠肝CYP1A1活性(P<0.01),且可为3-甲基胆蒽所诱导(表1)。
表1 3-甲基胆蒽(25mg/kgip,qd×3)对大鼠肝和
肾上腺7-乙氧异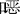 唑O-脱乙基酶活性的影响 分组n
唑O-脱乙基酶活性的影响 分组n
, http://www.100md.com
7-乙氧异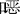 唑O-脱乙基酶(nmol.min-1.g-1)
唑O-脱乙基酶(nmol.min-1.g-1)
肾上腺( ±s)
±s)
肝( ±s)
±s)
对照组
3
0±0
4.6±1.6##
3-甲基胆蒽组
, http://www.100md.com
3
5.7±1.5**
79.3±24.2**##
与对照组相比,**P<0.01;与肾上腺相比,##P<0.01
2.2 人胎肾上腺和肝CYP1A1酶学表达和诱导
1例成人肝微粒体中EROD活性为21nmol.min-1.g-1,其活性与参加反应的微粒体蛋白浓度0.4~2mg/ml和反应时间10~30min间有良好的线性正相关。而在人胎肾上腺和肝微粒体中,微粒体蛋白浓度1~4mg/ml、7-乙氧异 唑浓度1~10μmol/L和反应时间5~30min范围内皆未检测到EROD活性。
唑浓度1~10μmol/L和反应时间5~30min范围内皆未检测到EROD活性。
, 百拇医药
体外培养的胎肾上腺皮质细胞经3-甲基胆蒽0.5~2μmol/L诱导处理24h后,仍不能检测到EROD活性。
2.3 人胎肾上腺和肝CYP1A1mRNA的表达
应用RT-PCR技术,检测胎肾上腺和肝组织中CYP1A1 mRNA的表达。图2显示了具代表性的RT-PCR扩增产物电泳结果。在对照的2例成人肝和2例成人肾上腺中,除1例成人肾上腺CYP1A1 mRNA表达阴性外,其余皆表现为阳性。在所测的9例胎肝和15例胎肾上腺中,CYP1A1 mRNA表达的阳性率分别为78%和73%(表2)。相关分析表明,胎组织中CYP1A1 mRNA的表达与胎龄和性别无关。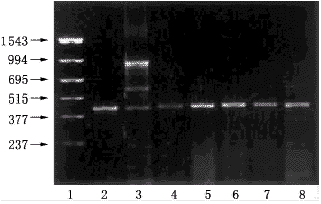
图2 CYP1A1的RTPCR扩增产物电泳结果
1.PCR标准品;2.成人肝;3.成人肾上腺;
, 百拇医药
4.胎肝;5~8.胎肾上腺.
表2 临床资料和CYP1A1的RT-PCR扩增结果 标本(No.)
胎儿性别
胎龄(周)
CYP1A1mRNA
成人肝
1
+
2
+
成人肾上腺
1
, 百拇医药
+
2
-
胎肝
1
F
22
+
2
F
24
+
3
M
, 百拇医药
26
+
4
M
19
+
5
F
24
-
6
?
28
+
, 百拇医药
7
?
20
+
8
F
33
+
9
M
19
-
胎肾上腺
1
, http://www.100md.com
M
19
+
2
F
33
+
3
F
22
+
4
M
20
, 百拇医药
+
5
M
18
+
6
F
24
+
7
M
19
-
8
, 百拇医药
M
15
+
9
M
17
+
10
F
24
+
11
M
26
, 百拇医药
+
12
M
16
+
13
F
20
-
14
M
13
-
15
, http://www.100md.com
M
22
-
3 讨论
已知在成人,CYP1A1主要分布于肝外组织,肝组织中CYP1A1活性虽低,经诱导后其活性可明显增强。3-甲基胆蒽和一些芳烃类环境致癌物(如苯并芘)既是CYP1A1的底物,也是其特异性诱导剂。
本文可见,成人肝组织中既有CYP1A1 mRNA表达,也存在CYP1A1标志酶EROD活性。而胎肝中CYP1A1是否有表达,文献报告是不一致的。1990年Omiecinski等应用PCR技术在胎肝中检测到CYP1A1mRNA,且观察到其含量变化随胎龄增长而增加[13]。而董海涛等采用自己设计的引物,用RT-PCR方法证实成人肝组织中有CYP1A1 mRNA表达的同时,发现胎肝中CYP1A1 mRNA表达阴性,认为胎儿发育期间肝CYP1A1基因处于封闭状态[14]。Hakkola早期工作中,应用RT-PCR技术在16例胎肝中未检测到CYP1A1 mRNA[11],但近年工作中则认为阴性结果可能是PCR循环次数不足所致[15]。我们在胎肝微粒体中未检测到CYP1A1酶活性,但选用Hakkola等设计的人CYP1A1引物,证实胎肝组织中达7/9例中有CYP1A1 mRNA表达,说明胎肝中存在低表达量的CYP1A1。
, http://www.100md.com
胎肾上腺中CYP1A1的表达至今未见报道。有文献提示胎肾上腺具有活化一些前致突变物的功能[16]。本文检测了2例成人肾上腺组织,有1例CYP1A1 mRNA表达阳性。胎肾上腺微粒体中CYP1A1酶活性检测阴性。离体研究也表明,3-甲基胆蒽不能诱导增强胎肾上腺细胞中CYP1A1酶活性。但应用灵敏度高的RT-PCR技术,证实胎肾上腺组织中确实存在CYP1A1 mRNA表达。说明胎肾上腺细胞中存在CYP1A1。其酶活性低于可检测水平,并不为3-甲基胆蒽所诱导。提示肾上腺在发育期间已具有代谢活化前致癌物、前致突变物的CYP1A1,有潜在的致癌可能性。
基金项目:本课题受国家自然科学基金(编号:39570831)资助
通讯作者:汪晖:Tel:86-27-87331565
Fax:86-27-8731-0966
, 百拇医药
E-mail:clbwhcbd@public.wh.hb.cn
[参考文献]
[1] Ioannides C,Parke DV. Induction of cytochrome P4501A as indicator of potential chemical carcinogenesis [J]. Drug Metab Rev, 1993, 25: 485~501.
[2] Peng RX, Yao XJ, Chen JH, et al. The capacity of drug metabolism in Chinese fetal liver: I. Presence of P-450 enzyme system [J]. Asia Pac J Pharmacol, 1989, 4 : 173~178.
, 百拇医药 [3] Peng RX, Lei SB, Gao P. The capacity of drug metabolism in Chinese fetal liver: II. Metabolism of ethylmorphine, aminopyrine and aniline [J]. Asia Pac J Pharmacol, 1990, 5: 13~18.
[4] Parker CR Jr,Stankovic AK,Falany CN,et al. Immunocytochemical analyses of dehydroepiandrosterone sulfotransferase in cultured human fetal adrenal cells [J]. J Clin Endocrinol Metab, 1995, 80: 1027~1031.
[5] Peng RX,Wang YS,Lei SB,et al.Characterization of monooxygenase system in Chinese fetal adrenal gland [J]. Asia Pac J Pharmacol, 1994, 9 : 195~200.
, http://www.100md.com
[6] Peng RX, Wang H, Wang YS, et al. Glutathione related enzyme activities in human fetal adrenal, liver, and kidney [J]. Chung Kuo Yao Li Hsueh Pao, 1998, 19: 167~171.
[7] Wang H, Peng RX, Zhang YH, et al. Demethylation capacity of human fetal adrenal mitochrondrial P 450 in vitro [J]. Chung Kuo Yao Li Hsueh Pao, 1999, 20 : 358~362.
[8] Mesiano S,Jaffe RB.Interaction of insulin like growth factor Ⅱ and estradiol directs steroidogenesis in the human fetal adrenal toward dehydroepiandrosterone sulfate production [J]. J Clin Endocrinol Metab, 1993, 77: 754~758.
, http://www.100md.com
[9] Burke MD,Prough RA, Mayer RT. Characteristics of a microsomal cytochrome P-448-mediated reaction. Ethoxyresorufin O-de-ethylation [J]. Drug Metab Dispos, 1977, 5 : 1~8.
[10] Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction [J]. Anal Biochem, 1987, 162: 156~159.
[11] Hakkola J,Pasanen M,Purkunen R,et al.Expression of xenobiotic-metabolizing cytochrome P450 forms in human adult and fetal liver [J]. Biochem Pharmacol, 1994, 48: 59~64.
, 百拇医药
[12] Burke MD,Mayer RT. Ethoxyresorufin:direct fluorimetric assay of a microsomal O dealkylation which is preferentially induced by 3-methylcholathrene [J].Drug metab Dispos,1974,2 :583~588.
[13] Omiecinski CJ,Redlich CA,Costa P. Induction and developmental expression of cytochrome P4501A1 messager RNA in rat and human tissues: detection by the polymerase chain reaction [J]. Cancer Res,1990, 50: 4315~4321.
[14] 董海涛, 吴健敏, 余应年. 细胞色素P4501A1基因mRNA的化学诱导及在人肝中的基础表达[J]. 中国药理学与毒理学杂志,1996,10:277~280.
, http://www.100md.com
[15] Hakkola J,Pelkonen O,Pasanen M,et al. Xenobiotic-metabolizing cytochrome P450 enzymes in the human feto-placental unit: role in intrauterine toxicity [J]. Crit Rev Toxicol,1998, 28: 35~72.
[16] Kato T, Nakasa H, Ohmori S, et al. Possible occurrence of P450 related to P450 HFLb in extrahepatic tissues of human fetuses and its contribution to metabolic activation of promutagens [J]. Mutat Res, 1994, 310: 73~77.
收稿日期:1999-06-17;修回日期:1999-09-06, 百拇医药
单位:汪晖(湖北医科大学药理教研室,湖北 武汉 430071);彭仁琇(湖北医科大学药理教研室,湖北 武汉 430071);于皆平(湖北医科大学附属第一医院消化内科,湖北 武汉 430060);孙来宝(湖北医科大学附属第一医院消化内科,湖北 武汉 430060)
关键词:CYP1A1;胎儿;肾上腺;肝
癌症000204
【摘 要】目的:研究与前致癌物和致突变物代谢活化密切相关的细胞色素P-450(cytochrome P-450,CYP)1A1在人胎肾上腺细胞中的表达。方法:用酶学和RTPCR技术检测胎肾上腺和肝细胞中CYP1A1酶活性和mRNA表达,并进行比较。结果:人胎肾上腺和胎肝微粒体中不能检测到CYP1A1标志酶7-乙氧异
 唑O-脱乙基酶(EROD)活性,同时在CYP1A1诱导剂3-甲基胆蒽(0.5~2.0μmol.L-1,24h)诱导的人胎肾上腺细胞中也不能检测到EROD活性。而动物在体实验表明,3-甲基胆蒽(25mg/kgip,qd×3)致成年大鼠肝脏EROD活性增强的同时,大鼠肾上腺EROD活性也提高。大鼠肾上腺EROD活性明显低于肝脏。RT-PCR结果进一步表明,胎肾上腺和胎肝中存在CYP1A1mRNA表达。结论:和胎肝一样,胎肾上腺中存在低表达量的CYP1A1,提示发育期间的胎肾上腺具有潜在的致癌可能性。
唑O-脱乙基酶(EROD)活性,同时在CYP1A1诱导剂3-甲基胆蒽(0.5~2.0μmol.L-1,24h)诱导的人胎肾上腺细胞中也不能检测到EROD活性。而动物在体实验表明,3-甲基胆蒽(25mg/kgip,qd×3)致成年大鼠肝脏EROD活性增强的同时,大鼠肾上腺EROD活性也提高。大鼠肾上腺EROD活性明显低于肝脏。RT-PCR结果进一步表明,胎肾上腺和胎肝中存在CYP1A1mRNA表达。结论:和胎肝一样,胎肾上腺中存在低表达量的CYP1A1,提示发育期间的胎肾上腺具有潜在的致癌可能性。, 百拇医药
中图分类号:R730.231 文献标识码:A
文章编号:1000-467X(2000)02-0112-04
Expression of adrenal cytochrome P-450 1A1 in human fetuses
WANG Hui PENG Ren-xiu
(Department of Pharmacology, Hubei Medical University, Wuhan 430071, P.R.China)
YU Jie-pin
(Department of Gastroenterology, First Affiliated Hospital,Hubei Medical University,Wuhan 430060, P.R.China)
, 百拇医药
【Abstract】 Objective: To study the expression and inducibility in vitro of adrenal cytochrome P-450 (CYP) 1A1 implicated in precarcinogen and premutagen activation in human fetuses.Methods:CYP1A1 mRNA and 7-ethoxyresorufin O-deethylase (EROD) activity of fetal adrenals were detected by using the reverse transcriptase-polymerase chain reaction (RT-PCR) and enzyme method respectively, which were compared with those of fetal liver. Results: The activity of CYP1A1 enzyme marker, EROD, was undetected in either adrenal tissue or 3-methylcholanthrene (3MC)-treated adrenal cultured cells in vitro. However, in vivo study with adult rat showed that 3MC (25 mg/kg ip, qd× 3) could enhance EROD activities of the adrenal gland and liver. Using RT-PCR method, the expression of CYP1A1 mRNA was detected in both fetal adrenal and fetal liver, and the percentage of CYP1A1 mRNA expression in these organs was 78% and 73 % , respectively. Conclusion: Human fetal adrenal as well as fetal liver had lower and undetectable CYP1A1 enzyme suggesting it possesses the potential risk of carcinogenesis during fetal development.
, http://www.100md.com
Key words:CYP1A1; Human fetuses; Adrenal gland; Liver
已知细胞色素P-4501A1(cytochrome P-4501A1,CYP1A1)参与了机体对多种前致癌物和致突变物的活化代谢过程。有研究表明,CYP1A水平是反映化学致癌作用的有效指征[1]。因此研究CYP1A在人胎肝和肝外组织的表达具有毒理学上的意义。我们在证实人胎肝CYP具有药物代谢功能[2,3]的基础上,曾进一步发现参与甾体激素合成的胎肾上腺[4]也具有较强的药物代谢功能[5~7]。但人胎肾上腺细胞中CYP1A1的表达如何,至今尚未见报道。本文采用细胞培养、酶学和分子生物学技术,在细胞、亚细胞和基因水平系统地观察了人胎肾上腺细胞中CYP1A1的表达。
1 材料及方法
1.1 主要试剂
, http://www.100md.com
3-甲基胆蒽(3-methylcholanthrene)、异
 唑(resorufin)、7-乙氧异
唑(resorufin)、7-乙氧异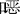 唑(7-ethoxyresorufin)、异柠檬酸(isocitric acid)、异柠檬酸脱氢酶(isocitric acid dehydrogenase)和胶原酶I(collagnaseI)均为美国Sigma公司产品。牛血清白蛋白(BSA)和氧化型辅酶Ⅱ等为国产分析纯。
唑(7-ethoxyresorufin)、异柠檬酸(isocitric acid)、异柠檬酸脱氢酶(isocitric acid dehydrogenase)和胶原酶I(collagnaseI)均为美国Sigma公司产品。牛血清白蛋白(BSA)和氧化型辅酶Ⅱ等为国产分析纯。1.2 标本来源
成人肝和肾上腺分别来自肝癌和嗜铬细胞瘤手术切除标本。胎肝和肾上腺来源于临床经水囊引产标本。液氮中保存备用。
1.3 微粒体制备
差速离心法制备亚细胞组分。组织经剪碎、漂洗、吸干后称重。用Tris.HCl50mmol/L(pH7.4)制备组织匀浆,9000×g离心20min。上清液经105000×g离心60min得微粒体沉淀。以1g肾上腺(或2g肝)∶1ml0.25mol/L蔗糖的比例制备微粒体混悬液,-30℃保存备用。
, http://www.100md.com
1.4 胎肾上腺皮质细胞分离、培养及处理
与成人肾上腺皮质部不同,胎肾上腺皮质部90%~95%是由胎儿带(fetal zone)细胞组成,其细胞分离和培养的方法参照文献[4,8]。将肾上腺皮质剪碎与5倍量的0.4mg/ml胶原酶I消化液37℃作用15min。用McCoy's5A培养基(Gibco)对倍稀释。800×g离心10min,沉淀用McCoy's5A培养基漂洗。以5×106/mL的细胞密度接种于培养瓶中,5%CO2、饱和湿度、37℃培养36~48h,使细胞贴壁。更新培养基,用3-甲基胆蒽0.5~2μmol/L处理细胞24h。收集并超声破碎细胞3次,每次5s。样本用于CYP1A1活性分析。
1.5 动物及处理
成年雄性Sprague-Dawley大鼠155±40g,由湖北医科大学动物实验中心提供。大鼠随机均分为对照组和3-甲基胆蒽诱导组。经腹腔注射(ip)3-甲基胆蒽25mg/kg,qd×3,等容量生理盐水作对照。末次给药后16h,乙醚麻醉、剖腹摘取大鼠肝脏和肾上腺,制备组织匀浆。
, 百拇医药
1.6 酶学分析
7-乙氧异
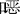 唑O-脱乙基酶(7-ethoxyresorufin O-deethylase,EROD)活性采用荧光法[9]测定。以异
唑O-脱乙基酶(7-ethoxyresorufin O-deethylase,EROD)活性采用荧光法[9]测定。以异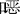 唑为标准品,在岛津RF-540荧光分光光度计上测定上清液荧光强度。激发波长530nm,发射波长586nm。
唑为标准品,在岛津RF-540荧光分光光度计上测定上清液荧光强度。激发波长530nm,发射波长586nm。1.7 总RNA提取
取100mg液氮冰冻组织,按异硫氰酸胍-酚-氯仿一步抽提法[10]提取组织总RNA。测定A260、A280和进行琼脂糖凝胶电泳,计算所提RNA的含量和纯度。每一样品RNA的28S、18S和5S带完整(图1)。-70℃保存备用。

, 百拇医药
图1 总RNA的琼脂糖凝胶电泳(异硫氰酸胍-酚-氯仿
一步法提取).1~2.胎肾上腺;3~5.胎肝.
1.8 逆转录聚合酶链式反应(reverse transcriptase-polymerase chain reaction,RT-PCR)
CYP1A1引物设计按文献报道[11]。正义引物为:TCACAGACAGCCTGATTGAG(928~947),反义引物为:GATGGGTTGACCCATAGCTT(1341~1360),由上海生工生物工程公司合成。
cDNA合成和PCR扩增在一步内完成,由Boehringer Mannheim公司提供TitanTM One Tube RT-PCR System试剂盒。反应体系中含1×RT-PCR缓冲液(pH7.5),总RNA2μg,引物400μmol/L,dNTP500μmol/L,DTT5mmol/L,RNA酶抑制剂10u,MgCl2 3.0mmol/L,AMV逆转录酶4.5u(Promega)和TaqDNA聚合酶1.25u。反应总体积25μL。反应前将引物和总RNA经65℃变性10min。50℃逆转录30min。予变性94℃2min5s后,94℃45s,55℃45s,68℃1min,循环10次。接着94℃45s,55℃45s,68℃1min(每轮递增5s),循环35次。在Hema480cDNA扩增仪(珠海黑马医学仪器有限公司)上进行。平行的阴性对照管不含RNA模板。RTPCR扩增产物用1.5%琼脂糖凝胶电泳分析,分子量为432bp。所参照的PCR标准品(Promega)分子量分别为237、377、515、695、994和1543bp。
, http://www.100md.com
2 结果
2.1 大鼠肾上腺和肝CYP1A1酶学表达和诱导
已知EROD是CYP1A1的标志酶,3-甲基胆蒽则是EROD的选择性诱导剂[12]。本研究中,成年大鼠肝经3-甲基胆蒽诱导后,其EROD活性明显增强,达对照组的14倍(P<0.01)。对照组肾上腺中未检测到EROD活性,在经3-甲基胆蒽诱导后的肾上腺中可检测之。提示成年大鼠肾上腺中存在CYP1A1活性,其低于大鼠肝CYP1A1活性(P<0.01),且可为3-甲基胆蒽所诱导(表1)。
表1 3-甲基胆蒽(25mg/kgip,qd×3)对大鼠肝和
肾上腺7-乙氧异
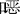 唑O-脱乙基酶活性的影响 分组n
唑O-脱乙基酶活性的影响 分组n, http://www.100md.com
7-乙氧异
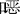 唑O-脱乙基酶(nmol.min-1.g-1)
唑O-脱乙基酶(nmol.min-1.g-1)肾上腺(
 ±s)
±s)肝(
 ±s)
±s)对照组
3
0±0
4.6±1.6##
3-甲基胆蒽组
, http://www.100md.com
3
5.7±1.5**
79.3±24.2**##
与对照组相比,**P<0.01;与肾上腺相比,##P<0.01
2.2 人胎肾上腺和肝CYP1A1酶学表达和诱导
1例成人肝微粒体中EROD活性为21nmol.min-1.g-1,其活性与参加反应的微粒体蛋白浓度0.4~2mg/ml和反应时间10~30min间有良好的线性正相关。而在人胎肾上腺和肝微粒体中,微粒体蛋白浓度1~4mg/ml、7-乙氧异
 唑浓度1~10μmol/L和反应时间5~30min范围内皆未检测到EROD活性。
唑浓度1~10μmol/L和反应时间5~30min范围内皆未检测到EROD活性。, 百拇医药
体外培养的胎肾上腺皮质细胞经3-甲基胆蒽0.5~2μmol/L诱导处理24h后,仍不能检测到EROD活性。
2.3 人胎肾上腺和肝CYP1A1mRNA的表达
应用RT-PCR技术,检测胎肾上腺和肝组织中CYP1A1 mRNA的表达。图2显示了具代表性的RT-PCR扩增产物电泳结果。在对照的2例成人肝和2例成人肾上腺中,除1例成人肾上腺CYP1A1 mRNA表达阴性外,其余皆表现为阳性。在所测的9例胎肝和15例胎肾上腺中,CYP1A1 mRNA表达的阳性率分别为78%和73%(表2)。相关分析表明,胎组织中CYP1A1 mRNA的表达与胎龄和性别无关。

图2 CYP1A1的RTPCR扩增产物电泳结果
1.PCR标准品;2.成人肝;3.成人肾上腺;
, 百拇医药
4.胎肝;5~8.胎肾上腺.
表2 临床资料和CYP1A1的RT-PCR扩增结果 标本(No.)
胎儿性别
胎龄(周)
CYP1A1mRNA
成人肝
1
+
2
+
成人肾上腺
1
, 百拇医药
+
2
-
胎肝
1
F
22
+
2
F
24
+
3
M
, 百拇医药
26
+
4
M
19
+
5
F
24
-
6
?
28
+
, 百拇医药
7
?
20
+
8
F
33
+
9
M
19
-
胎肾上腺
1
, http://www.100md.com
M
19
+
2
F
33
+
3
F
22
+
4
M
20
, 百拇医药
+
5
M
18
+
6
F
24
+
7
M
19
-
8
, 百拇医药
M
15
+
9
M
17
+
10
F
24
+
11
M
26
, 百拇医药
+
12
M
16
+
13
F
20
-
14
M
13
-
15
, http://www.100md.com
M
22
-
3 讨论
已知在成人,CYP1A1主要分布于肝外组织,肝组织中CYP1A1活性虽低,经诱导后其活性可明显增强。3-甲基胆蒽和一些芳烃类环境致癌物(如苯并芘)既是CYP1A1的底物,也是其特异性诱导剂。
本文可见,成人肝组织中既有CYP1A1 mRNA表达,也存在CYP1A1标志酶EROD活性。而胎肝中CYP1A1是否有表达,文献报告是不一致的。1990年Omiecinski等应用PCR技术在胎肝中检测到CYP1A1mRNA,且观察到其含量变化随胎龄增长而增加[13]。而董海涛等采用自己设计的引物,用RT-PCR方法证实成人肝组织中有CYP1A1 mRNA表达的同时,发现胎肝中CYP1A1 mRNA表达阴性,认为胎儿发育期间肝CYP1A1基因处于封闭状态[14]。Hakkola早期工作中,应用RT-PCR技术在16例胎肝中未检测到CYP1A1 mRNA[11],但近年工作中则认为阴性结果可能是PCR循环次数不足所致[15]。我们在胎肝微粒体中未检测到CYP1A1酶活性,但选用Hakkola等设计的人CYP1A1引物,证实胎肝组织中达7/9例中有CYP1A1 mRNA表达,说明胎肝中存在低表达量的CYP1A1。
, http://www.100md.com
胎肾上腺中CYP1A1的表达至今未见报道。有文献提示胎肾上腺具有活化一些前致突变物的功能[16]。本文检测了2例成人肾上腺组织,有1例CYP1A1 mRNA表达阳性。胎肾上腺微粒体中CYP1A1酶活性检测阴性。离体研究也表明,3-甲基胆蒽不能诱导增强胎肾上腺细胞中CYP1A1酶活性。但应用灵敏度高的RT-PCR技术,证实胎肾上腺组织中确实存在CYP1A1 mRNA表达。说明胎肾上腺细胞中存在CYP1A1。其酶活性低于可检测水平,并不为3-甲基胆蒽所诱导。提示肾上腺在发育期间已具有代谢活化前致癌物、前致突变物的CYP1A1,有潜在的致癌可能性。
基金项目:本课题受国家自然科学基金(编号:39570831)资助
通讯作者:汪晖:Tel:86-27-87331565
Fax:86-27-8731-0966
, 百拇医药
E-mail:clbwhcbd@public.wh.hb.cn
[参考文献]
[1] Ioannides C,Parke DV. Induction of cytochrome P4501A as indicator of potential chemical carcinogenesis [J]. Drug Metab Rev, 1993, 25: 485~501.
[2] Peng RX, Yao XJ, Chen JH, et al. The capacity of drug metabolism in Chinese fetal liver: I. Presence of P-450 enzyme system [J]. Asia Pac J Pharmacol, 1989, 4 : 173~178.
, 百拇医药 [3] Peng RX, Lei SB, Gao P. The capacity of drug metabolism in Chinese fetal liver: II. Metabolism of ethylmorphine, aminopyrine and aniline [J]. Asia Pac J Pharmacol, 1990, 5: 13~18.
[4] Parker CR Jr,Stankovic AK,Falany CN,et al. Immunocytochemical analyses of dehydroepiandrosterone sulfotransferase in cultured human fetal adrenal cells [J]. J Clin Endocrinol Metab, 1995, 80: 1027~1031.
[5] Peng RX,Wang YS,Lei SB,et al.Characterization of monooxygenase system in Chinese fetal adrenal gland [J]. Asia Pac J Pharmacol, 1994, 9 : 195~200.
, http://www.100md.com
[6] Peng RX, Wang H, Wang YS, et al. Glutathione related enzyme activities in human fetal adrenal, liver, and kidney [J]. Chung Kuo Yao Li Hsueh Pao, 1998, 19: 167~171.
[7] Wang H, Peng RX, Zhang YH, et al. Demethylation capacity of human fetal adrenal mitochrondrial P 450 in vitro [J]. Chung Kuo Yao Li Hsueh Pao, 1999, 20 : 358~362.
[8] Mesiano S,Jaffe RB.Interaction of insulin like growth factor Ⅱ and estradiol directs steroidogenesis in the human fetal adrenal toward dehydroepiandrosterone sulfate production [J]. J Clin Endocrinol Metab, 1993, 77: 754~758.
, http://www.100md.com
[9] Burke MD,Prough RA, Mayer RT. Characteristics of a microsomal cytochrome P-448-mediated reaction. Ethoxyresorufin O-de-ethylation [J]. Drug Metab Dispos, 1977, 5 : 1~8.
[10] Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction [J]. Anal Biochem, 1987, 162: 156~159.
[11] Hakkola J,Pasanen M,Purkunen R,et al.Expression of xenobiotic-metabolizing cytochrome P450 forms in human adult and fetal liver [J]. Biochem Pharmacol, 1994, 48: 59~64.
, 百拇医药
[12] Burke MD,Mayer RT. Ethoxyresorufin:direct fluorimetric assay of a microsomal O dealkylation which is preferentially induced by 3-methylcholathrene [J].Drug metab Dispos,1974,2 :583~588.
[13] Omiecinski CJ,Redlich CA,Costa P. Induction and developmental expression of cytochrome P4501A1 messager RNA in rat and human tissues: detection by the polymerase chain reaction [J]. Cancer Res,1990, 50: 4315~4321.
[14] 董海涛, 吴健敏, 余应年. 细胞色素P4501A1基因mRNA的化学诱导及在人肝中的基础表达[J]. 中国药理学与毒理学杂志,1996,10:277~280.
, http://www.100md.com
[15] Hakkola J,Pelkonen O,Pasanen M,et al. Xenobiotic-metabolizing cytochrome P450 enzymes in the human feto-placental unit: role in intrauterine toxicity [J]. Crit Rev Toxicol,1998, 28: 35~72.
[16] Kato T, Nakasa H, Ohmori S, et al. Possible occurrence of P450 related to P450 HFLb in extrahepatic tissues of human fetuses and its contribution to metabolic activation of promutagens [J]. Mutat Res, 1994, 310: 73~77.
收稿日期:1999-06-17;修回日期:1999-09-06, 百拇医药