重组人粒细胞集落刺激因子肽谱分析方法初探
作者:钟英 郑勇军
单位:钟英 郑勇军(杭州九源基因工程有限公司 310018)
关键词:重组人粒细胞集落刺激因子;反相高效液相色谱;毛细管区带电泳;肽谱
药物分析杂志000204 摘要 目的:建立检测重组人粒细胞集落刺激因子(rhG-CSF)肽谱的方法。方法:采用RP-HPLC法及CZE法。结果:检测rhG-CSF经胰蛋白酶裂解后的肽段,发现九源公司生产的各批产品的一级结构具有一致性。2种分析方法均具有灵敏度高,重现性好等优点。结论:本法适用于基因工程药物的肽谱分析。
Peptide Mapping of Recombinant Human Granulocyte
Colony Stimulating Factor by RP-HPLC or CZE
, http://www.100md.com
Zhong Ying and Zheng Yongjun
(Hangzhou Jiuyuan Gene Engineering Co. Ltd, 310018)
Abstract Objective:Establish the method for peptide mapping of rhG-CSF. Method:High-performance liquid chromatography and capillary zone electrophoresis (CZE). Results:Relative standard deviations of peak retention or migration times were less than 1% for RP-HPLC and less than 0.1% for CZE. Batch to batch consistency is required. Conclusions:The method was suitable for the peptide mapping of rhG-CSF.
, 百拇医药
Key words recombinant human granulocyte colony stimulating factor, peptide mapping, RP-HPLC, CZE
肽谱是检测基因工程药物质量的重要指标之一,对每一种蛋白来说,肽谱是特征的、专一的。通过肽谱分析,可以鉴别不同批次的产品其一级结构的一致性。目前分析肽谱的常用方法为溴化氰裂解甲硫氨酸位点[1,2],再利用SDS-PAGE方法分离降解的片段,但此法适用于溴化氰裂解的较大肽段的分析,小片段常易丢失。而反相高效液相色谱(RP-HPLC)法[3]是根据肽段疏水性大小来分离。毛细管区带电泳(CZE)法[4]是根据溶质荷质比不同进行分离,2种方法均可分离分子量较小的肽段。本文采用N-甲苯磺酰基-L-苯基丙氨酸氯甲基酮(N-Tosyl-L-Phenylalanine Chloromethyl Ketone, TPCK)处理的胰蛋白酶裂解rhG-CSF,再用RP-HPLC法或CZE法分析裂解片段,获得满意结果。
, 百拇医药
1 仪器、试剂及样品
Beckman HPLC系统,包括125型泵,168型二级管阵列检测器,System Gold数据处理软件;Beckman P/ACE 5000型毛细管电泳仪。
色谱柱:Vydac C18(4.6 mm×150 mm),5 μm;毛细管柱:Beckman Uncoated, 37 cm×75 μm。
TPCK处理的胰蛋白酶为Boehringer公司产品,序列级;三氟醋酸为Sigma公司产品;乙腈为Fisher公司产品;碳酸氢铵、磷酸氢二钠、磷酸二氢钠、硼砂、硼酸均为国产分析纯。
重组人粒细胞集落刺激因子样品来自九源公司。
2 胰蛋白酶酶切方法
, http://www.100md.com
取浓度为1 mg。mL-1的rhG-CSF样品对0.1 mol。L-1碳酸氢铵透析过夜,以1∶50(w/w)加入TPCK处理的胰蛋白酶,37 ℃酶切20 h,放入-20 ℃冰箱备用,进样前离心去除不溶物。
3 RP-HPLC分析方法
色谱条件:流速0.5 mL。min-1,检测波长214 nm,进样量50 μL,梯度洗脱程序见表1[流动相A:0.1%(w/v)三氟醋酸,流动相B:乙腈-水(9∶1)溶液,内含0.1%(w/v)三氟醋酸]。
表1 梯度洗脱程序 时间/min
各流动相比例/%
A
, 百拇医药
B
0
95
5
40
15
85
42
95
5
60
95
5
4 RP-HPLC法肽谱结果分析
, 百拇医药
rhG-CSF含有175个氨基酸,分子量约为18 000,其分子中含有5个Arg,分别位于第23,147,148,167,170位上,4个Lys,分别位于第17,24,35,41位上。rhG-CSF用胰蛋白酶裂解,理论上有9个裂解位点和8个肽段以及2种单氨基酸。但酶解常不完善或在非Arg, Lys残基上切断,因此会产生更多的分离峰。实验用3批rhG-CSF样品经胰蛋白酶裂解后肽段用RP-HPLC分析,各批间肽图一致(980203号样品肽谱见图1)。用此方法重复5次,结果完全一致。计算得同一样品中8个主要肽段同一天内出峰时间的RSD均小于1%(表2)。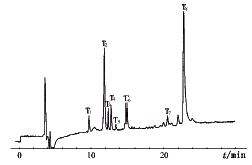
图1 rhG-CSF样品RP-HPLC肽谱
T1~T8为肽段
表2 RP-HPLC肽谱中8个主要肽段出峰时间及日内RSD 肽段
, 百拇医药
出峰时间/min
日内RSD/%
T1
9.734
9.681
9.842
0.8
T2
11.934
11.948
11.943
0.1
, 百拇医药
T3
12.449
12.475
12.435
0.2
T4
12.847
12.872
12.880
0.1
T5
14.907
, http://www.100md.com
14.899
14.917
0.1
T6
20.608
20.559
20.527
0.2
T7
22.064
22.046
21.921
, http://www.100md.com
0.4
T8
22.909
22.897
22.715
0.5
5 CZE分析条件的选择
5.1 缓冲液pH的影响 考察不同pH的0.05 mol。L-1磷酸缓冲液,在电压12 kV,柱温23 ℃,检测波长214 nm等条件不变情况下对rhG-CSF酶切后肽段的分离情况。缓冲液pH 5.8以下,肽段基本上达到基线分离,而且基线相对稳定,但pH 2.5时肽段分离时间比pH 5.8时长1倍。缓冲液pH大于6以上,分离效果均下降(图2)。实验中选择缓冲液pH 5.8。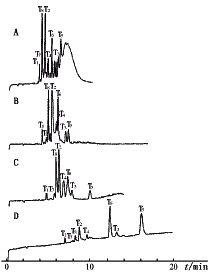
, 百拇医药
图2 不同pH下的CZE肽谱
A. pH 7.6 B. pH 6.6 C. pH 5.8 D. pH 2.5
T1~T8为肽段
5.2 磷酸缓冲液浓度的影响 实验表明硼酸-氢氧化钠体系分离效果均不如磷酸缓冲液,并随着磷酸缓冲液浓度增大,分离效果更好(图3),但由于增大缓冲液浓度,电流增大,热效应增加,基线不稳,易产生小的气泡尖峰,影响分离。实验中选择缓冲液浓度为0.05 mol。L-1。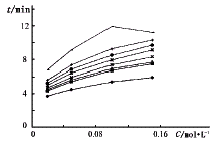
图3 缓冲液浓度对迁移时间的影响
图中曲线从下至上依次为
, 百拇医药
T1、T7、T8、T2、T4、T6、T3、T5 8个肽段
5.3 操作电压的选择 在其它实验条件不变情况下,改变操作电压为5,8,12,15,20 kV,8个主要肽段的迁移时间随电压的增加而减小。在8 kV至20 kV之间,电压对肽段的分离基本上没有影响(图4)。但随着电压的增加,电流增大,热效应增加,实验中选择电压为12 kV。
5.4 样品盐浓度和进样体积的影响 实验表明,0.1 mol。L-1碳酸氢铵不会影响分离,样品无需处理即可分析。进样量若大于5 s,分离效果下降,有若干峰分不开。实验中选择压力进样2 s。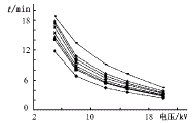
, 百拇医药
图4 操作电压对迁移时间的影响
图中曲线从下至上依次为
T1、T7、T8、T2、T4、T6、T3、T5 8个肽段
6 CZE的分析方法
毛细管柱:37 cm×75 μm,有效长度30 cm;检测波长214 nm;分离电压12 kV;分离时间12 min;柱温23 ℃;压力进样2 s;缓冲液为0.05 mol。L-1磷酸盐缓冲液,pH 5.8;每次运行之前用1 mol。L-1盐酸、0.1 mol。L-1氢氧化钠、蒸馏水、缓冲液分别依次冲洗毛细管各3 min。
, 百拇医药
7 CZE肽谱的分析结果
3批rhG-CSF样品经胰蛋白酶酶切后肽段CZE分析,可得批间一致(980203号样品肽谱见图5)。同一酶切后的样品重复进样,考察了8个肽段出峰时间的日内RSD,均小于0.1%(表3)。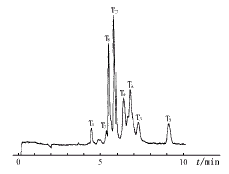
图5 rhG-CSF样品CZE肽谱
表3 CZE肽谱中8个主要肽段出峰时间及日内RSD 肽段
出峰时间/min
日内RSD/%
T1
4.469
, http://www.100md.com
4.470
4.467
0.03
T7
5.371
5.378
5.379
0.08
T8
5.545
5.550
5.552
, http://www.100md.com
0.06
T2
5.876
5.874
5.867
0.08
T4
6.362
6.365
6.355
0.08
T6
, 百拇医药
6.796
6.801
6.799
0.04
T3
7.285
7.279
7.291
0.08
T5
9.085
9.086
, 百拇医药
9.099
0.09
8 RP-HPLC肽谱与CZE肽谱比较
将RP-HPLC肽谱中8个肽段分别收集,冻干过夜,用蒸馏水溶解后做CZE分析,所出的峰分别与CZE肽谱比较,见表4。
表4 出峰时间比较(min) 峰号
HPLC
CZE
T1
9.7
4.5
T2
, http://www.100md.com
11.9
5.9
T3
12.4
7.3
T4
12.8
6.4
T5
14.9
9.1
T6
, 百拇医药
20.5
6.8
T7
21.9
5.4
T8
22.8
5.6
9 讨论
本文建立了胰蛋白酶裂解rhG-CSF后,用RP-HPLC法或CZE法分离检测肽段的方法。方法高度专一,具有重复性好,灵敏度高等特点。RP-HPLC肽谱中各肽段理论塔板数分别为12 173,12 639,13 750,14 646,16 135,15 745,29 926,38 383,缺点是主要肽段需在30 min全部出现,且多余未消化的胰蛋白酶在45 min左右出峰,这样整个肽谱分析过程时间需60 min。而CZE法则克服了传统电泳散热效率不高的缺点,全面改善分离质量。CZE法肽谱中各肽段理论塔板数分别为21 711, 22 754, 41 025, 38 922, 21 478, 26 589, 35 471, 38 752,分析只需ng级的样品,分析时间只需12 min,加上盐酸、氢氧化钠等清洗毛细管,整个肽谱分析过程只需24 min,非常适用于rhG-CSF的肽谱分析。九源公司生产的3批rhG-CSF经RP-HPLC和CZE 2种方法分析,批间均达到一致。推测本法也适用于其它基因工程蛋白质的肽谱分析。
, 百拇医药
参考文献
1,Vera Nikodem, Jacques R Fresco. Protein fingerprinting by SDS-gel electrophoesis after partial fragmrntation with CNBr. Anal Biochem, 1979, 97: 382
2,饶春明,赵燕平,张向明等.银染SDS-PAGE微量肽图法的改进.生物化学与生物物理进展.1989,16(3):241
3,Kelly A, Milos Novotny. High-sensitivity peptide mapping by capillary zone electrophoresis and microcolumn liquid chromatography, using immobilized trypsin for protein digestion. Anal Chem, 1989, 61: 2226
4,McCormick R M. Capillary zone electrophoretic separation of peptides and proteins using low pH buffers in modified silica capillaries. Anal Chem, 1988, 60:2322
(本文于1999年3月15日修改回), 百拇医药
单位:钟英 郑勇军(杭州九源基因工程有限公司 310018)
关键词:重组人粒细胞集落刺激因子;反相高效液相色谱;毛细管区带电泳;肽谱
药物分析杂志000204 摘要 目的:建立检测重组人粒细胞集落刺激因子(rhG-CSF)肽谱的方法。方法:采用RP-HPLC法及CZE法。结果:检测rhG-CSF经胰蛋白酶裂解后的肽段,发现九源公司生产的各批产品的一级结构具有一致性。2种分析方法均具有灵敏度高,重现性好等优点。结论:本法适用于基因工程药物的肽谱分析。
Peptide Mapping of Recombinant Human Granulocyte
Colony Stimulating Factor by RP-HPLC or CZE
, http://www.100md.com
Zhong Ying and Zheng Yongjun
(Hangzhou Jiuyuan Gene Engineering Co. Ltd, 310018)
Abstract Objective:Establish the method for peptide mapping of rhG-CSF. Method:High-performance liquid chromatography and capillary zone electrophoresis (CZE). Results:Relative standard deviations of peak retention or migration times were less than 1% for RP-HPLC and less than 0.1% for CZE. Batch to batch consistency is required. Conclusions:The method was suitable for the peptide mapping of rhG-CSF.
, 百拇医药
Key words recombinant human granulocyte colony stimulating factor, peptide mapping, RP-HPLC, CZE
肽谱是检测基因工程药物质量的重要指标之一,对每一种蛋白来说,肽谱是特征的、专一的。通过肽谱分析,可以鉴别不同批次的产品其一级结构的一致性。目前分析肽谱的常用方法为溴化氰裂解甲硫氨酸位点[1,2],再利用SDS-PAGE方法分离降解的片段,但此法适用于溴化氰裂解的较大肽段的分析,小片段常易丢失。而反相高效液相色谱(RP-HPLC)法[3]是根据肽段疏水性大小来分离。毛细管区带电泳(CZE)法[4]是根据溶质荷质比不同进行分离,2种方法均可分离分子量较小的肽段。本文采用N-甲苯磺酰基-L-苯基丙氨酸氯甲基酮(N-Tosyl-L-Phenylalanine Chloromethyl Ketone, TPCK)处理的胰蛋白酶裂解rhG-CSF,再用RP-HPLC法或CZE法分析裂解片段,获得满意结果。
, 百拇医药
1 仪器、试剂及样品
Beckman HPLC系统,包括125型泵,168型二级管阵列检测器,System Gold数据处理软件;Beckman P/ACE 5000型毛细管电泳仪。
色谱柱:Vydac C18(4.6 mm×150 mm),5 μm;毛细管柱:Beckman Uncoated, 37 cm×75 μm。
TPCK处理的胰蛋白酶为Boehringer公司产品,序列级;三氟醋酸为Sigma公司产品;乙腈为Fisher公司产品;碳酸氢铵、磷酸氢二钠、磷酸二氢钠、硼砂、硼酸均为国产分析纯。
重组人粒细胞集落刺激因子样品来自九源公司。
2 胰蛋白酶酶切方法
, http://www.100md.com
取浓度为1 mg。mL-1的rhG-CSF样品对0.1 mol。L-1碳酸氢铵透析过夜,以1∶50(w/w)加入TPCK处理的胰蛋白酶,37 ℃酶切20 h,放入-20 ℃冰箱备用,进样前离心去除不溶物。
3 RP-HPLC分析方法
色谱条件:流速0.5 mL。min-1,检测波长214 nm,进样量50 μL,梯度洗脱程序见表1[流动相A:0.1%(w/v)三氟醋酸,流动相B:乙腈-水(9∶1)溶液,内含0.1%(w/v)三氟醋酸]。
表1 梯度洗脱程序 时间/min
各流动相比例/%
A
, 百拇医药
B
0
95
5
40
15
85
42
95
5
60
95
5
4 RP-HPLC法肽谱结果分析
, 百拇医药
rhG-CSF含有175个氨基酸,分子量约为18 000,其分子中含有5个Arg,分别位于第23,147,148,167,170位上,4个Lys,分别位于第17,24,35,41位上。rhG-CSF用胰蛋白酶裂解,理论上有9个裂解位点和8个肽段以及2种单氨基酸。但酶解常不完善或在非Arg, Lys残基上切断,因此会产生更多的分离峰。实验用3批rhG-CSF样品经胰蛋白酶裂解后肽段用RP-HPLC分析,各批间肽图一致(980203号样品肽谱见图1)。用此方法重复5次,结果完全一致。计算得同一样品中8个主要肽段同一天内出峰时间的RSD均小于1%(表2)。

图1 rhG-CSF样品RP-HPLC肽谱
T1~T8为肽段
表2 RP-HPLC肽谱中8个主要肽段出峰时间及日内RSD 肽段
, 百拇医药
出峰时间/min
日内RSD/%
T1
9.734
9.681
9.842
0.8
T2
11.934
11.948
11.943
0.1
, 百拇医药
T3
12.449
12.475
12.435
0.2
T4
12.847
12.872
12.880
0.1
T5
14.907
, http://www.100md.com
14.899
14.917
0.1
T6
20.608
20.559
20.527
0.2
T7
22.064
22.046
21.921
, http://www.100md.com
0.4
T8
22.909
22.897
22.715
0.5
5 CZE分析条件的选择
5.1 缓冲液pH的影响 考察不同pH的0.05 mol。L-1磷酸缓冲液,在电压12 kV,柱温23 ℃,检测波长214 nm等条件不变情况下对rhG-CSF酶切后肽段的分离情况。缓冲液pH 5.8以下,肽段基本上达到基线分离,而且基线相对稳定,但pH 2.5时肽段分离时间比pH 5.8时长1倍。缓冲液pH大于6以上,分离效果均下降(图2)。实验中选择缓冲液pH 5.8。

, 百拇医药
图2 不同pH下的CZE肽谱
A. pH 7.6 B. pH 6.6 C. pH 5.8 D. pH 2.5
T1~T8为肽段
5.2 磷酸缓冲液浓度的影响 实验表明硼酸-氢氧化钠体系分离效果均不如磷酸缓冲液,并随着磷酸缓冲液浓度增大,分离效果更好(图3),但由于增大缓冲液浓度,电流增大,热效应增加,基线不稳,易产生小的气泡尖峰,影响分离。实验中选择缓冲液浓度为0.05 mol。L-1。

图3 缓冲液浓度对迁移时间的影响
图中曲线从下至上依次为
, 百拇医药
T1、T7、T8、T2、T4、T6、T3、T5 8个肽段
5.3 操作电压的选择 在其它实验条件不变情况下,改变操作电压为5,8,12,15,20 kV,8个主要肽段的迁移时间随电压的增加而减小。在8 kV至20 kV之间,电压对肽段的分离基本上没有影响(图4)。但随着电压的增加,电流增大,热效应增加,实验中选择电压为12 kV。
5.4 样品盐浓度和进样体积的影响 实验表明,0.1 mol。L-1碳酸氢铵不会影响分离,样品无需处理即可分析。进样量若大于5 s,分离效果下降,有若干峰分不开。实验中选择压力进样2 s。

, 百拇医药
图4 操作电压对迁移时间的影响
图中曲线从下至上依次为
T1、T7、T8、T2、T4、T6、T3、T5 8个肽段
6 CZE的分析方法
毛细管柱:37 cm×75 μm,有效长度30 cm;检测波长214 nm;分离电压12 kV;分离时间12 min;柱温23 ℃;压力进样2 s;缓冲液为0.05 mol。L-1磷酸盐缓冲液,pH 5.8;每次运行之前用1 mol。L-1盐酸、0.1 mol。L-1氢氧化钠、蒸馏水、缓冲液分别依次冲洗毛细管各3 min。
, 百拇医药
7 CZE肽谱的分析结果
3批rhG-CSF样品经胰蛋白酶酶切后肽段CZE分析,可得批间一致(980203号样品肽谱见图5)。同一酶切后的样品重复进样,考察了8个肽段出峰时间的日内RSD,均小于0.1%(表3)。

图5 rhG-CSF样品CZE肽谱
表3 CZE肽谱中8个主要肽段出峰时间及日内RSD 肽段
出峰时间/min
日内RSD/%
T1
4.469
, http://www.100md.com
4.470
4.467
0.03
T7
5.371
5.378
5.379
0.08
T8
5.545
5.550
5.552
, http://www.100md.com
0.06
T2
5.876
5.874
5.867
0.08
T4
6.362
6.365
6.355
0.08
T6
, 百拇医药
6.796
6.801
6.799
0.04
T3
7.285
7.279
7.291
0.08
T5
9.085
9.086
, 百拇医药
9.099
0.09
8 RP-HPLC肽谱与CZE肽谱比较
将RP-HPLC肽谱中8个肽段分别收集,冻干过夜,用蒸馏水溶解后做CZE分析,所出的峰分别与CZE肽谱比较,见表4。
表4 出峰时间比较(min) 峰号
HPLC
CZE
T1
9.7
4.5
T2
, http://www.100md.com
11.9
5.9
T3
12.4
7.3
T4
12.8
6.4
T5
14.9
9.1
T6
, 百拇医药
20.5
6.8
T7
21.9
5.4
T8
22.8
5.6
9 讨论
本文建立了胰蛋白酶裂解rhG-CSF后,用RP-HPLC法或CZE法分离检测肽段的方法。方法高度专一,具有重复性好,灵敏度高等特点。RP-HPLC肽谱中各肽段理论塔板数分别为12 173,12 639,13 750,14 646,16 135,15 745,29 926,38 383,缺点是主要肽段需在30 min全部出现,且多余未消化的胰蛋白酶在45 min左右出峰,这样整个肽谱分析过程时间需60 min。而CZE法则克服了传统电泳散热效率不高的缺点,全面改善分离质量。CZE法肽谱中各肽段理论塔板数分别为21 711, 22 754, 41 025, 38 922, 21 478, 26 589, 35 471, 38 752,分析只需ng级的样品,分析时间只需12 min,加上盐酸、氢氧化钠等清洗毛细管,整个肽谱分析过程只需24 min,非常适用于rhG-CSF的肽谱分析。九源公司生产的3批rhG-CSF经RP-HPLC和CZE 2种方法分析,批间均达到一致。推测本法也适用于其它基因工程蛋白质的肽谱分析。
, 百拇医药
参考文献
1,Vera Nikodem, Jacques R Fresco. Protein fingerprinting by SDS-gel electrophoesis after partial fragmrntation with CNBr. Anal Biochem, 1979, 97: 382
2,饶春明,赵燕平,张向明等.银染SDS-PAGE微量肽图法的改进.生物化学与生物物理进展.1989,16(3):241
3,Kelly A, Milos Novotny. High-sensitivity peptide mapping by capillary zone electrophoresis and microcolumn liquid chromatography, using immobilized trypsin for protein digestion. Anal Chem, 1989, 61: 2226
4,McCormick R M. Capillary zone electrophoretic separation of peptides and proteins using low pH buffers in modified silica capillaries. Anal Chem, 1988, 60:2322
(本文于1999年3月15日修改回), 百拇医药