冻融法制备5-氟尿嘧啶脂质体及其稳定性考察
作者:张奇 邓英杰
单位:沈阳药科大学药学系,沈阳 110015
关键词:5-氟尿嘧啶脂质体;冻融法;包封率;稳定性
沈阳药科大学学报000203 摘 要:采用反相蒸发法制备5-氟尿嘧啶脂质体制剂.结合冻融法,可使5-氟尿嘧啶的包封率达(45.31±0.208 5)%.离心加速实验和ζ电位的测定进一步验证了冻融法可使脂质体稳定性提高.
分类号 R94
The Preparation of 5-FU Liposome by a Freeze-thawing Method and the Study on Its Stability
Zhang Qi Deng Yingjie
, http://www.100md.com
(Department of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110015)
Abstract:5-FU liposome was prepared by the reverse evaporating method.Then the entrapment reached 43.31% by freeze-thawing 5-FU liposome several times.The centrifugal accelaration experiment and the measurement of ζ potential proved that the stability of the liposome could be ameliorated.
Key words:5-FU liposome;freeze-thawing method;entrapment;stability▲
, http://www.100md.com
5-氟尿嘧啶(5-FU)是一种常用的抗癌药物,主要用于各种恶性肿瘤及恶性淋巴瘤转移的患者〔1〕.但5-FU的吸收不稳定,一般均静脉给药.静脉注入后血中半衰期仅为7.5~10 min,消除极快,并且有骨髓抑制和胃肠道反应的毒副作用〔2〕.脂质体作为药物载体,有使药物浓集于靶组织、减少毒副作用、提高疗效的作用,为此,将5-FU制成脂质体制剂.为了克服脂质体对水溶性小分子物质包封率低的缺点,作者采用冻融法制备出具有较高包封率的5-FU脂质体,并对制剂稳定性进行了考察.
1 试药与仪器
5-FU(济南制药总厂);豆磷脂:药用(沈阳药科大学制药厂);胆固醇:进口品(上海生化试剂厂分装);其它试剂均为分析纯.
旋转蒸发仪(上海医械专机厂);超声波清洗机(昆山市超声波仪器厂);涡流振荡器(沈阳机械厂);UV-260型分光光度计(日本岛津);OLYMPUS显微镜(日本);BDL-B型表面电位粒径仪(上海市检测技术所检测仪器厂).
, http://www.100md.com
2 方法与结果
2.1 5-FU脂质体的制备及冻融法对包封率的影响
脂质体的制备方法很多,有薄膜法、复乳法、乙醚注入法等.作者采用反相蒸发法.精密称取一定比例的磷脂、胆固醇等于茄形瓶中,用适量氯仿溶解,将少量5-FU磷酸缓冲液加入上述有机相中,超声使成均匀乳,旋转蒸发仪上减压除尽有机溶剂,使成凝胶,涡流振荡间隔减压蒸发,得白色均匀脂质体溶液,用缓冲液定容至刻度.4℃冰箱贮存.
将所制备的脂质体,冰箱冷冻后室温融化,重复3次,5-FU脂质体包封率变化结果如表1.
Tab.1 The difference between entrapment of liposome before and after being frozen-thawed Samples
, http://www.100md.com
1
2
3
En/%
Before frozen
26.66
24.87
25.77
25.77±0.748
After frozen
45.37
45.33
, 百拇医药 45.03
45.31±0.208 5
可见冻融法可明显提高脂质体包封率,并且方法简易可行.
2.2 包封率的测定及柱回收率考察
脂质体相对分子质量在10万~30万,而5-FU相对分子质量为130.10,利用Sephadex G-50柱,可将脂质体与游离药物很好分开,测定未被包入脂质体中5-FU,从而求出包封率(En%):
En%=(1-C外/C总)×100%.
C外:未包入脂质体中游离5-FU量;C总:5-FU总药物量.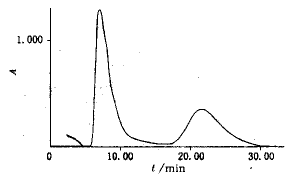
, 百拇医药
Fig.1 The separation curve
配制高、中、低3个剂量5-FU标准磷酸缓冲盐水溶液:15.0、8.5、2.0 g/L,Sephadex G-50(1.2 cm×25 cm)柱层析,收集5-FU流份,稀释至25 mL.层析条件如下,上样量:0.2 mL;流动相:磷酸缓冲液(pH 8.0);流速:1.0 mL/min;紫外检测波长265 nm.得3份柱分离样品.另精密吸取5-FU标准溶液0.2 mL,流动相稀释至25 mL,得3份5-FU标准样品.柱分离样品浓度与标准样品浓度相比,求得柱空白回收率,结果如表2.
Tab.2 The recoveries of 5-FU The concentration
of 5-FU standard/g。L-1
, 百拇医药 The concentration
of 5-FU sample/g。L-1
Recovery/
%
15.007
14.887
99.20
8.492
8.625
98.46
1.966
2.101
, http://www.100md.com
93.06
平均回收率:(97.081±0.025)% 配制一系列5-FU标准品与空白脂质体混合的标准溶液,0.2 mL柱层析,得到加样回收率,结果如表3.其中用氯仿热萃取法测定5-FU总药量.
Tab.3 The recoveries of the 5-FU sample The concentration
of 5-FU standard/g。L-1
The concentration
of 5-FU sample/g。L-1
Recovery/
, 百拇医药
%
7.970
7.719
96.80
6.376
6.200
97.24
3.188
3.526
110.60
1.599
1.583
99.00
, http://www.100md.com
0.800
0.810
101.30
0.400
0.394
98.52
平均回收率:(100.577±0.047)%2.3 脂质体稳定性考察
2.3.1 离心加速实验
为考察冻融对脂质体稳定性的影响,将冻融前后样品分别采用离心加速试验(1 000r/min,离心5 min),采用分光光度法测定脂质体离心前后λ500 nm处吸光度,根据公式KE=(|A-A0|)×100%求稳定性参数KE.A0为脂质体稀释液λ500 nm处的吸光度;A为脂质体稀释液离心后λ500 nm处吸光度.离心前后脂质体吸光度变化越小,说明脂质体粒径变化越小;KE值越小,脂质体越稳定.
, 百拇医药
由表4实验数据可见,冻融法不仅可以提高5-FU包封率,而且使KE值变小,提高了制剂稳定性.
Tab.4 The differences between the stability of liposome before and after being frozen-thawed Samples of different
prescriptions
KE before
be frozen
KE after
be frozen
1
, 百拇医药
0.051
0.044
2
0.061
0.054
3
0.035
0.025
4
0.014
0.011
5
0.079
, http://www.100md.com
0.037
2.3.2 脂质体形态观察
在OLYMPUS显微镜下(10×100倍),脂质体为圆球形,颜色偏暗,变化焦距圆球中心无亮点,冻融前单位视野中脂质体量不多,粒径大的约4~5 μm,小的2~3 μm,单层或多层.冻融后单位视野中脂质体量多而密,粒径较均匀,多为2~5 μm,单层或多层.
2.3.3 脂质体荷电量的变化
脂质体属胶体分散体系,分散相粒子在与外界电解质接触的界面上,由于发生电离、离子吸附或离子溶解等作用,使粒子表面带电,在外加电场下,粒子在分散介质中作定向移动称电泳.电泳产生的原因是由于分散系的微粒表面形成双电层,双电层的滑动面上产生电动(Zeta)电位,所以通过测定电泳速度,根据Helmholtz公式ζ=4zηu/DE=ktU/E求ζ电位.冻融法改变了微粒表面的ζ电位,结果如表5. Tab.5 The differences between the ζ ptential of liposome before and after being frozen-thawed Samples
, http://www.100md.com
1
2
3
4
5
ζ Before be frozen
-59.352
-56.153
-46.499
-48.555
-61.238
ζ After be frozen
, 百拇医药
-55.120
-52.311
-37.200
-59.075
-46.499
由表5可以看出,脂质体表面荷负电,冻融后脂质体荷电量下降,脂质体稳定性提高,与留样观察结果相一致.
3 讨论
a.5-FU是一种难溶性药物,分子量小,分子中有两个活泼的酰亚胺基,存在烯醇型互变异构,将5-FU包封于脂质体水相中制成5-FU脂质体.由于5-FU难溶,制得有高包封率的脂质体很难.为提高包封率,采用对水溶性药物包封率较高的反相蒸发法,并将产物冻融几次处理,有效提高了包封率.由于冰冻使磷脂周围药物浓度增高,在反复冻融过程中粒径小的脂质体互相融合成稍大脂质体,粒径趋于均匀化〔3〕,使脂质体包封率明显提高,最终可达约40%,比冻融前20%大约提高1倍.
, 百拇医药
b.采用离心分光光度法〔4〕,以稳定性常数KE为指标评价脂质体的稳定性.同样条件下,K\-E值愈小,脂质体愈稳定.此法实际上是离心法与浊度法的结合,其吸光度包括了散射光.这种方法原用于评价乳剂稳定性.而乳剂与脂质体有许多相似之处,所以现也用来评价脂质体稳定性.
c.微粒的聚结稳定性是由粒子间的作用力决定的〔5〕,作用力是Vander Waals引力和双电层间的静电斥力决定的〔6〕,其中ζ电位是微粒带电情况的表现.当ζ电位在-40mv~-60mv间时,体系很稳定〔7〕.ζ电位变小,表明溶剂化层变薄,与溶胶体系加入少量电解质而使体系稳定性增加原理一样.由于冻融改变了粒子表面电荷分布,从理论上给脂质体体系稳定性提高以合理的解释.
在综合考察了各种因素对制剂的影响,优化了处方及各影响因素后,最终制备出具有较高包封率和较好稳定性的脂质体,为以后的研究工作创造了条件.■
, http://www.100md.com
基金项目:国家自然科学基金资助项目,No.39570843
参考文献:
[1]余勤.反相高效液相法测定人血浆及淋巴组织中5-FU浓度.华西医学,1995,10(3):288
[2]王贤才.临床药物大典.青岛:青岛出版社,1990.1558
[3]薛玉英.阿糖腺苷脂质体的制备及其稳定性.药学学报,1991,27(1):79
[4]韩继洪,苏德森.抗癌药物FT-207脂肪乳剂物理性质的研究.沈阳药学院学报,1991,8(1):14
[5]Wen HH.Stability-indicating assay for vidarabine. J Pharm Sci,1979,68:499
[6]王建明.分散体系理论在制剂学中的应用.北京:北京医科大学协和医科大学联合出版社,1995.44
[7]Washington C.新型药物载体:脂质微球.国外医学药学分册,1997,24(5):308
收稿日期:1999-04-07, 百拇医药
单位:沈阳药科大学药学系,沈阳 110015
关键词:5-氟尿嘧啶脂质体;冻融法;包封率;稳定性
沈阳药科大学学报000203 摘 要:采用反相蒸发法制备5-氟尿嘧啶脂质体制剂.结合冻融法,可使5-氟尿嘧啶的包封率达(45.31±0.208 5)%.离心加速实验和ζ电位的测定进一步验证了冻融法可使脂质体稳定性提高.
分类号 R94
The Preparation of 5-FU Liposome by a Freeze-thawing Method and the Study on Its Stability
Zhang Qi Deng Yingjie
, http://www.100md.com
(Department of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110015)
Abstract:5-FU liposome was prepared by the reverse evaporating method.Then the entrapment reached 43.31% by freeze-thawing 5-FU liposome several times.The centrifugal accelaration experiment and the measurement of ζ potential proved that the stability of the liposome could be ameliorated.
Key words:5-FU liposome;freeze-thawing method;entrapment;stability▲
, http://www.100md.com
5-氟尿嘧啶(5-FU)是一种常用的抗癌药物,主要用于各种恶性肿瘤及恶性淋巴瘤转移的患者〔1〕.但5-FU的吸收不稳定,一般均静脉给药.静脉注入后血中半衰期仅为7.5~10 min,消除极快,并且有骨髓抑制和胃肠道反应的毒副作用〔2〕.脂质体作为药物载体,有使药物浓集于靶组织、减少毒副作用、提高疗效的作用,为此,将5-FU制成脂质体制剂.为了克服脂质体对水溶性小分子物质包封率低的缺点,作者采用冻融法制备出具有较高包封率的5-FU脂质体,并对制剂稳定性进行了考察.
1 试药与仪器
5-FU(济南制药总厂);豆磷脂:药用(沈阳药科大学制药厂);胆固醇:进口品(上海生化试剂厂分装);其它试剂均为分析纯.
旋转蒸发仪(上海医械专机厂);超声波清洗机(昆山市超声波仪器厂);涡流振荡器(沈阳机械厂);UV-260型分光光度计(日本岛津);OLYMPUS显微镜(日本);BDL-B型表面电位粒径仪(上海市检测技术所检测仪器厂).
, http://www.100md.com
2 方法与结果
2.1 5-FU脂质体的制备及冻融法对包封率的影响
脂质体的制备方法很多,有薄膜法、复乳法、乙醚注入法等.作者采用反相蒸发法.精密称取一定比例的磷脂、胆固醇等于茄形瓶中,用适量氯仿溶解,将少量5-FU磷酸缓冲液加入上述有机相中,超声使成均匀乳,旋转蒸发仪上减压除尽有机溶剂,使成凝胶,涡流振荡间隔减压蒸发,得白色均匀脂质体溶液,用缓冲液定容至刻度.4℃冰箱贮存.
将所制备的脂质体,冰箱冷冻后室温融化,重复3次,5-FU脂质体包封率变化结果如表1.
Tab.1 The difference between entrapment of liposome before and after being frozen-thawed Samples
, http://www.100md.com
1
2
3
En/%
Before frozen
26.66
24.87
25.77
25.77±0.748
After frozen
45.37
45.33
, 百拇医药 45.03
45.31±0.208 5
可见冻融法可明显提高脂质体包封率,并且方法简易可行.
2.2 包封率的测定及柱回收率考察
脂质体相对分子质量在10万~30万,而5-FU相对分子质量为130.10,利用Sephadex G-50柱,可将脂质体与游离药物很好分开,测定未被包入脂质体中5-FU,从而求出包封率(En%):
En%=(1-C外/C总)×100%.
C外:未包入脂质体中游离5-FU量;C总:5-FU总药物量.

, 百拇医药
Fig.1 The separation curve
配制高、中、低3个剂量5-FU标准磷酸缓冲盐水溶液:15.0、8.5、2.0 g/L,Sephadex G-50(1.2 cm×25 cm)柱层析,收集5-FU流份,稀释至25 mL.层析条件如下,上样量:0.2 mL;流动相:磷酸缓冲液(pH 8.0);流速:1.0 mL/min;紫外检测波长265 nm.得3份柱分离样品.另精密吸取5-FU标准溶液0.2 mL,流动相稀释至25 mL,得3份5-FU标准样品.柱分离样品浓度与标准样品浓度相比,求得柱空白回收率,结果如表2.
Tab.2 The recoveries of 5-FU The concentration
of 5-FU standard/g。L-1
, 百拇医药 The concentration
of 5-FU sample/g。L-1
Recovery/
%
15.007
14.887
99.20
8.492
8.625
98.46
1.966
2.101
, http://www.100md.com
93.06
平均回收率:(97.081±0.025)% 配制一系列5-FU标准品与空白脂质体混合的标准溶液,0.2 mL柱层析,得到加样回收率,结果如表3.其中用氯仿热萃取法测定5-FU总药量.
Tab.3 The recoveries of the 5-FU sample The concentration
of 5-FU standard/g。L-1
The concentration
of 5-FU sample/g。L-1
Recovery/
, 百拇医药
%
7.970
7.719
96.80
6.376
6.200
97.24
3.188
3.526
110.60
1.599
1.583
99.00
, http://www.100md.com
0.800
0.810
101.30
0.400
0.394
98.52
平均回收率:(100.577±0.047)%2.3 脂质体稳定性考察
2.3.1 离心加速实验
为考察冻融对脂质体稳定性的影响,将冻融前后样品分别采用离心加速试验(1 000r/min,离心5 min),采用分光光度法测定脂质体离心前后λ500 nm处吸光度,根据公式KE=(|A-A0|)×100%求稳定性参数KE.A0为脂质体稀释液λ500 nm处的吸光度;A为脂质体稀释液离心后λ500 nm处吸光度.离心前后脂质体吸光度变化越小,说明脂质体粒径变化越小;KE值越小,脂质体越稳定.
, 百拇医药
由表4实验数据可见,冻融法不仅可以提高5-FU包封率,而且使KE值变小,提高了制剂稳定性.
Tab.4 The differences between the stability of liposome before and after being frozen-thawed Samples of different
prescriptions
KE before
be frozen
KE after
be frozen
1
, 百拇医药
0.051
0.044
2
0.061
0.054
3
0.035
0.025
4
0.014
0.011
5
0.079
, http://www.100md.com
0.037
2.3.2 脂质体形态观察
在OLYMPUS显微镜下(10×100倍),脂质体为圆球形,颜色偏暗,变化焦距圆球中心无亮点,冻融前单位视野中脂质体量不多,粒径大的约4~5 μm,小的2~3 μm,单层或多层.冻融后单位视野中脂质体量多而密,粒径较均匀,多为2~5 μm,单层或多层.
2.3.3 脂质体荷电量的变化
脂质体属胶体分散体系,分散相粒子在与外界电解质接触的界面上,由于发生电离、离子吸附或离子溶解等作用,使粒子表面带电,在外加电场下,粒子在分散介质中作定向移动称电泳.电泳产生的原因是由于分散系的微粒表面形成双电层,双电层的滑动面上产生电动(Zeta)电位,所以通过测定电泳速度,根据Helmholtz公式ζ=4zηu/DE=ktU/E求ζ电位.冻融法改变了微粒表面的ζ电位,结果如表5. Tab.5 The differences between the ζ ptential of liposome before and after being frozen-thawed Samples
, http://www.100md.com
1
2
3
4
5
ζ Before be frozen
-59.352
-56.153
-46.499
-48.555
-61.238
ζ After be frozen
, 百拇医药
-55.120
-52.311
-37.200
-59.075
-46.499
由表5可以看出,脂质体表面荷负电,冻融后脂质体荷电量下降,脂质体稳定性提高,与留样观察结果相一致.
3 讨论
a.5-FU是一种难溶性药物,分子量小,分子中有两个活泼的酰亚胺基,存在烯醇型互变异构,将5-FU包封于脂质体水相中制成5-FU脂质体.由于5-FU难溶,制得有高包封率的脂质体很难.为提高包封率,采用对水溶性药物包封率较高的反相蒸发法,并将产物冻融几次处理,有效提高了包封率.由于冰冻使磷脂周围药物浓度增高,在反复冻融过程中粒径小的脂质体互相融合成稍大脂质体,粒径趋于均匀化〔3〕,使脂质体包封率明显提高,最终可达约40%,比冻融前20%大约提高1倍.
, 百拇医药
b.采用离心分光光度法〔4〕,以稳定性常数KE为指标评价脂质体的稳定性.同样条件下,K\-E值愈小,脂质体愈稳定.此法实际上是离心法与浊度法的结合,其吸光度包括了散射光.这种方法原用于评价乳剂稳定性.而乳剂与脂质体有许多相似之处,所以现也用来评价脂质体稳定性.
c.微粒的聚结稳定性是由粒子间的作用力决定的〔5〕,作用力是Vander Waals引力和双电层间的静电斥力决定的〔6〕,其中ζ电位是微粒带电情况的表现.当ζ电位在-40mv~-60mv间时,体系很稳定〔7〕.ζ电位变小,表明溶剂化层变薄,与溶胶体系加入少量电解质而使体系稳定性增加原理一样.由于冻融改变了粒子表面电荷分布,从理论上给脂质体体系稳定性提高以合理的解释.
在综合考察了各种因素对制剂的影响,优化了处方及各影响因素后,最终制备出具有较高包封率和较好稳定性的脂质体,为以后的研究工作创造了条件.■
, http://www.100md.com
基金项目:国家自然科学基金资助项目,No.39570843
参考文献:
[1]余勤.反相高效液相法测定人血浆及淋巴组织中5-FU浓度.华西医学,1995,10(3):288
[2]王贤才.临床药物大典.青岛:青岛出版社,1990.1558
[3]薛玉英.阿糖腺苷脂质体的制备及其稳定性.药学学报,1991,27(1):79
[4]韩继洪,苏德森.抗癌药物FT-207脂肪乳剂物理性质的研究.沈阳药学院学报,1991,8(1):14
[5]Wen HH.Stability-indicating assay for vidarabine. J Pharm Sci,1979,68:499
[6]王建明.分散体系理论在制剂学中的应用.北京:北京医科大学协和医科大学联合出版社,1995.44
[7]Washington C.新型药物载体:脂质微球.国外医学药学分册,1997,24(5):308
收稿日期:1999-04-07, 百拇医药